Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.32 n.2 Lima abr./jun. 2012
ARTÍCULOS ORIGINALES
Manejo de Tumores Quísticos del Páncreas en el Hospital Alberto Sabogal Sologuren
Management of pancreatic cystic tumors in the Alberto Sabogal Sologuren Hospital
Edmundo Mori1, Katherine Yuen2, Héctor Medrano1, José Torres1, Cesar García3, Jaime Montes4
1. Servicio de Cirugía General Especializada y Oncológica, Hospital IV Alberto Sabogal Sologuren, Lima, Perú.
2. Facultad de Medicina, Universidad San Martin de Porres, Lima, Perú.
3. Servicio de Gastroenterología, Hospital IV Alberto Sabogal Sologuren, Lima, Perú.
4. Departamento de Anatomía Patológica, Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú.
RESUMEN
INTRODUCCIÓN: Los tumores quísticos del páncreas comprenden el 1 % de todas las neoplasias del páncreas y el 10 al 15% de los quistes pancreáticos. Existe una gran variedad de lesiones quísticas, de ellos el 90% está constituido por cistoadenomas serosos, neoplasias mucinosas quísticas, neoplasias intraductales mucinosas y las neoplasias sólido pseudopapilares.
MATERIALES Y MÉTODOS: El presente estudio describe y analiza en forma retrospectiva las características clínicas, radiológicas, quirúrgicas, patológicas y de seguimiento de 12 pacientes operados por tumores quísticos del páncreas en el hospital IV Alberto Sabogal Sologuren, en el periodo 2005 al 2010.
RESULTADOS: Se encontraron 5 (41%) cistoadenomas serosos con una edad media de 66 años, localizándose 80% en cabeza y 20% en cuerpo; 2 (17%) neoplasias mucinosas quísticas con una edad media de 54 años, todas localizadas en cuerpo; 2 (17%) neoplasias intraductales mucinosas con una edad media de 63 años, todas localizadas en cabeza, y 3 (25%) neoplasias sólido pseudopapilares con una edad media de 33 años, ubicadas 33% en cuerpo y 66% en cola, con predominancia del sexo femenino en una relación de 3:1. Presentaron dolor abdominal (75%), baja de peso (17%) y masa palpable (17%). De las 2 neoplasias mucinosas quísticas, solo uno presentó displasia de bajo grado, de las 2 neoplasias intraductales mucinosas 1 resultó con displasia de grado moderado y otra de alto grado, el resto de neoplasias quísticas resultaron benignas. Se realizaron 6 pancreatoduodenectomías, 4 pancreatectomías corporocaudales, 2 pancreatectomías distales; de ellas se realizó esplenectomía en 4 pacientes (2 en pancreatectomías corporocaudal y 2 pancreatectomías distales). En todos los casos el diagnóstico preoperatorio se basó en TEM abdominal, en 4 pacientes se amplió con RMN por sospecha de tumor mucinoso y en 2 se realizó CPRE por sospecha de tumores intraductales. Dos pacientes cursaron con atelectasias, 1 presentó fístula pancreática grado A y otro pancreatitis leve post quirúrgica. Ningún paciente fue reintervenido. No hubo mortalidad post operatoria. La estancia post operatoria fue mayor para el grupo de pancreatoduodenectomía. En un seguimiento de 2 años, no se observó recurrencia, todos los pacientes están vivos.
CONCLUSIÓN: El diagnóstico preoperatorio es crucial, dada las diferencias en la historia natural del espectro de las lesiones. A pesar de los avances en las técnicas de imagen, el diagnóstico definitivo se estable únicamente tras el estudio histológico de la pieza de resección.
PALABRAS CLAVES: Tumor, quístico, páncreas, tratamiento, cirugía.
ABSTRACT
INTRODUCTION: Cystic tumors of the pancreas comprise 1% of all neoplasms of the pancreas and 10 to 15% of pancreatic cysts. There are a variety of cystic lesions, of which 90% is made up of serous cystadenomas, mucinous cystic neoplasms, intraductal mucinous neoplasms and solid pseudopapillary neoplasms.
MATERIALS AND METHODS: This study describes and analyzes retrospectively the clinical, radiological, surgical, pathological and follow up of 12 patients operated on for cystic tumors of the pancreas in the hospital IV Alberto Sabogal Sologuren, in the period 2005 to 2010.
RESULTS: we found 5 (41%) serous cystadenomas with a mean age of 66 years, localized 80% in the head and 20% body; 2 (17%) mucinous cystic neoplasms with a mean age of 54, all located in body, 2 (17%) intraductal mucinous neoplasms with a mean age of 63, all located in the head, and 3 (25%) solid pseudopapillary neoplasms with a mean age of 33 years, located in body 33% and 66% in tail with a predominance of females in a ratio of 3:1. Had abdominal pain (75%), weight loss (17%) and palpable mass (17%). Of the 2 cystic mucinous neoplasms, only one have a low-grade dysplasia, of the two mucinous intraductal neoplasms, one have grade moderate dysplasia and the other with a high degree, the rest of cystic neoplasms were benign. We realize 6 Pancreaticoduodenectomy, 4 corporocaudales pancreatectomies, 2 distal pancreatectomies; of them splenectomy realize in 4 patients (2 in corporocaudal pancreatectomies and 2 distal pancreatectomies). In all cases the preoperative diagnosis was based on abdominal TEM. in 4 patients was expanded with RMN for suspicion of mucinous tumor and in 2 patients was performed CPRE for suspected intraductal tumors. Two patients coursed with atelectasis, and one patiernt had pancreatic fistula grade A and other mild pancreatitis post-operative. No patient was reoperated. There was no mortality post operative. Postoperative was more for the pancreaticoduodenectomy group. In a 2 year follow up, no observed recurrence and all patients are alive.
CONCLUSION: Preoperative diagnosis is crucial given the differences in natural history of the spectrum of lesions. Despite improved radiographic imaging, techniques, definitive diagnosis is only made after studying the resection sample.
KEY WORD: tumors, cystic, pancreas, treatment, surgery.
INTRODUCCIÓN
Los tumores quísticos del páncreas comprenden el 1 % de todas las neoplasias del páncreas y el 10 al 15% de los quistes pancreáticos1,2. Existe una gran variedad de lesiones quísticas, pero el 90% está constituido por cistoadenomas serosos (CS), neoplasias mucinosas quísticas (NMQ), neoplasias intraductales mucinosas (NIDM) y neoplasias sólido pseudopapilares (NSP)3,4
Durante los últimos años, ha sido posible el diagnóstico de una mayor cantidad de lesiones denominadas "incidentalomas", de las cuales las lesiones quísticas pancreáticas representan una importante proporción. El diagnóstico preoperatorio se ha convertido en una prioridad, debido a las repercusiones terapéuticas que conlleva, dada las diferencias en la historia natural del espectro de las lesiones. A pesar de los avances en las técnicas de imagen, el diagnóstico definitivo se establece únicamente tras el estudio histológico de la pieza de resección. Sin embargo, el momento de la indicación puede depender de la presentación clínica y de las características morfológicas de la lesión.
El objetivo de este trabajo es describir y analizar las características clínicas, radiológicas, quirúrgicas, patológicas y de seguimiento de 12 casos operados de un tumor quístico del páncreas en un servicio especializado de un hospital de referencia.
MATERIALES Y MÉTODOS
El presente estudio describe y analiza en forma retrospectiva todos los pacientes que fueron diagnosticados y operados por neoplasias quísticas del páncreas en el Hospital IV Alberto Sabogal Sologuren, en el periodo 2005 al 2010. Los casos fueron identificados mediante el registro de anatomía patológica y ampliados con la historia clínica. En cada paciente se analizó el sexo, la edad, cuadro clínico, estudio de imágenes, marcadores tumorales, otros métodos diagnósticos utilizados, la cirugía practicada y complicaciones asociadas postquirúrgicas. En el estudio de anatomía patológica se evaluó la ubicación, el tamaño tumoral, el compromiso de bordes quirúrgicos, ganglios regionales y el diagnóstico histológico definitivo. La morbilidad y mortalidad operatoria se definieron como la ocurrida durante los 30 días post operatorios. El diagnóstico de fístula pancreática se basó en las definiciones del ISGPS (Internacional Study Group on Pancreatic Surgery)5,6, y la clasificación histológica se realizó de acuerdo a los criterios OMS 20107.
RESULTADOS
Los pacientes con diagnóstico de neoplasias quísticas del páncreas fueron 12, los cuales fueron intervenidos quirúrgicamente, resultando 5(41%) cistoadenomas serosos, 2(17%) neoplasias mucinosas quísticas, 2(17%) neoplasias intraductales mucinosas y 3(25%) neoplasias sólido pseudopapilares.
Se analizan las características clínico patológicas para cada una de ellas, detalladas en la tabla 1. Con relación a la edad, la media para cada uno de los grupos fue de 66 años para cistoadenomas serosos, 54 años para neoplasias mucinosas quísticas, 63 años para neoplasias intraductales mucinosas y 33 años para neoplasias sólido pseudopapilares; siendo el paciente de menor edad de 28 años y el de mayor edad de 73 años. Predominó el sexo femenino sobre el masculino en una relación de 3:1 (9 mujeres por 3 varones), para cada uno de los grupos se encontró 5 mujeres para cistoadenomas serosos, 2 mujeres para neoplasias mucinosas quísticas, 2 varones para neoplasias intraductales mucinosas, y 2 mujeres y 1 varón para neoplasias sólido pseudopapilares. El cuadro clínico presentado fue dolor abdominal en 9 pacientes, asociados a baja de peso en 2 pacientes: uno en neoplasia mucinosa quística con displasia de bajo grado y otro en Neoplasia intraductal mucinosa con displasia de alto grado; 3 de los 5 pacientes (60%) con diagnóstico de Cistoadenoma seroso no presentaron molestias y fueron diagnosticados en el estudio de diversas enfermedades.
En cuanto al tamaño tumoral, varía desde 1.3 cm hasta 12 cm, correspondiendo los tumores más pequeños a neoplasias intraductales mucinosas y los tumores más grandes a cistoadenomas serosos. En relación a la localización para cada uno de los grupos se encontró: 4(80%) en cabeza y 1(20%) en cuerpo para cistoadenomas serosos, 2(100%) en cuerpo para neoplasias mucinosas quísticas, 2(100%) en cabeza para neoplasias intraductales mucinosas y las neoplasias sólido pseudopapilares se encontraron : 1(33%) en cuerpo y 2(66%) en cola.
Al analizar el tipo histológico, de las 2 neoplasias mucinosas quísticas, una resultó con displasia de bajo grado; de las 2 neoplasias intraductales mucinosas, una resultó con displasia de grado moderado y la otra con displasia de alto grado; el resto de neoplasias quísticas resultaron benignas.
En cuanto al tipo de cirugía, dependió de la ubicación y tamaño de la tumoración: se realizaron 6 pancreatoduodenectomías, 4 pancreatectomías corporocaudal, 2 pancreatectomías distales, de ellas se realizó esplenectomía en 4 pacientes (2 en pancreatectomías corporocaudal y 2 pancreatectomías distales).
El diagnóstico preoperatorio (detallado en la tabla 2) se basó en los resultados obtenidos mediante Tomografía Espiral Multicorte (TEM) abdominal. En 4 pacientes se amplió con colangioresonancia magnética por sospecha de tumores mucinosos quísticos, en 2 pacientes se realizó CPRE por sospecha de tumores intraductales mucinosos, no se realizó punción-aspiración con aguja fina (PAAF) y se determinó el Ca 19.9 sérico resultando normal en todos los casos excepto en uno con diagnóstico de neoplasia intraductal mucinosa con displasia de alto grado.
En los 2 pacientes con diagnóstico de neoplasia intraductal mucinosa (NIDM) se realizó el examen citológico del jugo pancreático tomado mediante CPRE, realizando cepillado y dosaje de marcadores tumorales (Ca 19.9 y CEA). En el primer paciente se encontraron células mucinosas en el cepillado con marcadores tumorales normales, por el contrario, en el segundo paciente se encontraron células atípicas con marcadores tumorales elevados. Detallados en la tabla 3.

La complicaciones post operatorias están detalladas en la tabla 2: Dos pacientes cursaron con atelectasias; en dos de los pacientes en quienes se realizaron pancreatoduodenectomía, 1 presentó fístula pancreática grado A y otro pancreatitis leve post quirúrgica, este último con diagnóstico histológico de neoplasia intraductal mucinosa con displasia de bajo grado. Ningún paciente fue reintervenido. No hubo mortalidad post operatoria. La estancia post operatoria fue de 15 días para el grupo de pancreatoduodenectomía y 12 días en el grupo de pancreatectomía corporocaudal y pancreatectomía distal asociada o no a esplenectomía.
DISCUSIÓN
Las neoplasias quísticas del páncreas (N.Q.P) comprenden el 1 % de todas las neoplasias del páncreas y el 10 al 15% de los quistes pancreáticos1,2. Existe una gran variedad de lesiones quísticas, pero el 90% está constituido por cistoadenomas serosos (CS), neoplasias mucinosas quísticas (NMQ), neoplasias intraductales mucinosas (NIDM) y neoplasias sólido pseudopapilares (NSP) 3,4.
En el caso de lesiones incidentales y asintomáticas, es importante averiguar si se trata de una neoplasia serosa o mucinosa, y en tal caso cuál es el riesgo de transformación maligna. Tras estas valoraciones, dependiendo de la edad y enfermedad de base del paciente, se indicará tratamiento quirúrgico o seguimiento. Los tumores quísticos son un grupo heterogéneo de lesiones pancreáticas que difi eren en su presentación clínica y en su morfología, siendo el tratamiento generalmente quirúrgico. En su mayoría afecta a mujeres, como se observó en nuestra serie (93%).
Epidemiología
En relación a la edad y sexo, es series occidentales 8,9,10 los cistoadenomas serosos son más frecuentes en mujeres (6585%) con una media de 65 años (rango de 35-90 años), la neoplasia quística mucinosa es más frecuente en mujeres (84%) con una edad media de 53 años(rangote 18-82 años), la neoplasia intraductal mucinosa es más frecuente en hombres, con una media de 68 años (rango de 40-80 años) y la neoplasia sólido pseudopapilar es más frecuente en mujeres jóvenes (93%) con edad media de 26 años (rango de 8 – 60 años) comparable a nuestro estudio donde se aprecia edades de presentación similar.
Según la literatura, las neoplasias mucinosas quísticas representan el 50% seguido de las neoplasias quísticas se-rosas en un 25%, las neoplasias intraductales mucinosas constituyen el 2-7% y las neoplasias sólido pseudopapilares el 3%9, habiendo discrepancias según la frecuencia ya que algunos autores consideran como la más frecuente a las neoplasias quísticas serosas11. En nuestro estudio la neoplasia quística pancreática más frecuente es el cistoadenoma seroso (41%) seguido de la neoplasia sólido pseudopapilar (25%), las neoplasias mucinosas quísticas y las intraductales mucinosas igualan en (17%).
Cuadro clínico
No existe un síntoma patognomónico, sin embargo, el síntoma más frecuente es el dolor epigástrico (75%) como lo fue en 9 de los 12 pacientes de nuestra serie. También se puede asociar a baja de peso (17%), masa palpable (17%) e ictericia (0% en nuestra serie) que depende del tamaño y la localización de la tumoración. La baja de peso en tumores mucinosos indica en su mayoría probable malignidad12, lo que se constató en nuestra serie en 2 de los pacientes.
Los tumores quísticos serosos en su mayoría son asintomáticos y el diagnóstico es incidental como se observó en 3 de los 5 pacientes estudiados (60%), mientras que en los tumores mucinosos los síntomas son de presentación inespecífica predominando el dolor abdominal, en el tipo intraductal mucinoso cursan con síntomas de pancreatitis crónica, dolor, esteatorrea, diabetes, etc., en ausencia de factores etiológicos12.
Localización
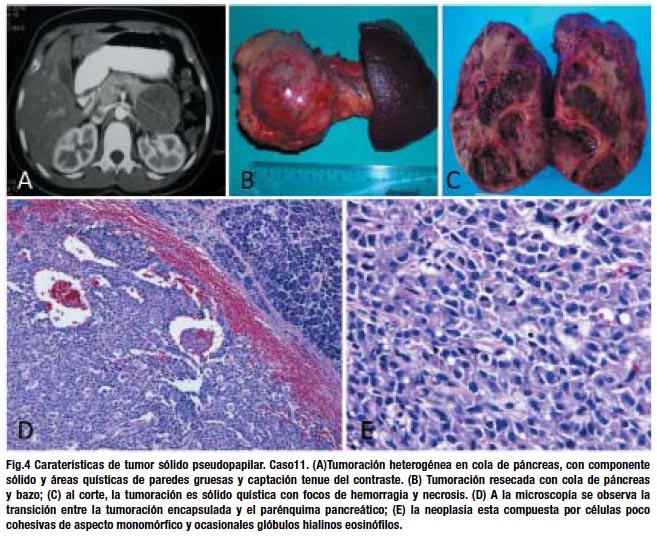
En las neoplasias quísticas serosas, la localización más frecuente es en cuerpo y cola de páncreas1,2, por el contrario, otros autores señalan que es más frecuente en cabeza, como en nuestro estudio el 80% se ubican en cabeza. Las neoplasias mucinosas quísticas en su mayoría se encuentran en cuerpo y cola de páncreas1,2,13. En las neoplasias intraductales mucinosas encontramos 3 tipos; el MDT (Main duct type) que se ubica en el 75% en cabeza, el BDT (Branch duct type) que se ubica en proceso uncinado y el tipo mixto de lozalización variable14,15. En nuestra serie encontramos 2 pacientes con neoplasias intraductales mucinosas, uno con displasia de grado moderado y otra de alto grado, siendo el primer tipo MDT y el segundo BDT, ambos localizados en cabeza. En las neoplasias sólido pseudopapilares la localización es en cuerpo y cola en un 64%16 como lo corrobora nuestro estudio.
Diagnóstico
El diagnóstico preoperatorio de las neoplasias quísticas del páncreas se inicia habitualmente con una ecografía, pero el examen principal es la tomografía computada (TC) helicoidal o una resonancia magnética (RM) de abdomen, que definen mejor la lesión y permiten un seguimiento más preciso y objetivo, además, son también útiles para sugerir la benignidad o malignidad de la lesión. Pueden ser de utilidad la ecoendoscopía, la colangiopancreatografía endoscópica (CPRE), la tomografía por emisión de positrones (PET) y la PAAF guiada por TC, aunque hay que tener en cuenta que cada uno de ellos tiene sus ventajas e inconvenientes.
La RM (principalmente las secuencias sopesadas en T2) es útil en la evaluación de las lesiones quísticas del páncreas y tiene ventaja, sobre la TC, por su habilidad para determinar la comunicación de la lesión con el conducto pancreático principal y evaluar la extensión extrapancreática de la lesión y en pacientes con función renal deteriorada17. En nuestra casuística se utilizó en los 4 pacientes con sospecha de tumores mucinosos quísticos.
En las neoplasias intraductales mucinosas, el CPRE permite identificar las características típicas de estos tumores, definidas por la triada: dilatación quística del conducto pancreático, mucina intraductal o intraquística y papila abombada con salida de moco, y además permite la toma de muestras por cepillado y el examen citológico del jugo pancreático18,19. En nuestro estudio se realizó a los 2 pacientes con sospecha de neoplasias intraductales mucinosas (fig. 3C); en el primer paciente se encontraron células mucinosas en el cepillado con marcadores tumorales (CEA y Ca 19.9) normales, mientras que en el segundo paciente se encontraron células atípicas con marcadores tumorales elevados.
En un intento de obtener un diagnóstico preoperatorio lo más aproximado posible, ciertos autores aconsejan la realización de una PAAF guiada por TC, ecografía o ecoendoscopía, pero con la limitación que proporciona una muestra pequeña, riesgo de diseminación tumoral a lo largo del trayecto de la punción, por lo que muchos grupos, entre los que nos incluimos, desaconsejan su utilización ante los métodos de diagnóstico por imagen disponibles en la actualidad20. El líquido intraquístico en las NMQP presenta valores bajos de enzimas pancreáticas, contenido mucinoso y valores variables de marcadores tumorales (CEA, Ca 19.9, Ca 72.4 y Ca 15.3), una alta viscosidad, poliploidía en las células y positividad del K-ras en las neoplasias malignas21.
La determinación del riesgo de malignidad de una lesión se establece sumando diferentes variables como la clínica del paciente, los marcadores tumorales y la apariencia imagenológica, pero el diagnóstico definitivo se establece únicamente tras el estudio de la pieza de resección23.
Anatomía patológica
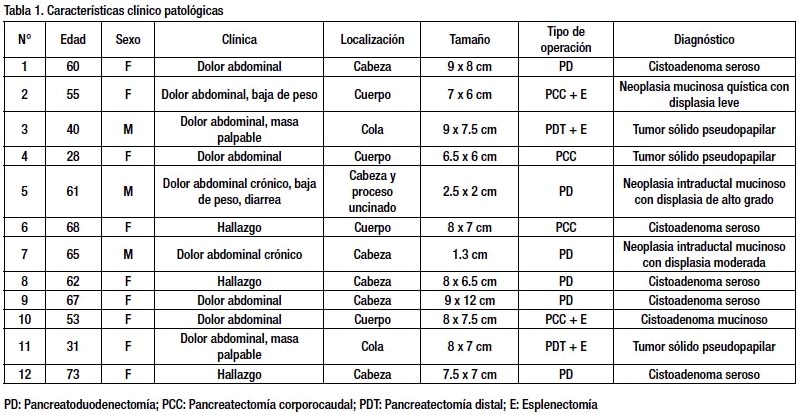
El cistoadenoma seroso es frecuentemente del tipo Microquístico, pero también se han descrito cuatro variantes morfológicas: a)cistoadenoma serosos macroquístico (que incluye al clasificado anteriormente como oligoquístico), b) adenoma seroso sólido, c) asociada a enfermedad de Von Hippel Lindau y d) Neoplasia serosa–neuroendocrina mixta. Cuatro de los cinco cistoadenomas serosos del estudio fueron de tipo microquístico (80%) y 1 macroquístico (20%). Es el tumor que se origina de las células centroacinares pancreáticas, la forma microquística tiene el aspecto de panal de abeja o esponja y pueden presentar una cicatriz central en forma estrellada (10-38%) siendo casi patognomónica. Estos tumores están tapizados con una sola capa de células cuboideas, ricas en glucógeno PAS +, con núcleo redondo y citoplasma claro sin atipias celulares. El estroma fibroso está muy vascularizado y puede estar calcificado ocasionalmente calcificada8,22 (fig. 1 D-E).
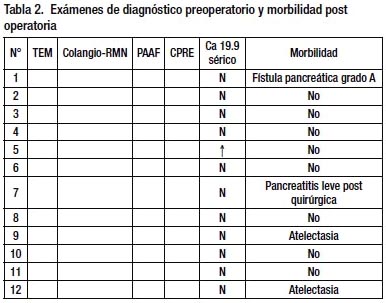
Las neoplasias mucinosas quísticas (NQM), se dividen en tres tipos7: a)NMQ con displasia de grado bajo – intermedio b) NMQ con displasia de alto grado c) NMQ asociada a carcinoma invasivo . De los 2 casos de neoplasias mucinosas quísticas del estudio, 1 resultó con displasia de bajo grado. Estos tumores no comunican con el conducto pancreático, son multiloculares con bordes definidos y superficie lisa, con varios quistes de tamaño variable, con contenido mucinoso, puede tener proyecciones papilares y ocasionalmente calcifi caciones periféricas dando la imagen de "cáscara de huevo" 24,25. La presencia de estroma tipo ovárico subyacente al epitelio es un requisito para el diagnóstico de estas neoplasias13. Siguiendo este criterio, Goh y col26 revisaron 344 caos de NQM con estroma tipo ovárico y demuestran que se trata de mujeres en un 99.7%, se localizan en cuerpo y cola en un 94.6% de los casos y raramente comunican con el ducto pancreático (6.8%).
La neoplasia intraductal papilar mucinosa (NIDM) se divide en tres tipos: a) MDT (main Duct type), que presenta dilatación ductal del conducto pancreático principal en forma difusa o segmentaria y tiene comportamiento maligno en 67-100% de los casos, b) BDT (Branch Duct type), que compromete a las ramas secundarias de forma macro o microquística, siendo malignos en un 0-47% de los casos, y el c) Tipo mixto17,27. Según la nueva clasificación de la OMS pueden corresponder a los siguientes subtipos histológicos: a) NIDM con displasia de grado bajo – intermedio, b) NIDM con displasia de alto grado, c) NIDM asociada a carcinoma invasivo, d) Neoplasia intraductal túbulo papilar. En nuestros 2 casos de NIDM, uno presentó displasia de grado moderado y el otro de alto grado, corroborando el alto potencial de malignidad de estos tumores.
La neoplasia sólido pseudopapilar se caracteriza por tener multiples patrones histológicos con presencia de: a) áreas sólidas con seudoquistes y estructuras seudopapilares y hemorrágicas, b) red microvascular (seudorosetas) que acompañan al estroma mixoide o hialinizado, c) la presencia de células eosinofílicas PAS + o "espumosas" 29,30,31. Los estudios de inmunohistoquímica son útiles e indispensables para su correcto diagnóstico, presentan positividad a Alfa 1 antitripsina, alfa 1 antiquimotripsina, enolasa, vimentina, CD10, CD56, y son positivas a queratina en un 30 – 70 % de casos.
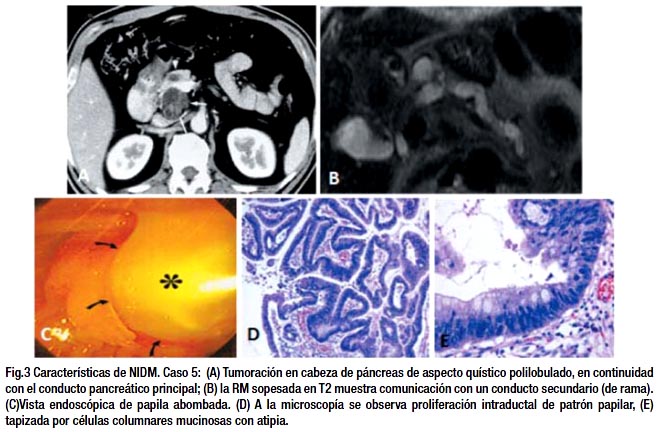
Tratamiento
El tratamiento de elección de los tumores quísticos del páncreas en general es la resección quirúrgica, dependiendo de la localización del tumor y su naturaleza se realizan cirugías radicales vs conservadoras32,33,34,35. En este estudio se realizaron 6 pancreatoduodenectomías con preservación de píloro y anastomosis pancreatoyeyunal con técnica de telescopaje simplifi cada44 (fig 1G), 4 pancreatectomía corporocaudal, 2 pancreatectomías distales, de ellas se realizó esplenectomía en 4 pacientes (2 en pancreatectomías corporocaudal y 2 pancreatectomías distales) por tratarse de grandes masas con compromiso del hilio esplénico. En caso de lesión maligna la cirugía debe ser radical con linfadenectomía asociada y si es necesario con resección de estructuras u órganos adyacentes 36,37,38. En uno de los dos pacientes con neoplasia intraductal mucinosa, el que correspondía a probable MDT, intraoperatoriamente se congeló el borde de sección pancreática para determinar presencia de malignidad en el conducto de Wirsung.
El grado de malignidad de la neoplasia es el principal factor de riesgo de recurrencia tumoral y este sólo puede establecerse una vez que la pieza ha sido estudiada en su totalidad por el patólogo33. Los 3 casos diagnosticados en forma incidental correspondientes a cistoadenomas serosos fueron operados por tratarse de grandes tumoraciones y debido a que las condiciones clínicas del paciente lo permitían. Diversos estudios40,41 han intentado predecir, con base en el tamaño, el potencial maligno con el objetivo de determinar cúales deben intervenirse y cuáles deben observarse. En el estudio de Allen y col42 de la experiencia del Memorial Sloan Kettering Center, concluyen que los quistes menores de 3 cm sin componente sólido tienen un riesgo de malignidad inferior al 3%, por lo tanto deben ser seguidos imagenológicamente, en pacientes con cistoadenoma serosos, que se encuentren asintomáticos, menores de 4 cm pueden observarse con control tomográfico cada 2 años. En el 2006 en el Consenso Internacional para el Tratamiento del NIDM43 se estableció que los pacientes que presentaran dilatación del conducto pancreático principal no mayor de 6 mm, ausencia de nódulos murales y lesión inferior a 3 cm deberían ser tratados de forma conservadora con seguimiento. Se recomienda hacerlo durante dos años, dependiendo del tamaño de la lesión, así: menor de 10mm cada 6-12 meses, y entre 10-20 mm cada 3-6 meses; luego de dos años el seguimiento puede ser anual.
En un seguimiento de 2 años, no se observó recurrencia en los 3 pacientes con tumoraciones mucinosas e intraductales quísticas con potencial maligno, todos los pacientes están vivos.
En conclusión: Las Neoplasias quísticas del páncreas representan un grupo heterogéneo de tumores; el valor de los estudios preoperatorios para identificar el subtipo final es limitado y requiere validación. El tratamiento debe ser individualizado de acuerdo a los factores de riesgo (enfermedades asociadas, edad, etc.), consensuado con el paciente y realizado con la participación de un equipo multidisciplinario; en nuestra experiencia, la resección quirúrgica permite un adecuado manejo con mínima morbilidad y mortalidad.
REFERENCIAS
1. FERNÁNDEZ DEL CASTILLO C, WARSHAW AL. Cystic neoplasm of the pancreas. Pancreatology 2001;1:641-7.
2. KLÖPPEL G, KOSMAHL M. Cystic lesions and neoplasms of the pancreas. The features are becoming clearer. Pancreatology 2001;1: 648-55.
3. LE BORGNE J, DE CALAN L, PARTENSKY y cols. Cystoadenomas and cystoadenocarcinomas of the pan-creas: A multiinstitutional retrospective study. Ann Surg 1999;230: 152-61. 9. Brugge WR. Cystic lesions of the pancreas. Curr Treat Opt Gastroenterol 2002;5:325-30.
4. FERNÁNDEZ DEL CASTILLO C, WARSHAW AL. Cystic tumors of the pancreas. Surg Clin North Am 1995;75:1001-6.
5. BASSI C, DEVERNIS C, BUTTURINI G y cols. Postoperative pancreatic fistula: An international study group (ISGPF) definition. Surgery 2005;138:8-13.
6. WENTE M, BASSI C, DEVERNIS C y cols. Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2007;142:761-768.
7. BOSSMAN F, CARNEIRO F (eds): World Health Organization Classification of Tumours of the digestive System. Lyon, IARC Press, 2010
8. SARR MG, KENDRIK ML, NAGORNEY DM y cols. Cystic neoplasms of the pancreas. Benign to malignant epithelial neoplasms. Surg Clin North Am 2001;3:497-509.
9. BRUGGE WR, LEWANDROWSKI K, LEE-LEWANDROWSKI E y cols. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126:1330-6.
10. PYKE CM, VAN HEERDEN JA, COLBY TV y cols. The spectrum of serous cystoadenoma of the pancreas. Clinical, pathological and surgical aspects. Ann Surg 1992;215:132-9.
11. BASSI C, SALVIA R, MOLINARI E y cols. Management of 100 consecutive cases of pancreatic serous cystoadenoma: wait for symptoms and see at imaging or viceversa? World J Surg 2003;27:319-23.
12. BOX GJ, DOUGLAS HO. Management of cystic neoplasms of the pancreas. Am Surg 2000;66:495-501.
13. YEO TP, HRUBRAN RH, LEACH SD y cols. Pancreatic cancer. Curr Probl Cancer 2002;26(4).
14. FARRELL JJ, BRUGGE WR. Intraductal papillary mucinous tumor of the pancreas. Gastrointest Endosc 2002;55:701-14.
15. TAOULI B, VILGRAIN V, OTOOLE D y cols. Intraductal papillary mucinous tumors of the pancreas: Features with multimodality imaging. J Comput Assist Tomogr 2002;26: 223-31.
16. LAM KY, LO CY, FAN ST. Pancreatic solid-cystic-papillary tumor: Clinicopathologic features in eight patients from Hong-Kong and review of the literature.World J Surg 1999;23:1045-50
17. SONG SJ, LEE JM, KIM YJ y cols. Differentiation of intraductal papillary mucinous neoplasms from other pancreatic cystic masses: comparison of multirowdetector CT and MR imaging using ROC analysis. J Magn Reson Imaging. 2007;26:86-93.
18. IRIE H, HONDA H, AIBE H y cols. cholangiopancreatographic differentiation of benign and malignant intraductal mucin-producing tumors of the pancreas. AJR Am J Roentgenol. 2000;174:1403-8.
19. KOITO K, NAMIENO T, ICHIMURA T y cols. Mucin-producing pancreatic tumors: comparison of MR cholangiopancreatography with endoscopic retrograde cholangiopancreatography. Radiology. 1998;208:231-7.
20. OTOOLE D, PALAZZO L, AROTCARENA R y cols. Assessment of complications of EUS-guided fi ne-needle aspiration. Gastrointest Endosc. 2001;53:470-4.
21. BRUGGE WR, LEWANDROWSKI K, LEE-LEWANDROWSKI E y cols. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126:1330-6.
22. COMPAGNO J, OERTEL JE. Microcystic adenomas of the pancreas (glycogen-rich cystoadenomas): a clinicopathologic study of 34 cases. Am J Clin Pathol 1978;69:289-98.
23. SARR MG, CARPENTER HA, PRABHAKAR LP. Clinical and pathologic correlation of 84 mucinous cystic neoplasms of the pancreas: can one reliably differentiate benign from malignant (or premalignant) neoplasms? Ann Surg 2000;231:205.
24. CEM BALCI N, SEMELCA RC. Radiologic features of cystic, endocrine and other pancreatic neoplasms. Eur J Radiol 2001;38:113-9.
25. MEGIBOW AJ, LOMBARDO FP, GUARISE A y cols. Pancreatic masses: cross-sectional imaging observations and serial follow-up. Abdom Imaging 2001;26: 640-7.
26. GOH BK. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2005;128: 1529.
27. KURODA A. recent progress in clinicopathology of pancreatic tumors. J Biliary Tract Pancreas. 1988;9:1459-70.
28. LONGNECKER DS, HUBRAN RH, KLOPPEL G. Intraductal papillary-mucinous neoplasms of the pancreas. En: Hamilton SR, Aaltonen LA, editors. World Health Organization classification of tumors. Pathology and genetics of tumors of the digestive system. Lyon: IARC Press, 2000; p. 237-40.
29. KOSHMAL M, SEADA LS, JÄNIG U y cols. Solid-pseudopapillary tumor of the pancreas: Its origin revisited. Virchows Arch 2000;436:473-80.
30. PETTINATO G, DI VICIO D, MANIVEL JC y cols. Solid-pseudopapillary tumor of the pancreas: A neoplasm with distinct and highly characteristic cytological features. Diagn Cytopathol 2002;27:325-34.
31. SAVCI G, KILICTURGAY S, SIVRI Z y cols. Solid and papillary epithelial neoplasm of the pancreas: CT and MR findings. Eur Radiol 1996;6:86-8.
32. HORVATH KD, CHABOT JA. An aggressive resectional approach to cystic neoplasms of the pancreas. Am J Surg 1999;178:269-74.
33. ELOUBEIDI MA, HAWES RH. Mucinous tumors of the exocrine pancreas. Cancer Control 2000;7:445-51.
34. TALAMINI MA, PITT HA, HROBAN RH y cols. Spectrum of cystic tumors of the pancreas. Am J Surg 1992;163:117-24.
35. BORGNE JL. Cystic tumours of the pancreas. Br J Surg 1998;85: 577-9.
36. TALAMANI M, MOESINGER R, YEO C: Cystadenomas of the pancreas. Is enucleation an adequate operation?. Ann Surg 1998; 227: 896-903.
37. LUKISH J, ROTHSTEIN J, PETRUZZIELLO M y cols. Spleen-preserving pancreatectomy for cystic pancreatic neoplasm. Am Surg 1999; 65, 596-99.
38. KIMURA W, INOUE T, FUTAKAWA N: Spleen preserving distal pancreatectomy with conservation of the splenic artery and vein. Surgery 1996; 61: 885-90.
39. BURGOS L: Tumores quísticos del páncreas. En: Burgos L (ed). Cirugía Pancreática. 1ª ed. Santiago, Chile: Sociedad de Cirujanos de Chile 2002: 172-5.
40. LIM SJ, ALASADI R, WAYNE JD y cols. Preoperative evaluation of pancreatic cystic lesions: costbenefi t analysis and proposed management algorithm. Surgery. 2005 Oct; 138(4):672-9; discussion 679-80.
41. LEE CJ, SCHEIMAN J, ANDERSON MA y cols. Risk of malignancy in resected cystic tumors of the pancreas G or =3 cm in size: Is it safe to observe asymptomatic patients? A multi-institutional report. J Gastrointest Surg 2008;12(2):234-42
42. ALLEN PJ, DANGELICA M, GONEN M y cols. A selective approach to the resection of cystic lesions of the pancreas: results from 539 consecutive patients. Ann Surg 2006 Oct; 244(4):572-82
43. TANAKA M, CHARI S, ADSAY V y cols. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006; 6(12):17-32. Review.
44. TANAKA M, CHARI S, ADSAY V y cols. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006; 6(12):17-32. Review.
45. CELIS J, BERROSPI F, RUIZ A, PAYET E. Safe pancreaticojejunostomy after whipple procedure: Modifi ed technique. J Surg Oncol 2001; 76: 138-140.
Correspondencia:
Dr. Edmundo Mori Gonzales
e-mail: edmorig1@hotmail.com
Hospital IV Alberto Sabogal Sologuren
Jr. Colina Nª1081 Bellavista Callao – Perú
Teléf.: 429-7744 anexo 5081













