Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.32 no.4 Lima Oct./Dec. 2012
ARTÍCULOS ORIGINALES
Tumores estromales gastrointestinales: evaluación clinicopatológica y sobrevida en el Hospital Rebagliati
Gastrointestinal stromal tumors: clinicopathologic and survival evaluation in Rebagliati Hospital
María Nelly Manrique(1), César Soriano(2), Alejandro Yábar(3), Oscar Frisancho(4) y Alaciel Melissa Palacios(5)
1. Gastroenteróloga Asistente del Hospital Uldarico Rocca Fernández, EsSALUD, Lima, Perú.
2. Profesor Asociado de Medicina de la Universidad Nacional Mayor de San Marcos, Lima, Perú.
3. Médico Anatomopatólogo del Departamento de Anatomía Patológica del Hospital Nacional Edgardo Rebagliati Martins (HNERM), EsSALUD, Lima, Perú.
4. Gastroenterólogo Asistente del Departamento del Aparato Digestivo del HNERM, EsSALUD, Lima, Perú.
5. Médico Nefróloga, Magister en Epidemiología.
RESUMEN
OBJETIVO: Determinar las manifestaciones clínicas, radiológicas, histopatológicas y sobrevida de los pacientes con Tumor Estromal Gastrointestinal (GIST) en el Hospital Nacional Edgardo Rebagliati Martins (HNERM), de Lima, Perú.
MATERIAL Y MÉTODOS: El presente es un estudio descriptivo, retrospectivo. El cual se realizó a partir de las historias clínicas de 103 pacientes con GIST confirmado por inmunohistoquímica que fueron evaluados y tratados en el HNERM, desde Enero del 2002 hasta Diciembre de 2010.
RESULTADOS: En los 103 pacientes el promedio de edad fue 64 años (entre 30 y 88 años). Predominó en mujeres (52%). El tiempo de enfermedad promedio fue 7 meses. La forma de presentación más frecuente fue sangrado digestivo (48.3%). El diagnóstico se hizo más por endoscopía (50.5%). La prevalencia por órganos fue más frecuente en estómago 56.3%. El promedio de tamaño fue 98mm, (49% entre 50mm y 100mm), el tumor de mayor tamaño alcanzaba 260 mm. El estadio tumoral más frecuente fue localizado (70.9%). Presentaron otro cáncer asociado el 9.7% de pacientes El patrón histológico predominante fue fusiforme 73.8%. El 84.5% tuvo bajo índice mitótico. La inmunohistoquímica mostró la expresión de KIT (CD 117) 94.17%, CD 34 77.5%, Vimentina 96.6%, NSE 84.9%, Alfa actina 52.7%, CD56 44.4%, S-100 32.3% y Actina 20.0%. La característica tomográfica más frecuente fue tumor heterogéneo (43.6%). La distribución según clasificación de riesgo fue: muy bajo riesgo 3.9%, bajo riesgo 28.2%, riesgo intermedio 37.7% y alto riesgo 30.1%. La resección quirúrgica completa se realizó en 87.4% de pacientes, 4.9% de pacientes recibió Imatinib. La sobrevida global acumulada a 5 años fue 31.07%. En el análisis bivariado se encontró asociación estadística entre el haber sobrevivido con: ausencia de cáncer asociado p= 0.004, CD 34 p=0.01, índice mitótico bajo p=0.00 y tratamiento quirúrgico recibido p= 0.000. En el análisis multivariado se encontró asociación estadística de mayor sobrevida con: los de menor tamaño del tumor p=0.015 (IC -3.67, -0.41), estadio tumoral localizado p=0.036 (IC -5.83, -0.19), menor índice mitótico p=0.038 (IC -0.86, 0.02), paciente asintomático p=0.009 (IC 1.25, 8.62), no recidiva del tumor p=0.01 (IC -8.49, -1.17) y el no presentar metástasis p=0.001 (IC 2.66, 10.62).
CONCLUSIONES: Los resultados de nuestro estudio fueron similares a lo que reporta la literatura internacional. Los factores que se asociaron a mayor sobrevida fueron: haber recibido tratamiento quirúrgico, pacientes con menor tamaño tumoral, estadio tumoral localizado, índice mitótico bajo, paciente asintomático, no recidiva del tumor, no metástasis y no cáncer asociado.
PALABRAS CLAVES: Tumores estromales gastrointestinales, Tumores mesenquimales, Sarcomas.
ABSTRACT
OBJECTIVE: To determine the clinical, radiological, histopathological manifestations and survival of patients with gastrointestinal stromal tumor (GIST)in the National Hospital Edgardo Rebagliati Martins (HNERM) from Lima, Perú.
MATERIAL AND METHODS: This is a descriptive and retrospective study, which was based on the medical records of 103 patients with confirmed GIST with immunohistochemical. All the patients were evaluated and treated at the HNERM, from January 2002 until December 2010.
RESULTS: In 103 patients between 30 and 88 years the average age was 64 years. The tumor was more frequent in females (52%). The mean disease duration was 7 months. The most frequent form of presentation was gastrointestinal bleeding (48.3%). The diagnosis was made more by endoscopy (50.5%). The prevalence of GISTs by organs was more frequent in stomach (56.3%). The average size of the tumors was 98mm, 49% had a size between 50mm and 100mm, the largest tumor was 260 mm. Tumor stage more frequent was localized (70:9%). GIST associated with another cancer was 9.7% of patients. The predominant histologic pattern was fusiform (73.8%). The 84.5% had low mitotic index. Immunohistochemistry showed expression KIT (CD 117) was 94.17%, CD34 77.5%, Vimentin 96.6%, NSE 84.9%, alpha actin 52.7%, CD56 44.4%, S-100 32.3% and Actin 20%. The tomographic characteristic more frequent was heterogeneous tumor (43.6%).The distribution according to risk classification was: very low risk 3.9%, low risk 28.2, intermediate risk 37.7% and high risk 30.1%. Complete surgical resection was performed in 87.4% of patients and 4.9% of patients received imatinib. The cumulative overall survival at 5 years was 31.07%. In bivariate analysis statistical association was found between surviving with: no presence of cancer associated p = 0.004, CD 34 p = 0.01, low mitotic index p = 0.00 and received surgical treatment p = 0.000. In multivariate analysis one found statistical association of longer survival with smaller tumor size p = 0.015 (CI -3.67, -0.41), localized tumor stage p = 0.036 (CI -5.83, -0.19), lower mitotic index p = 0.038 (CI -0.86, 0.02), asymptomatic patient p=0.009 (CI 1.25, 8.62), no tumor recurrence p = 0.01 (CI -8.49, -1.17), and no metastasis p = 0.001 (CI 2.66, 10.62).
CONCLUSIONS: The results of our study were similar to what was reported in international literature. Factors that were associated with longer survival were receiving surgical treatment, patients with smaller tumor size, tumor stage localized, low mitotic index, asymptomatic patient, not tumor recurrence, not metastasis and no cancer associated.
KEYWORDS: Gastrointestinal stromal tumors, Mesenchymal tumors, Sarcomas.
INTRODUCCIÓN
Los tumores estromales gastrointestinales (GISTs) son las neoplasias mesenquimales más frecuentes del tracto gastrointestinal. Se originan de las Células Intersticiales de Cajal (CIC) o desde células precursoras primitivas que se diferencian hacia CIC y hacia células fenotípicamente musculares lisas. Las CIC se encuentran intercaladas entre los nervios autonómicos y las células musculares lisas, su principal función es generar el ritmo autónomo de contracciones involucradas en la digestión y peristaltismo (1,2).
Los GISTs se caracterizan por la expresión de un receptor de membrana mutante con actividad tirosina quinasa anormal (la proteína c-Kit), debido a una mutación en la función del gen KIT ubicado en el cromosoma 4 (q11-12). Existe una fracción de estos tumores que no expresan el receptor c-Kit, de estos un 30% son positivos para una mutación del gen del Receptor Alfa del Factor de Crecimiento Derivado de Plaquetas (PDGFRA) que también tiene actividad tirosina quinasa asociada. Aproximadamente 60%-70% de los GIST c-Kit negativos también son PDGFRA negativos lo que sugiere la existencia de mecanismos adicionales aún desconocidos que definen una proliferación celular no regulada (3, 4, 5).
La incidencia exacta de los GISTs es difícil de determinar. Estudios recientes reportan una incidencia de aproximadamente 10-15 casos por millón por año en Europa. Sin embargo la prevalencia de GIST es más alta, debido a que muchos pacientes viven por años con la enfermedad (6).
Con el presente estudio se pretende determinar las manifestaciones clínicas, radiológicas, histopatológicas y sobrevida de los pacientes con diagnóstico de Tumor estromal gastrointestinal en el HNERM. Considerando que son pocos los estudios nacionales y latinoamericanos sobre esta patología de presentación poco frecuente y de comportamiento variable.
MATERIAL Y MÉTODOS
El presente es un estudio descriptivo, retrospectivo. Se realizó a partir de las fichas de informe de anatomía patológica e historias clínicas de los pacientes con diagnóstico de Tumor estromal gastrointestinal evaluados y tratados en el HNERM, hospital de referencia de EsSALUD, desde Enero del 2002 hasta Diciembre de 2010.
El diagnóstico de todos los casos de GIST fue hecho basado en las características histológicas y expresión inmunohistoquímica CD117 y/o CD 34.
Se incluyó en el estudio a los pacientes que cumplían los siguientes criterios: tumor localizado y/o adyacente al tracto gastrointestinal (mesenterio, omento o retroperitoneo), apariencia histológica fusiforme o epitelioide compatible con GIST, diagnóstico de GIST confirmado en el Departamento de Anatomía Patológica del HNERM, mediante pruebas de inmunohistoquímica positivas a CD117 y/o CD34 y pacientes con historia clínica antigua.
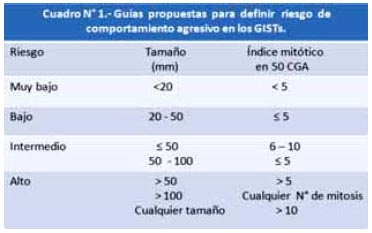
Los pacientes con diagnóstico de GIST fueron divididos en 4 grupos, según el sistema de clasifi cación consenso del "National Institutes of Health" (NIH), para definir riesgo de curso clínico agresivo de los GIST primario (Cuadro N° 1).
Procesamiento y análisis de datos.
Los datos obtenidos se trasladaron a una base de datos en el programa Excel 97-2003. Se realizó inicialmente el análisis descriptivo presentado en número, promedios, desviación estándar y porcentajes. Se presentan para tal efecto tablas y gráficos. Se realizó el análisis inferencial (comparaciones) con estudio bivariado: chi2 para las variables categóricas y regresión lineal simple para analizar la relación entre dos variables continuas, considerando sobrevida de los pacientes como variable principal; con un p<0.05. Se realizó un estudio multivariado de regresión múltiple para evaluar los factores asociados a sobrevida de los pacientes. Todos los datos obtenidos se analizaron y procesaron con el programa estadístico STATA 11.1.
RESULTADOS
El Departamento de Anatomía Patológica del HNERM reportó un total de 140 pacientes con diagnóstico probable de GIST desde el 2002 al 2010, de los cuales 103 tuvieron resultados de pruebas de inmunohistoquímica positivos a CD117 y/o CD34 y cumplían los criterios de inclusión.
Resultados epidemiológicos y clínicos
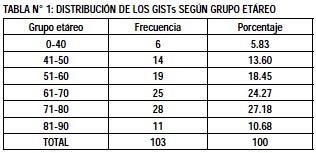
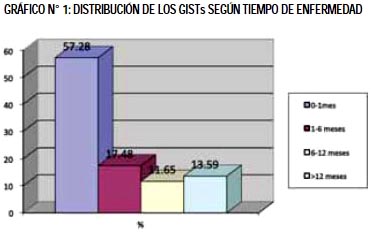
En el presente estudio el rango de edades fue de 30 a 88 años con un promedio de edad de 64.04 ± 13.51 años, la mayoría estuvo entre 60 y 80 años (Tabla N°1). 50 fueron varones (48.54%) y 53 mujeres (51.46%). Se encontró un promedio de 209.48 ± 466.65 días de tiempo de enfermedad previo al ingreso, siendo mayor porcentaje de pacientes entre 0-1 mes (30 días) de enfermedad (Gráfico N°1).
Respecto a la forma de presentación, se obtuvo síntomas en el 95.7% de pacientes, siendo: sangrado digestivo (48.3%), masa abdominal (18.2%), dolor abdominal (15.1%), hiporexia (3.2%), disfagia (3.2%), vómitos (2.2%), diarrea (1.1%), obstrucción intestinal (1.1%), absceso hepático (1.1%), anemia (1.1%) y dolor anal (1.1%).
El tipo de sangrado digestivo fue: melena (57.8%), hematemesis (20.0%), sangrado digestivo de origen oscuro (11.2%), hematoquezia (4.4%), rectorragia (4.4%), sangrado digestivo de origen oculto (2.2%).
El método diagnóstico utilizado fue: endoscopía digestiva en 52 (50.49%), ecografía en 28 (27.18%), tomografía en 16 (15.53%), y laparotomía exploratoria en 7 (6.8%). De los pacientes sometidos a endoscopia digestiva, fueron altas 46 (88.5%), enteroscopias 4 (7.7%) y endoscopias digestivas bajas 2 (3.8%).
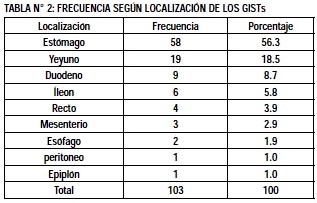
La distribución según localización de los GIST en los 103 pacientes estudiados fue: estómago 58 (56.3%), intestino delgado 34 (33.0%), recto 4 (3.9%) y otras localizaciones en 7 (6.8%) pacientes (Tabla N°2). De los pacientes con GIST de localización gástrica se encontró: en fondo 18 (33.3%), en cuerpo 28 (51.9%), en antro 6 (11.1%) y multicéntricos 2 (3.7%).
El promedio de tamaño de los GISTs fue 98.24 ± 58.12mm (De 12mm a 260mm). Considerando el tamaño en estratos, se aprecia mayor frecuencia de presentación entre 50-100mm (Gráfico N°2).
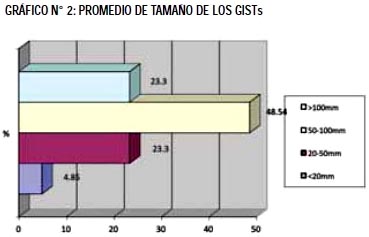
En relación al estadio tumoral fue: localizado en 70.87%, regional en 25.24%, y con metástasis el 3.88%. De los 5 pacientes con metástasis al diagnóstico se encontró: metástasis hepática y pulmonar (1), metástasis hepática (1), metástasis pulmonar (1), y metástasis retroperitoneal (2). Tuvieron otro cáncer asociado 10 pacientes (9.71%).
Resultados anatomopatológicos
El tipo histológico más frecuente fue fusocelular (73.79%), epitelioide (13.69%) y mixto (12.62%). El índice mitótico fue ≤5 mitosis por 50 Campos de Gran Aumento (CGA) en 87 (84.47%), 6-10 mitosis por 50 CGA en 12 (11.65%), y >10 mitosis por 50 CGA en 4 (3.88%) pacientes.
Los exámenes de inmunohistoquímica practicados, mostraron que para todas las localizaciones la expresión de KIT (CD 117) fue de 94.17% y para el marcador CD 34 fue 77.45%. Otros marcadores que mostraron positividad fueron: Vimentina 96.55%, NSE 84.85%, Alfa actina 52.73%, CD-56 44.44%, S-100 32.26% y Actina 20.00%. Los marcadores sinaptofisina, citoqueratina, des-mina, cromogranina, mioglobina y HMB15 practicados en un menor número de pacientes fueron negativos.
Según la clasificación de riesgo se encontró: riesgo muy bajo 4 (3.88%), bajo riesgo 29 (28.16%), riesgo intermedio 39 (37.86%), y alto riesgo 31 (30.1%).
Resultados radiológicos
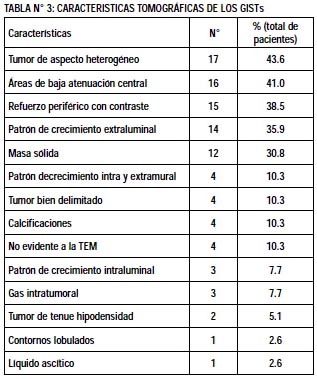
Se revisaron 39 informes tomográficos encontrándose las siguientes características en general: tumor de aspecto heterogéneo (43.6%), áreas de baja atenuación central (41%), refuerzo periférico con contraste (38.5%), patrón de crecimiento extraluminal (35.9%), masa sólida (30.8%), y en menor proporción otras características (Tabla N° 3).
Tratamiento y sobrevida
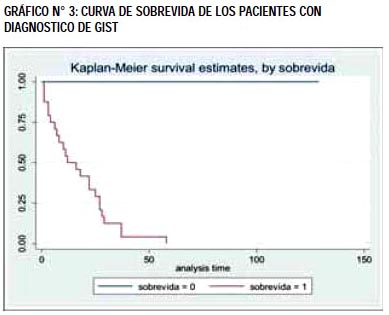
El tratamiento fue: resección quirúrgica completa en 90 (87.38%), Imatinib 5 (4.85%), otros considerados irresecables no recibieron tratamiento 4 (3.88%) (Tabla N°4). Hubo recidiva del tumor en 7 (6.8%) pacientes. El promedio de sobrevida de fue 44.72±32.06 meses, considerando seguimiento mínimo de un año por paciente. Fallecieron 24 (23.30%) y sobrevivieron 79 (76.7%). La sobrevida al año fue 88.35%. A los 2 años fue 67.96% y a los 5 años fue 31.07% (Gráfico N°3).
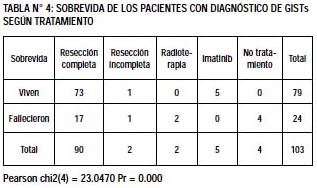
Se presenta un cuadro comparativo de las características clínico epidemiológicas de los pacientes que sobrevivieron con los que fallecieron (Tabla N°5).
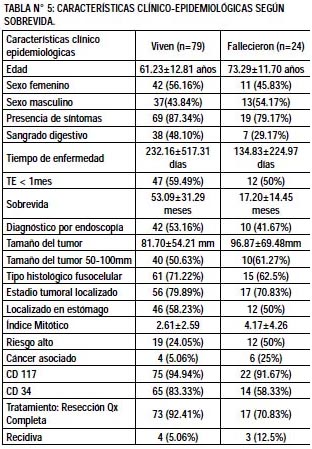
Análisis bivariado
Se realizó el análisis bivariado con la prueba de chi2 de la variable sobrevida con las otras variables categóricas, encontrándose asociación estadística entre el haber sobrevivido y: la presencia de cáncer asociado p= 0.004, CD 34(+) p=0.01, índice mitótico bajo p=0.00 y tratamiento quirúrgico recibido p= 0.000.
Análisis multivariado
En el análisis multivariado de regresión logística, se encontró asociación estadística de mayor sobrevida de los pacientes con menor tamaño del tumor p=0.015 (IC -3.67, -0.41), estadío tumoral localizado p=0.036 (IC -5.83, -0.19), menor índice mitótico p=0.038 (IC -0.86, 0.02), paciente asintomático p=0.009 (IC 1.25,8.62), no recidiva del tumor p=0.01 (IC -8.49, -1.17) y no metástasis p=0.001 (IC 2.66, 10.62).
DISCUSIÓN
Los tumores estromales gastrointestinales (GISTs) constituyen el grupo más común de tumores mesenquimales, que al no ser de presentación frecuente, su mejor conocimiento incidirá en un adecuado diagnóstico y manejo terapéutico (7).
Los GISTs tienen un amplio espectro de manifestaciones clínicas, pueden ser asintomáticos, su comportamiento biológico va de benigno a maligno. Los hallazgos histopatológicos y moleculares son variados, por lo que en la actualidad continua siendo un tema de investigación determinar su comportamiento y naturaleza (8,9).
Actualmente es difícil diferenciar entre lesión benigna y maligna basándose sólo en los cambios histológicos. Estudios previos han reportado la significancia pronóstica del: tamaño tumoral, conteo mitótico, el índice del Ki-67, el subtipo de mutación KIT, angiogénesis y la expresión aberrante del ciclo de células reguladoras (3,10). Sin embargo, aparte del tamaño no existen características groseras que predigan el comportamiento biológico.
El marcador inmunohistoquímico de los tumores GISTs es el C-Kit (CD117), sin embargo, en algunos casos, especialmente en algunos GISTs mutantes del receptor alfa del Factor de Crecimiento Derivado de Plaquetas (PDGFRA), la positividad puede ser débil o estar ausente(1,2), en tales casos la alternativa de marcadores como CD 34 y la proteína kinasa C theta pueden ser de utilidad; pero existen GISTs que son CD117-negativo y CD34- negativo, en cuyo caso es necesario el análisis molecular.
La edad promedio de presentación fue similar al encontrado en otros estudios (11, 12, 13) y mayor a la encontrada en China y en otro estudio nacional (14, 15). La menor edad de presentación fue 30 años y no hubo niños en esta serie. Los GISTs son raros en individuos menores de 50 años (11) en el presente estudio el 80.6 % de casos fueron mayores de 50 años.
En cuanto al sexo la bibliografía reporta resultados variables, algunos estudios indican una predilección masculina (11, 16, 17), mientras que otros sugieren una predominancia femenina (15, 18, 19). Un estudio clínico patológico de 275 casos de GISTs realizado en México, Alvarado y cols. (2007) encuentran igual número de varones y mujeres (13). En el presente estudio se encontró mayor predominio del género femenino (51.46%) sin embargo no hubo una diferencia significativa. El tiempo de enfermedad para las presentaciones sintomáticas suelen pasar el año (12), en este estudio el tiempo promedio de enfermedad fue de 7 meses, siendo el mayor porcentaje de pacientes entre 0- 30 días de enfermedad lo que muestra un mayor tiempo de evolución de enfermedad asintomática.
Con respecto a la forma de presentación, el sangrado digestivo es la manifestación clínica más frecuente de los GISTs (20, 21), seguido de masa abdominal y dolor abdominal (15, 22); triada sintomática que suelen tener los GISTs (15, 22), que se corrobora en el presente estudio.
En relación al método diagnóstico utilizado, el presente trabajo corrobora que la endoscopia digestiva es útil en detectar GISTs y debe tenerse presente este diagnóstico frente a una lesión elevada tipo submucosa ya que es la principal forma de presentación (23).
Los resultados sobre prevalencia de los GISTs por órganos son consistentes con lo que reporta la literatura internacional, siendo el estómago el lugar más afectado por estas lesiones variando desde un 50% a 70%, seguido por el intestino delgado de 20% a 30%, en el presente estudio representó el 33%. Son raros en el colon y recto (5-10%) y aún más raros en el esófago y otras localizaciones (11, 13, 14, 18, 22).
En cuanto a los GIST de localización gástrica, similar distribución encuentran Levy y cols. (2003), en un estudio Chileno de 64 casos de GIST con confirmación patológica, el 14% de los GISTs gástricos estaban confinados al cardias y fondo, el 75% se localizaban en el cuerpo y el 11% en el antro; no se reportaron multicéntricos (21).
Los GISTs son típicamente masas bien circunscritas que comprimen el tejido adyacente y que carecen de una verdadera cápsula, el tamaño va de varios milímetros a más de 30 cm (21). En relación al estadio tumoral, en una serie de 31 GISTs estudiados con TAC y RMN publicada por Sanrasegaran y cols. las metástasis más frecuentes fueron a hígado (32%) y mesenterio (26%) (24). Los pacientes portadores de GISTs tienen un alto riesgo de presentar segundos tumores primarios del tracto gastrointestinal, se reporta una incidencia de 14%, siendo los más frecuentes el carcinoma gástrico, carcinoma de colon y linfoma gástrico (25), lo cual es similar a lo encontrado en el presente estudio, la incidencia fue 9.71% y los más frecuentes fueron: carcinoma gástrico (5), seguido de carcinoma colorrectal (2), linfoma (1), cáncer de páncreas (1) y carcinoma de células transicionales de vejiga (1).
Los GISTs exhiben 3 patrones histológicos fundamentales: fusiforme (70%), epitelioide (20%) y mixto (10%(25). Los GISTs de c-KIT negativos son más frecuentemente de tipo epitelioide y localizados en epiplón y mesenterio. Se ha reportado que el tipo histológico podría tener valor pronóstico, teniendo el patrón fusiforme una mejor expectativa de vida (41). En el presente estudio el patrón histológico predominante fue: fusiforme (73.79%), epitelioide (13.69%) y mixto (12.62%). Estos hallazgos son similares a los reportados por otros autores donde en los casos gástricos, de intestino delgado y colon predomina el patrón fusiforme (70% -80%) (13, 22).
El 84.47% de pacientes tuvieron bajo índice mitótico (≤ 5 mitosis en 50CGA) lo cual es un hallazgo frecuente en los GISTs; sin embargo este hallazgo independientemente no se relaciona con un comportamiento benigno de la enfermedad; es así que se reporta que de 27 pacientes con índice mitótico bajo 10 (37%) tenían metástasis primaria(15). En el presente estudio de los 5 pacientes con metástasis al diagnostico 3 de ellos tuvieron bajo índice mitótico.
Los exámenes de inmunohistoquímica son importantes para poder hacer el diagnóstico diferencial frente a otros tumores que puedan mostrar positividad a CD34 que no es un marcador específico de GIST, por ejemplo la Desmina diferencia GIST de Tumor de músculo liso, en los GIST la desmina es generalmente negativa (7).
Las características radiológicas de los GISTs varían en relación al tamaño y órgano de origen. Las lesiones pequeñas son tumores de atenuación homogénea, mientras que las lesiones mayores a 5cm son tumores de aspecto heterogéneo. Debido a que la mayoría de GISTs crecen dentro de la muscular propia del estómago o intestino delgado ellos más comúnmente tienen un patrón de crecimiento exofítico y se manifiestan como una masa dominante fuera del órgano de origen, menos frecuentemente se manifiestan como una masa intramural e intraluminal (21). Es así que en el presente estudio el patrón de crecimiento predominante fue el extramural (35.9%), intra y extramural (10.3%) e intraluminal (7.7%). Entre otras características tomográficas frecuentes se encontró: tumor de aspecto heterogéneo (43.6%) y áreas de baja atenuación central (38.5%) en relación a necrosis, hemorragia y degeneración quística; el patrón de refuerzo periférico con contraste (38.5%) se correlaciona con tumor viable y está presente en la mayoría de GISTs (21). Es importante resaltar que las linfadenopatías no son una característica de los pacientes con GIST. En el presente estudio no se describieron linfadenopatias.
El uso del USE (Ultrasonido Endoscópico) permite una imagen clara de las capas de la pared gastrointestinal y una evaluación precisa del tumor submucoso (TSM); si se origina de una compresión extrínseca o de una de las capas de la pared en la cual la lesión es intramural. Usualmente los GISTs se ven por USE como un tumor sólido hipoecoico en la capa correspondiente a la muscularis mucosae o muscular propia. Sin embargo otras lesiones submucosas (leiomiomas, neurinomas, tumor carcinoide, páncreas ectópico, linfoma maligno y metástasis) pueden aparentar una masa sólida hipoecoica y no ser caracterizada adecuadamente sin una muestra de biopsia. En el proceso diagnóstico de GIST, el análisis inmunohistoquímico del tejido con C-KIT es vital para la confirmación de esta enfermedad. Por lo tanto la punción con aguja fina guiada por USE (PAF-USE) debería ser realizado en todo tumor hipoecoico mayor de 1cm, visto por USE, ya que en tumores menores es difícil obtener muestras histológicas y existe riesgo de metástasis. La PAF-USE es un procedimiento seguro y certero. La certeza diagnóstica de la PAFUSE usando análisis de inmunohistoquímica es excelente. Los niveles diagnósticos reportados para tumores gástricos menores de 2cm, de 2cm a 4cm y mayores de 4cm fueron 71%, 86% y 100% respectivamente (26). En el presente estudio no se realizaron procedimientos mediante ultrasonido endoscópico y sólo 2 pacientes fueron diagnosticados de GIST mediante USE.
En lo que respecta al riesgo de malignidad utilizando la clasificación de Fletcher y col. (Cuadro N° 1) (27). Se encontró que la mayor proporción de pacientes fueron de riesgo intermedio (37.86%) seguidos por los pacientes de alto riesgo (30.1%) y en menor proporción los pacientes de bajo riesgo (28.16%) y de muy bajo riesgo (3.88%). El 30.1% fue de alto riesgo, lo cual se relaciona a hallazgos previos que van de 22 a 66% (12, 13, 27). Esta evaluación del riesgo de malignidad es muy importante por ejemplo en los pacientes tratados quirúrgicamente de tumores localizados, la evaluación de riesgo ayuda a elegir la pauta de seguimiento. Los pacientes con alto riesgo generalmente recaen dentro de los 2 a 3 años, mientras que los pacientes de bajo riesgo pueden recaer más tarde, aunque es poco probable. Se sugiere seguimiento con Tomografía Espiral Multicorte (TEM) en los pacientes de alto riesgo y riesgo intermedio cada 3 a 4 meses durante los 3 primeros años, luego cada 6 meses hasta los 5 años y luego anualmente; para los pacientes con tumores de bajo riesgo el seguimiento es con TEM cada 6 meses por 5 años. Para los GIST con muy bajo riesgo probablemente no se requiera seguimiento de rutina, aunque se debe tener claro que el riesgo no es nulo (28, 29).
En cuanto al tratamiento, los GISTs son tumores radio resistentes, además como otros sarcomas intrabdominales no pueden ser tratados con radioterapia por la importante morbilidad que se produciría al estar ubicados vecinos a otros órganos, que toleran limitadamente la dosis de radiación a administrar. La radioterapia no es un estándar de tratamiento adyuvante en GIST; podría tener algún rol en casos seleccionados como paliación. La quimioterapia sistémica no ha sido efectiva (25).
La cirugía es el "gold standard" de tratamiento para los GISTs no metastásicos, la resección debe ser con criterio oncológico parecido a otros sarcomas intraabdominales, es decir con un margen libre de tumor. De involucrar órganos adyacentes se recomienda la resección en bloque debido a la demostrada mayor sobrevida de los pacientes tratados más agresivamente. Debido a la baja frecuencia de metástasis ganglionares no se recomienda realizar linfadenectomía regional. El imatinib, un inhibidor de la tirosina kinasa ha revolucionado el tratamiento del GIST metastásico, pero no reemplaza ni puede palear una inadecuada cirugía inicial (30), además, aún no está claro un aumento real de la sobrevida a partir de información poblacional debido a los aumentos de la incidencia de GIST a partir de su redefinición con el uso de marcadores moleculares (31).
En el presente estudio el tratamiento recibido fue: resección quirúrgica completa en 87.38% pacientes, Imatinib en 4.85% pacientes, fueron considerados irresecables y no recibieron tratamiento 3.88% pacientes. No recibieron tratamiento debido a que fueron pacientes diagnosticados de GIST irresecables y/o con metástasis antes de la llegada del Imatinib al HNERM. Dos pacientes recibieron radioterapia paliativa y uno quimioterapia adyuvante a la cirugía en la era pre - imatinib. No se requirió Sunitinib en este grupo de pacientes.
Hubo recidiva del tumor en 7 (6.8%) pacientes, todos fueron clasificados de alto riesgo y sometidos a resección quirúrgica completa, el tiempo promedio de recidiva fue de 2.5 años, la recurrencia local se presentó en el 66.7% de pacientes y los lugares de metástasis fueron: hígado (83.3%), retroperitoneo (33.3%) y pulmón (16.7%). Se observa una baja incidencia de recidiva en comparación a otros estudios (32), sin embargo sí existe una correspondencia entre los rasgos histopatológicos de riesgo y el comportamiento clínico.
Los estimados de sobrevida han variado ampliamente; en una gran serie de casos, Tran y cols. (2005) encuentran estimados de sobrevida al año y 5 años de 80% y 45% respectivamente(11). Los rangos de sobrevida a 5 años de pacientes con GIST van de 28%(33) a 84%(34). En el presente estudio la sobrevida al año fue de 88.35%, a los 2 años 67.96% y a los 5 años 31.07%, lo cual está en relación a lo que reporta la literatura internacional. Además en general no hay acuerdo sobre los factores pronósticos que afectan la supervivencia (16, 17, 18, 19, 33, 34). En el presente estudio los factores que se asocian a mayor sobrevida fueron: haber recibido tratamiento quirúrgico, pacientes con menor tamaño del tumor, estadio tumoral localizado, índice mitótico bajo (<5 mitosis en 50 CGA), paciente asintomático, no recidiva del tumor y no presentar metástasis. La presencia de otro cáncer estuvo asociado a menor sobrevida.
Los pacientes que vivieron fueron en promedio 10 años más jóvenes; pero mayores de 50 años, y predominó el sexo femenino. En un estudio mexicano, Medina-Franco y cols. (2009) encuentran como factores pronósticos favorables: el sexo femenino, baja cuenta mitótica, tamaño tumoral <10 cm, ausencia de necrosis y negatividad para P 53; lo cual se relaciona con nuestros resultados (35).
En conclusión los pacientes diagnosticados de GIST en el HNERM son en su mayoría mayores de 50 años (80.6%) y mujeres (52%). La principal forma de presentación fue el sangrado digestivo (48.3%) y el método diagnóstico más importante fue la endoscopia digestiva alta (50.49%). Se confirma que la localización más frecuente de los GISTs es el estómago, seguido del intestino delgado, donde el segmento más afectado es yeyuno; y en menor frecuencia esófago, recto, mesenterio y epiplón. El tipo histológico más frecuente fue el fusiforme seguido del epitelioide. El índice mitótico fue bajo en el 84.5% de pacientes y se asoció con mayor sobrevida. El riesgo de malignidad alto se encontró en el 30.1% de casos. El promedio de sobrevida global fue 44.72±32.06 meses y la sobrevida a 5 años fue 31.07%. En el presente estudio los factores que se asocian a mayor sobrevida fueron: haber recibido tratamiento quirúrgico, menor tamaño del tumor, estadio tumoral localizado, índice mitótico bajo, paciente asintomático, no recidiva del tumor, no presentar metástasis y no presencia de otro cáncer asociado. El género y la localización del tumor no influyeron en las sobrevida de los pacientes con diagnóstico de GIST. En general las manifestaciones clínicas, radiológicas, histopatológicas y sobrevida de los pacientes con diagnóstico de Tumor Estromal gastrointestinal en el HNERM fueron similares a lo que reporta la literatura internacional.
Se sugiere determinar el riesgo de malignidad y otras características claves del tumor mediante la mejora del registro de datos en las Fichas de Anatomía Patológica a fi n permitir a los oncólogos planificar un protocolo de tratamiento y seguimiento adecuado, teniendo en cuenta que actualmente se dispone del Imatinib y Sunitinib para el tratamiento de esta patología poco frecuente.
Siendo la endoscopia digestiva alta el principal método diagnóstico para detectar GIST se recomienda tenerla presente en el diagnóstico diferencial de lesiones submucosas y posterior realización de PAF-USE que en la actualidad es una prueba segura y certera que permite un diagnóstico temprano de esta patología. Además se recomienda implementar el uso de registros informatizados en los hospitales a fin de facilitar el acceso a la información y la implementación de pruebas genéticas que permitan diagnosticar GIST que no expresan marcadores CD117 y CD34 a fin de poder guiar la decisión terapéutica.
La creación de un registro nacional de GISTs con confirmación inmunohistoquímica y/o genética que incluya a todas las entidades prestadoras de salud, tanto públicas como privadas, permitiría obtener una muestra representativa de la población y caracterizar esta patología poco frecuente.
REFERENCIAS
1. RUBIN B, FLETCHER J, FLETCHER C. Molecular insights into the histogenesis and pathogenesis of gastrointestinal stromal tumors. Int J Surg pathol 2000; 8:5-10.
2. CORLESS CL, SCHROEDER A, GRIFFITH D, et al; PDGFRA mutation in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol 2005; 23(23): 5357-64.
3. HASEGAWA T, MATSUNO Y, SHIMODA T, et al. Gastrointestinal stromal tumor: consistent CD117 immunostaining for diagnosis, and prognostic classification based on tumor size and MIB-1 grade. Human Pathology 2002; 33:669-76.
4. MIETTINEN M, SOBIN LH, LASOTA J. Gastrointestinal stromal tumors of the stomach: a clinic pathologic, immunohistochemical, and molecular genetics study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29:52-68.
5. MUÑOZ C, SABAH S, NAVARRO A, et al. Tumores del estroma gastrointestinal (GIST): Revisión de la literatura. Gastr Latinoam 2006; 17(1): 43-5.
6. PENNACCHIOLI et al. Update on management of GIST and postsurgical use of imatinib. Open Access Surgery 2010:3 63–71.
7. HOLDEN J, WILLMORE-PAYNE C, LAYFIELD L. Gastrointestinal stromal tumors:a guide to the diagnosis. Surgical Pathology 2010,3: 241–276.
8. CHAK A, CANTO MI, RÖSCH T, et al. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997;45:468-73.
9. KAMIYAMA Y, AIHARA R, NAKABAYASHI T, et al. 18F-fluorodeoxyglucose positron emission tomography: useful technique for predicting malignant potential of gastrointestinal stromal tumors. World J Surg 2005; 29:1429-35.
10. NAKAMURA N, YAMAMOTO H, YAO T, et al. Prognostic significance of expressions of cell-cycle regulatory proteins in gastrointestinal stromal tumor and the relevance of the risk grade. Hum pathol 2005;36: 828-37.
11. TRAN T, DAVILA J, EL-SERAG H. The Epidemiology of Malignant Gastrointestinal Stromal Tumours:An Análisis de 1,458 casos from 1992 to 2000. Am J Gastroenterol 2005; 100:162-168.
12. EUANORASETR C. Outcomes and prognostic factors of primary gastric GIST following complete surgical resection: a single surgeon experience. J Med Assoc Thai 2011; 94(1):55-64.
13. ALVARADO I, VÁZQUEZ G, SIERRA S. Clinicopathologic study of 275 cases of gastrointestinal stromal tumors: the experience at 3 large medical centers in Mexico. Ann Diagn Pathol 2007; 11(1):39-45.
14. LIANG YM, LI XH, LÜ YY. Prognostic signifi cance of clinicopathologic parameters in gastrointestinal stromal tumor: a study of 156 cases. Zhonghua Bing Li Xue Za Zhi 2007; 36(4):233-8.
15. BARREDA F, LIU H, SÁNCHEZ J. Factores de Sobrevida en 152 pacientes con Tumores Estro-males Gastrointestinales. Rev Gastroenterol Perú 2010;30:305-23.
16. DE MATTEO R, LEWIS J, LEUNG D, et al; Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Annals of Surgery 2000, 231(1): 51-58.
17. TRUPIANO J, STEWART R,MISICK C, et al. Gastric stromal tumours. A clinicopathologic study of 77 cases with correlation of features with nonaggressive clinical behavior. Am J Surg Pathol 2002; 26: 705-14.
18. LEV D, KARIV J, ISSAKOV J, et al. Gastrointestinal stromal sarcomas. Br J Surg 1999; 86:545-9.
19. KIM C, DAY S, YEH K. Gastrointestinal stromal tumours: analysis of clinical and pathologic factors. Am Surg 2001; 67: 135-7.
20. HALPIN R,THOMSON SR, CATTERALL N, HAFFEJEE. A Smooth muscle tumours of the stomach: clinicopathological aspects. JR Coll Surg Edimb 1993; 38:23-7
21. LEVY A, REMOTTI H, THOMPSON W, et al. Gastrointestinal estromal tumors: Radiologic Feature with Pathologic Correlation. RadioGraphics 2003; 23:283-304.
22. ICHIYANAGUI C, FRISANCHO O, YÁBAR A. Perfi l Clínico, Endoscópico e Histológico de los Tumores Estromales Gastrointestinales en el Hospital Rebagliati. Rev Gastroenterol Perú 2010; 30: 201-210
23. MUÑOZ C, SABAH S, NAVARRO A, et al. Tumores del estroma gastrointestinal (GIST): Revisión de la literatura. Gastr Latinoam 2006; 17 (1): 43-5.
24. SANDRASEGARAN K, RAJESH A, RUSHING D, et al. Gastrointestinal stromal tumors: CT and MRI findings.Eur Radiol 2005; 15: 1407-14.
25. BÓRQUEZ P, NEVEU R. Tumores del estroma gastrointestinal (GIST), un particular tipo de neoplasia. Rev Med Chile 2008; 136: 921-929.
26. AKAHOSHI K, OYA M. Gastrointestinal stromal tumor of the stomach: How to manage? .World J Gastrointest Endosc 2010; 2(8): 271-277.
27. JOENSUU H. Risk stratification of pacients diagnosed with gastrointestinal stromal tumor. Human Pathology 2008; 39: 1411- 1419.
28. CASALI P, JOST L, REICHARDT P.Gastrointestinal stromal tumors: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Annals of Oncology 2008; 19 (Supp 2): ii35–ii38.
29. KANG Y, KIM K, SOHN T, et al. Clinical Practice Guideline for Accurate Diagnosis and Effective Treatment of Gastrointestinal Stromal Tumor in Korea. J Korean Med Sci 2010; 25:1543-52.
30. APARICIO T, BOIGE V, SABOURIN JC, et al. Prognostic factors after surgery of primary resectable gastrointestinal stromal tumours. EJSO 2004; 30: 1098 – 103.
31. PEREZ E, LIVINGSTONE S, FRANCESCHI D, ROCHE LIMA C, et al. Current incidence and outcomes of gastrointestinal mesenchymal tumors including gastrointestinal stromal tumors. J Am Coll Sur 2006; 202:623-29.
32. EIZAGUIRRE B, BURGOS J.Tumores GIST. Revisión de la literatura. Rev Esp Patol 2006; 39 (4): 209-218.
33. COLON KC, CASPER ES, BRENNAN MF, Primary gastrointestinal sarcomas: analysis of prognostic variables. Ann Surg Oncol 1995; 2: 26-31.
34. TATEISHI U, HASEGAWA T, SATAKE M, et al. Gastrointestinal stromal tumor: Correlation of computed tomography findings with tumor grade end mortality. J Comput Assist Tomogr 2003; 27:792 -8.
35. MEDINA-FRANCO H, AGUILAR-JIMÉNEZ J, MEDINA-CUAIRÁN J. Tumores del estroma gastrointestinal. Análisis de factores pronósticos en un grupo de pacientes mexicanos. Gac Méd Méx 2009; 146 (2): 91- 96.
Correspondencia
Dra. María Nelly Manrique L.
E-mail: marianelly20@yahoo.es













