Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.32 no.4 Lima Oct./Dec. 2012
REPORTE DE CASOS
Endometriosis del ileon como causa de obstrución intestinal
Endometriosis of the ileum as cause intestinal obstruction
*José Luis Meza Flores, ** Karin Ruiz Yaya, ** Freddy Luis Ramírez. Anglas, *** Alejandro Yabar Berrocal
* Médico Gastroenterólogo. Hospital EsSalud II Huamanga.
** Cirujano General. Hospital EsSalud II Huamanga.
*** Jefe de Servicio. Dpto. de Anatomía Patológica. HNERM - EsSalud
RESUMEN
Presentamos el caso de una paciente de 40 años, en edad fértil que inicio con un cuadro clínico abdominal obstructivo, la laparoscopia diagnóstica reveló una tumoración ileal de aspecto estenosante, se hace la resección intestinal y en el estudio histopatológico se encontró epitelio endometrial y estroma del endometrio confirmando el diagnóstico de endometriosis ileal. Se hace la revisión de esta patología. En pacientes jóvenes, sin cirugías previas y con antecedentes de períodos menstruales dolorosos asociados a distensión abdominal y alteración del ritmo defecatorio, debe incluirse la endometriosis en el diagnóstico diferencial de una obstrucción intestinal.
PALABRAS CLAVE: Endometriosis, obstrucción intestinal.
ABSTRAC
We report the case of a patient of 40 years, in childbearing age with clinical abdominal obstruction, diagnostic laparoscopy revealed an ileal stenosing tumor , after intestinal resection their histopathological study found endometrial epithelium and stroma confirming the diagnosis of endometrial ileal endometriosis. It is the revision of this pathology. In young patients without previous surgery and with a history of painful periods bloating associated with defecation rhythm alteration, endometriosis should be included in the differential diagnosis of intestinal obstruction.
KEY WORDS: Endometriosis, Intestinal obstruction.
INTRODUCCIÓN
La endometriosis; una enfermedad crónica y enigmática se define como la presencia de tejido endometrial funcional (epitelio glandular y estroma) fuera de la cavidad uterina(1), mayormente sobre la superficie peritoneal y del ovario (2). Fue descrita por primera vez por Rokitansky en 1860. Su prevalencia en general es desconocida, se estima que la incidencia clínica de endometriosis en edad reproductiva es de 5-10% (3). Si se considera al subgrupo de las mujeres infértiles esta cifra alcanza a un 30%, algunas series refieren hasta un 70% (4).Se observa mayor incidencia en mujeres asiáticas, siendo dos veces superior a las caucásicas y más frecuente en la raza blanca que las de raza negra (5). La patogenia de la enfermedad es incierta y existen varias teorías pero ninguna logra explicar su origen : 1) la de «migración retrógrada» que defiende el paso de material endometrial a través de las trompas a la cavidad abdominal (6); 2) también la «transformación metaplásica" de las células mesoteliales pluripotenciales(7); 3) algunos autores han asociado un déficit inmunitario local y/o general que impide la eliminación del tejido endometrial ectópico (8); y, 4) otras teorías son la del trasplante mecánico de células en pacientes sometidas a cirugía, la de metástasis linfáticas o vasculares y la de la extensión directa (9). La teoría de la migración retrógrada postulada por Sampson en 1921, tiene más defensores y ofrece una explicación fi siopatológica más lógica y algunos autores la han asociado con un défi cit inmunitario local y/o general que impide la eliminación 6 del tejido endometrial ectópico (10).
CASO CLÍNICO
Relato: Paciente mujer de 40 años de edad, que ingresa por emergencia con tiempo de enfermedad de 15 días caracterizado por dolor abdominal tipo cólico, malestar general.
Examen físico: FUR 01- 08- 11, a la palpación abdominal dolor difuso a predominio de mesogastrio, leventemente distendido, RHA disminuidos, timpánicos.
Laboratorio: En el hemograma leve leucocitosis.
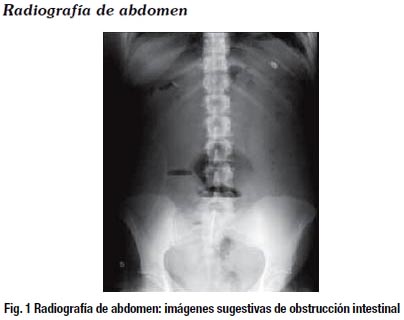
Intervención quirúrgica: Se realizó una incisión mediana supra umbilical de 1.5cm y bajo visión directa colocación de T1 e identificación de asas intestinales delgadas muy dilatadas, evaluación de hígado, bazo, estómago, mesenterio sin lesiones. Se hace la apertura de cavidad abdominal y se encuentra una tumoración ileal de aspecto estenosante a 10cm de la válvula ileocecal de aproximadamente 2cm de longitud que obstruye la luz intestinal en el 100%.Se hace la resección intestinal de ciego y 20cm de asa ileal desde la válvula ileocecal, cierre del muñón del colon ascendente, anastomosis termino lateral ileocecal en dos planos y cierre por planos hasta piel. El diagnóstico presuntivo postquirúrgico fue obstrucción intestinal por un tumor ileal.
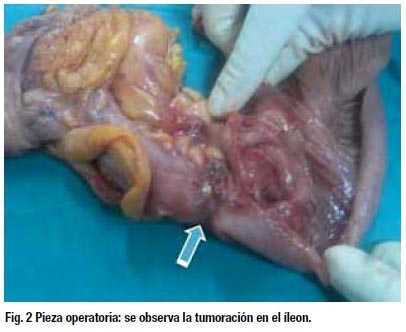
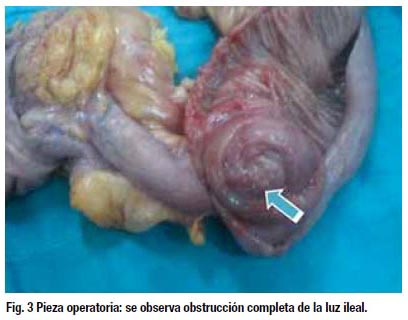
Evolución: Paciente estuvo hospitalizada durante 3 días, evoluciona satisfactoriamente, tiene control por el servicio de ginecología .Actualmente asintomática.
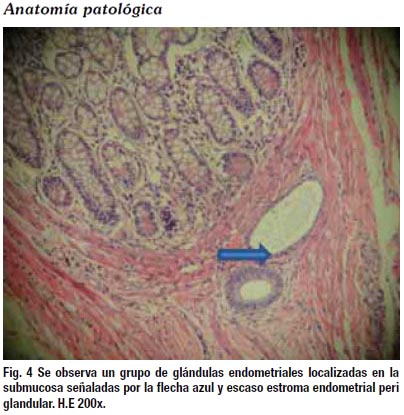
DISCUSIÓN
Sampson fue el primero en describir la asociación de endometriosis peritoneal secundaria a una diseminación menstrual dentro de la cavidad peritoneal (6) y a la endometriosis intestinal por primera vez en 1922 (11). Se define como la infiltración de la pared intestinal por tejido endometrial ectópico, comprometiendo la muscular propia (12).
Según Sampson el contenido menstrual con fragmentos de endometrio pasa por las trompas de Falopio alcanzando la cavidad peritoneal, a esto se llama menstruación retrógrada, se ha observado sangre (menstrual) en la cavidad abdominal en pacientes durante los videos de laparoscopías. Para ello debe existir una alteración inmunológica que permita la implantación de dicho tejido y su crecimiento, sin ser reconocido como extraño y favorecer su desarrollo. El fundamento de la endometriosis peritoneal se explica por el siguiente mecanismo: la migración del tejido endometrial a través de las trompas a la cavidad peritoneal con la presencia de glándulas y de estroma sobre la superficie peritoneal y en los órganos del abdomen y pelvis, donde en los próximos ciclos menstruales se produce el sangrado menstrual (13) estas células pueden adherirse al mesotelio peritoneal y favorecer los procesos de invasión, implantación y proliferación y en algún caso invadir profundamente el espacio subperitoneal donde pueden proliferar y expandirse. Pequeños defectos microscópicos permiten a estas células contactar con la matriz submesotelial, luego por acción de las moléculas de adhesión (ICAM-1) (14) y la proteólisis de la matriz extra-celular por acción de metaloproteinasas consigue la implantación favorecidas por alteraciones inmunológicas (15) y humorales locales (16). Los factores angiogénicos: factor de crecimiento vascular (VEGF) y la interleuquina, favorecen la proliferación de vasos y una menor apoptosis del tejido endometrial (17) contribuyendo así al desarrollo y posterior diseminación a la cavidad peritoneal. Lo anterior configura la lesión roja endometriósica. Luego de la implantación esta sufre sangrado con depósito de hemosiderina y reparación fibrótica conformando la lesión negra de la endometriosis. A posteriori dicha cicatrización progresa y se establece la lesión blanca, con intensa reacción de retracción y fibrosis endometriósica (18).
Al igual que los procesos tumorales los implantes endometriales no pueden proliferar a menos que exista un proceso de neoangiogénesis. Se ha propuesto que la angiogénesis endometrial excesiva pudiera ser un importante mecanismo en la patogénesis de la endometriosis. Healy y colaboradores, hacen notar el proceso de neoangiogénesis como fundamental en el desarrollo de la endometriosis y destaca que en pacientes con endometriosis en quienes se realizó la cirugía laparoscópica alrededor de los implantes endometriales observó la presencia de vasos sanguíneos(19). El proceso de angiogénesis implica la interacción de varios factores de crecimiento entre ellos el factor de crecimiento vascular (VEGF), reconocido como el principal factor angiogénico (20) El VEGF tiene variaciones cíclicas ya que es estrógeno dependiente y ha sido demostrado en el endometrio humano con efecto angiogénico tanto en el epitelio como el estroma en la fase proliferativa manteniéndose solo en epitelio en la fase secretora (21). McLaren y colaboradores han demostrado el VEGF en líquido peritoneal de mujeres con endometriosis, teniendo los niveles más altos en fase proliferativa del ciclo menstrual donde el peritoneo se encuentra expuesto al fenómeno de la menstruación (22) estos datos sugieren la presencia de VEGF durante la menstruación retrógrada y hacen pensar que el tejido que alcanza la cavidad pélvica puede proliferar bajo la influencia del fenómeno de angiogénesis. El líquido peritoneal regula el microambiente peritoneal, baña las trompas y ovarios, difunde al lumen tubario e incluso se describe que llega a la cavidad uterina. Desempeña un papel fundamental en el desarrollo, mantenimiento y propagación de la enfermedad endometriósica, su volumen varía durante el ciclo menstrual con un peak de 20 cc al momento de la ovulación. Contiene varias células libres incluyendo macrófagos, células mesoteliales, linfocitos, eosinófi los y mastocitos, el porcentaje mayor con macrófagos 85%. En la endometriosis se ha visto un aumento del número y actividad de macrófagos, esto genera citoquinas y factores de crecimiento que producen un microambiente apropiado para la proliferación e implantación a nivel peritoneal del tejido endometrial. Participa en la remodelación de los implantes a través de la secreción de factor de necrosis tumoral, el cual regula la secreción de las metaloproteinasas de la matriz (23). Además, estimula la angiogénesis en los focos endometriósicos permitiendo su sobrevida y crecimiento, por ello el líquido peritoneal se transforma en un rico cocktail de citoquinas, que participan activamente en el origen y progresión de esta enfermedad (24). En el líquido peritoneal se ha visto niveles elevados de TNF que se correlacionarían con la severidad de la enfermedad. Estos niveles elevados serían por una mayor producción de los macrófagos y monocitos en sangre periférica (25). Las células de los focos endometriósicos tienen una resistencia a la apoptosis y fagocitosis. Se ha demostrado, in vitro, una menor actividad NK contra células endometriales de mujeres con endometriosis; y esto se relaciona con el estado de la enfermedad. Posteriormente este hallazgo se detectó in vivo a nivel del líquido peritoneal (26). Estudios recientes con cirugía laparoscópica demuestran que la menstruación retrograda es frecuente y se presentan entre el 76% y el 90% de las mujeres con trompas de Falopio permeables (27) y solo el 10-15% de las mismas desarrolla endometriosis. La explicación radica en la presencia de factores inmunológicos que favorecen la invasión, progresión y persistencia de las lesiones. Estos datos sugieren que el endometrio de mujeres con endometriosis tienen capacidad de proliferación para sobrevivir en localizaciones ectópicas y que el VEGF interviene en la angiogénesis de la endometriosis de una manera directa, pero existen otros mecanismos conocidos y desconocidos que influyen en este proceso. Los cambios producidos en el tejido endometrial ectópico son consecuencia del estímulo menstrual fisiológico. Su presencia fuera del útero desencadena un proceso inflamatorio local con una fase reparativa posterior, que dará lugar a un proceso de fibrosis que en la fase terminal ya no será reversible ni responderá a manipulación hormonal. El grado y la cantidad de tejido fibrótico están en relación con el grado de endometriosis (28). En las áreas de mayor afección, la fibrosis se extiende a la grasa y el tejido conectivo perivisceral. El grado de estenosis en las fases avanzadas causará la clínica obstructiva e influirá en la intervención quirúrgica a realizarse.
Pueden aparecer neoplasias malignas a nivel de tejido endometrial ectópico, en cicatrices de cesárea, se han publicado casos de malignización de endometriosis recto sigmoidea. Principalmente se trata de carcinomas endometrioides, mucho más raramente presentan transformación sarcomatosa. Esto hace obligatorio el estudio histológico de los focos de endometriosis.
El aparato digestivo es la localización más frecuente de la endometriosis extragonadal, oscila entre el 3 al 37%(29),se ha detectado prácticamente en todo el intestino, pero más frecuente la afectación del recto y del colon sigmoideo (74%), seguido del tabique rectovaginal (12%), ciego (2%) y apéndice (3%), región ileocecal (30), y más raramente otros segmentos de colon o intestino del-gado(31). serán tributarias de resección intestinal alrededor del 1%de las endometriosis (32) los implantes superficiales son habituales, siendo poco frecuente la forma profunda 0,9 %; que compromete toda la pared intestinal (33) su principal problema a este nivel es que se comporta como una gran simuladora de graves procesos intestinales. La mayoría de los casos son asintomáticos y cuando se presenta clínicamente es inespecífica, es difícil diagnosticarla sin el antecedente previo de endometriosis (34). Clínicamente se presenta con dolor pélvico, infertilidad, dismenorrea y dispareunia (35) la asociación de la endometriosis con estos síntomas fue reconocida desde la década del 20. El dolor pélvico (dismenorrea, dispareunia y otras molestias peri menstruales y la esterilidad son los problemas por los que con más frecuencia acude la paciente a consulta, sin que exista correlación entre la frecuencia e intensidad de los síntomas y la severidad de la endometriosis. Los síntomas intestinales aparecen o desaparecen a expensas del ciclo menstrual, son intensos en el periodo premenstrual y durante la menstruación se convierte en dolor incapacitante, para posteriormente a medida que cesa la menstruación, el dolor comienza a disminuir y se hace poco aparente después del término menstrual, como sucede con el dolor irradiado al periné al defecar (52%),cambio de ritmo deposicional en un 25-40%, diarrea en un porcentaje similar, y alternancia de estreñimiento y diarrea en un 14%. Se presentan rectorragia, generalmente coincidiendo con la menstruación en un 15-20% de los casos, y alrededor de un 12% de las pacientes tienen síntomas típicos de suboclusión intestinal. No es infrecuente la oclusión intestinal aguda, aunque generalmente hay síntomas previos que pueden hacer que se sospeche el diagnóstico. Los implantes endometriósicos aumentan de tamaño durante la menstruación y al final de ésta pueden drenar su contenido, acumularlo ejerciendo un efecto masa sobre las estructuras vecinas o generar intensa inflamación que se vuelve crónico y da lugar a fibrosis y adherencias locales. Todo ello puede simular diversas entidades clínicas como la obstrucción intestinal por neoplasia de colon, apendicitis aguda, síndrome del colon irritable o enfermedad de Crohn (36); La rectorragia se debe al desgarro transitorio de la mucosa digestiva normal debido al aumento de tamaño de un endometrioma subyacente bajo el influjo hormonal cíclico (37). Los implantes penetran en la pared intestinal y afectan la serosa, luego la capa muscular, la afectación de la mucosa es rara. la diarrea o estreñimiento se justifican por una alteración en la producción ovárica de progesterona, LH, HCG y relaxina. Las complicaciones abdominales con indicación quirúrgica se presentan con mayor frecuencia en recto y colon sigmoides y consisten en hemorragia digestiva baja, constipación crónica, obstrucción intestinal y dolor crónico refractario a tratamiento médico(38) Las causas de obstrucción del intestino delgado son: estenosis del segmento afectado, intususcepción y vólvulo de un asa secundario a adherencias (39). Mucho más rara es la perforación intestinal como complicación excepcional(40). Macroscópicamente es difícil sospechar el compromiso endometriósico, incluso se reportan apéndices descritos como normales (41). En la mayoría de los casos, la afección de la pared intestinal por la endometriosis será mínima, pequeños implantes no superiores a los 2 cm. Afectan superficialmente a la serosa intestinal, los mecanismos implicados en la génesis del dolor han sido ampliamente estudiados y se correlacionan con el estado inflamatorio y la distorsión anatómica originada por el tejido endometriósico ectópico o la infiltración de fibras nerviosas somáticas o autonómicas. El diagnóstico es clínico pero complicado; se basa en una correcta anamnesis, la mayoría tienen síntomas sugestivos de endometriosis genital que justifiquen la afectación gastrointestinal. El diagnóstico se hace con la visualización directa de la lesión endometrial ectópica (vía laparoscopia), y la confirmación histológica de las características patognomónicas de este tipo de lesión: epitelio endometrial y glándulas o estroma del endometrio con o sin presencia de hemorragia (42). Tener en cuenta que la afectación intestinal de la endometriosis es seromuscular y rara vez compromete la mucosa. Existen pruebas complementarias que ayudan a un correcto diagnóstico, como el enema opaco con doble contraste que muestra el patrón extraluminal, su extensión y el grado de estenosis (43). Si hay afectación colorrectal la prueba es la colonoscopia, con biopsias para descartar procesos estenosantes como la enfermedad de Crohn o adenocarcinomas. Los estudios de imagen como RMN y TC no son suficientemente sensibles para el diagnóstico definitivo (70% sensibilidad y especificidad) aunque la sensibilidad de la RMN mejora con la utilización de contraste vaginal y rectal al expandir estos órganos y permitir una mejor delimitación (44).La ecografía ginecológica tiene un escaso rendimiento (45) y se recomienda la vía transvaginal y/o la transrectal para diagnosticar la endometriosis pelviana (46). La laparoscopia es el método estándar confirma el diagnóstico, permite retirar biopsias y precisa el grado y la extensión de la enfermedad(47). El tratamiento de la endometriosis intestinal, con la cirugía y la terapia hormonal dependerán de la localización, extensión, grado de penetración de las lesiones, la edad, sintomatología, estatus hormonal, deseo genésico, infertilidad o grado de obstrucción intestinal. La terapia hormonal sola es incapaz de revertir la estenosis intestinal, y por tanto la resección está indicada. El abordaje quirúrgico puede restaurar la anatomía y reducir el estado inflamatorio, mejorando los síntomas en el postoperatorio. Los resultados son generalmente satisfactorios en relación a la endometriosis intestinales una cirugía sin mortalidad, puede tener complicaciones como fístulas y abscesos, entre las más frecuentes, El tratamiento médico de la endometriosis después de la cirugía consiste en la supresión hormonal que, eventualmente produce involución y atrofia de los implantes de endometriosis (35).
REFERENCIAS
1. GIUDICE LC, KAO LC. Endometriosis. Lancet 2004;364:1789-99
2. VINATIER, D., et al., Theories of endometriosis. Eur J Obstet Gynecol Reprod Biol, 2001. 96(1): p. 21-34.
3. GAZVANI, R. AND A. TEMPLETON, New considerations for the pathogenesis of endometriosis. Int J Gynaecol Obstet, 2002. 76(2): p. 117-26.
4. MURPHY, A.A., et al., Unsuspected endometriosis documented by scanning electron microscopy in visually normal peritoneum. Fertil Steril, 1986. 46(3): p. 522-4.
5. MIYZAWA, K., incidence of endometriosis among Japanese women. Obstet Gynecol, 1976. 48: p. 407.
6. SAMPSON JA. Peritoneal endometriosis due to menstrual dissemination of endometrial tissue into the peritoneal cavity. Am J Obstet Gynecol 1927; 14: 422-9. 7. Vinatier D, Orazi G, Cosson M, Dufour P. Theories of endometriosis. Eur J Obstet Gynecol Reprod Biol 2001; 96:21-34.
7. ULUKUS M, ARICI A. Inmunology of endometriosis. Minerva Gynecol 2005; 57: 237-48.
8. ULUKUS M, ARICI A. Inmunology of endometriosis. Minerva Gynecol 2005; 57: 237-48.
9. FERRERO A, PINEDO A, FERNÁNDEZ-CORONA A. Endometriosis extragenital. Clin Invest Gin Obst 2007; 34(1):6-10.
10. ULUKUS M, ARICI A. Inmunology of endometriosis. Minerva Ginecol.2005; 57:237-48.
11. SAMPSON JA. Intestinal adenomas of endometrial type. Arch Surg 1922; 5:217-21.
12. CHAPRON C, FAUCONNIER A, VIEIRA M, BARAKAT H, DO USSET B, PANSINI V, et al. Anatomical distribution of deeply infiltrating endometriosis: surgical implicatio ns and proposition for a classification. Hum Reprod 2003; 18:157-61.
13. CATERINO S, RICCA L, CAVALLINI M, CIARDI A, CAMILLI A, ZIPARO V. ANN Italchir 2002 May-Jun; 73(3):323-9; discussion 329-30.
14. PICUCCI L, ALIBRANDI M, PERSICO STELLA L, DAVOLI G, FORLINI G, QUONDAMCARLO C, CRESCENZIA. DIAS JL. Minerva Ginecol. 1995 Apr;47(4):155-64.
15. CAMERON IC, ROGERS S, COLLINS MC, REED MW. Int J Colorectal Dis. 1995; 10(2):83-6.
16. HSU KC, FAN HA, WANG TK, CHEN MC. ZHONGHUA YI XUEZAZHI (Taipei). 1992 Feb; 49(2):123-7.
17. BARTKOWIAK R, ZIENIEWICZ K, KAMINSKI P, KRAWCZYK M, MARIANOWSKI L, SZYMANSKA K. Med SciMonit. 2000 Jul-Aug;6(4):787-90.
18. VENEZIANO M, ZARACA F, FRAMARINO M, DI PAOLA M, GIOBBE M, MONTEMURRO L, FABIANI C, FILIPPOUSSIS P, MANCICNI B, MARZETTI L, CARBONI M. Chir Ital. 1999 May-Jun;51(3):241-5.
19. HEALY, D.L., et al., Angiogenesis: a new theory for endometriosis. Hum Reprod Update, 1998. 4(5): p. 736-40.
20. TAYLOR, R.N., D.I. LEBOVIC, AND M.D. MUELLER, Angiogenic factors in endometriosis. Ann N Y AcadSci, 2002. 955: p. 89-100; discussion 118, 396-406.
21. SHIFREN, J.L., et al., Ovarian steroid regulation of vascular endothelial growth factor in the human endometrium: implications for angiogenesis during the menstrual cycle and in the pathogenesis of en dometriosis. J Clin Endocrinol Metab, 1996. 81(8): p. 3112-8.
22. PELLICER, A., et al., The follicular and endocrine environment in women with endometriosis: local and systemic cytokine production. FertilSteril, 1998. 70(3): p. 425-31.
23. BARTOSIK D: Endometrial tissue in peritoneal fluid. FertilSteril 1986; 46: 796-800.
24. TASUKU H: Role of cytokines in endometriosis. Fertil Steril 2001; 76: 1-10. Las células Natural Killers (NK) participan en la inmunovigilancia del organismo, son las encargadas de reconocer y destruir células tumorales, células infectadas con virus y líneas celulares trasplantadas.
25. DAN I: Inmunobiology of endometriosis. FertilSteril 2001; 75: 1-10.
26. OOSTERLYNCK DJ: Immunosuppressive activity of peritoneal fluid in women with endometriosis. Obstetric Gynecol 1993;82: 206-12.
27. DMOWSKI, W.P., Immunological aspects of endometriosis. Int J Gynaecol Obstet, 1995. 50 Suppl 1: p. S3-10.
28. ITOGA T, MATSUMOTO T, TAKEUCHI H, YAMASAKI S, SASAHARA N, HOSHIT, et al. Fibrosis and smooth muscle metaplasia in rectovaginal endometriosis. Pathol Int. 2003;53:371-5.
29. CATERINO S, RICCA L, CAVALLINI M, CIARDI A, CAMILLI A, ZIPARO V. annitalchir 2002 mayjun;73(3):323-9; discussion 329-30
30. CAMPAGNACCI R, PERRETTA S, GUERRIERI M, PAGANINI AM, DE SANCTIS A, CIAVATTINI A, LEZOCHE E. surgendosc. laparoscopic colorectal resection for endometriosis. 2005; 19(5):662-4.
31. URBACHDR, REEDIJK M, RICHARDCS, LIE KI, ROSS TM. BOWEL resection for intestinal endometriosis. dis colon rectum. 1998;41:1158-64.
32. HIGGS H, NORONHA F, RAMOS DIASJL. intestinal endometriosis. Acta medport. 1995;8:635-8.
33. HIGGS H, NORONHA F, RAMOS acta medport. 1995 nov;8(11):635-8
34. AZZENA A, LITTA P, FERRARA A, PERIN D, BROTTO M, CHIARELLI S, SANDEI F. Clin Exp Obstet Gynecol. 1998; 25(3):94-6.
35. GIUDICE LC, KAO LC. Endometriosis. The Lancet 2004; 364: 1789-99.
36. 36. DIMOULIOS P, KOUTROUBAKIS IE, TZARDI M. A case of sigmoid endometriosis difficult to differentiate from colon cancer. BMC Gastroenterol 2003; 3:18.
37. LEVITT MD, HODBY KJ, VAN MERWYK AJ. Cyclical rectal bleeding in colorectal endometriosis. Aust N Z J Surg 1983; 59: 941-3)
38. OLIVE DL, PRITTS EA. Treatment of endometriosis. N Engl J Med 2001; 345: 266-74.
39. SEYFER AE, MOLOGNE LA, MORRIS RL, CLARK JR. Endometriosis causing acute small bowel obstruction: Report of a case and review of the literature. Am Surg1975; 41: 168-71
40. VIALLE R, PIETIN-VIALLE C, BURDY G, DRAIN O, GILLOT V, BERNIER M, et al. Peritonitis by sigmoid perforation in two patients with endometriosis: report o two cases. Gastroenterol Clin Biol. 2005;29:924-4.
41. PRYSTOWSKY JE, STRYKERS J, UJIKI GT ET AL. Gastrointestinal Endometriosis. Arch Surg. 1988; 123:855 – 857.
42. OWLAND R, VERNON-ROBERTS B. Endometriosis of the appendix. Br J Surg1981; 68:121- 4.
43. RIDHA JR, CASSARO S. Acute small bowell obstruction secondaryto ileal endometriosis: report of case. Surg Today 2003; 33: 944-7.
44. CHASSANG M, NOVELLAS S, Bloch Marcotte C. Utility of vaginal and rectal contrast medium in MRI for the detection of deep pelvic endometriosis. Eur Radiol 2009; Oct 23,in print.,
45. FRIEDMAN H, VOGELZANG RL, MENDELSON EB, NEIMAN HL, COHEN M. Endometriosis detection by US with laparoscopic correlation. Radiology.1985; 157:217-20.
46. KOGA K, OSUGA Y, YANO T, MOMOEDA M, HIROTA Y, KUGU K, et al. Characteristic images of deeply infiltrating rectosigmoid endometriosis on transvaginal and transrectal ultrasonography. HumReprod.2003;18:1328-33.
47. IKODA F, VANNI D, VASCONCELOS A, PODGAEC S, ABRAO MJ. Micro laparoscopy vs conventional laparoscopyfor the management of early stage pelvic endometriosis, a comparison. J Reprod Med. 2005; 50: 771-8.













