Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.33 n.1 Lima ene./mar. 2013
REPORTE DE CASOS
Neoplasia intraductal papilar quística mucinosa del páncreas y pancreatitis recurrente
Intraductal papillary mucinous neoplasm
Eduardo Gálvez 1, Gustavo Gálvez 1, Aurelio Barboza 2, Eduardo Barboza 2, Juan Manuel Combe 3, Mario R. Combe 3, Juan Combe 3, Javier Arias Stella C. 4, Javier Arias Stella 4
1 Servicio de Gastroenterología, Clínica San Pablo, Lima, Perú.
2 Departamento de Cirugía, Clínica San Felipe, Lima, Perú.
3 Instituto Enfermedades Neoplásicas, Lima, Perú.
4 Instituto Arias Stella, Clínica San Felipe, Lima, Perú.
RESUMEN
La neoplasia Intraductal papilar quística mucinosa (NIPM) fue descrita por primera vez en 1982 por Ohashi, como una neoplasia del páncreas caracterizada por una proliferación de células neoplásicas mucinosas, que forman papilas y causan dilatación del ducto principal o sus ramas. Las NIPM representan el 1% de las neoplasias pancreáticas y el 25% de las neoplasias quísticas. Son potencialmente malignas, progresan desde una lesión benigna hasta carcinoma en un promedio de 5 años. Afecta con mayor frecuencia al sexo masculino entre 60 y 70 años, con síntomas de pancreatitis crónica o pancreatitis aguda recidivante y se localiza preferentemente en la cabeza y proceso uncinado. La clasificación depende de su localización, en variante ducto principal, variante rama lateral o mixto y la importancia radica en el pronóstico, con incidencia de cáncer que varía de 25% a 70%. Las imágenes (T.E.M y Colangio RM) nos permiten establecer el diagnóstico, la variedad, la localización, la extensión y determinar indicios de benignidad o malignidad. Además la eco endoscopía nos permite obtener una muestra y poder estudiar el líquido del quiste. El tratamiento de estas neoplasias es la duodeno pancreatectomía de Whipple. Reportamos un paciente obeso, con historia de pancreatitis recurrente, observado a lo largo de 10 años por una lesión quística del páncreas que creció en los últimos 24 meses. El estudio eco endoscópico y el análisis del líquido del quiste orientó al diagnóstico de NIPM por lo que se le sometió a una resección duodeno pancreática con evolución favorable. El estudio histológico confirmó el diagnóstico de NIPM.
Palabras clave: Neoplasias; Pancreatitis; Enfermedad de Whipple (fuente: DeCS BIREME).
ABSTRACT
Ohashi described for the first time the IPMN on 1982 as a pancreatic neoplasia with mucine cells forming papillae and producing dilatation of the main pancreatic duct or its branches. The IPMN represent the 1% of the pancreatic tumors and 5% of the cystic neoplasias. It is potentially malignant in a period of five years being more frequent in males between 60-70 and clinically these patients presents as acute, recurrent or chronic pancreatitis, with an incidence of malignancy from 25% to 70%. CT scan and cholangio MRI allows the diagnosis, the variety, localization and possibility of determine malignancy. The treatment is the Whipple resection. We are reporting the case of an obese middle age male, being observed along the last 10 years because of recurrent pancreatitis with a cystic lesion of the head of the pancreas. The CT scan, endoscopic-ultrasound and the analysis of the liquid content suggested a mucinous lesion, reason why the patient underwent a pancreatic-duodenal resection. The histology study confirms the diagnosis of IPMN.
Key words: Neoplasm; Pancreatitis; Whipple disease (source: Me SH NLM).
INTRODUCCIÓN
Las neoplasias intraductales papilares mucinosas del páncreas, fueron descritas por Ohashi en 1982 y se caracterizan por presentar proliferación de células neoplásicas que forman papilas y dilatan el conducto principal del páncreas o sus ramas, Son potencialmente malignas y representan el 1% de las neoplasias del páncreas y el 25% de las neoplasias quísticas.
Clínicamente se presentan con cuadros de pancreatitis aguda recurrente o pancreatitis crónica, pudiéndose observar incidentalmente en exámenes por imágenes.
Presentamos el caso de un tumor NIPM con presentación de pancreatitis recurrente y con imágenes de quiste pancreático.
ENFERMEDAD ACTUAL
Paciente varón de 55 años de edad que es evaluado por presentar cuadro de pancreatitis aguda a repetición Acude con un tiempo de enfermedad de 12 horas de dolor epigástrico en banda de moderada intensidad, constante, irradiado a la espalda. Niega la presencia de náuseas, vómitos, deposiciones líquidas, ictericia, coluria y/o alergias a medicamentos.
Refiere tener sobrepeso (peso al ingreso 125 kg), consumo discreto de licor, fumador hasta hace 15 años de manera moderada. Antecedentes de hipertensión arterial tratado con Losartán y Amlodipino. Diabetes Mellitus tipo 2 recibiendo Metformina. Litiasis ureteral bilateral, 2007. Colecistectomía laparoscópica 2009. Pancreatitis aguda Balthazar E con pseudoquiste en 1999. Pancreatitis aguda Balthazar E 2003. Pancreatitis aguda Balthazar D en mayo 2010 con re-hospitalización junio 2010 por reagudización del cuadro; la resonancia magnética muestra lesión quística multitabicada en cabeza de páncreas. Ver Figuras 1 y 2.
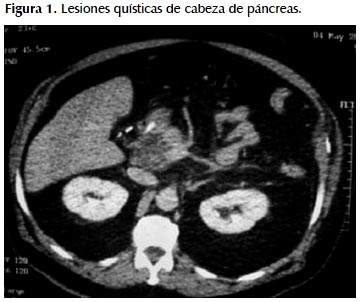
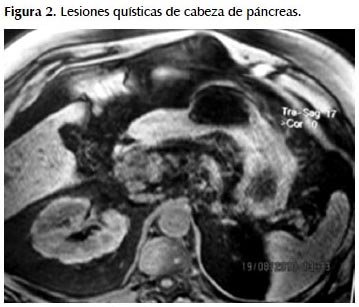
EXAMEN FÍSICO
Al ingreso presión arterial de 160/90, frecuencia cardiaca 88 por minuto, frecuencia respiratoria 18 por minuto, temperatura 36,7. Paciente obeso (peso: 125 kg) hidratado sin distress aparente, abdomen con ruidos hidroaéreos presentes, abdomen globuloso, blando, depresible, doloroso a la palpación en epigastrio (2+), no rebote, Murphy (-). El resto del examen físico no fue contributorio.
ANÁLISIS DE LABORATORIO Y ESTUDIOS AUXILIARES
Amilasa; 1948, U/L, glucosa 140 mg/dl, urea 25 mg/dl, creatinina sérica 1,14 mg/dl, leucocitos 8190 3% abastonados, hematocrito 43,5%, VS 9 mm/hora, TGO 28, TGP 41, HDL 274, lipasa 778, calcio 8,9, Proteína C reactiva 1,30 mg/dl, inmunoglobulina G 730 mg/dl, glucosa 92 mg/dl.
El paciente ingresa para completar estudios no encontrándose causas que expliquen el episodio de pancreatitis, tiene amilasa y lipasa elevadas con reactantes de fase aguda elevados, el perfil hepático es normal, no hipertrigliceridemia, ni hipercalcemia; Inmunoglobulina G está dentro de rango normal y no hay estudios que sugieran pancreatitis autoinmune, lo que aleja este diagnóstico. Tiene historia de haber sido colecistectomizado 8 meses antes por presentar barro biliar con la intención de eliminar posible factor causal de pancreatitis y en nuevas ecografías abdominales no hay indicios de litiasis residual, así como en la colangioresonancia magnética.
Por el hallazgo previo de lesión quística se decidió realizar una nueva colangiopancreatografía por resonancia magnética la que mostró crecimiento de un proceso quístico multitabicado y multilobulado, de contornos definidos, que no se asocia a componente sólido o captación patológica de sustancia de contraste, localizado en el proceso uncinado de páncreas, de 4,7x3,9x5,7 cm (Figura 3), y que muestra un conducto único que se comunica con el conducto pancreático principal; se asocia a parénquima pancreático de caracteres normales sin otras lesiones focales en el resto del mismo.
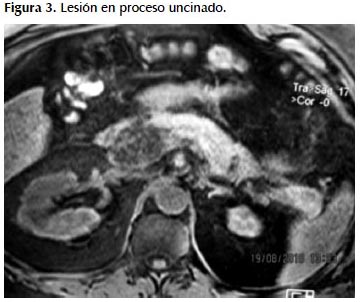
Se realizó Colangiografía endoscópica retrógrada para visualizar mejor las vías biliares, ver Figura 4 encontrándose la papila en ubicación habitual, con poro único.
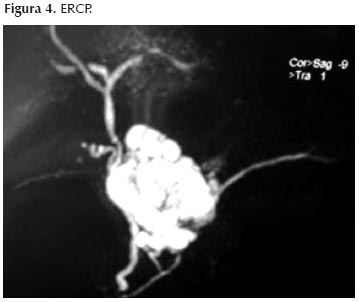
Al canular el colédoco se opacificó adecuadamente, evidenciándose tortuosidad del lumen en el extremo distal pre-ampular; el diámetro máximo mide 4 mm; la vía biliar intrahepática no está dilatada; incidentalmente se visualiza imagen radiotransparente pequeña poliédrica (2 mm) en la porción final ampular del colédoco.
Se procede a realizar esfinterotomía amplia (15 mm) hasta el límite de seguridad, con buen drenaje de contraste y bilis. Se pasa catéter balón (8 mm), sin demostrar litiasis.
Al no encontrarse lesiones en las vías biliares, se procede a realizar ecoendoscopía para tener una mejor visualización del quiste pancreático y posibilidad de obtener fluido para estudio.
En la ecoendoscopía se observa la vena porta de 10 mm, arteria hepática de forma y eco patrón conservados, la cabeza del páncreas muestra múltiples tractos finos hiper-ecogénicas, así mismo lesión quística que se extiende hacia el proceso uncinado, que mide en 44x52 mm, paredes hiper-ecogénicas de 1,2 mm de espesor, multitabicada, dando aspecto multiquístico, con lesiones menores de 2 cm, sin calcificación evidente, con múltiples vasos gruesos (1-2 mm), en toda su cápsula externa y no compromete la vena porta. El conducto pancreático a nivel de la cabeza mide 3mm. en su diámetro máximo y el colédoco intrapancreático de 5 mm.
La cola y el cuerpo de páncreas muestran patrón hiper-ecogénico que alterna con zonas hipo-ecogénicas, lo que es sugerente de inflamación crónica. El conducto pancreático a este nivel mide 2 mm. No se visualiza la vesícula biliar; no se observan signos de malignidad.
Se procede a realizar PAFF de lesión quística pancreática con aguja #22 obteniéndose líquido mucoide para estudios de PAP, bioquímico y marcadores tumorales. Una dificultad para estos estudios es que el volumen de los quistes suele ser escaso lo que dificulta su análisis; en este caso el estudio cito-químico mostró 2 cc. de líquido turbio, ligeramente sanguinolento, presenta escasa celularidad donde se observa fondo proteinaceo de apariencia mucoide, polimorfonucleares en regular cantidad, hematíes, histiocitos, detritus y escasas células epiteliales cúbicas y cilíndricas; en algunas se aprecia contenido mucoide que sugiere neoplasia quística mucinosa con proceso inflamatorio asociado.
El análisis bioquímico mostró deshidrogenasa láctica de 3167 U/L, amilasa de 10 U/l, lipasa de 34 U/L. Los niveles de amilasa y lipasa son usados para confirmar la presencia de pseudoquiste que tiene usualmente niveles elevados en rango de mil o más, a diferencia de los adenomas mucinosos y serosos en los que se encuentran disminuidos como en nuestro caso, por lo que se aleja el diagnóstico de pseudoquiste.
En lo que respecta a marcadores tumorales el único que ha demostrado utilidad es el CEA en diferenciar quiste seroso (niveles bajos) del mucinoso (niveles altos). Su uso no es aprobado por la FDA, por cuanto los niveles varían mucho entre estudio y estudio.
Los resultados de marcadores tumorales del paciente mostraron CEA 66,7 ng/ml, CA125 es 180,5 ng/ml, CA 19,9 es 124,141 ng/ml.
Con estos resultados el diagnóstico de quiste neoplásico tomó mayor importancia así como su participación en los cuadros de pancreatitis recurrentes por lo que se decidió manejo quirúrgico.
PROCEDIMIENTO QUIRÚRGICO
Laparotomía Exploradora + Pancreatoduodenectomía proximal (WHIPPLE) + anastomosis pancreato-yeyunal termino lateral (BLUMGART) transmesocólica + hepato-yeyunoanastomosis término lateral + gastroyeyuno anastomosis ante cólica con Braun complementario.
Hallazgos operatorios.- Masa sólido-quística de 10x10 cm que compromete la cabeza del páncreas. No se observan implantes tumorales ni metástasis hepática. La lesión no compromete los vasos mesentéricos. No se encuentra la vesícula biliar y el colédoco mide 4 mm de diámetro. Hígado esteatósico.
Durante el acto operatorio el paciente no recibió transfusiones de sangre y salió de alta el día 10 del post operatorio.
PATOLOGÍA
Evaluación macroscópica
Se recibe fragmento de epiplon, segmento distal de estómago, duodeno, acompañado de cabeza de páncreas y colédoco. La cabeza de páncreas mide 8,6x4, 5x3,8 cm, páncreas de color pardo (Figura 5). Al corte se observa múltiples formaciones quísticas ubicadas en sus bordes superiores, en un área total de 5x2x2 cm conteniendo sangre y material mucoide, de paredes delgadas, algunos con proyecciones papilares.
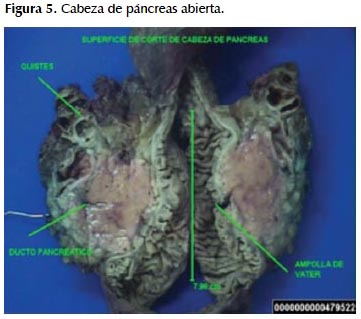
Parénquima pancreático restante de color pardo-amarillento, ligeramente congestivo, conducto colédoco mide 6x0,6 cm permeable con estrechez a nivel de la ampolla de Vater, observándose además el conducto principal pancreático de 4 cm de longitud por 0,1 cm de diámetro mayor, permeable. Borde quirúrgico pancreático sin alteraciones macroscópicas; de la grasa peripancreática se disecan 20 ganglios linfáticos de 0,5 a 0,8 cm.
EVALUACIÓN MICROSCÓPICA
La alteración fundamental en este caso es la presencia de marcada dilatación de los conductos pancreáticos (Figuras 6, 7, 8, 9, 10 y 11) con variable hiperplasia de los conductos menores periféricos.
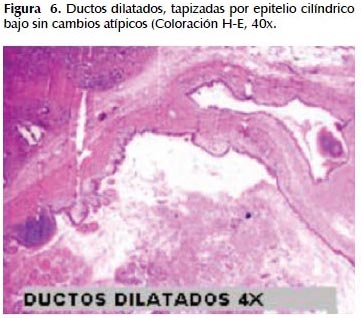
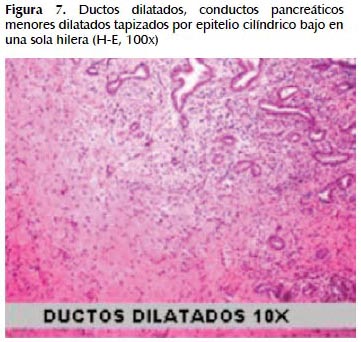
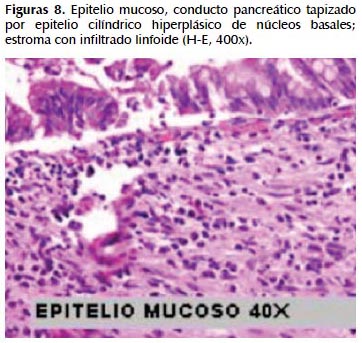
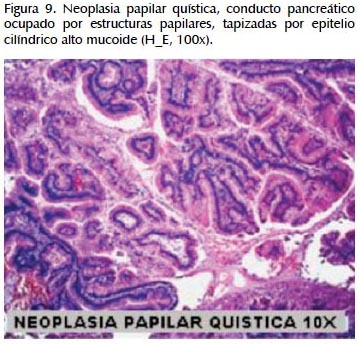
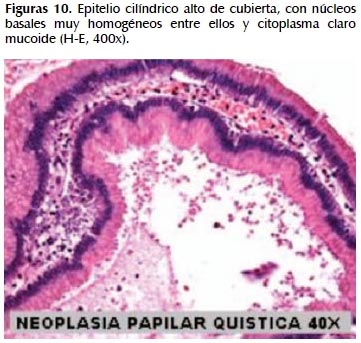
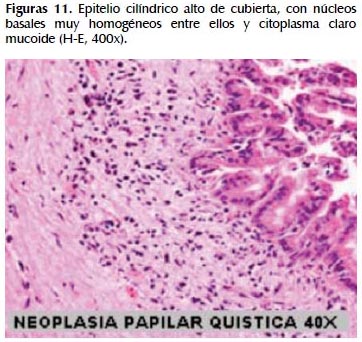
Los quistes están limitados por células ductales altas, algunas mucinosas, en su mayor extensión dispuestas en una fila. De manera focal se ve proyecciones papilares del epitelio y también focos de erosión con reacción inflamatoria, exudado linfocitario y formación de tejido de granulación.
El resto del parénquima pancreático muestra múltiples focos de autolisis y variable hiperplasia de los ductos.
La mucosa del estómago y del intestino muestra leve a moderada infiltración linfocitaria.
Los ganglios peri pancreáticos muestran hiperplasia linfoide y sinusoidal reactiva.
Páncreas con hiperplasia del epitelio ductal, margen quirúrgico pancreático libre, ganglios peri pancreáticos con hiperplasia linfoide y sinusoidal reactiva, estómago y duodeno sin alteraciones de significación, epiplón con tejido fibroadiposo con aislados focos de infiltración linfocitaria. Libre de proliferación celular atípica.
Diagnóstico Final.- Neoplasia Intraductal papilar quística mucinosa.
NEOPLASIA MUCINOSA PAPILAR INTRADUCTAL
Descrita por primera vez en 1982 en pacientes con diagnóstico de carcinoma pancreático que tuvieron buen pronóstico (1). Es un tumor originado a partir del ducto pancreático principal o sus ramas ductales, por lo que usualmente se demuestra una conexión del tumor con éstas. Otra característica es el de una producción importante de mucina causando dilatación ductal. Su tamaño suele ser mayor de 1 cm en diámetro y muestra predominantemente arquitectura papilar. Son potencialmente malignos y progresan desde una lesión benigna (hiperplasia), a adenoma (displasia leve), luego borderline (displasia moderada) y finalmente carcinoma (displasia de alto grado) pudiendo ser invasiva o no (2), esta secuencia está reconocida y ocurre a lo largo de varios años, siendo considerado de 5 a 7 años (3,4) y en algunos otros describen la progresión de 15-20 años (5-7). El riesgo de transformación maligna es particularmente importante dependiendo de su localización y tamaño. Una característica importante es la producción abundante de mucina pudiéndose observar drenaje a través de la papila y es muy importante cuando se obtiene por PAAF. Son lesiones que inicialmente fueron poco reportadas, pero que con los avances en estudios por imágenes son las que más frecuentemente se reportan en las series actuales (8,9).
Se han descrito 3 tipos histológicos: 1) Tipo intestinal que es el más común, tiene estructuras vellosas bien definidas cubiertas por células elongadas pseudoestratificadas, de manera similar a los adenomas vellosos de colon, algunos casos pueden tener células caliciformes. Esta variante muestra grados de displasia moderados a severos. 2) Tipo gástrico foveolar asociado la variante rama ductal, tienen epitelio o papilas aplanadas y las células muestran abundante mucina citoplasmática atípica y núcleos basofílicos con una disposición basal, muestran displasia de bajo grado o en el peor de los casos grado moderado. 3) Tipo pancreatobiliar, poco común, tienen una distribución papilar más arquitectónicamente compleja, con micropapilas y cribiformismo focal, hay mas atipia citológica los núcleos son redondos no presentan distribución pseudoestratificados, similares a las neoplasias de los conductos biliares. Usualmente tienen displasia de alto grado, Tanto el tipo intestinal como el pancreatobiliar muestran áreas de transición cubiertas por tipo gástrico foveolar lo que pudiera indicar que el foveolar puede ser un tipo precursor a los otros 2 (10).
Se presentan en hombres en mayores de 60 años (x: 70) y se localiza en la cabeza de páncreas, usualmente en el proceso uncinado; clínicamente pueden ser asintomáticos, así como producir episodios de dolor abdominal epigástrico con irradiación a espalda y es usual su asociación a episodios recurrentes de pancreatitis (11), pérdida de peso, ictericia y esteatorrea (12). Se han reportado en pacientes con Síndrome de Peutz Jeghers y síndromes de polipomatosis adenomatosa familiar y datos emergentes sugieren que pueden ser más comunes en pacientes con cáncer pancreático hereditario (12-14). Pueden ser clasificados por su localización en variante ducto principal, variante rama ductal o mixto cuando existe ambas presentaciones simultáneamente; la importancia en esta diferenciación es que los presentes en ductos laterales aparecen en pacientes más jóvenes, usualmente en la cabeza de páncreas y tiene menor grado de displasia y menor frecuencia de cáncer invasivo (15), pero por otro lado la enfermedad de ductos laterales se han reportado como multifocales en regiones distantes del páncreas hasta en el 30% de pacientes (16) y puede hacer recurrencia en aquellos pacientes con NMPI (IPMN) no invasivo que son sometidos a resección parcial de páncreas con márgenes quirúrgicos negativos hasta en el 10% (17).
El estudio por imágenes es una parte importante de la evaluación, que nos permite establecer el diagnóstico, definir la variedad de localización sea ducto principal o rama ductal, la extensión del compromiso ductal y determinar indicios de benignidad o malignidad.
Tomografía multidetector y Resonancia ductal, muestra dilatación de un segmento o de la totalidad del ducto pancreático revelando los defectos de llenado que representan tumor papilar, nódulos murales o glóbulos de mucina,; en casos de rama lateral se observa un racimo de pequeños quistes o la combinación de ambos (18). En casos de carcinoma invasivo se observa una masa sólida y la presencia de nódulos que indican carcinoma in situ (19). En lesiones menores de 3 cm la resonancia magnética es superior a la tomografía en demostrar comunicación con el ducto principal y morfología del quiste (20), la observación de nódulos pequeños es difícil, especialmente diferenciarlos de grumos de mucina, calcificaciones o hemorragias antiguas, especialmente si son menores de 2 cm. Un factor que ayuda a su detección es que son captadores de contraste (21). El uso de colangioresonancia mejorada con secretina ha sido recomendado por últimas publicaciones (22,23) pero su rol en NMPI es aún controversial y no específico. La idea es que mejore la visualización al incrementar la secreción exocrina permitiendo una mejor apreciación del conducto pancreático, teniendo en contra su costo y disponibilidad así como la posibilidad de efectos adversos como dolor abdominal. En casos de pancreatitis crónica su pobre respuesta a secretina podría ser de poca utilidad (24).
Colangiopancreatografía endoscópica retrógrada
Puede observarse dilatación del conducto principal, defectos de relleno o tumores papilares originados del ducto principal (25), así como una papila prominente que secreta mucina. Desventajas de este procedimiento son la inhabilidad del contraste de demarcar todo el conducto pancreático debido a la presencia intraductal de mucina (26) o presencia de tumor papilar, o un orificio papilar patente que produce escape de la sustancia de contraste, así como el potencial de producir pancreatitis aguda. La alternativa es realizar colangioresonancia (27).
Endosonografía endoscópica
Permite una mejor evaluación del contenido del quiste especialmente si es pequeño; permite evaluar septos internos, nódulos murales y áreas sólidas siendo los criterios de benignidad la presencia de septos delgados y compartimientos uniloculares simples. Los criterios de malignidad son paredes y septos gruesos y nódulos murales protuyentes. Otra utilidad de la endosonografía endoscópica es que permite obtener fluido para estudio, pero es un procedimiento dependiente del operador; su exactitud en distinguir benigno de maligno varia de 40% a 90% (28-33). Los criterios de malignidad señalados con este procedimiento son ducto principal >10 mm, lesión focal >3 cm y nódulo >5 mm (34,35).
Estudio de Líquido de Quiste
Varios marcadores tumorales han sido estudiados, siendo el CEA el que ha demostrado ser el más exacto en determinar la presencia de quistes mucinosos; los niveles a utilizarse han sido revisados en varios estudios, siendo el nivel de 192 ng/ml sugerido por el Massachusetts General hospital (36). Usando un metanálisis se rescata que un nivel >800 ng/ml es 98% específico para un quiste mucinoso y niveles menores de 5 ng/ml fueron 98% específicos para un cistoadenoma seroso (37).
El análisis molecular se puede realizar con un test comercial y el requerimiento de volumen requerido es bastante escaso lo que facilita el estudio, lo que no ocurre con estudios de análisis químico o citología. Se han demostrado cambios en KRAS, p53 y pérdida de SM16 y SMAD4. Es un campo de investigación activo y un grupo de la universidad de Pittsburgh demostró que los niveles incrementados de DNA junto con la presencia de mutación KRAS y la pérdida de heterogeneidad se asocian a neoplasia mucinosa (38).
Estudios recientes señalan que el análisis molecular es inferior a CEA en predicción de quistes mucinosos, teniendo menor sensibilidad que CEA, pero al combinarlos la sensibilidad llega a 100 sugiriendo que los estudios son complementarios (39), siendo confirmado en el estudio PANDA (40). Sin embargo aún se necesitan mayores estudios para llegar a una conclusión definitiva.
Manejo
Los pacientes que presenten lesiones con indicios de malignidad son candidatos a resección quirúrgica. Estos indicios son el compromiso del ducto principal (Wirsung) ó de una variante rama ductal, o tumores mayores de 3cm y con componentes sólidos. Clínicamente la presencia de ictericia, esteatorrea y/o diabetes mellitus de reciente aparición deben alertar al médico para recomendar el tratamiento quirúrgico (41).
El procedimiento consiste en pancreatectomía parcial (42). Es importante obtener evaluación intraoperatoria del margen quirúrgico por biopsia congelación para asegurar que el tumor no se extiende microscópicamente a través del conducto pancreático. La pancreatectomía total solo se indica cuando existe compromiso difuso del conducto pancreático, lo cual es muy infrecuente.
Los signos predictivos de carcinoma invasivo incluyen la dilatación >10 mm del ducto principal con compromiso difuso o multifocal, la presencia de nódulo mural grande o masa sólida, los contenidos intraluminal calcificados y la obstrucción del conducto biliar común (21, 43,44).
La sobrevida es >40% en NMPI invasivo y aún menor si se evidencia invasión ganglionar; en los casos en que no existe invasión la sobrevida aumenta a 70% (42).
NMPI asintomático, detectados incidentalmente por tomografía merecen observación vigilada, especialmente cuando el tamaño del colédoco es menor de 6mm y no existen nódulos murales, sin paredes y septos gruesos, o cuando el quiste es menor de 3cm de tamaño. Las lesiones de rama ductales asintomáticas sin componentes sólidos tienen baja prevalencia de cáncer invasivo y generalmente no cambian con el tiempo por lo que se puede hacer manejo conservador. Las lesiones <1 cm pueden tener seguimiento anual; las lesiones de 1-2 cm seguimiento de 6-12 meses y las lesiones >2 cm seguimiento de 3-6 meses. En los casos de aparición de síntomas, crecimiento del quiste por encima de los límites mencionados, aparición de nódulos o dilatación del conducto pancreático se sugiere resección. Si no hay cambios morfológicos o éste es mínimo después de varios años de observación el intervalo de seguimiento puede extenderse (45). Un incremento mayor de un cm en un año es muy sugestivo de malignidad (47).
El seguimiento post resección es importante porque la taza de recurrencia en NMPI no invasivo es 7% y la prevalencia de cáncer invasivo en variante rama ductal sintomática puede ser hasta 30% (4, 45,46). Las guías del International Association of Pancreatology sugieren seguimiento anual con tomografía y resonancia magnética en NMPI benignos que han recibido tratamiento quirúrgico, pudiéndose ampliar posteriormente el intervalo si no hay cambios en varios años. En los casos de NMPI invasivos se recomienda el seguimiento cada 6 meses (45,48).
La evidencia respecto a los márgenes quirúrgicos es contradictoria, por cuanto algunos encuentran que la presencia de enfermedad en los márgenes conlleva a recurrencia (49), mientras que otros no encuentran correlación (4), La recurrencia a pesar de márgenes negativos se explicaría por la naturaleza multifocal de NMPI y esta recurrencia aparece en zonas distantes (50).
En lesiones multifocales el manejo debe hacerse dependiendo de la edad del paciente y se recomienda resección quirúrgica de todo el páncreas teniendo presente que existe mayor probabilidad de malignidad En caso de lesiones pequeñas hay que mantener vigilancia y en casos de duda proceder con resección segmentaria (45).
BIBLIOGRAFÍA
1. Ohashi K, Mirukami Y, Muruyama M, Takekoshi T, Ohta H, Ohashi I. Four cases of mucus secreting pancreas cancer. Prog Dig Endosc. 1982;20:348-51. 2. Hruban RH, Takaori K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin AV, et al. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol. 2004;28(8):977–87 3. Salvia R, Festa I, Butturini G, Tonsi A, Sartori N, Biasutti C, et al. Pancreatic cystic tumours. Minerva Chir. 2004;59(2):185-207. 4. Sohn TA, Yeo CJ, Cameron JL, Hruban RH, Fukushima N, Campbell KA, et al. Intraductal papillary mucinous neoplasms of the pancreas: an updated experience. Ann Surg. 2004;239(6):788-97. 5. Yanagisawa A, Ohashi K, Hori M, Takagi K, Kitagawa T, Sugano H, et al. Ductectatic-type mucinous cystadenoma and cystadenocarcinoma of the human pancreas: A novel clinicopathological entity. Jpn J Cancer Res. 1993;84(4):474-9. 6. Zgraggen K, Rivera JA, Compton CC, Pins M, Werner J, Fernández-del Castillo C, et al. Prevalence of activating K-ras mutations in the evolutionary stages of neoplasia in intraductal papillary mucinous tumors of the pancreas. Ann Surg. 1997;226(4):491-8. 7. Shimizu Y, Yasui K, Morimoto T, Torii A, Yamao K, Ohhashi K. Case of intraductal papillary mucinous tumor (noninvasive adenocarcinoma) of the pancreas resected 27 years after onset. Int J Pancreatol. 1999;26(2):93-8. 8. Kirkpatrick ID, Desser TS, Nino-Murcia M, Jeffrey RB. Small cystic lesions of the pancreas: clinical significance and findings at follow-up. Abdom Imaging. 2007;32(1):119-25. 9. Parra-Herran CE, Garcia MT, Herrera L, Bejarano PA. Cystic lesions of the pancreas: clinical and pathologic review of cases in a five year period. JOP. 2010;11(4):358-64. 10. Katabi N, Klimstra DS. Intraductal papillary mucinous neoplasms of the pancreas: clinical and pathological features and diagnostic approach. J Clin Pathol. 2008;61(12):1303-13. 11. Barboza E, Ronceros V, Salinas E, Calmet F, Combe J, Huerta J, et al. Desafío clínico-quirúrgico de la pancreatitis aguda con obstrucción del conducto de Wirsung y sospecha de neoplasia pancrática. Rev Diagnóstico. 2002;41(5-6):229-34. 12. Hruban RH, Pitman MB, Klimstra DS. Tumors of the pancreas.Atlas of tumor pathology. 4th series, fascicle 6. Washington: American Registry of Pathology; 2007. 13. Su GH, Hruban RH, Bansal RK, Bova GS, Tang DJ, Shekher MC, et al. Germline and somatic mutations of the STK11/LKB1 Peutz–Jeghers gene in pancreatic and biliary cancers. Am J Pathol. 1999;154(6):1835-40. 14. House MG, Guo M, Iacobuzio-Donahue C, Herman JG. Molecular progression of promoter methylation in intraductal papillary mucinous neoplasms (IPMN) of the pancreas. Carcinogenesis. 2003;24(2):193-8. 15. Bernard P, Scoazec JY, Joubert M, Kahn X, Le Borgne J, Berger F, et al. Intraductal papillary-mucinous tumors of the pancreas: predictive criteria of malignancy according to pathological examination of 53 cases. Arch Surg. 2002;137(11):1274-8. 16. Kaneko T, Nakao A, Inoue S, Sugimoto H, Hatsuno T, Ito A, et al. Intraoperative ultrasonography by high- resolution annular array transducer for intraductal papillary mucinous tumors of the pancreas. Surgery. 2001;129(1):55-65. 17. Chari ST, Yadav D, Smyrk TC, DiMagno EP, Miller LJ, Raimondo M, et al. Study of recurrence after surgical resection of intraductal papillary mucinous neoplasm of the pancreas. Gastroenterology. 2002;123(5):1500-7. 18. Silas AM, Morrin MM, Raptopoulos V, Keogan MT. Intraductal papillary mucinous tumors of the pancreas. AJR Am J Roentgenol. 2001;176(1):179-85. 19. Vullierme MP, Giraud-Cohen M, Hammel P, Sauvanet A, Couvelard A, OToole D, et al. Malignant intraductal papillary mucinous neoplasm of the pancreas: in situ versus invasive carcinoma surgical respectability. Radiology. 2007;245(2):483-90. 20. Sainani N, Crippa S, Saokar A, Deshpande V, Fernandes-Del Castillo C, Sahani. Is thin-section MDCT accurate for evaluation of small pancreatic cysts (3 cm or smaller)? A comparative performance of MDCT and MR-MRCP. RSNA 2007. Chicago, USA. November 25-30, 2007. 21. Sahani DV, Kadavigere R, Blake M, Fernandez-Del Castillo C, Lauwers GY, Hahn PF. Intraductal papillary mucinous neoplasm of pancreas: multi-detector row CT with 2D curved reformations--correlation with MRCP. Radiology. 2006;238(2):560-9. 22. Fukukura Y, Fujiyoshi F, Sasaki M, Nakajo M. Pancreatic duct: morphologic evaluation with MR cholangiopancreatography after secretin stimulation. Radiology. 2002;222(3):674-680. 23. Matos C, Cappeliez O, Winant C, Coppens E, Devière J, Metens T. MR imaging of the pancreas: a pictorial tour. Radiographics. 2002;22(1):e2. 24. Akisik MF, Sandrasegaran K, Aisen AA, Maglinte DD, Sherman S, Lehman GA. Dynamic secretin- enhanced MR cholangiopancreatography. Radiographics. 2006;26(3):665-77. 25. Hara T, Yamaguchi T, Ishihara T, Tsuyuguchi T, Kondo F, Kato K, et al. Diagnosis and patient management of intraductal papillary-mucinous tumor of the pancreas by using peroral pancreatoscopy and intraductal ultrasonography. Gastroenterology. 2002;122(1):34-43. 26. Talbot ML, Foulis AK, Imrie CW. Total dorsal pancreatectomy for intraductal papillary mucinous neoplasm in a patient with pancreas divisum. Pancreatology. 2005;5(2-3):285-8. 27. Bassi C, Crippa S, Salvia R. Intraductal papillary mucinous neoplasms (IPMNs): is it time to (sometimes) spare the knife? Gut. 2008;57(3):287-9. 28. Hernadez LV, Mishra G, Forsmarck C, Draganov PV, Peterson JM, Hochwald SN, et al. Role of endoscopic ultrasound (EUS) and EUS-guided fine needle aspiration in the diagnosis and treatment of cystic lesions of the pancreas. Pancreas. 2002;25(3):222-8. 29. Sedlack R, Affi A, Vazques-Sequeiros E, Norton ID, Clain JE, Wierseman MJ. Utility of EUS in the evaluation of cystic pancreatic lesions. Gastrointest Endosc. 2002;56(4):543-7. 30. Frossard JL, Amouyal P, Amouyal G, Palazzo L, Amaris J, Soldan M, et al. Performance of endosonagraphy-guided fine needle aspiration and biopsy in the diagnosis of pancreatic cystic lesions. Am J Gastroenterol. 2003;98(7):1516-24. 31. Ahmad NA, Kochman ML, Lewis JD, Ginsberg GG. Can EUS alone differentiate between malignant and benign cystic lesions of the pancreas? Am J Gastroenterol. 2001;96(12):3295-300. 32. Gress F, Gottlieb K, Cummings O, Sherman S, Lehman G. Endoscopic ultrasound characteristics of mucinous cystic neoplasms of the pancreas. Am J Gastroenterol. 2000;95(4):961-5. 33. Koito K, Namieno T, Nagakaea T, Shonai T, Hirokawa N, Morita K. Solitary cystic tumour of the pancreas: EUS pathologic correlation. Gastrointest Endosc. 1997;45(3):268-76. 34. Ahmad NA, Kochman ML, Brensinger C, Brugge WR, Faigel DO, Gress FG, et al. Interobserver agreement among endosonographers for the diagnosis of neoplastic versus non-neoplastic pancreatic cystic lesions. Gastrointest Endosc. 2003;58(1):59-64. 35. Okabayashi T, Kobayashi M, Nishimori I, Sugimoto T, Namikawa T, Okamoto K, et al. Clinicopathological features and medical management of intraductal papillary mucinous neoplasms. J Gastroenterol Hepatol. 2006;21(2):462-7. 36. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, et al. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330-6. 37. van der Waaij LA, van Dullemen HM, Porte RJ. Cyst fluid analysis in the differential diagnosis of pancreatic cystic lesions: a pooled analysis. Gastrointest Endosc. 2005;62(3):383-9. 38. Khalid A, McGrath KM, Zahid M, Wilson M, Brody D, Swalsky P, et al. The role of pancreatic cyst fluid molecular analysis in predicting cyst pathology. Clin Gastroenterol Hepatol. 2005;3(10):967-73. 39. Sawhney MS, Devarajan S, OFarrel P, Cury MS, Kundu R, Vollmer CM, et al. Comparison of carcinoembryonic antigen and molecular analysis in pancreatic cyst fluid. Gastrointest Endosc. 2009;69(6):1106-10. 40. Khalid A, Zahid M, Finkelstein SD, LeBlanc JK, Kaushik N, Ahmad N, et al. Pancreatic cyst fluid DNA analysis in evaluating pancreatic cysts: a report of the PANDA study. Gastrointest Endosc. 2009;69(6):1095-102. 41. Tanno S, Nakano Y, Nishikawa T, et al. Natural history of branch duct intraductal papillary mucinous neoplasms of the pancreas without mural nodules: long-term follow-up results. Gut. 2008;57(3):339-43. 42. Conlon KC. Intraductal papillary mucinous tumors of the pancreas. J Clin Oncol. 2005;23(20):4518-23. 43. Taouli B, Vilgrain V, Vullierme MP, Terris B, Denys A, Sauvanet A, et al. Intraductal papillary mucinous tumors of the pancreas: helical CT with histopathologic correlation. Radiology. 2000;217(3):757-64. 44. Kawamoto S, Horton KM, Lawler LP, Hruban RH, Fishman EK. Intraductal papillary mucinous neoplasm of the pancreas: can benign lesions be differentiated from malignant lesions with multidetector CT? Radiographics. 2005;25(6):1451-68. 45. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al. Internacional Association of Pancreatology. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006;6(1-2):17-32. 46. Salvia R, Fernández-del Castillo C, Bassi C, Thayer SP, Falconi M, Mantovani W, et al. Main-duct intraductal papillary mucinous neoplasia of the pancreas: clinical predictors of malignancy and long-term survival following resection. Ann Surg. 2004;239(5):678-85. 47. Yamaguchi T, Baba T, Ishihara T, Kobayashi A, Nakamura K, Tadenuma H, et al. Long-term follow- up of intraductal papillary mucinous neoplasm of the pancreas with ultrasonography. Clin Gastroenterol Hepatol. 2005;3(11):1136-43. 48. Belyaev O, Seelig MH, Muller CA, Tannapfel A, Schmidt WE, Uhl W. Intraductal papillary mucinous neoplasms of the pancreas. J Clin Gastroenterology. 2008;42(3):284-94. 49. Raut CP, Cleary KR, Staerkel GA, Abbruzzese JL, Wolff RA, Lee JH, et al. Intraductal papillary mucinous neoplasms of the pancreas: effect of invasion and pancreatic margin status on recurrence and survival. Ann Surg Oncol. 2006;13(4):582-94. 50. DAngelica M, Brennan MF, Suriawinata AA, Klimstra D, Conlon KC. Intraductal papillary mucinous neoplasms of the pancreas: an analysis of clinic pathologic features and outcome. Ann Surg. 2004;239(3):400-8.
Correspondencia:
Eduardo Gálvez Guerra
E-mail: edu_gal@hotmail.com
Citar como: Gálvez E, Gálvez G, Barboza A, Barboza E, Combe JM, Combe MR, et al. Neoplasia intraductal papilar quística mucinosa del páncreas y pancreatitis recurrente. Gastroenterology training today. Rev Gatroenterol Peru. 2013;33(1):66-74.
Recibido: 24/10/2012;
Aceptado: 21/02/2013













