Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.33 n.1 Lima ene./mar. 2013
REPORTE DE CASOS
Extracción endoscópica por CPRE de Fasciola hepática viva: reporte de dos casos y revisión de la literatura
Endoscopic removal by ERCP of Fasciola hepatica alive: two cases report and review of the literature
Luis Lazo Molina 1a, Renato Garrido Acedo 1,2a, Bertha Cárdenas Ramírez 1b, Juan Torreblanca Nava 1,2c
1 Servicio de Gastroenterología del Hospital Nacional Guillermo Almenara Irigoyen. Essalud. Lima-Perú.
2 Unidad de Vías Biliares y Páncreas, Hospital Nacional Guillermo Almenara Irigoyen. Essalud. Lima-Perú.
a Médico asistente, b Médico residente, c Médico Jefe
RESUMEN
Presentamos dos casos de fascioliasis crónica en pacientes procedentes de la zona andina del Perú, con sintomatología de varios meses de evolución, con dolor tipo biliar, coluria e ictericia en uno de los casos. Ambos referidos al Servicio de Gastroenterología del Hospital Nacional Guillermo Almenara Irigoyen para estudio por sospecha de colédocolitiasis. Se les realizó exámenes de laboratorio que mostraban aumentos variables en las pruebas de función hepática (colestasis) y en uno de ellos eosinofilia marcada. Se realizó colangioresonancia magnética (CRMN) en ambos casos demostraron imagen sugestiva de cálculo en colédoco. La pancreatocolangiografía retrograda endoscópica (CPRE) fue realizada y luego de esfinterotomía, se extrajo un parásito aplanado, lanceolado, con movilidad activa morfológicamente compatible con Fasciola hepática en ambos casos. Posterior a la CPRE se inició tratamiento antiparasitario con triclabendazol, siendo la evolución clínica favorable.
Palabras clave: Fasciola hepática; Fascioliasis; Pancreatocolangiografía retrógrada endoscópica (fuente: DeCS BIREME).
ABSTRACT
We report two cases of biliary fascioliasis in patients from the highlands of Peru; with several months of symptoms characterized for biliary-type pain, dark urine and jaundice in one case. Both of them referred to the department of Gastroenterology of the Hospital Nacional Guillermo Almenara Irigoyen for suspicious of choledocolithiasis. Laboratory tests were performed which showed variable high levels of functional liver tests (cholestasis) and marked eosinophilia in one case. Magnetic resonance cholangiography (CRMN) was performed and then informed as an apparent image of biliary stone in choledocus in both cases. Endoscopic retrograde cholangiopancreatography (ERCP) was performed and after sphincterotomy, one flattened, lanceolate parasite, with active mobility morphologically compatible with Fasciola hepatica was extracted. After the ERCP antiparasitic treatment was given with triclabendazole. Clinical outcome was favourable.
Key words: Fasciola hepatica; Fascioliasis; Cholangiopancreatography, endoscopic retrograde (source: Me SH NLM).
INTRODUCCIÓN
La fascioliasis o distomatosis es una infección zoonótica causada por el trematodo Fasciola hepática (F. hepática), un parásito en forma de hoja (duela) que infecta a animales herbívoros en especial al ganado ovino y vacuno en diversas zonas del mundo (1). Su presencia es más común en países en vías de desarrollo (2).
La mayoría de los reportes de infección humana han venido de América del Sur, Europa, África, China, Australia y Oriente Medio, pero los casos esporádicos también se han reportado en los Estados Unidos (3,4).
La incidencia de la fascioliasis en el ser humano ha ido en aumento durante las tres últimas décadas. En 2002, se estimó que 2,4 millones de personas se infectaron en 61 países y más de 180 millones estuvieron en riesgo de contraer la infección (5). En América Latina es una parasitosis endémica y en México hay más de 100 casos publicados (6).
A nivel mundial, los Andes sudamericanos son las zonas más afectadas. Por ejemplo, se reporta hasta un 67% de prevalencia en el altiplano boliviano y un 72% en el altiplano peruano (7,8).
La situación actual de la fascioliasis humana en nuestro país es dramática y aún desconocida por la mayoría de médicos. Las más altas tasas de prevalencia por pruebas coprológicas van desde 8% en Cajamarca, 34,2% en Junín, 35% en Puno y por pruebas serológicas hasta un 36,3% en Junín (8-14). La mayoría de casos se presenta en niños de entre 5 a 15 años de edad. Asimismo, algunas otras zonas ganaderas como Ancash (1,3%) y Huancavelica han presentado reportes de casos. En Lima se ha observado un incremento de casos importados como consecuencia de las migraciones a las ciudades, así como también han aparecido nuevas áreas endémicas como Canta y Huarochirí (15%) en la región Lima (15).
La oveja es el huésped definitivo usual y el hombre es un huésped accidental. Esta parasitosis se adquiere en humanos por la ingesta de berros (Nasturtium officinale), lechuga (Lactula sativa) así como agua contaminada no hervida (6).
La Fasciola hepática mide 25-30 mm x 10-15 mm, tiene forma lanceolada (hoja de laurel). La fasciola adulta vive en el conducto hepático y vía biliar común del huésped. Este parásito cuenta con un cono cefálico y un tegumento carnoso revestido por una cutícula con salientes espículas, tiene una ventosa anterior y otra ventral; sus huevos son ovalados, de color amarillo-café y pueden medir de 130 a 150 μm. por 60 a 90 μm (16).
El ciclo biológico inicia cuando los huevos inmaduros son liberados en los conductos biliares y posteriormente en las heces del ganado, los huevos embrionados se liberan en el agua en un plazo de 9 a 15 días para posteriormente liberar miracidios ciliados que nadan. Los miracidios invaden un huésped intermediario: los caracoles de la especie Lymnae y en éstos pasan por distintos estadios: esporocisto, redia y cercaria en un proceso que dura entre 4 a 7 semanas. Las cercarias se liberan de los caracoles y forman quistes en la vegetación acuática, conocidos como metacercarias (la forma infectante) y cuando esta vegetación contaminada es ingerida por mamíferos o humanos éstos adquieren la infección. Las metacercarias se desenquistan en el duodeno y forman larvas, que migran por la pared intestinal, cavidad peritoneal y penetran la cápsula de Glisson para llegar al parénquima hepático y de ahí a la vía biliar, en donde se alojan adhiriéndose a la pared de la vía biliar mediante las ventosas. En cuestión de 12 semanas alcanzan la forma adulta, adquiriendo la capacidad para producir huevos (ovoposición) (1). (Figura 1).
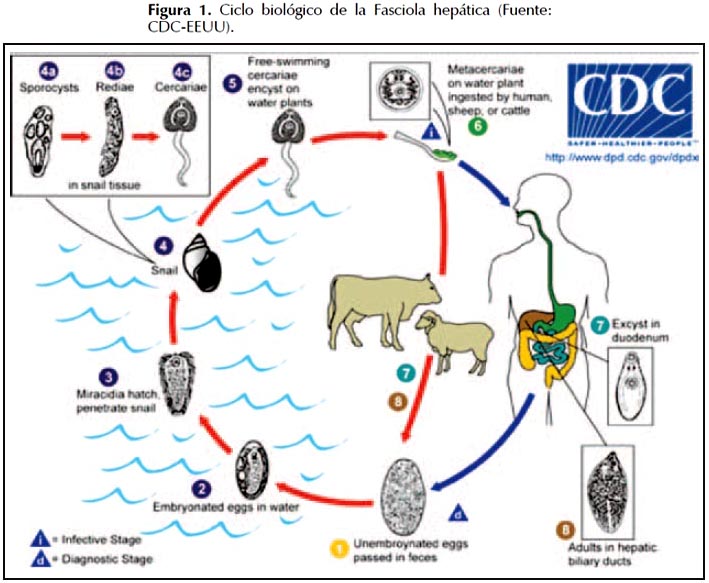
La infección con F. hepática tiene dos fases clínicas conocidas:
En la fase aguda se da la migración del parásito a través del parénquima hepático. Durante esta fase la sintomatología del paciente puede ser muy variada y presentar fiebre, dolor abdominal predominantemente en hipocondrio derecho, vómito, ascitis, eosinofilia, urticaria, hepatitis y hepatomegalia en diversos grados. Estas características aparecen 14 días después de la ingestión de agua contaminada (metacercarias infectantes) y puede durar 1 a 3 meses. Durante la infección aguda, ningún huevo se encuentra en las heces (1,17).
En la segunda fase, la crónica, o fase biliar, las formas jóvenes del trematodo migran hacia los conductos biliares, donde maduran y completa su forma adulta, comienzan a producir huevos, pudiendo permanecer sin provocar síntoma alguno por tiempo indefinido, o provocar un proceso inflamatorio local con hiperplasia epitelial, desencadenando además anemia, colangitis, colecistitis, obstrucción biliar y pancreatitis. Estos parásitos pueden predisponer a la formación de cálculos (6,18-22).
El diagnóstico puede ser confirmado por serología ELISA, en la fase aguda, con una sensibilidad >97% y especificidad >98% y por la identificación de los huevos en las heces o en aspirado duodenal, en la fase crónica (23).
La litiasis vesicular o coledociana asociada también es común, así como los huevos o los fragmentos de parásitos muertos pueden formar parte del núcleo de los cálculos (24).
Nosotros describimos dos casos de infestación por F. hepática que fue diagnosticada por pancreatocolangiografia retrograda endoscópica (CPRE) y se realizó la extracción endoscópica recibiendo la medicación antiparasitaria posteriormente.
CASO CLINICO 1
Se presenta el caso de una mujer de 47 años de edad natural, procedente de Huaraz - Ancash, Perú, quien tiene por antecedentes, hipertensión arterial y colecistectomía convencional electiva hace 10 años.
Viene con un tiempo de enfermedad de 8 meses caracterizado por dolor en hipocondrio derecho tipo opresivo irradiado a epigastrio de dos horas de duración asociado a náuseas y vómitos, asimismo, coluria sin ictericia. Es evaluada por facultativo de su ciudad de origen, quién indica analgésicos, que calman el dolor.
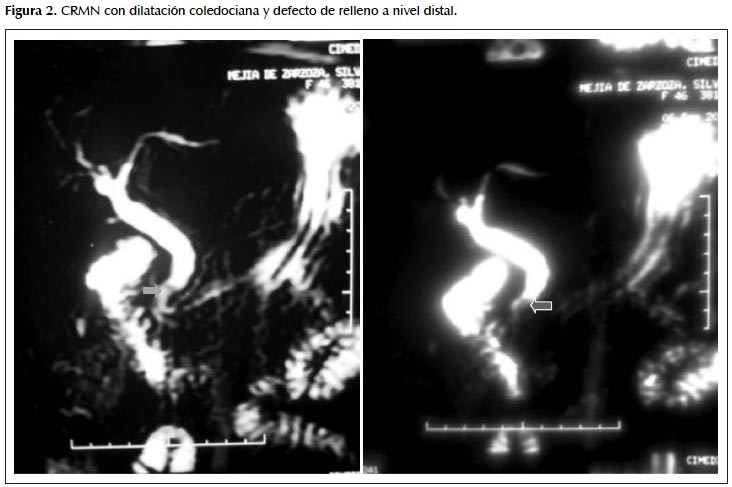
Dos semanas después presenta cuadro similar tras comida copiosa, acude al Hospital de Huaraz, se le realiza una tomografía computarizada (TC), no evidenciándose alteraciones. El cuadro clínico se ha presentado en forma intermitente durante los siguientes meses, por lo que la paciente es enviada a nuestro hospital. Se le realizan estudios de laboratorio TGP: 126, TGO: 87, albúmina: 4,03, BT: 0,9, BD: 0,26, fosfatasa alcalina: 322; Colangioresonancia magnética (CRMN) que muestra al hepático común y colédoco de 12 mm con imagen litiásica de 5 mm en su extremo distal. Por tal motivo, se indica hospitalización para CPRE terapéutica (Figura 2).
Exámenes de laboratorio de la hospitalización: FA: 103, GGTP: 51 TGP: 58 TGO: 45 bilirrubina total: 0,68, albumina: 4,27 leucocitos: 7650, neutrófilos: 59 % eosinófilos: 4,1% linfocitos: 33%, monocitos: 4% y hemoglobina: 14,7 g/dl.
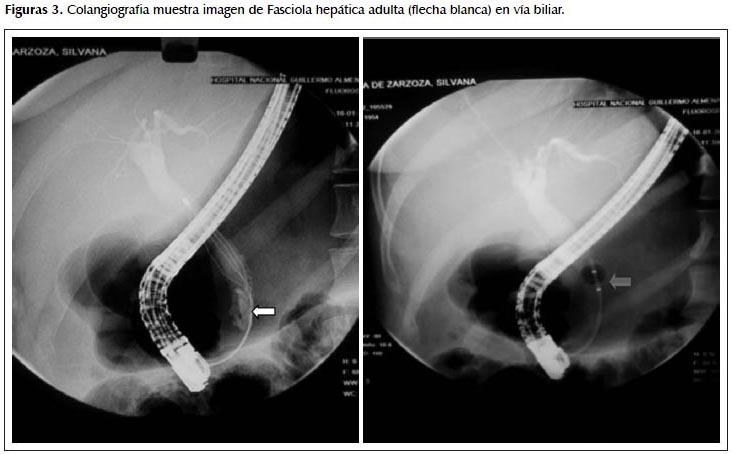
Se realizó CPRE: Papila alargada, se canula vía biliar a través de precorte por canulación difícil, se inyecta contraste observándose colédoco de 10 mm con imagen de sustracción en tercio distal del colédoco y presencia de pará sito aplanado, lanceolado, con movilidad activa morfológicamente compatible con Fasciola hepática. No lográndose extraer con canastilla de Dormia por lo que se extrae con balón. Se recupera espécimen y se envía al laboratorio de microbiología (Figura 3).
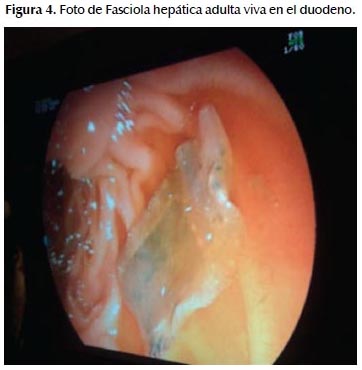
Examen directo: Macroscopía: espécimen adulto de Fasciola hepática; Microscopía: huevos maduros e inmaduros de Fasciola hepática. Se inicia tratamiento con Triclabendazol 10 mg/Kg de peso en dosis única (Figuras 4 y 5).
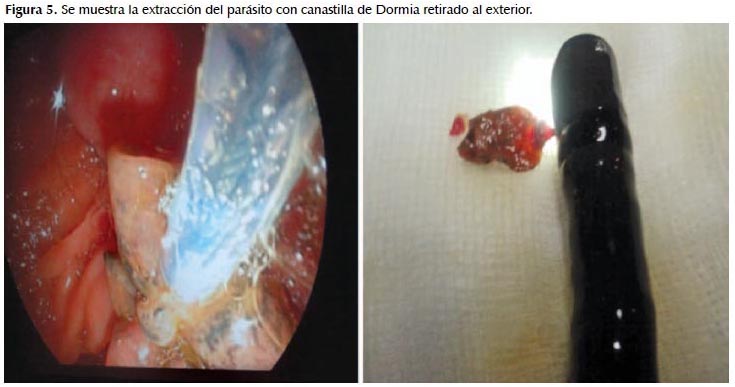
CASO CLINICO 2
Varón de 58 años procedente de Cajamarca, médico, con antecedente de hepatitis viral en la infancia.
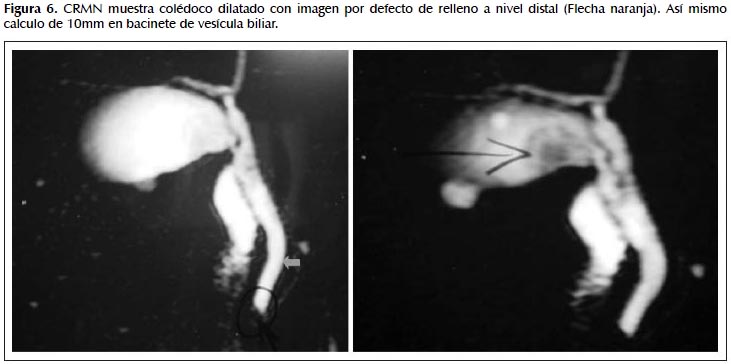
Tiempo de enfermedad de 8 meses de evolución caracterizado por dolor abdominal en cuadrante superior derecho tipo gravativo, el cual cede con antiespasmódico, además ,nota coluria e ictericia asociadas a dos episodios de dolor. Es evaluado por facultativo de su lugar de procedencia que le realiza estudios de laboratorio: perfil hepático: F. alcalina: 860, BT: 3,6 BD: 2,7, TGO: 62 TGP: 76, hemograma: leucocitos: 5850. eosinófilos: 16% (936). Estudios de imágenes: ecografía abdominal: hígado normal, colédoco de 4,8 mm, vesícula biliar con paredes engrosadas y un cálculo redondeado de 10 mm, en el bacinete. Páncreas normal. CRMN: colédoco de 13 mm, con pequeño cálculo en su interior cercano a la ampula de 3 mm. Wirsung de aspecto filiforme y calibre habitual. El paciente es hospitalizado para CPRE. (Figura 6).
CPRE: Se cánula la vía biliar, se inyecta contraste observándose colédoco de 13 mm con imagen de sustracción en tercio distal del colédoco, se procede a esfinterotomía y limpieza de vía biliar con balón extrayéndose un parásito aplanado, lanceolado morfológicamente compatible con Fasciola hepática.
El paciente recibió tratamiento con Triclabendazol (Fasinex 10%) 12 mg/kg VO en dosis única.
Se le realizó colecistectomía laparoscópica posteriormente, encontrándose cálculo único en bacinete de la vesícula. Evoluciona sin complicaciones. Sale de alta a las 48 horas.
DISCUSIÓN
Las manifestaciones clínicas van a depender del número de parásitos, de la duración y de la fase de la infección, aunque muchos de los casos presentan síntomas leves (25).La fase aguda (larva), migratoria, que se presenta entre 6 a 12 semanas después de la ingesta de metacercarias y en 80 a 90% de los casos se manifiesta con fiebre, dolor abdominal, cefalea, urticaria, leucocitosis con eosinofilia y aumento de la velocidad de sedimentación globular. La ausencia de eosinofilia no descarta el diagnóstico. En esta etapa, las enzimas hepáticas, fosfatasa alcalina y bilirrubinas son normales. En algunos casos las larvas migran hacia otros órganos, produciendo lesiones a vasos sanguíneos pulmonares, pleura, pericardio, ventrículos cerebrales, pared intestinal, tejido subcutáneo o mucosa faríngea (16).
La fase crónica (forma adulta), se presenta dos a cuatro meses después de la ingesta del parásito y su presentación clínica es muy variable: ausencia de síntomas, cuadros de dolor abdominal superior inespecífico, cólico biliar, fatiga crónica con duración de décadas o más y con enzimas hepáticas normales o aumentadas; puede o no presentarse eosinofilia y anemia crónica. En infecciones graves hay éstasis biliar, atrofia hepática y cirrosis periportal así como colecistitis, colelitiasis, colangitis, abscesos hepáticos y pancreatitis aguda y en casos prolongados puede dar como consecuencia, la aparición de colangitis esclerosante y cirrosis biliar (16).
Las manifestaciones clínicas de los casos que presentamos corresponden a la fase crónica, con dolor abdominal tipo biliar así como coluria. El caso número uno tenía aumento leve de fosfatasa alcalina y transaminasas con bilirrubina y eosinófilos en rango normal. El caso dos, presentó ictericia con eosinofilia absoluta.
En cuanto al diagnóstico imagenológico va a depender de la fase de enfermedad en la cual se encuentre el paciente, comprendiendo dos entidades: la fase aguda y la crónica.
En la fase del parénquima hepático (aguda), esta entidad obliga a un alto grado de sospecha dado que puede ser indistinguible de otras lesiones focales hepáticas. Los hallazgos ecográficos son inespecíficos. La TC puede mostrar regiones subcapsulares con nódulos múltiples periféricos, tubulares, tortuosos, entre 20 a 30 mm de diámetro, que se dirigen hacia el hilio hepático, sugiriendo el recorrido del parásito. La CRMN también puede utilizarse para determinar la participación del parénquima hepático y es mejor que la TC en la caracterización de lesiones hemorrágicas (26).
En fase de fascioliasis crónica, la ecografía tiene un rol mayor, dado que es capaz de constatar engrosamiento parietal del colédoco con dilatación moderada, además, con su capacidad para demostrar en vivo el movimiento del parásito dentro de los conductos dilatados (27). El rol de la TC es relativo, pudiendo solo mostrar mínima dilatación de la vía biliar extrahepática y de la confluencia de los hepáticos, siendo un hallazgo no específico (28). En la CRMN suele aparecer leve dilatación de los conductos biliares. La señal intermedia de defecto de llenado representa los parásitos que pueden verse en los conductos dilatados (28).
En cuanto a la microbiología, a las 10 semanas después de la infección, los huevos del parásito pueden ser detectados en las heces. El parásito adulto y los huevos también se pueden encontrar en el aspirado de líquido duodenal y biliar (29).
En relación a nuestros casos la TC no aportó información relevante y la CRMN objetivó dilatación del hepático común y colédoco con defecto de relleno a nivel distal, haciendo sospechar litiasis coledociana, razón por la cual, se realizó CPRE.
La esfinterotomía endoscópica seguida de la extracción con canastilla o balón es considerada el mejor método para tratar la parasitosis biliar, incluyendo también, la ascaridiasis biliar y la hidatidosis biliar (30,31). Reportes previos dan cuenta de la efectividad de este método para extraer F. hepática del árbol biliar y proveer así un adecuado drenaje biliar resolviendo los ataques de colangitis, ello asociado a un adecuado régimen antiparasitario (32-34).
Cabe mencionar que en aquellos casos de fascioliasis masiva de la vía biliar o resistencia al tratamiento oral algunos autores han propuesto la instilación transendoscópica, intraductal de una solución de povidona yodada al 2,5%, durante 10 minutos, en una cantidad de 20 cc, con el objetivo de asegurar la muerte de todos los parásitos adultos y huevos ubicados en el árbol biliar. No se reportan efectos colaterales locales de la vía biliar, ni sistémicos ya que la absorción biliar es mínima o nula (35,36).
Después del tratamiento endoscópico, los pacientes deben recibir un tratamiento sistémico que ha demostrado ser altamente eficaz contra F. hepática. El triclabendazol (TCBZ) ha sido el tratamiento de elección desde 1983, es activo contra las formas inmaduras y maduras del parásito (37). La OMS recomienda la dosis de 10-20 mg/kg/día de triclabendazol por uno o dos días con una tasa de curación del 83%. Otras alternativas incluyen: bitionol, emetina, dehidroemetina, cloroquina y prazicuantel; teniendo menor eficacia (38).
En el 2005 se reportó el primer caso de resistencia a TCBZ en Australia (39). Debido a esto, nuevas drogas en otras zonas del mundo están siendo utilizadas, tales como la nitazoxanida, que ha demostrado su eficacia contra la Fasciola hepática en algunos estudios clínicos aleatorios, controlados con placebo (40,41).
Nosotros describimos dos casos de fascioliasis en fase crónica, que fueron diagnosticados y tratados con CPRE asociado a triclabendazol. En su control ambulatorio después de un mes no presentaron sintomatología alguna.
BIBLIOGRAFÍA
1. Adel AFM. Trematodes and Other Flukes. In: Mandell GL, Bennett JE, Dolin R (Eds). Principles and practice of infectious diseases. 5th ed. Philadelphia: Churchill Livingstone; 2000. p. 2954-6. 2. Graham CS, Brodie SB, Weller PF. Imported Fasciola hepatica infection in the United States and treatment with triclabendazole. Clin Infect Dis. 2001; 33(1):1-5. 3. Maclean JD, Mahanty S. Liver, lung and intestinal fluke infections. In: Guerrant, RL, Weller PF (Eds). Tropical Infectious Diseases: Principles, Pathogens and Practice. 1st ed. Philadelphia. Churchill Livingstone; 1999. p. 1039. 4. Mas-Coma S. Epidemiology of fascioliasis in human endemic areas. J Helminthol. 2005; 79(3):207-16. 5. Haseeb AN, el-Shazly AM, Arafa MA, Morsy AT. A review on fascioliasis in Egypt. J Egypt Soc Parasitol. 2002;32(1):317-54. 6. Carrada-Bravo T. Fascioliasis: diagnóstico, epidemiología y tratamientos. Rev Gastroenterol Mex. 2003; 68(2):135-42. 7. Esteban JG, Flores A, Angles R, Mas-Coma S. High endemicity of human fascioliasis between Lake Titicaca and La Paz valley, Bolivia. Trans R Soc Trop Med Hyg. 1999;93(2):151-6. 8. Marcos LA, Maco V, Florencio L, Terashima A, Samalvides F, Miranda E, et al. Altas tasas de prevalencia de fasciolosis humana en el Perú: una enfermedad emergente. Rev Per Enf Infec Trop. 2005; 3:8-13. 9. Loja Oropeza D, Alvizuri Escobedo J, Vilca Vásquez M, Avilés Gonzaga R, Sánchez Mercado M. Hematoma hepático subcapsular por fasciola. Rev Gastroenterol Peru. 2003; 23(2):142-8. 10. Gotuzzo E. Enfermedades emergentes y re-emergentes en el Perú. Rev Med Hered. 2002; 13(2):37-9. 11. Mas-Coma M, Esteban J, Bargues M. Epidemiología de la fascioliasis humana: Revisión y propuesta de nueva clasificación. Bull World Health Org. 1999;77(4):340-6. 12. Ortiz P, Cabrera M, Jave J, Claxton J, Williams D. Human fascioliasis: prevalence and treatment in a rural area of Peru. Infect Dis Rev. 2000;2(1):42-6. 13. Albán Olaya M, Jave Ortiz J, Quispe Lazo T. Fasciolasis en Cajamarca. Rev Gastroenterol Peru. 2002;22(1):28-32. 14. Marcos LA, Maco V, Castillo M, Terashima A, Zerpa R, Gotuzzo E. Reporte de casos de fasciolosis en el Instituto Especializado de Salud del Niño, Lima - Perú (1988-2003). Rev Gastroenterol Peru. 2005;25(2):198-205. 15. Marcos LA, Terashima A. Update on human fascioliasis in Peru: diagnosis, treatment and clinical classification proposal. Neotrop Helminthol. 2007;1(2):85-103. 16. Vasquez-Elizondo G, Zavala-Garcia C, Elizondo J, Lizardi-Cervera J. Infestación por Fasciola hepática en la vía biliar. Medica Sur, México. 2007;14(1):26-30. 17. Rana SS, Bhasin DK, Nanda M, Singh K. Parasitic infestations of the biliary tract. Curr Gastroenterol Rep. 2007;9(2):156-64. 18. Ozer B, Serin E, Gümürdülü Y, Gür G, Yilmaz U, Boyacioğlu S. Endoscopic extraction of living fasciola hepatica: case report and literature review. Turk J Gastroenterol. 2003;14(1):74-7. 19. Martinez-Barbabosa I, Gutierrez-Quiroz M, Romero-Cabello R, Ruiz-Gonzalez L, Gutierrez-Cardenas Em, Alpizar-Sosa A, et al. Seroepidemiology of fascioliasis in school children in Mexico city. Rev Biomed. 2006;17:251-7. 20. Arjona R, Riancho JA, Aguado JM, Salesa R, Gonzalez-Macías J. Fascioliasis in developed countries: a review of classic and aberrant forms of the disease. Medicine (Baltimore). 1995;74(1):13-23. 21. Marsden PD. Parasitic diseases of the liver. In: Schiff L, Ed. Diseases of the liver. Philadelphia: JB Lippincott: 1975. p. 1078-88. 22. Belgraier AH. Common bile duct obstruction due to Fasciola hepatica. N Y State J Med. 1976;76(6):936-7. 23. Callahan CM, Vincent AL, Greene JN, Sandin RL. Infectious causes of malignancy. Cancer Control. 1999;6(3):294-300. 24. Wong RK, Peura DA, Mutter ML, Heit HA, Birns MT, Johnson LF. Hemobilia and liver flukes in a patient from Thailand. Gastroenterology. 1985;88(6):1958-63. 25. Adachi S, Kotani K, Shimizu T, Tanaka K, Shimizu T, Okada K. Asymptomatic fascioliasis. Intern Med. 2005;44(9):1013-5. 26. Millan M, Wagenknecht R, Cardenas A, Carrasco C. Parásitos de Fasciola hepática intracoledociano. Rev Chilena de Cirugía. 2008;60(4):332-5. 27. Kabaalioğlu A, Cubuk M, Senol U, Cevikol C, Karaali K, Apaydin A, et al. Fascioliasis: US, CT, and MRI findings with new observations. Abdom Imaging. 2000;25/4):400-4. 28. Dusak A, Onur MR, Cicek M, Firat U, Ren T, Dogra VS. Radiological imaging features of Fasciola hepatica infection – A pictorial review. J Clin Imaging Sci. 2012;2:2. Epub 2012 Jan 27.. 29. Mas-Coma S, Bargues MD, Valero MA. Fascioliasis and other plant-borne trematode zoonoses. Int J Parasitol. 2005;35(11-12): 1255-78. 30. Khuroo MS, Zargar SA, Mahajan R. Hepatobiliary and pancreatic ascariasis in India. Lancet. 1990;335(8704):1503-6. 31. al Karawi MA, Yasawy MI, el Shiekh Mohamed AR. Endoscopic management of biliary hydatid disease: report of six cases. Endoscopy. 1991;23(5):278-81. 32. Dias LM, Silva R, Viana HL, Palhinhas M, Viana RL. Biliary fascioliasis: diagnosis, treatment and follow-up by ERCP. Gastrointest Endosc. 1996;43(6):616-20. 33. Kim JC, Lee SK, Seo DW, Lee SS, Kim MH. Fasciola hepatica in the common bile duct. Gastrointest Endosc. 2006;63(3):501. 34. Cheung J, Enns R, Romney M, Reynolds S, Amar J. Biliary fascioliasis. Gastrointest Endosc. 2005;61(4):596-7. 35. Dowidar N, El Sayad, M, Osman M, Salem A. Endoscopic therapy of fascioliasis resistant to oral therapy. Gastrointest Endosc. 1999;50(3):345-51. 36. Villa-Gomez G. Hepatic Fascioliasis in America: a new challenge for therapeutic endoscopy. Schindler Lecture (OMED). World Gastroenterology News. 2002;7(1):12-3. 37. Boray JC, Crowfoot PD, Strong MB, Allison JR, Schellenbaum M, Von Orelli M, et al. Treatment of immature and mature Fasciola hepatica infections in sheep with triclabendazole. Vet Rec. 1983; 113(14):315-7. 38. Keiser J, Utzinger J. Chemotherapy for major food-borne trematodes: a review. Expert Opin Pharmacother. 2004;5(8):1711-26. 39. Overend DJ, Bowen FL. Resistance of Fasciola hepatica to triclabendazole. Aust Vet J. 1995;72(7):275-6. 40. Favennec L, Jave Ortiz J, Gargala G, Lopez Chegne N, Ayoub A, Rossignol JF. Double- blind, randomized, placebo-controlled study of nitazoxanide in the treatment of fascioliasis in adults and children from northern Peru. Aliment Pharmacol Ther. 2003;17(2):265-70. 41. Keiser J, Duthaler U, Utzinger J. Update on the diagnosis and treatment of food-borne trematode infections. Curr Opin Infect Dis. 2010;23(5):513-20.
Correspondencia:
Luís Lazo Molina
E-mail: luisi_med@hotmail.com
Citar como: Lazo Molina L, Garrido Acedo R, Cárdenas Ramírez B, Torreblanca Nava J. Extracción endoscópica por CPRE de Fasciola hepática viva: reporte de dos casos y revisión de la literatura. Gastroenterology training today. Rev Gatroenterol Peru. 2013;33(1):75-81.
Recibido: 04/09/2012;
Aceptado: 10/02/2013













