Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.33 no.4 Lima oct./dic. 2013
Artículos de revisión
Colangiopancreatrografía retrógrada endoscópica: una técnica en permanente evolución
Endoscopic retrograde cholangiopancreatography: a technique in permanent evolution
Everson LA Artifon 1,2,a, Asadur Jorge Tchekmedyian 3,4,a, Pedro Alonso Aguirre 5,6,a
1 Servicio de Endoscopía, Hospital Ana Costa. Santos, San Pablo, Brasil.
2 Sector de Endoscopia Biliopancreática (CPRE), Servicio de Endoscopía, Hospital de Clínicas, Universidad de San Pablo. San Pablo, Brasil.
3 Hospital Pasteur, Ministerio de Salud Pública. Montevideo, Uruguay.
4 Sociedad de Gastroenterología del Uruguay. Montevideo, Uruguay.
5 Servicio de Aparato Digestivo, Complejo Hospitalario Universitario. La Coruña, España.
6 Sociedad Española de Endoscopía Digestiva. Madrid, España.
a Médico gastroenterólogo.
RESUMEN
En este artículo revisaremos las generalidades anatómicas, técnicas del procedimiento, indicaciones, contraindicaciones y complicaciones de la CPRE.
Palabras clave: Endoscopía; Fluoroscopía; Patología (fuente: DeCS BIREME).
ABSTRACT
In this article we will review all the anatomic aspects, technics, indications, contraindications and complications of ERCP.
Key words: Endoscopy; Fluoroscopy; Pathology (fuente: MeSH NLM).
INTRODUCCIÓN
La colangiopancreatografía retrógrada endoscópica (CPRE) se describió a finales de la década de 1960 como una técnica diagnóstica (1). Posteriormente, en 1974, dos grupos independientes describieron la esfinterotomía asociada a la extracción de cálculos biliares (2,3), abriendo el terreno de la terapéutica asociada a la CPRE.
En los últimos años, con el advenimiento y desarrollo de técnicas menos invasivas, como la colangiopancreatografía por resonancia magnética (CPRM) y la ecoendoscopía, la CPRE se ha posicionado como un procedimiento netamente terapéutico. No obstante, la necesidad de obtener biopsias o citología, así como el previsible desarrollo de la colangioscopía, hacen de la CPRE un procedimiento clave en el estudio de pacientes con patología del sistema biliopancreático.
La curva de aprendizaje de esta técnica es prolongada. Exige que el endoscopista haya adquirido las destrezas suficientes en la endoscopía convencional y posea profundos conocimientos de las estructuras anatómicas del sistema biliopancreático, así como conocer las indicaciones, contraindicaciones y complicaciones de la CPRE. A su vez es indispensable conocer la técnica y el instrumental a ser utilizado.
Previo a la CPRE, la anamnesis del enfermo permitirá conocer el motivo por el cual ha sido indicada, evaluar las enfermedades asociadas que puedan influenciar el procedimiento en sí, así como la sedación. Es importante conocer la existencia de cirugías previas que puedan condicionar el procedimiento (Billroth II), conocer los resultados de exámenes auxiliares (fundamentalmente el estado de la coagulación) y exámenes de imágenes previos (ecografía, TAC), así como eventuales contraindicaciones.
En esta revisión veremos generalidades anatómicas, técnicas del procedimiento, indicaciones, contraindicaciones y complicaciones de la CPRE.
Aspectos anatómicos esencialessA) Conductos biliares
Los conductos biliares constituyen el aparato excretor de la bilis y comprende: 1) los conductos biliares intrahepáticos, 2) el conducto hepático común, 3) la vesícula biliar, 4) el conducto cístico y 5) el conducto
colédoco.
Los conductos intrahepáticos se van uniendo entre sí a medida que confluyen hacia el hilio hepático para formar dos conductos mayores, el conducto hepático derecho y el conducto hepático izquierdo. De la fusión de ambos conductos surge el conducto hepático común, el cual se continúa con el colédoco en el sitio donde desemboca el conducto cístico. El conjunto de conducto hepático y colédoco recibe el nombre de vía biliar principal, mientras que la vesícula y el conducto cístico reciben el nombre de vía biliar accesoria.
Durante la CPRE, la visualización con contraste de los conductos intra-hepáticos puede variar con el tipo de decúbito del enfermo. El decúbito ventral expone en forma más uniforme el estudio colangiográfico de los conductos derecho e izquierdo.
El conducto hepático común tiene una longitud de unos 3 cm y un diámetro de unos 5 mm. Por su parte el colédoco mide entre 3,5 y 4,5 cm y el diámetro es de unos 4 mm, aunque puede ser mayor en pacientes colecistectomizados.
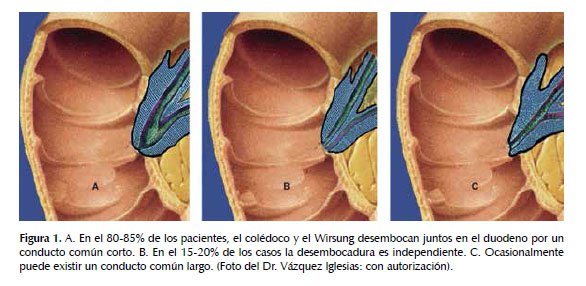
En la porción final del colédoco, dentro del parénquima pancreático surge la unión con el conducto pancreático (Wirsung) formando un conducto común que varía de 2 a 10 mm de extensión de acuerdo con Kim et al. (4).
En la Figura 1 se exponen los diferentes tipos de desembocadura del colédoco y del Wirsung.
B) Conductos pancreáticosLas variaciones anatómicas de los conductos pancreáticos y las anomalías congénitas del páncreas son hallazgos frecuentes durante la pancreatografía y otros estudios de imagen. Es de vital importancia la identificación de estas variaciones para evitar errores diagnósticos (tumores, lesiones post traumáticas o inflamatorias que puedan simular alteraciones de los conductos).
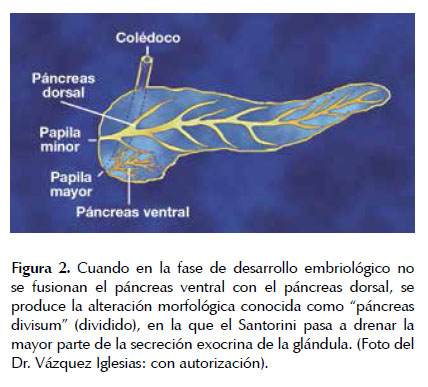
En cerca de 60% de los casos el conducto pancreático principal está formado por la unión de los conductos dorsal (Santorini) y ventral (Wirsung) que desembocan en la papila duodenal mayor. En la tercera parte de los casos el conducto de Santorini desemboca en la papila menor.
El páncreas divisum corresponde a una anomalía congénita de los conductos pancreáticos que se presenta en un 5 -10% de la población general (5). El páncreas divisum ocurre cuando no se fusionan el conducto ventral con el conducto dorsal. Como resultado el conducto ventral solo drena al páncreas ventral. La mayoría del páncreas drena por el conducto dorsal, en la papila menor (ver Figura 2). En estos pacientes, la papila menor es frecuentemente estenótica y disminuye el flujo del jugo pancreático (5). Aproximadamente un 20% de los pacientes con el diagnóstico de pancreatitis aguda recurrente tienen páncreas divisum. En dichos casos, el manejo endoscópico, mediante la esfinterotomía de la papila menor brinda buenos resultados.
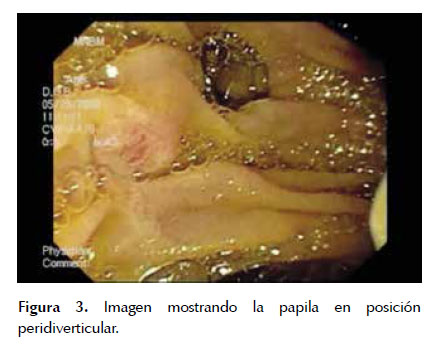
C) Papila duodenal mayorEl conocimiento de la anatomía de la papila duodenal mayor es fundamental para lograr el éxito en la realización de la CPRE. La papila duodenal mayor o Papila de Vater se presenta como una pequeña elevación en la pared posterior o postero-medial de la segunda porción duodenal a unos 8 a 10 cm del píloro, aunque puede localizarse tanto proximal como distalmente (6,7). La papila de Vater recibe al colédoco y al conducto pancreático. Estos dos conductos están separados uno del otro por un pequeño repliegue transversal en forma de espolón, localizándose el primero por encima del segundo (8). La presencia de un pliegue longitudinal junto a la papila permite su mejor identificación, entretanto la existencia de un divertículo puede condicionar la canulación (Figura 3). De todas maneras, en un trabajo presentado como resumen por uno de los autores (AT) no se encontraron diferencias significativas en la canulación en pacientes con o sin divertículos. (Gentile M, Tchekmedyian A. Colangiopancreatografía endoscópica retrógrada en pacientes con divertículos periampulares. XIV Congreso Uruguayo de Gastroenterología y IV Congreso Uruguayo de Endoscopía Digestiva. 11-13 setiembre de 2008. Montevideo, Uruguay.)
D) Papila duodenal menorComo vimos anteriormente, la misma posee especial relevancia en aquellos pacientes que presentan “páncreas divisum” donde el conducto de Santorini (conducto pancreático accesorio) drena la mayor parte del páncreas a través de la papila menor. Para su canulación se utilizan catéteres especialmente diseñados para este fin.
Indicaciones de la CPRE:
A) Enfermedades de las vías biliares
La CPRE tiene especial indicación en la ictericia obstructiva, como por ejemplo en la coledocolitiasis y las estenosis, pudiendo definir la etiología y topografía de la obstrucción. Un estudio realizado por Pasanen y col. demostró que la CPRE permitió diferenciar entre causas obstructivas y no obstructivas en hasta un 90% de las veces (9).
La coledocolitiasis es una de las causas más frecuentes de obstrucción biliar, la cual puede cursar con dolor abdominal, ictericia, pancreatitis y colangitis. La especificidad y la sensibilidad en la detección de cálculos en el conducto biliar común supera el 95% (10). Pese a ello, hay que prestar especial atención en no inyectar aire en la vía biliar durante la colangiografía dado que las burbujas de aire pueden ser falsamente interpretadas como litiasis.
Una indicación común de la CPRE es en el postoperatorio de la colecistectomía laparoscópica, cuando no ha sido posible la remoción completa de los cálculos de la vía biliar principal (11).
La CPRE mantiene su indicación en la colangitis esclerosante primaria (CEP) donde permite el cepillado para citología, así como el manejo de las estenosis dominantes (12).
Por último, debemos recordar la disfunción del esfínter de Oddi y el estudio de la vía biliar en pacientes sometidos a trasplante hepático como otras indicaciones de la CPRE.
B) Enfermedades Pancreáticas
Inicialmente indicada para el diagnóstico de estas afecciones, actualmente la CPRE se utiliza como complemento de estudios de imagen menos invasivos (TAC, ecografía, CPRM) y para el manejo intervencionista en caso de estenosis o cálculos pancreáticos.
La pancreatitis aguda es una patología común, potencialmente grave. Los cálculos biliares son la principal causa de esta enfermedad. La utilidad de la CPRE en esta entidad, ha sido evaluada en gran medida y aunque existen controversias, la evidencia existente está a favor de su uso en algunas situaciones específicas (13). Es así, que un meta-análisis realizado por Petrov y col. concluye que la CPRE está indicada para la eliminación de los cálculos en el ducto biliar en pacientes con pancreatitis severa o colangitis, aquellos que son pobres candidatos para colecistectomía o que se encuentran post-colecistectomía y aquellos con evidencia fuerte de obstrucción biliar persistente (14).
Los traumatismos de abdomen pueden lesionar el conducto pancreático produciendo fístulas y estenosis, que pueden ser tratadas mediante la colocación de una prótesis en el conducto pancreático.
Las colecciones pancreáticas como el pseudoquiste de páncreas pueden tener o no comunicación con el Wirsung. En el primer caso pueden ser tratados con el drenaje transpapilar (asociando eventualmente el drenaje transgástrico) y en los segundos es posible tratarla con punción eco-guiada vía transgástrica.
En el cáncer de páncreas no resecable, la colocación de una prótesis biliar se considera el estándar para la paliación de la ictericia (15).
CPRE en situaciones especiales:
A) Embarazo
La CPRE debe utilizarse durante el embarazo sólo cuando se plantea una intervención terapéutica. La pancreatitis biliar, la coledocolitiasis sintomática, o la colangitis son indicaciones habituales ya que pueden conducir a la pérdida del feto si no se tratan adecuadamente.
Se debe cuidar en minimizar la exposición a la radiación del feto y la madre, así como documentar el tiempo de exposición. Utilizando una técnica adecuada y minimizando la exposición a la radiación para el feto la CPRE es segura durante el embarazo (16).
Par minimizar los riesgos durante la esfinterotomía, se aconseja colocar la placa de tierra del electro-bisturí de manera que el útero no quede entre el papilótomo y dicha placa, de manera que el flujo de corriente eléctrica a través del líquido amniótico sea mínimo (16).
B) Niños
Las indicaciones principales son la coledocolitiasis, la evaluación por sospecha de quistes de colédoco y la pancreatitis aguda recurrente. El procedimiento debe ser explicado a los niños de una manera apropiada para su edad y etapa de desarrollo, recabando el consentimiento según corresponda en la legislación correspondiente. Hay que prestar especial atención a las medidas de radioprotección, siendo fundamental el trabajo conjunto con el gastroenterólogo pediatra y el equipo de radiología.
Existen duodenoscopios pediátricos, pese a ello en la mayoría de los pacientes los duodenoscopios de adultos pueden ser utilizados (12), prestando especial precaución al realizar la rectificación en el duodeno de manera de minimizar los eventuales riesgos por el equipo.
Contraindicaciones
Son básicamente las mismas que para la endoscopía digestiva alta. La evaluación clínica debe ser hecha de manera individualizada, teniendo en cuenta los motivos por los cuales se realizará el procedimiento. Hay que evaluar si el paciente presenta comorbilidades que puedan aumentar el riego del procedimiento. Pacientes con inestabilidad hemodinámica o que se nieguen a realizar el procedimiento deben ser considerados como contraindicación absoluta.
Complicaciones
Es de vital importancia para el endoscopista conocer las potenciales complicaciones de la CPRE, las tasas de incidencia y los factores de riesgo. Debemos recordar que el mejor tratamiento para cualquiera de las complicaciones es su prevención.
Así, las complicaciones de la CPRE según Freeman (17) son: pancreatitis, hemorragia, perforación, infecciones y cardiopulmonares. A continuación se analizan las más importantes por su frecuencia y severidad.
Pancreatitis aguda post-CPRE
Es la complicación más común y más grave de la CPRE, su incidencia varía según los autores, pero es próxima al 3,5% (18).
Algunos de los factores de riesgo estudiados por análisis multivariados fueron: sospecha de disfunción del esfínter de Oddi, jóvenes, bilirrubinas anormales, historia previa de pancreatitis post CPRE, Inyección en el conducto pancreático, esfinterotomía pancreática, precorte y dilatación de la papila de Vater con balón (17). Otros factores incluyen, la manipulación excesiva de la papila para conseguir la canulación, o la ampulectomía.
En los últimos años se ha sumado evidencia del uso de AINEs (antiinflamatorios no esteroides) como la indometacina rectal o de prótesis pancreáticas de manera de reducir el riesgo de esta complicación (19,20).
Hemorragia
La hemorragia puede ocurrir durante la esfinterotomía debido a la lesión inadvertida del plexo arterial papilar. El principal responsable de esta complicación no es el tamaño de la esfinterotomía sino la posición anatómica de la arteria retroduodenal. Esta complicación ocurre en el 1,3% de las pacientes, siendo en general de poca magnitud (18).
Los factores de riesgo para el sangrado son: coagulopatía, utilización de anticoagulantes dentro de las 72 horas posteriores a la esfinterotomía, estenosis papilar, colangitis aguda, realización de precorte y menor experiencia del endoscopista (21).
El tratamiento de esta complicación puede ser efectuado endoscópicamente a través de la inyección de solución de adrenalina, asociada o no a métodos térmicos y los clips metálicos (22).
La CPRE con esfinterotomía se considera un procedimiento con riesgo para el sangrado, debiendo ajustarse la terapia antitrombótica de acuerdo a las guías publicadas (23).
Una hemorragia poco frecuente, pero que ha sido descrita es el hematoma subcapsular hepático secundario a lesión traumática por la guía biliar (24). Esta complicación puede confundirse clínicamente con la perforación ya que ambas se expresan por dolor. El diagnóstico diferencial es importante ya que el tratamiento del hematoma puede ser conservador, no estando indicada la cirugía.
C) Perforación
Esta es una complicación infrecuente pero grave. La misma puede ser tratada en forma conservadora en la mayoría de los casos cuando es identificada rápida y precozmente e instaurado un correcto tratamiento, aunque cuando involucra la pared lateral del duodeno requiere habitualmente de cirugía. Una publicación reciente de Baron y col. clasifica a la perforación vinculada con la CPRE en 4 tipos (25). El tipo I, involucra a la pared lateral del duodeno, siendo en general de resolución quirúrgica. El tipo II o peri-papilar, varía en gravedad y no requiere habitualmente de cirugía. En estos casos, si la TAC muestra gran cantidad de líquido retroperitoneal se requiere la intervención quirúrgica o percutánea. Últimamente ha cobrado relevancia el manejo endoscópico de estos tipos de perforaciones mediante la colocación de un tubo nasoduodenal y drenaje biliar o mediante el uso de clips. Las lesiones de tipo III, son lesiones de la vía biliar distal a causa de la instrumentación con Dormia o guía cerca de un área obstruida. En general son pequeñas y sin relevancia clínica. La perforación de la vía biliar distal puede manejarse mediante la colocación de un stent plástico o de un stent autoexpandible totalmente cubierto. La presencia de aire a nivel retroperitoneal por si solo (tipo IV) probablemente se relaciona a la insuflación mantenida durante la CPRE, aunque puede producirse por pequeñas perforaciones y asociarse a dolor luego del procedimiento. Si es un hallazgo incidental no se considera una perforación verdadera y no requiere de cirugía.
D) Infecciones
La colangitis es una complicación que puede llegar a ser grave, con su consiguiente mortalidad. La misma está asociada a la combinación de procedimientos percutáneos, colocación de prótesis en las estenosis malignas de la vía biliar, presencia de ictericia, drenaje biliar incompleto y colangitis esclerosante primaria. El correcto drenaje de la vía biliar luego del procedimiento es el principal aliado del endoscopista en la prevención de esta complicación. Es así que el drenaje de la vía biliar mediante la colocación de un stent está indicado cuando no se logra la extracción completa de la coledocolitiasis. La utilización de antibióticos en forma profiláctica debe ser considerada cuando existe sospecha de no lograr un completo drenaje biliar post CPRE, como en caso de estenosis del hilio hepático y colangitis esclerosante primaria (21). Los antibióticos deben cubrir Gram negativos y enterococos.
E) Cardiopulmonares
Estas complicaciones pueden estar relacionadas a la sedación, a un tiempo prolongado de la CPRE y a factores de riesgo de los pacientes. La posición del paciente puede contribuir a una menor perfusión tisular, debiendo existir siempre una adecuada monitorización y aporte de oxígeno.
Técnica
En primer lugar debemos resaltar la importancia del manejo correcto por todo el equipo de los accesorios de radioprotección, tales como delantales de plomo, protectores de tiroides y eventualmente de lentes con cristales plomados. En nuestro continente, a excepción del chaleco plomado hay una subutilización de las medidas de radioprotección (físicas y dosimetría personal), tal como se desprende de una reciente encuesta Latinoamericana (26).
La sedación debe ser adecuada y sistematizada, de acuerdo a los protocolos de cada centro.
La posición del paciente varía de acuerdo a la preferencia del endoscopista, aunque las posiciones más habituales son el decúbito prono y el lateral izquierdo, o incluso una posición intermedia entre las dos anteriores. Luego de posicionado el paciente, el duodenoscopio debe ser introducido siguiendo el eje longitudinal del enfermo, sin forzar para evitar perforaciones o laceraciones en el trayecto. Ante la menor resistencia deben de considerarse la existencia de alteraciones anatómicas como divertículos esofágicos, hernia hiatal o estenosis. En esas situaciones un aparato de visión frontal es siempre útil para el correcto diagnóstico.
Una vez en el estómago, se insufla la menor cantidad de aire que permita la visualización y se realiza un correcto aspirado del contenido gástrico para evitar una posible broncoaspiración. Se debe flexionar el endoscopio hacia abajo y avanzar hacia el antro, para finalmente alcanzar el píloro. Una vez situados encima del píloro, cuyo orificio veremos en el borde inferior como “a modo de sol poniente”, un ligero giro del mando lateral del duodenoscopio hacia abajo permitirá la entrada al duodeno. Al observar la segunda porción, se frenan ambos mandos y se realiza la rectificación del equipo. A continuación se identifica la papila de Vater, la cual presenta un pliegue longitudinal por abajo y uno transverso en su porción proximal.
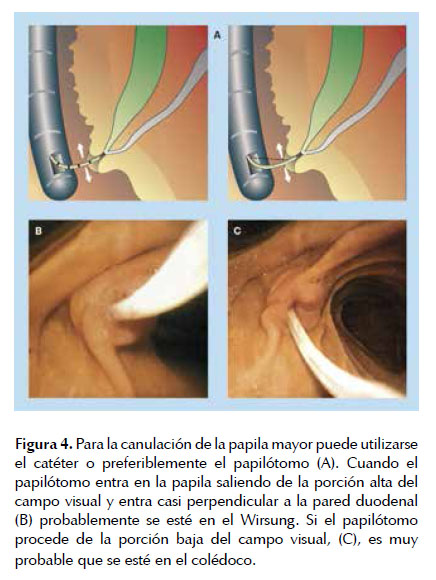
Finalmente se procede a la canulación de la papila. Dos situaciones son claves a la hora de lograr el éxito de dicha maniobra, por un lado la posición del endoscopio y por otro la aproximación a la papila. Hay diferentes técnicas de canulación en función del uso o no de guía. Actualmente se ha prodigado su uso porque disminuye el riesgo de pancreatitis post CPRE (27). En caso de canular con guía, debe introducirse mínimamente el papilótomo en el orificio papilar, con la orientación adecuada (ver más abajo) y avanzar la guía. Por la posición que adopta la misma, generalmente es reconocible qué conducto se ha canalizado, ya sea el colédoco o el conducto pancreático. Si se está en el colédoco la guía se desplaza hacia arriba en forma tangencial al endoscopio; por el contrario si se está en el Wirsung, la guía se cruza sobre la columna vertebral sobre L4-L5.
La cateterización selectiva debe ser realizada de acuerdo con la indicación del procedimiento. La pancreatografía puede ser obtenida con el catéter posicionado perpendicularmente a la papila, hacia la hora 1. La canulación de la vía biliar debe ser realizada con la papila visualizada de abajo hacia arriba, algo desplazada hacia la izquierda, con el catéter en una posición que apunte hacia la hora 11 (Figura 4).
Se debe tener precaución de no introducir el catéter o papilótomo más de 2 cm para evitar la lesión del conducto. La inyección de contraste debe ser realizada lentamente, bajo control fluoroscópico, confirmando la posición en el conducto biliar o en el conducto pancreático.
En caso de no conseguir la canulación selectiva de la vía biliar por acceso repetido de la guía al conducto pancreático se pueden intentar diferentes maniobras o “trucos”. Uno consiste en dejar la guía en el conducto pancreático, extraer el papilótomo y volver a introducirlo con otra guía montada e intentar la canulación de la vía biliar con esa otra guía, esperando que la ocupación del acceso al conducto pancreático de la primera, facilite el acceso al colédoco de esa segunda guía (técnica de doble guía). Otra posibilidad, con el mismo fundamento, es colocar un stent pancreático de fino calibre (3 o 5 Fr). Esta segunda opción tiene la ventaja de que el stent pancreático temporal es una medida que disminuye el riesgo de pancreatitis post-CPRE en caso de canulaciones difíciles y puede ayudar a orientar la dirección del corte de una fístuloinfundibulotomia (precorte).
En caso de que los intentos de canulación selectiva biliar fracasen sin conseguir tampoco el acceso al conducto pancreático, la técnica que debe emplearse es el “pre-corte” en sus diferentes variantes.
Consideraciones finales
La CPRE es un procedimiento que requiere de una técnica compleja, para lo cual es imprescindible un adecuado entrenamiento y un profundo conocimiento de las maniobras a realizar. El uso de equipos e instrumentales diferentes a la endoscopía convencional le otorgan características propias que deben ser conocidas y dominadas por quien realiza esta técnica. En la Tabla 1 se presentan 10 consejos para el éxito del procedimiento. A su vez, la CPRE requiere el uso de rayos, para lo cual se debe estar familiarizado con la fluoroscopía, conociendo sus potenciales riesgos y dominando la interpretación de las imágenes radiológicas. Ciertamente la CPRE es un procedimiento con innumerables tácticas a ser aprendidas, la cual ha evolucionado de un estudio diagnóstico a un procedimiento cada vez más terapéutico.
Conflictos de interés:
Los autores no presentan conflictos de intereses para declarar.