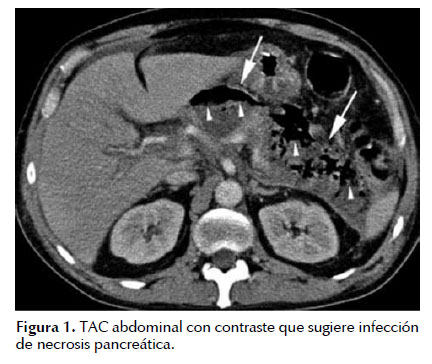
Reseña Histórica
En 1996 Baron y cols. evaluaron por primera vez la factibilidad del drenaje endoscópico en pacientes con necrosis pancreática organizada (24). La técnica utilizada fue la misma que para el drenaje de pseudoquistes no complicados. Fueron 11 pacientes con necrosis pancreática extensa (≥50%), solo tres de ellos tenían infección de la NP y en 10 de ellos se realizó el drenaje endoscópico. Se utilizó stents de 10 French con doble pigtail en todos ellos, en 8 pacientes fue colocado un drenaje naso quístico de 7 French simultáneamente para la irrigación. Se pensó que la irrigación podía ayudar a licuar el tejido necrótico. El drenaje completo se logró en 9 pacientes (90%) en un número promedio de 2,7 sesiones. Sin embargo 5 pacientes (50%) presentaron complicaciones como infección (4 pacientes) y sangrado (1 paciente); y 60% de los pacientes con drenaje exitoso desarrollaron colecciones dentro de los dos siguientes años.
En el 2000, Seifert y col., utilizaron el ultrasonido endoscópico para facilitar el acceso a la colección necrótica retroperitoneal a través de la pared gástrica (29).
Papachristou y col. (30) reportaron su experiencia en el drenaje transgástrico o transduodenal de la necrosis pancreática encapsulada en 53 pacientes. Veintisiete pacientes presentaban necrosis encapsulada estéril y veintiséis pacientes con necrosis encapsulada infectada. Las lesiones se ubicaron: 4 (8%) en la cabeza, 27 (51%) en el cuerpo, 5 (9%) en la cola y 17 (32%) en el cuerpo / cola del páncreas. El diámetro medio máximo fue de 16 cm. El drenaje efectuado fue transgástrico en 32 pacientes (60%), transduodenal en 19 (37%), transpapilar en uno y combinado transgástrico y transduodenal en uno. Se utilizó eco endoscopia en todos los pacientes para caracterizar la colección pancreática y para ubicar el sitio de acceso. El procedimiento se realizó luego de un promedio de 49 días después de iniciada la enfermedad. Luego de la creación de la comunicación gastro o entero cística se colocaron prótesis de plástico (1 o 2) con doble pigtail; todos tuvieron sistemas de irrigación simultaneo 37 pacientes (70%) con sonda naso quística de 7 Fr, 10 pacientes (19%) a través de extensión yeyunal del tubo de gastrostomía endoscópica percutánea y 6 pacientes tenían drenaje colocados con guía radiológica antes del drenaje endoscópico que se utilizaron después para la irrigación). La debridación completa se logró en el 81% de los casos luego de un promedio de 3 sesiones. Once pacientes (20%) presentaron complicaciones asociados al procedimiento (sangrado y migración de la prótesis).
La primera serie de casos con seguimiento a largo plazo fue publicada por Seifert y col. (18), con reclutamiento retrospectivo de 93 pacientes con necrosis pancreática infectada en 6 diferentes hospitales de Alemania y con un seguimiento prospectivo de 43 meses en promedio. El éxito clínico inicial se observó en el 80% de los pacientes, 26% de los pacientes presentaron complicaciones y una tasa de mortalidad de 7,5% a los 30 días. El 84% de los pacientes inicialmente tratados con éxito había mantenido su mejoría clínica. Concluyendo que la remoción endoscópica transluminal de necrosis pancreática se asocia a eficacia clínica mantenida a largo plazo.
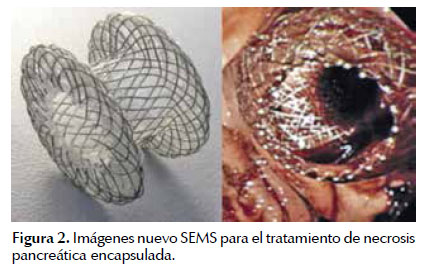
El uso de stents metálicos auto expandibles (selfexpandable metal stent: SEMS) fue reportado por primera vez por Antillony col. (31), quién utilizó un SEMS esofágico para la tratamiento de la NP infectada con un buen resultado. En los últimos años se han desarrollado nuevos modelos de SEMS (32,33). El objetivo de estos stents es facilitar el drenaje y el acceso a la cavidad que contiene la NP. Figura 2.
En agosto del 2009 en el Instituto Gastroenterológico Boliviano Japonés de Cochabamba (Bolivia), se realizó la primera necrosectomía pancreática endoscópica en una paciente mujer de 46 años de edad, séptica, con diagnóstico de necrosis pancreática infectada. El acceso a la necrosis pancreática encapsulada se realizó sin guía eco endoscópica, a través de una gastrocistostomía. La necrosectomía se inició en la tercera semana de haber iniciado la enfermedad y se completó luego de 7 sesiones sin complicaciones.
Indicaciones
Las indicaciones para la NPE es el tratamiento de NP infectada o NP estéril sintomática (Dolor abdominal persistente, dificultad para el vaciamiento gástrico, obstrucción de vía biliar, etc.). El tiempo recomendado para realizarla con mejores resultados, es entre la cuarta a sexta semana después de inicio de la pancreatitis aguda; luego de este tiempo la necrosis pancreática se organiza y se auto limita por una cápsula inflamatoria (20). La NP debe de presentarse en contacto con la pared gástrica o duodenal (a una distancia menor a un centímetro) para poder realizar su debridación por esta técnica.
Técnica Endoscópica
La realización de la necrosectomía pancreática endoscópica requiere de un gastroenterólogo o cirujano bien entrenado en endoscopía terapéutica. El procedimiento debe ser realizado en un centro hospitalario que cuente con profesionales, médicos radiólogos y cirujanos, que sean capaces de manejar las complicaciones que no puedan ser controladas endoscópicamente (20,34).
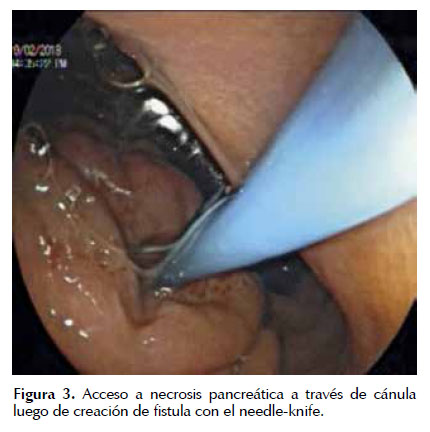
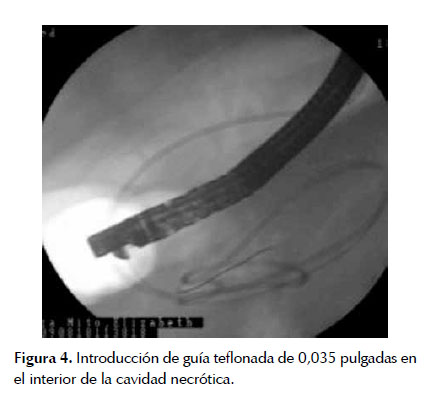
Es un procedimiento que puede realizarse bajo sedación consiente o anestesia. El abordaje de las colecciones pancreáticas se ha demostrado que tiene mayor éxito técnico con guía eco endoscópica (80 y 100%) (35). Luego de ubicación y caracterización de la colección, se aplica el doppler color para valorar la presencia de vasos regionales propios o secundarios al establecimiento de trombosis esplénica relacionada a la pancreatitis o por enfermedad hepática previa (36). Con aguja No 19 se crea una fistula transgástrica o transentérica hacia la necrosis pancreática encapsulada. De no disponer con un eco endoscopio se puede ubicar la necrosis pancreática, valorar su contacto con pared gástrica o duodenal y valorar la presencia de vasos regionales con la ayuda de la tomografía abdominal con contraste, previa a la evaluación endoscópica. El sitio de punción es a nivel de la compresión extrínseca en pared gástrica o duodenal (Figura 3). Se crea una fistula a través de incisión realizada por el needle-knife, se retira el alambre de corte y por la cánula que queda en lumen quístico se puede aspirar contenido de colección necrótica para estudio microbiológico. Posteriormente por fistula creada se introduce guía teflonada de 0,035 pulgadas en el interior de la cavidad y se puede realizar inyección de sustancia de contraste a discreción bajo guía fluoroscópica (20,37) (Figura 4).
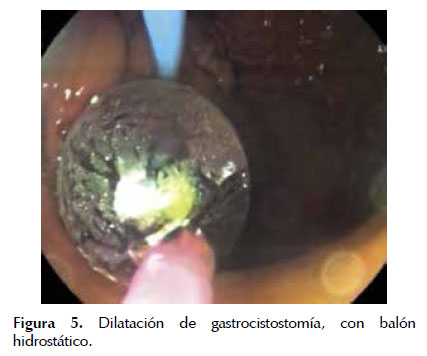
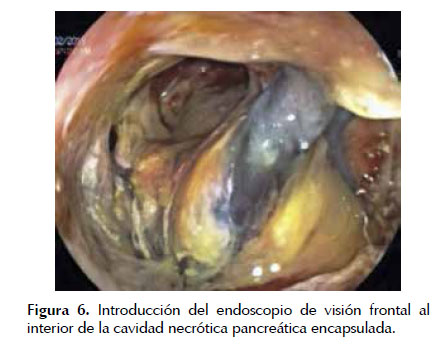
Luego se debe realizar la dilatación de la fistula con balón hidrostático (15-20 mm) hasta crear una cistogastrostomía o una cistoenterostomía de un diámetro que permita la introducción de un endoscopio de visión frontal dentro de la cavidad. Figuras 5 y 6
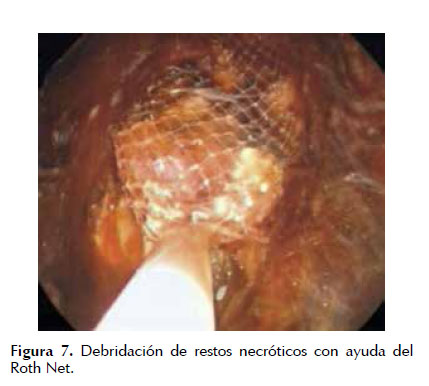
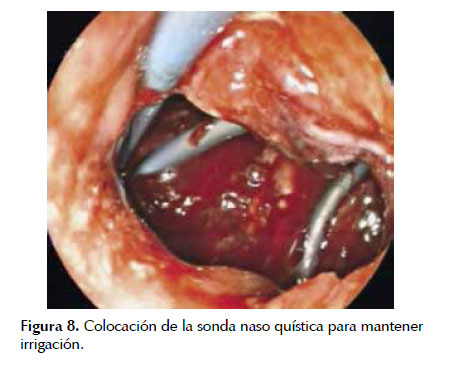
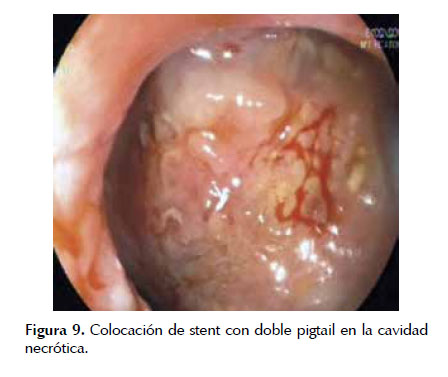
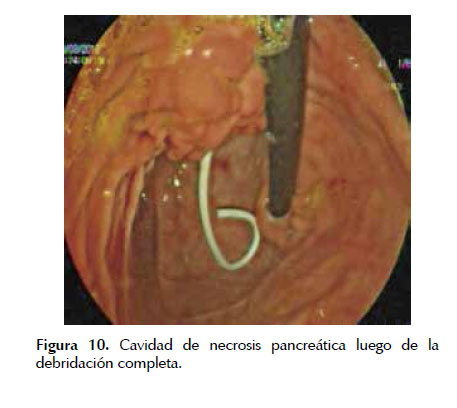
La extracción de tejido necrótico se realiza mediante lavado abundante con solución fisiológica normal, aspiración enérgica, debridación con asas de polipectomía, pinzas de cuerpo extraño, canastilla de Roth y canastillas metálicas; el tejido obtenido se debe dejar en la luz gástrica o intestinal (20,37) (Figura 7). Al término de la sesión se puede colocar prótesis plásticas única o múltiples (de 10 French, con doble pigtail) o prótesis metálicas autoexpandibles, y se debe valorar colocar un catéter nasoquistico (de 7 French) de acuerdo a la cantidad de tejido necrótico sólido remanente con objetivo de mantener irrigación continua (1 a 3 Lts. de solución fisiológica normal en 24 horas, cuidando la sobre hidratación, para lo cual se puede dejar una SNG para vaciamiento). La colocación de stents de mayor diámetro, o múltiples facilitaría la resolución de la colección con drenaje no solo a través de la luz de los stents sino también entre los espacios dejados entre ellos (32,35). Figuras 8 , 9 y 10 .
Las prótesis metálicas auto expandibles con un diámetro mayor ofrecen mejor permeabilidad y facilitan el acceso a la cavidad.
Algunos investigadores han intentado la eliminación de todo el material necrótico en una sola sesión, mientras que otros sugieren realizarlo en varias sesiones en intervalos de 1 a 4 días hasta que toda la necrosis se halla eliminado (26,27). Es más cauteloso repetir las sesiones con el fin de limitar el riesgo de sangrado que se produce principalmente durante la eliminación extensa de la necrosis o perforación al resecar tejido sano junto a fragmentos de necrosis firmemente adherida. La insuflación de aire en la cavidad necrótica que es el procedimiento habitual en la realización de la endoscopia estándar sigue siendo un problema real, puesto que existen reportes de caso de embolia gaseosa durante procedimientos prolongados por lo que algunos centros han reemplazado su uso por el dióxido de carbono.
La necrosectomía endoscópica se realiza generalmente en las colecciones encapsuladas a nivel retro gástrico sin embargo hay reportes de casos que puede extenderse a regiones más distantes como la corredera paracólica (18,19). Tomografías abdominales seriadas deben de realizarse después de la intervención para seguir la resolución de necrosis pancreática.
Efectividad
Los artículos revisados informan del éxito terapéutico de la necrosectomía pancreática endoscópica en promedio variable que ha mejorado en relación a la progresión de los años desde 78% a 93% e inclusive en algunos series hasta 100%; la tasa de complicaciones asociadas a este procedimiento es de 8 a 28% (hemorragia, neumoperitoneo, migración de la prótesis, embolismo aéreo, fistula entéricas) y una tasa de mortalidad de 0 a 5,6 % (2,14-16,20,21,32,33,37).
Conclusión
La necrosectomía pancreática endoscópica es una alternativa de tratamiento para pacientes seleccionados con necrosis pancreática sintomática con buena eficacia y bajo porcentaje de complicaciones y mortalidad.
BIBLIOGRAFÍA
1. Whitcomb DC. Clinical practice. Acute pancreatitis . N Engl J Med. 2006;354(20):2142-50. [ Links ]
2. Büchler MW, Gloor B, Müller CA, Friess H, Seiler CA, Uhl W. Acute necrotizing pancreatitis: treatment strategy according to the status of infection . Ann Surg. 2000;232(5):619-26. [ Links ]
3. Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG. Classification of acute pancreatitis2012: revision of the Atlanta classification and definitions by international consensus . Gut. 2013;62(1):102-11. doi: 10.1136/ gutjnl-2012-302779. [ Links ]
4. Spanier BW, Nio Y, van der Hulst RW, Tuynman HA, Dijkgraaf MG, Bruno MJ. Practice and yield of early CT scan in acute pancreatitis: a Dutch observational multicenter study . Pancreatology 2010;10(2):222-8. [ Links ]
5. Bollen TL, Singh VK, Maurer R, Repas K, van Es HW, Banks PA, et al. A comparative evaluation of radiologic and clinical scoring systems in the early prediction of severity of acute pancreatitis . Am J Gastroenterol. 2012;107(4):612-9. [ Links ]
6. Isenmann R, Büchler M, Uhl W, Malfertheiner P, Martini M, Beger HG. Pancreatic necrosis: an early finding in severe acute pancreatitis . Pancreas. 1993;8(3):358-61. [ Links ]
7. Balthazar EJ. Acute pancreatitis: assessment of severity with clinical and CT evaluation . Radiology. 2002;223(3):603-13. [ Links ]
8. Petrov MS, Chong V, Windsor JA. Infected pancreatic necrosis: Not necessarily a late event in acute pancreatitis . World J Gastroenterol. 2011;17(27):3173-6. doi: 10.3748/wjg.v17. i27.3173. [ Links ]
9. Isenmann R, Rau B, Beger HG. Bacterial infection and extent of necrosis are determinants of organ failure in patients with acute necrotizing pancreatitis . Br J Surg. 1999;86(8):1020-4. [ Links ]
10. Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis . Cochrane Database Syst Rev. 2010;(5):CD002941. doi: 10.1002/14651858.CD002941.pub3. [ Links ]
11. Eatock FC, Chong P, Menezes N, Murray L, McKay CJ, Carter CR, et al. A randomized study of early nasogastric versus nasojejunal feeding in severe acute pancreatitis . Am J Gastroenterol. 2005;100(2):432-9. [ Links ]
12. Berenholtz SM, Pronovost PJ, Lipsett PA, Hobson D, Earsing K, Farley JE, et al. Eliminating catheter-related bloodstream infections in the intensive care unit . Crit Care Med. 2004;32(10):2014-20. [ Links ]
13. Tablan OC, Anderson LJ, Besser R, Bridges C, Hajjeh R; CDC; et al. Guidelines for preventing health-care--associated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee . MMWR Recomm Rep. 2004;53(RR-3):1-36. [ Links ]
14. Uhl W, Warshaw A, Imrie C, Bassi C, McKay CJ, Lankisch PG, et al. IAP Guidelines for the Surgical Management of Acute Pancreatitis . Pancreatology. 2002;2(6):565-73. [ Links ]
15. Hughes SJ, Papachristou GI, Federle MP, Lee KK. Lee. Necrotizing pancreatitis . Gastroenterol Clin North Am. 2007;36(2):313-23.
16. Beger HG, Bittner R, Block S, Büchler M. Bacterial contamination of pancreatic necrosis. A prospective clinical study . Gastroenterology. 1986;91(2):433-8. [ Links ]
17. Gardner TB, Chahal P, Papachristou GI, Vege SS, Petersen BT, Gostout CJ, et al. A comparison of direct endoscopic necrosectomy with transmural endoscopic drainage for the treatment of walled-off pancreatic necrosis . Gastrointest Endosc. 2009;69(6):1085-94. doi: 10.1016/j.gie.2008.06.061. [ Links ]
18. Seifert H, Biermer M, Schmitt W, Jürgensen C, Will U, Gerlach R, et al. Transluminal endoscopic necrosectomy after acute pancreatitis: a multicenter study with long-term follow-up (the GEPARD Study) . Gut 2009;58(9):1260-6. doi: 10.1136/ gut.2008.163733. [ Links ].
19. Barthet M, Ezzedine S. Transluminal endoscopic necrosectomy for pancreatic necrosis: in all hands and for all patients, or with selected endoscopists in selected patients? Gut. 2009;58(9):1180-2. doi: 10.1136/gut.2009.180588. [ Links ]
20. Freeny PC, Hauptmann E, Althaus SJ, Traverso LW, Sinanan M. Percutaneous CT-guided catheter drainage of infected acute necrotizing pancreatitis: techniques and results . AJR Am J Roentgenol. 1998;17(4)0:969-75.
21. Seewald S, Groth S, Omar S, Imazu H, Seitz U, de Weerth A, et al. Aggressive endoscopic therapy for pancreatic necrosis and pancreatic abscess: a new safe and effective treatment algorithm (videos) . Gastrointest Endosc. 2005;62(1):92-100. [ Links ]
22. Slavin J, Ghaneh P, Sutton R, Hartley M, Rowlands P, Garvey C, et al. Management of necrotizing pancreatitis . World J Gastroenterol. 2001;7(4):476-81. [ Links ]
23. Bello B, Matthews JB. Minimally invasive treatment of pancreatic necrosis . World J Gastroenterol. 2012;18(46):6829-35. [ Links ]
24. Baron TH, Thaggard WG, Morgan DE, Stanley RJ. Endoscopic therapy for organized pancreatic necrosis . Gastroenterology. 1996;111(3):755-64. [ Links ]
25. Gagner M. Laparoscopic treatment of acute necrotizing pancreatitis . Semin Laparosc Surg. 1996;3(1):21-8. [ Links ]
26. Windsor JA. Minimally invasive pancreatic necrosectomy . Br J Surg. 2007;94(2):132-3. [ Links ]
27. van Santvoort HC, Besselink MG, Bakker OJ, Hofker HS, Boermeester MA, Dejong CH, et al. A Step-up approach or open necrosectomy for necrotizing pancreatitis . N Engl J Med. 2010;362(16):1491-502. [ Links ]
28. Navarrete C, Castillo C, Caracci M, Vargas P, Gobelet J, Robles I. Wide percutaneous access to pancreatic necrosis with self-expandable stent: new application (with video) . Gastrointest Endosc. 2011;73(3):609-10. doi: 10.1016/j. gie.2010.08.015. [ Links ]
29. Seifert H, Wehrmann T, Schmitt T, Zeuzem S, Caspary WF. Retroperitoneal endoscopic debridement for infected peripancreatic necrosis . Lancet. 2000;356(9230):653-5. [ Links ]
30. Papachristou GI, Takahashi N, Chahal P, Sarr MG, Baron TH. Peroral endoscopic drainage/debridement of walled-off pancreatic necrosis . Ann Surg. 2007;245(6):943-51. [ Links ]
31. Antillon MR, Bechtold ML, Bartalos CR, Marshall JB. Transgastric endoscopic necrosectomy with temporary metallic esophageal stent placement for the treatment of infected pancreatic necrosis (with video) . Gastrointest Endosc. 2009;6(1)9:178-80. doi: 10.1016/j.gie.2008.03.1066.
32. Itoi T, Nageshwar Reddy D, Yasuda I. New fully-covered self-expandable metal stent for endoscopic ultrasonography guided intervention in infectious walled-off pancreatic necrosis (with video) . J Hepatobiliary Pancreat Sci. 2013;20(3):403-6. doi: 10.1007/s00534-012-0551-5. [ Links ]
33. Yamamoto N, Isayama H, Kawakami H, Sasahira N, Hamada T, Ito Y, et al. Preliminary report on a new, fully covered, metal stent designed for the treatment of pancreatic fluid collections . 2013;77(5):809-14. doi: 10.1016/j.gie.2013.01.009.
34. Fogel EL. Endoscopic pancreatic necrosectomy . J Gastrointest Surg. 2011;15(7):1098-100. doi: 10.1007/s11605-0111505-y. [ Links ]
35. Varadarajulu S, Christein JD, Tamhane A, Drelichman ER, Wilcox CM. Prospective randomized trial comparing EUS and EGD for transmural drainage of pancreatic pseudocysts (with videos) . Gastrointest Endosc. 2008;68(6):1102-11. doi: 10.1016/j.gie.2008.04.028.
36. Kahaleh M, Shami VM, Conaway MR, Tokar J, Rockoff T, De La Rue SA, et al. Endoscopic ultrasound drainage of pancreatic pseudocyst: a prospective comparison with conventional endoscopic drainage . Endoscopy. 2006;38(4):355-9. [ Links ]
37. Kahaleh M. Endoscopic necrosectomy for walled-off pancreatic necrosis . Clin Endosc. 2012;45(3):313-5. [ Links ]
Correspondencia:
Dr. James Köller Echalar E-mail: jrkoll@hotmail.com
Recibido: 27/05/2013
Aprobado: 19/10/2013
 Cited by SciELO
Cited by SciELO  Similars in
SciELO
Similars in
SciELO