Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.34 no.3 Lima jul. 2014
Artículos Originales
Positividad anticuerpo antitransglutaminasa tisular humana en adultos histológicamente compatibles con enfermedad celíaca
Antitransglutaminase antibody positivity in adults histologically compatible with celiac disease
Judy Melissa Piscoya Moncada 1, a, Gustavo Vicente Gálvez Villacorta 1, b
1 Servicio de Gastroenterología, Clínica San Pablo. Lima, Perú
a Interna de Medicina, b Jefe del Departamento de Gastroenterología
RESUMEN
Objetivo: Determinar la frecuencia de positividad de anticuerpo antitransglutaminasa tisular humana en pacientes adultos histológicamente compatibles con enfermedad celiaca. Material y método: El presente trabajo corresponde a un diseño analítico, transversal con régimen de investigación orientado, en el que se realizó una revisión de historias clínicas de pacientes del Servicio de Gastroenterología de la Clínica San Pablo, Lima, Perú, con resultados de biopsias compatible con enfermedad celíaca (EC) desde el año 1994 al 2011 y que además contó con valor de anticuerpo antitransglutaminasa tisular humana (AATG), calculándose la frecuencia de positividad del mismo. Resultados: Según criterios señalados por el presente estudio se trabajó sobre un total de 44 historias clínicas conformadas por 18 (40,9%) correspondientes a hombres y 26 (59,1%) a mujeres, con una edad media al momento del diagnóstico de 51 ± 16,23 años en general de las cuales 12 (27,27%) obtuvieron resultado positivo para AATG, 2 (4,54%) valores indeterminados y 30 (68,18%) resultados negativos con resultados histológico compatible con EC. Conclusión: No es frecuente la positividad del anticuerpo antitransglutaminasa tisular humana en pacientes adultos histológicamente compatibles con enfermedad celiaca.
Palabras clave: Enfermedad celíaca; Anticuerpos; Histología (fuente: DeCS BIREME).
ABSTRACT
Objective: To determine the frequency of positive results for antitransglutaminase antibody in adult patients histologically compatible with celiac disease. Material and methods: Cross sectional, descriptive study with research-oriented regime, which included medical records of Gastroenterology Service of San Pablo Clinic, Lima, Peru from 1994 to 2011 with biopsies histologically compatible with CD and antitransglutaminase antibodies to find the frequency of positive serology. Results: According to criteria established by the present study, we worked on a total of 44 medical records which included18 (40.9%) men and 26 (59.1%) women, mean age at diagnosis of 51 ± 16.23 years at the total. From all, 12 (27.27%) were positive for AATG, 2 (4.54%) values were indeterminate and 30 (68.18%) were negative with histological findings compatible with CD. Conclusion: It is not frequent positive results for antitransglutaminase antibody in adult patients histologically compatible with celiac disease.
Key words: Celiac disease; Antibodies; Histology (source: MeSH NLM).
INTRODUCCIÓN
La enfermedad celíaca (EC) es una forma de enteropatía que afecta a individuos genéticamente predispuestos, al entrar en contacto con alimentos que contienen gluten, hallándose fuerte asociación con el HLA-DQ2 y HLA-DQ8 (1).
Enfermedad celíaca resulta ser más frecuente en poblaciones caucásicas, presentándose 2 veces más en mujeres que en varones, debiéndose en parte a un incremento real de prevalencia en las mujeres respecto a los hombres y también al hecho de que las mujeres utilizan los servicios de salud más que estos (2).
En Perú se considera aún como una entidad clínica raramente diagnosticada (3), siendo la estimación de prevalencia mundial 1/266 (4).
Se consideran grupos de riesgo a los familiares de enfermos celiacos, en especial los de primer grado y a los pacientes con enfermedades asociadas tales como: diabetes mellitus tipo I, endocrinopatía autoinmune en especial enfermedad de la tiroides, hepatitis autoinmune, síndrome de Sjögren, lupus eritematoso sistémico, enfermedad de Addison, encefalopatía progresiva, síndromes cerebelosos, desórdenes genéticos como: síndrome de Down y síndrome de Turner, fibrosis quística, entre otras (5).
La EC puede presentarse a cualquier edad y el espectro de manifestaciones clínicas es muy variable; así los síntomas digestivos pueden ser poco prominentes o bien, a nivel clínico, puede haber franco predominio de manifestaciones extraintestinales (6), yendo desde formas asintomáticas hasta completamente diversas y complejas presentaciones clínicas (4,7,8).
Para el diagnóstico de EC contamos con biopsia de intestino delgado, siendo considerado hasta ahora el Gold standard (9); cuyas formas compatibles oscilan desde tan sólo un aumento de la población de linfocitos intraepiteliales (enteritis linfocítica) hasta formas avanzadas de atrofia vellositaria; hallazgos que son clasificados según los Criterios de Marsh; los cuales comprenden: Marsh 0: mucosa normal, Marsh 1: incremento del número de linfocitos intra-epiteliales, usualmente exceden los 20/100 enterocitos, Marsh 2: Proliferación de criptas de Liberkuhn, Marsh 3: atrofia vellositaria variable, Marsh 3a: Atrofia vellositaria parcial, Marsh 3b: Atrofia vellositaria subtotal, Marsh 3c: Atrofia vellositaria total, Marsh 4: Hipoplasia de la arquitectura histológica del intestino delgado (10).
El desarrollo de las pruebas serológicas con sensibilidad y especificidad para EC, y su realización a sujetos que son aparentemente sanos ha demostrado que EC sigue siendo sub-diagnosticada en todos los grupos de edad (11).
El diagnóstico por serología ha sufrido cambios con el devenir del tiempo; así los anticuerpos antitransglutaminasa tisular humana y anti-endomisio han sustituido a los anticuerpos anti-gliadina como pruebas serológicas de diagnóstico (12).
Se entiende por transglutaminasas a aquellas que catalizan irreversiblemente las modificaciones proteicas post-translacionales (13). Tanto Rostom A. et al. (14) como Sugai E. et al. (15) concuerdan en que el anticuerpo antitransglutaminasa tisular humana constituye el mejor test para diagnóstico inicial de EC y que la combinación de dos test incluyendo a éste podrían hacer, en diversos escenarios, un diagnóstico en donde se prescinda de biopsia intestinal. Weitz J. et al (16) obtienen como resultado de un total de 49 pacientes que tanto anticuerpos antitransglutaminasa tisular humano como anti-endomisio mostraron una especificidad y valor predictivo positivo del 100%, sensibilidad de 89 y 92% respectivamente y el valor predictivo negativo del 92 y 94%, respectivamente.
Por su parte Abrams J. et al. (17) concluyen en que el anticuerpo anti-transglutaminasa tisular humana puede depender en gran medida de la presentación clínica de la EC, pues ésta va desde formas clásicas a silentes.
Se estima que los pacientes con criterios de Marsh III a, b o c de grado de atrofia vellositaria, poseen una sensibilidad, especificidad, valor predictivo positivo y negativo de la prueba del anticuerpo antitransglutaminasa tisular humana de 71%, 65%, 91% y 30%, respectivamente (18).
Sierra C. et al. (19) encuentran presencia de mayor número de lesiones patológicas a medida que aumenta los valores de anticuerpo anti-transglutaminasa tisular humana; observaron que por encima de 10,6 veces su punto de corte establecido (16 UE/ml) para valor de anticuerpo anti-transglutaminasa tisular humana, todas las biopsias se catalogan como Marsh 3.
Lanzini A. et al. (20) reportaron en un estudio que comprendió a 465 pacientes con diagnóstico de enfermedad celíaca que los cambios histológicos se producen en una media de 16 meses luego de iniciada la dieta libre de gluten.
El iceberg con el que se compara a la enfermedad celíaca no deja de ser una realidad que afecta el ámbito diagnóstico en nuestro medio.
Además, debido a que las pruebas serológicas son escasas y con un precio elevado, la histología se ha convertido en la piedra angular del diagnóstico de EC en pacientes con síntomas gastrointestinales superiores en el Perú (3).
Sin embargo, las dificultades para el diagnóstico de EC no es algo que escape al ámbito global y es que la clínica de la EC presenta mucha variabilidad comportándose como distractor de un diagnóstico muchas veces oportuno (15).
Por todas las dificultades mencionadas, resulta importante el hecho de conocer con qué frecuencia un resultado de biopsia compatible con enfermedad celíaca se refleja realmente en el valor de anticuerpo anti-transglutaminasa tisular humano considerado el mejor dentro de las pruebas serológicas, constituyendo éste el principal motivo de esta investigación.
MATERIAL Y MÉTODOS
El presente trabajo corresponde a un diseño analítico, transversal con régimen de investigación orientado. Se utilizó como unidad de análisis las historias clínicas y los registros concernientes a esta investigación consignados en el Servicio de Gastroenterología de La Clínica San Pablo, Lima, Perú.
Se indagó acerca del diagnóstico de enfermedad celíaca, con resultados de biopsias duodenales descritas según los criterios de Marsh (definidos como el gold estandar) y serología para anticuerpo antitransglutaminasa tisular humana.
Para el presente estudio se utilizó una ficha de identificación de los pacientes celiacos, procediendo al llenado de una hoja de recolección de muestra elaborada para tal fin (ver anexo).

El registro de datos consignados en las correspondientes hojas de recolección de datos fue procesado utilizando hojas de cálculo de Excel 2010 para la exposición de los resultados concernientes a este estudio.
Población Objetivo
La población objetivo estuvo constituida por 76 Historias clínicas de los pacientes atendidos en el Servicio de Gastroenterología de la Clínica San Pablo en donde se consigne el diagnóstico de enfermedad celíaca en el período comprendido desde el año 1994 al 2011.
Muestra
El tamaño de la muestra estuvo conformado por 44 historias clínicas de pacientes adultos con diagnóstico de enfermedad celíaca por biopsia intestinal atendidos en el Servicio de Gastroenterología de la Clínica San Pablo que cumplan con los criterios de selección establecidos.
Criterios de inclusión:
Historias clínicas de pacientes atendidos en el Servicio de Gastroenterología en donde se encuentre registrado el diagnóstico de enfermedad celíaca.
Historias clínicas que contengan resultado de biopsia intestinal según los criterios de Marsh que sea compatible con enfermedad celíaca. Para este fin se incluyeron aquellas biopsias en las que el reporte patológico indicara desde infiltración de linfocitos intra-epiteliales hasta atrofia de vellosidades (Marsh 1-4).
• Historias clínicas que contengan resultado serológico de anticuerpo anti-transglutaminasa tisular.
Criterios de exclusión:
Historia clínica que no contengan resultado de biopsia intestinal.
Historia clínica que no contengan resultado de anticuerpo anti-transglutaminasa tisular humana.
Historia clínica que contenga resultado de biopsia intestinal negativo, es decir que reporte mucosa normal o sin alteraciones.
Historia clínica en la que conste el inicio dieta libre de gluten antes de realizarse estudio serológico y de biopsia.
Definiciones Operacionales:
• Anticuerpo anti-transglutaminasa tisular humana:
Pacientes con resultado de dosaje de anticuerpo anti-transglutaminasa tisular humana positivo o negativo, prueba que se realiza bajo el método de ELISA y cuyos valores referenciales para el presente estudio son (21): Negativo: < 20 UE/ml Indeterminado: 20-30 UE/ml Positivo: >30 UE/ml
• Enfermedad celíaca:
Paciente que consigne en sus historias clínicas el diagnóstico de enfermedad celíaca y que presente resultado compatible en la biopsia duodenal (incluyendo desde infiltración de linfocitos intraepiteliales hasta atrofia de vellosidades) Marsh 1: incremento del número de linfocitos intra-epiteliales, usualmente exceden los 20/100 enterocitos, Marsh 2: Proliferación de criptas de Liberkuhn, Marsh 3: atrofia vellositaria variable, Marsh 3a: Atrofia vellositaria parcial, Marsh 3b: Atrofia vellositaria subtotal, Marsh 3c: Atrofia vellositaria total, Marsh 4: Hipoplasia de la arquitectura histológica del intestino delgado (10).
• Aspectos éticos:
El presente estudio se basará en los lineamientos éticos de la investigación científica divulgadas por la OMS. OMS – OPS. Normas éticas del PSI para las investigaciones con sujetos humanos. Declaración de Helsinski de la Asociación Médica Mundial, 2000 (22).
RESULTADOS
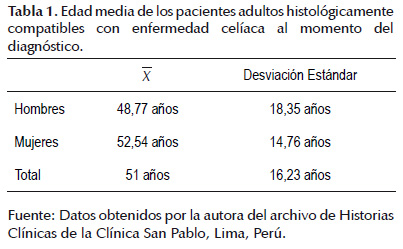
La muestra del presente estudio estuvo conformada por un total de 44 historias clínicas que cumplieron con los criterios establecidos y que como se muestra en la Figura 1 estuvo conformada por 18 (40,9%) historias clínicas correspondientes a hombres y 26 (59,1%) a mujeres; cuyas edades medias al momento del diagnóstico se muestran en la Tabla 1.
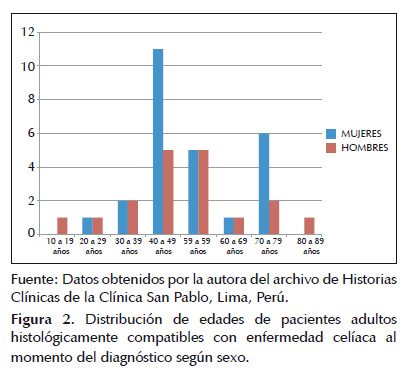
Se observa un pico en cuanto a distribución de edades al momento del diagnóstico según sexo ubicado entre los 40 a 49 años para ambos.
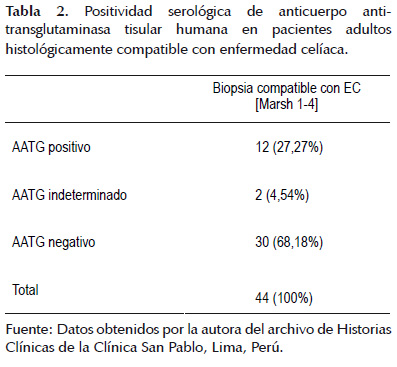
Los valores del anticuerpo anti-transglutaminasa tisular humana fueron contrapuestos con aquellos pacientes Histológicamente compatibles con enfermedad celíaca (Tabla 2).
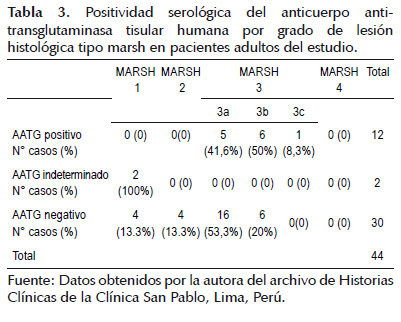
A continuación, en la Tabla 3 se presentan los valores de AATG por grado de lesión histológica según categorías de Marsh en adultos histológicamente compatibles con EC, notándose que la totalidad de resultados positivos se ubican en categoría Marsh 3; en cuanto a los 2 con valores indeterminados, se ubicaron en categoría Marsh 1; mientras que los valores negativos se distribuyeron en categorías Marsh 1, 2, 3a y 3b.
DISCUSIÓN
Enfermedad celíaca (EC) constituye una entidad clínica poco diagnosticada en Perú, esto se debe a causas diversas; tales como: la no disponibilidad y/o alto valor económico de exámenes serológicos, la realización de endoscopía más biopsia duodenal para estudio histopatológico, que si bien es cierto cuenta con mayor acceso, requiere acompañarse de otros exámenes para una diagnóstico adecuado, sin mencionar que una minoría de pacientes se niega a la realización de pruebas invasivas; se agrega también la extensa expresión clínica que muestra esta patología, la misma que en muchos casos desvía ampliamente la atención por el hecho de no limitarse a sintomatología gastrointestinal, prolongando su diagnóstico y si a esto sumamos el hecho de que el tratamiento consiste en el inicio de una dieta libre de gluten, pues nos enfrentamos a la introducción de tratamiento previo al diagnóstico certero con el fin de observar evolución clínica, lo que afectaría resultados de pruebas diagnósticas si en el futuro se decidiese realizarlas, cabe también, resaltar que la totalidad de los pacientes seleccionados en este estudio tuvieron como criterio de exclusión la dieta libre de gluten previo al diagnóstico de EC y que mostraron, según seguimiento, evolución favorable al ser introducida.
La muestra del presente estudio estuvo conformada por 44 pacientes con resultado histológico de biopsia duodenal compatible con EC, de los cuales 18 (40,9%) corresponden a hombres y 26 (59,1%) a mujeres (Figura 1), lo que coincide con otros estudios en donde se menciona mayor prevalencia en mujeres que en hombres (2,3,8,9,11,17,18) ya sea por la razón genética inherente a esta patología; así como al hecho de que las mujeres son usuarias más frecuentes de los servicios de salud (18); se observa además una edad media al momento del diagnóstico de 48,77años ± 18,35 DE y 52,54 años ± 14,76 DE a cada grupo respectivamente, con un promedio general de 51 años ± 16,23 DE (Tabla 1), similar al valor promedio encontrado de 44,5 años ± 15,4 para ambos sexos por Abrams (17).
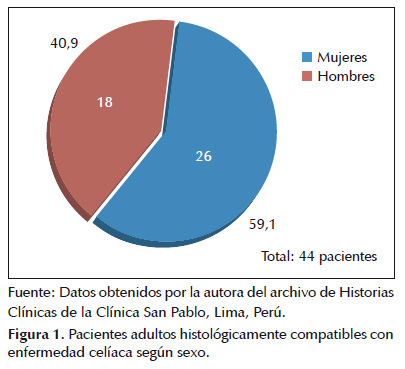
En la Figura 2 puede observarse un pico en cuanto a distribución de edades al momento del diagnóstico según sexo ubicado entre los 40 a 49 años, el mismo que difiere ligeramente con el pico de edad al momento del diagnóstico encontrado por Freeman (18) entre los 30 y 40 años correspondiente a la población canadiense y la hallada por Catassi ubicada entre los 50 y 60 años en población estadounidense (23).
Al igual que el estudio de Llanos (25), la mayoría de pacientes mostraron una presentación clásica de la enfermedad y fueron pocos los casos con sintomatología extra intestinal aislada. La media de la demora entre el inicio de síntomas y el diagnóstico fue de 10 años lo que permitió la exclusión de otras enfermedades causantes de atrofia vellositaria.
Con respecto al objetivo principal del presente estudio tan sólo 12 (27,27%) de un total de 44 pacientes con resultado histológico de biopsia duodenal compatible con EC obtuvieron valores positivos de AATG, 2 (4,54%) obtuvieron valores indeterminados y 30 (68,18%) valores negativos (Tabla 2), estos resultados de frecuencia de positividad coinciden con los obtenidos por Arévalo (3) en donde tan sólo 5 (16,1%) de 31 pacientes fueron los correspondientes a valores positivos de AATG en pacientes con histología compatible con EC; sin embargo, difieren con los obtenidos por Ludvigsson (9) y Giangreco (11) quienes obtuvieron un 85% y 100% de positividad de valor de AATG respectivamente frente a atrofia vellositaria e incremento de linfocitos, estos valores corresponden a estudios realizados en Suecia e Italia respectivamente (4) y esta diferencia de resultados serológicos comparados con los obtenidos histológicamente se deberían a la existencia de otras enteropatías, muchas de ellas infecciosas, causantes de patrones histológicos similares (1,3). Pese a todo, la histología del intestino delgado sigue siendo considerado el patrón oro para el diagnóstico de EC (12,15). Cabe resaltar que uno de los dos pacientes con resultado de AATG indeterminado cuenta con estudio genético en el que se reporta presencia HLA DQ2, resultado a favor de enfermedad celíaca.
Las pruebas diagnósticas han cambiado en los últimos años, dejándose de lado el uso de la anti gliadina (IgA e IgG) como screening debido a su baja sensibilidad y especificidad, (80% y 85% respectivamente) debiéndose utilizar, entonces, el dosaje de IgA Anti-transglutaminasa (sensibilidad 90 a 98%, especificidad 95-97%) e IgA antiendomisio (sensibilidad 85-98%), especificidad 97-100%) (25). AATG es considerada la más eficiente prueba serológica para diagnóstico de EC debido a su carácter cuantitativo, menor costo, a su procesamiento rápido y por no ser dependiente del operador (8,14,16) en comparación a otras pruebas serológicas; Sin embargo, existen datos acerca de resultados serológicos negativos para AATG en casos de lesión histológica correspondientes a categorías por debajo de Marsh 3 (8,12), un 90% (54/60) pacientes con EC con resultado histopatológico correspondiente a atrofia vellositaria total y tan sólo un 30% (18/60) de pacientes con atrofia vellositaria parcial obtuvieron valores positivos para el AATG en el estudio realizado por Abrams (17); por su parte 44% (7/16) pacientes con atrofia vellositaria obtuvieron resultado de AATG positivo en el estudio de Hopper (24) lo que respaldaría el hecho de que todos los valores positivos en el presente estudio se encuentren en la categoría de Marsh 3; sin embargo, también se hallaron valores negativos con categorías de Marsh 1,2 e incluso 3, lo que nos lleva a pensar en posibles resultados falsos negativos (Tabla 3).
De nuestra serie pudimos obtener además que 7 pacientes obtuvieran resultado positivo para Antiendomisio y 16 para Anti-gliadina, siendo dos de ellos positivos para ambas pruebas serológicas.
No olvidemos que los estudios serológicos como muchos otros se encuentran supeditados en gran medida a su forma de determinación, el kit utilizado y el operador a cargo en cada caso en particular.
Otra posible razón para la reducida frecuencia de positividad de AATG en el presente estudio, podría estar constituida por la deficiencia selectiva de IgA (2,3,4,6,7,10,12,19) definida por valores séricos totales <0,05 g/L (17), correspondiendo a 1 de 40 casos en pacientes con EC comparada con 1 de cada 400 de la población general (1), llegando a reportarse hasta 15 veces más común y con una prevalencia de 1,7% a 3% en dichos pacientes (12); lo que conllevaría a resultados falsos negativos de AATG. En nuestra serie todos los pacientes contaron con valores de IgA y tan sólo uno de los 44 obtuvo como resultado déficit en su valor sérico.
Finalmente, cabe agregar que la pobre cantidad de estudios referentes a EC realizados en población peruana conlleva al hecho de que no contemos con puntos de corte de valores de AATG estandarizados para nuestra población, que es con lo que se cuenta en muchos países del mundo, en donde sí se realiza investigación con amplio número de casos y contando con mayor disponibilidad y accesibilidad a pruebas diagnósticas; así es como, en el Perú realizamos pruebas serológicas de AATG con valores similares a los utilizados en países norteamericanos en donde el punto de corte es de 20 UE/ml (15) difiriendo de diversos países europeos en donde los valores han venido siendo estandarizados para cada población en particular, teniendo puntos de corte tales como 16 UE/ ml en el caso de España (19) y 6,4 UE/ml en Inglaterra (21). Porqué asumir entonces que nuestra población debe ser medida con estos estándares, si es obvio que la variación es notable de población a población.
BIBLIOGRAFÍA1. Green PH, Cellier C. Celiac diasease . N Engl J Med. 2007 Oct 25;357(17):1731-43.
2. Shah S, Leffler D. Celiac disease: an underappreciated issue in women’s health . Womens Health (Lond Engl). 2010 Sep;6(5):753-66. doi: 10.2217/whe .10.57.
3. Arévalo F, Roe E, Arias-Stella Castillo J, Cárdenas J, Montes P, Monge E. Low serological positivity in patients with histology compatible with celiac disease in Perú . Rev Esp Enferm Dig. 2010 Jun;102(6):372-5.
4. Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum . Gastroenterology. 2001 Feb;120(3):636-51.
5. Freeman HJ. Risk factors in familial forms of celiac diasease . World J Gastroenterol. 2010 Apr 21;16(15):1828-31.
6. Canales P, Araya M, Alliende F, Hunter B, Alarcón T, Chávez R. Estado actual del diagnóstico y presentaciones clínicas de enfermedad celíaca. Estudio multicéntrico . Rev Méd Chile 2008;136:296-303.
7. Fernández A, González L, De la Fuente J. Coeliac disease: clinical features in adult populations . Rev Esp Enferm Dig. 2010 Jul;102(8):466-71.
8. Fernández Salazar LI1, de la Torre Ferrera N, Velayos Jiménez B, Nocito Colón M, González Hernández JM, Garrote Adrados JA. Diagnostic problems in adult celiac disease . Rev Esp Enferm Dig. 2008 Jan;100(1):24-8.
9. Ludvigson JF, Brandt L, Montgomery S, Granath F, Ekbon A. Validation study of villous atrophy and small intestinal inflammation in Swedish biopsy registers . BMC Gastroenterol. 2009 Mar 11;9:19. doi: 10.1186/1471-230X-9-19.
10. Kalhan S, Joseph P, Sharma S, Dubey S, Dudani S, Dixit M. Comparative study of histopathological Marsh grading with clinical and serological parameters in celiac iceberg of north India . Indian J Pathol Microbiol. 2011 AprJun;54(2):279-83. doi: 10.4103/0377-4929.81593.
11. Giangreco E, D’agate C, Barbera C, Puzzo L, Aprile G, Naso P, et al. Prevalence of celiac disease in adult patients with refractory functional dyspepsia: value of routine duodenal biopsy . World J Gastroenterol. 2008 Dec 7;14(45):6948-53.
12. Rostom A, Murray JA, Kagnoff MF. American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease . Gastroenterology. 2006 Dec;131(6):1981-2002.
13. Ricotta M, Iannuzzi M, De Vivo G, Gentile V. Physio-pathological roles of transglutaminase-catalyzed reactions . World J Biol Chem. 2010 May 26;1(5):181-7. doi: 10.4331/wjbc .v1.i5.181.
14. Rostom A, Murray JA, Kagnoff MF. Medical position statement on celiac disease . 2006;131(6):1977-80.
15. Sugai E, Moreno M, Hwang H, Cabanne A, Crivelli A, Nachman F, et al. Celiac disease serology in patients with different pretest probabilities: is biopsy avoidable? World J Gastroenterol. 2010 Jul 7;16(25):3144-52.
16. Weitz J, Montalva R, Alarcón T, Contreras L . Determinación de anticuerpos anti-transglutaminasa en el diagnóstico de enfermedad celíaca . Rev Méd Chile. 2003;131:25-9.
17. Abrams JA, Brar P, Diamond B, Rotterdam H, Green PH. Utility in clinical practice of immunoglobulin a anti-tissue transglutaminase antibody for the diagnosis of celiac disease . Clin Gastroenterol Hepatol. 2006 Jun;4(6):726-30.
18. Freeman HJ, Chopra A, Clandinin MT, Thomson ABR. Recent advances in celiac disease . World J Gastroenterol. 2011 May 14;17(18):2259-72. doi: 10.3748/wjg .v17.i18.2259.
19. Sierra C, Blasco J, Navas V, Vicioso M, Serrano J, Weil B, et al. Predicción de lesión histológica intestinal en pacientes pediátricos con enfermedad celíaca . An Pediatr (Barc). 2011;74(4):226-31.
20. Lanzini A, Lanzarotto F, Villanacci V, Mora A, Bertolazzi S, Turini D, et al. Complete recovery of intestinal mucosa occurs very rarely in adult coeliac patients despite adherence to gluten free diet . Aliment Pharmacol Ther. 2009 Jun 15;29(12):1299-308. doi: 10.1111/j.1365-2036.2009.03992.x.
21. Leja M, Kojalo U, Frickauss G, Bandere B, Gavars D, Boka V. Changing patterns of serological testing for celiac disease in Latvia . J Gastrointestin Liver Dis. 2011 Jun;20(2):121-6.
22. Organización Mundial de la Salud; Organización Panamericana de la Salud. Normas éticas del PSI para las investigaciones con sujetos humanos. Declaración de Helsinski de la Asociación Médica Mundial. Edimburgo: OMS; 2000.
23. Catassi C, Kryszak D, Louis-Jacques O, Duerksen DR, Hill I, Crowe SE, et al. Detection of Celiac disease in primary care: a multicenter case-finding study in North America . Am J Gastroenterol. 2007 Jul;102(7):1454-60.
24. Hopper AD, Hadjivassiliou M, Hurlstone DP, Lobo AJ, McAlindon ME, Egner W, et al. What is the role of serologic testing in celiac disease? A prospective, biopsy-confirmed study with economic analysis . Clin Gastroenterol Hepatol. 2008 Mar;6(3):314-20. doi: 10.1016/j.cgh .2007.12.008.
25. Llanos O, Matzumura M, Tagle M, Huerta Mercado J, Cedrón H, Scavino Y, et al. Enfermedad celíaca: estudio descriptivo en la Clínica Anglo Americana . Rev Gastroenterol Peru. 2012 Apr-Jun;32(2):134-40.
Correspondencia:
Judy Melissa Piscoya Moncada Lucio Séneca 508 Urb. Rázuri. Trujillo, Perú E-mail: melissapiscoya@hotmail.com
Recibido: 07/01/2014
Aprobado: 11/06/2014














