Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.34 no.3 Lima July 2014
Reportes de Casos
Cáncer colorrectal en niños: reporte de tres casos
Colorectal cancer in children: report of three cases
Liliana Vásquez 1, Mónica Oscanoa 1, Iván Maza 1, Jenny Gerónimo 1, Fanny Tarrillo 1, Alan Latorre 2, Oscar Frisancho 3, Juan Llatas 3
1 Departamento de Oncología, Hospital Nacional Edgardo Rebagliati, EsSalud. Lima, Perú. 2 Departamento de Anatomía Patológica, Hospital Nacional Edgardo Rebagliati, EsSalud. Lima, Perú. 3 Departamento del Aparato Digestivo, Hospital Nacional Edgardo Rebagliati, EsSalud. Lima, Perú.
Recibido: 16-04-2014
Aprobado: 14 -07-2014
RESUMEN
El cáncer colorrectal (CCR) es extremadamente infrecuente en niños y adolescentes. Existe poca literatura publicada sobre esta entidad, principalmente de reportes de casos y artículos de revisión. Reportamos tres casos de niños con carcinoma de colon de histología poco diferenciada y enfermedad avanzada al momento del diagnóstico. La sintomatología más común fue el dolor abdominal y estreñimiento con una latencia de síntomas de 4 a 48 meses. Ningún paciente fue operable al debut; presentando progresión de enfermedad a pesar del tratamiento en dos casos. Este estudio reafirma el pobre pronóstico del CCR pediátrico, probablemente debido a factores como una biología tumoral agresiva y estadio avanzado al debut. Las directrices terapéuticas están basadas en manejo de adultos, aunque es necesario mejorar las herramientas de diagnóstico y las terapias que incrementen la sobrevida en niños y adolescentes
Palabras clave: Cáncer colorrectal; Carcinoma; Niño; Adolescente (fuente: DeCS BIREME).
ABSTRACT
Colorectal cancer (CRC) is extremely infrequent in children and adolescents. There is little information about this entity, mainly case reports and review articles. We describe three cases of children with poor-differentiated colorectal carcinoma and advanced disease at onset. The presenting symptoms were abdominal pain and constipation, with a median of latency of symptoms of 4-48 months. None of these patients had operable disease at onset; having a disease progression despite therapy in two cases. This study reaffirms poor prognosis of pediatric CRC, probably due to an aggressive tumoral biology and advanced stage at diagnosis. Therapeutic guidelines are based in adult treatment; therefore, efforts should be made to improve tools in early diagnosis and future therapies for a better survival in childhood.
Key words: Colorectal cancer; Carcinoma; Child; Adolescent (source: MeSH NLM).
INTRODUCCIÓN
El cáncer colorrectal (CCR) es una entidad extremadamente rara en niños y adolescentes, con una incidencia estimada de 0,3 a 1,5 casos por millón de habitantes (1,2), no habiendo estudios previos en nuestro país. En adultos, la tasa de curación es alta cuando se realiza un diagnóstico precoz y el tratamiento es multidisciplinario. Sin embargo, en la población pediátrica debido a un bajo índice de sospecha, infrecuencia del tumor, comportamiento biológico agresivo y alto potencial de diseminación, el diagnóstico es generalmente tardío y el pronóstico sombrío, con pobre sobrevida a pesar del tratamiento (3). Adicionalmente, el manejo clínico y enfoque terapéutico se basa en la experiencia de los casos en adultos. Ante la rareza de esta patología, se presentan tres casos de pacientes con CCR atendidos en la Unidad de Oncología Pediátrica y del Adolescente del Hospital Nacional Edgardo Rebagliati Martins y una revisión de la literatura publicada hasta la fecha.
CASOS CLÍNICOS
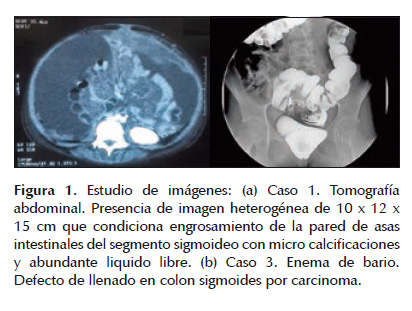
CASO 1 Varón de 12 años de edad, natural y procedente de la localidad de Junín, Perú; sin antecedentes patológicos o familiares contributorios. Presenta un tiempo de evolución de 4 meses de dolor abdominal intermitente y progresivo, pérdida de peso y astenia. Al examen clínico se palpaba una tumoración en hemiabdomen izquierdo mal definida. En tomografía abdominal se destacó un engrosamiento marcado de las paredes del sigmoides y del descendente distal con compromiso graso pericólico, infiltración de mesosigmoides, mesocolon, mesenterio; liquido libre en cavidad en moderada cantidad y la presencia de un nódulo pulmonar derecho (Figura 1a). Debido a un cuadro de obstrucción intestinal fue intervenido quirúrgicamente por laparotomía exploratoria, donde se observó tumoración cerebroide dependiente de colon descendente, de bordes mal definidos considerado inoperable tomando solo especímenes para biopsia. El resultado de anatomía patológica fue de un adenocarcinoma mucinoso pobremente diferenciado, con estadio clínico Dukes D. Por razones extramédicas, el paciente se pierde y retorna a su ciudad de origen sin tratamiento alguno, regresando dos meses después con mayor compromiso del estado general, aumento de volumen abdominal y de miembros inferiores, signos de caquexia, disnea progresiva por derrame pleural masivo y episodios de obstrucción intestinal. Se le realizó estudios para K-ras en la biopsia realizada, siendo mutado. Inicia quimioterapia a titulo paliativo en base a régimen FOLFOX4-bevacizumab a dosis reducidas (50%) por dos cursos. Adicionalmente, recibió antibioticoterapia de amplio espectro, nutrición parenteral y manejo de dolor. Fue sometido a drenaje torácico, paracentesis evacuatoria a demanda y manejo de paciente postrado. Su evolución fue desfavorable desarrollando falla multiorgánica y falleciendo a los 5 meses del diagnóstico por progresión de enfermedad.
Mujer de 14 años de edad, natural y procedente de la localidad de Ica, Perú; sin antecedentes contributorios. Inicia su enfermedad 4 años antes de su ingreso, caracterizada por estreñimiento, dolor y distensión abdominal intermitente y progresiva. Al examen clínico se evidenció una tumoración palpable en hemiabdomen derecho mal definida. Se le realiza una laparotomía exploratoria, evidenciando tumoración de colon ascendente infiltrante a epiplón e implantes peritoneales, catalogándose como inoperable por lo que se toma una biopsia con resultado anátomopatológico que mostró un carcinoma de células en anillo de sello, con metástasis a pleura (Figura 2a) y estadio clínico Dukes D. Al debut se realiza tomografía de tórax, abdomen y pelvis que revela abundante líquido libre más engrosamiento de epiplón mayormente por infiltración. Inicia quimioterapia de primera línea en base a régimen FOLFOX4 y bevacizumab por 6 cursos con progresión de enfermedad. Se índica tratamiento de segunda línea con cetuximab e irinotecan por 6 cursos con evolución desfavorable, cursando con cuadros de suboclusión intestinal. El paciente fallece por progresión de enfermedad a los 10 meses del diagnóstico.
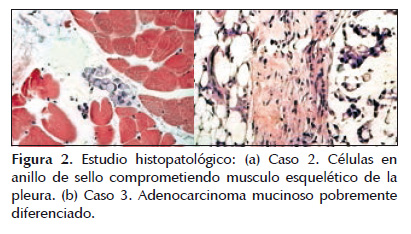
Mujer de 11 años de edad, natural y procedente de la localidad de Lima, Perú, con antecedente familiar de abuela y tío paterno fallecidos por cáncer de colon. Inicia su enfermedad con una historia de 3 meses caracterizado por dolor abdominal, pérdida ponderal no cuantificada y estreñimiento, que requería tratamiento con laxantes y enemas. Se le realiza un examen ecográfico basal que muestra una masa intraperitoneal de 8 cm de diámetro a nivel de pared posterior de peritoneo pélvico. En un estudio de enema de bario se visualizó un defecto de llenado en la región del colon sigmoides compatible con un proceso neoformativo (Figura 1b). Es sometida a laparotomía exploratoria donde se observa lesiones granulomatosas, blanquecinas y nodulares en todo el peritoneo y epiplón; considerado inoperable se tomó especímenes para biopsia de epiplon. En la tomografía de tórax, abdomen y pelvis se observa engrosamiento de paredes del sigmoides con calcificaciones, sin evidencia de metástasis, con estadio Dukes D. El resultado patológico fue adenocarcinoma mucinoso pobremente diferenciado con compromiso de epiplón (Figura 2b). Se realizó el estudio de K-ras en la muestra con resultado no mutado. La paciente actualmente está en tratamiento con quimioterapia en base a régimen FOLFOX4, habiendo recibido seis cursos. En evaluación de la respuesta se evidencia enfermedad estable por tomografía.
DISCUSIÓN
El CCR es una patología muy infrecuente en niños y adolescentes. La importancia del presente estudio radica en que representa la primera publicación de CCR en niños en nuestro país.
La edad de presentación del CCR pediátrico más común es durante la segunda década de la vida (1,4-6); aunque se ha reportado en todas las edades, incluyendo fetos y recién nacidos (7,8). Es más frecuente en países desarrollados como Estados Unidos y países europeos, siendo más raro en África y Asia, a excepción de Japón (9).
Varios factores etiológicos han sido descritos, como la predisposición familiar, exposiciones ambientales y trastornos inflamatorios del tracto gastrointestinal (10). Los síndromes hereditarios asociados a mayor predisposición al carcinoma colorrectal son la poliposis adenomatosa familiar y el cáncer colorrectal hereditario no polipósico (HNPCC). Asimismo, también esta descrito una relación con la colitis ulcerativa, enfermedad de Crohn (11), neurofibromatosis, síndrome de Turner, síndrome de Peutz-Jeghers y síndrome de Bloom (12,13). Solo uno de nuestros casos tuvo historia familiar de CCR, lo cual es consistente con los reportes previos en los que mayormente no se halla antecedentes familiar de CCR, poliposis familiar o algún otro síndrome asociado, lo cual denota que no hay una correlación estricta con la temprana edad de presentación de esta enfermedad (14,15).
Existen al menos 200 casos de CCR pediátrico reportados en la literatura; siendo en su mayoría pacientes con diagnóstico tardío, tumores poco diferenciados y estadio avanzado (1,4-7,13,16-22). Esto podría deberse al bajo índice de sospecha de esta entidad, sumado a lo inespecífico de los síntomas iniciales como dolor abdominal, estreñimiento, nauseas, vómitos, cambios en el patrón defecatorio, hematoquezia, anemia y baja de peso (21). En los casos presentados se reafirma la ocurrencia de un retraso en el diagnóstico, siendo de 4 a 48 meses de latencia de síntomas hasta el diagnóstico, lo cual se corresponde con las series de casos previamente reportados (6). Los síntomas y signos de los pacientes presentados concuerdan con los reportados en la literatura, siendo más común el dolor abdominal, aunque en todos los niños se evidenció alta incidencia de pseudooclusión intestinal, siendo esto un signo de enfermedad muy avanzada. En comparación a los adultos, la presentación aguda es más común en la población pediátrica (23); habiendo reportes de pacientes que debutan como un cuadro de peritonitis u obstrucción intestinal.
Ante la sospecha de CCR, es necesaria una evaluación oportuna con rayos X abdominal, enema baritado, tomografía y eventualmente, colonoscopía (24). El diagnóstico de CCR en niños se dificulta en muchas ocasiones ya que los estudios de colonoscopía pueden ser frustros o no localizan el tumor, dada la alta frecuencia de lesiones del colon ascendente (13). La biopsia de alguna lesión sospechosa es indispensable para el diagnóstico y puede ser obtenida por colonoscopía o laparotomía. En nuestros casos, las muestras fueron obtenidas por laparotomía exploratoria, debido a dificultades técnicas de otros estudios. El rol de la tomografía por emisión de positrones PET-CT no está claro, siendo poca su utilidad en neoplasias mucinosas (25). La monitorización por marcadores tumorales séricos, como el antígeno carcinoembrionario (CEA) no es útil, a diferencia de los adultos, observando que en muchos casos no se corresponde con la presencia de enfermedad residual o progresión (20,26). El estadiaje se basa en guías de adultos, destacando la guía de cáncer del American Joint Commision on Cancer (AJCC) (27) y el estadiaje de Dukes.
Histopatológicamente, el CCR en niños es a predominio adenocarcinoma poco diferenciado como el subtipo mucinoso y en anillo de sello en más de la mitad de los casos (20,21,28,29); a diferencia de los adultos, donde estos tipos representa entre un 5-15% de los casos. Estos subtipos histológicos se asocian a un peor pronóstico (30). En nuestra serie, todos los casos correspondieron a tumores poco diferenciados. Recientemente se ha evidenciado que en pacientes jóvenes hay mayor porcentaje de expresión p53 normal y mayor inestabilidad microsatélite de alta frecuencia (1,17).
El manejo de estos pacientes es basado generalmente en protocolos empleados en adultos (31). El tratamiento quirúrgico en casos de CCR localizado es fundamental para mejorar las tasas de curación y sobrevida. Sin embargo, dado el estadio avanzado de muchos pacientes, la posibilidad de resección completa de la tumoración es muy difícil. La quimioterapia adyuvante con 5-fluorouracilo y ácido folínico (leucovorina) es el estándar en casos de compromiso de ganglios linfáticos comprometidos o resección incompleta (32). Estas drogas asociadas a otras como el oxaliplatino (esquema FOLFOX) o irinotecan (esquema FOLFIRI) proveen mayores tasas de respuesta y sobrevida libre de progresión en enfermedad avanzada o metastásica (33). Los anticuerpos monoclonales como el bevacizumab y cetuximab también han sido empleados con resultados favorables (34). La radioterapia ha demostrado su utilidad en caso de cáncer rectal, de manera concomitante a la quimioterapia (35), así como en casos de manejo paliativo.
El pronóstico del CCR en niños en las series publicadas usualmente es muy pobre (36-37), teniendo una sobrevida media de 9 a 15 meses a pesar del tratamiento (38). A los 5 años, se han reportado sobrevida global del 10-51%, muy inferior al descrito en su contraparte en adultos (39-40).
En conclusión, este estudio reafirma el pobre pronóstico del CCR pediátrico, probablemente debido a varios factores como el estadio avanzado al momento del diagnóstico, lo cual a su vez se origina de un diagnóstico tardío y/o una biología tumoral agresiva. Es necesario mejorar las herramientas de diagnóstico precoz y manejo multidisciplinario para lograr incrementar la sobrevida de los niños y adolescentes que padecen cáncer de colon.
BIBLIOGRAFÍA
1. Durno C, Aronson M, Bapat B, Cohen Z, Gallinger S. Family history and molecular features of children, adolescents, and young adults with colorectal carcinoma . Gut. 2005 Aug;54(8):1146-50.
2. Fairley TL, Cardinez CJ, Martin J, Alley L, Friedman C, Edwards B, et al. Colorectal cancer in U.S. adults younger than 50 years of age, 1998-2001. Cancer. 2006 Sep;107(5 Suppl):1153-61.
3. Vastyan AM, Walker J, Pinter AB, Gerrard M, Kajtar P. Colorectal carcinoma in children and adolescents--a report of seven cases . Eur J Pediatr Surg. 2001 Oct;11(5):338-41.
4. Steinberg JB, Tuggle DW, Postier RG. Adenocarcinoma of the colon in adolescents . Am J Surg. 1988 Dec;156(6):460-2.
5. Enker WE, Palovan E, Kirsner JB. Carcinoma of the colon in the adolescent: a report of survival and an analysis of the literature . Am J Surg. 1977 Jun;133(6):737-41.
6. Chantada GL, Perelli VB, Lombardi MG, Amaral D, Cascallar D, Scopinaro M, et al. Colorectal carcinoma in children, adolescents, and young adults. J Pediatr Hematol Oncol. 2005 Jan;27(1):39-41.
7. Taguchi T, Suita S, Hirata Y, Ishii E, Ueda K. Carcinoma of the colon in children: a case report and review of 41 Japanese cases . J Pediatr Gastroenterol Nutr. 1991 Apr;12(3):394-9.
8. Toki A, Todani T, Watanabe Y, Ogura K, Miyauchi A, Agatsuma Y. Carcinoma of the colon in childhood; report of 2 cases expressing p53 without K-ras mutation . Eur J Pediatr Surg. 1997 Oct;7(5):315-7.
9. Rodriguez-Bigas MA, Lin EH, Crane CH. Adenocarcinoma of the colon and rectum. En: Kufe DW, Pollock RE, Weichselbaum RR, Bast RC, Gansler TS, Holland JF, et al., editors. Cancer medicine. Vol. 2. Hamilton: BC Decker; 2003. p. 1635-65.
10. Dragovich T, Tsikitis VL. Colon cancer, adenocarcinoma. E-medicine.com [Internet]. March 9, 2010 [citado el 31 de diciembre de 2010]. Disponible en: http://emedicine.medscape.com/article/277496
11. Tiszlavicz L, Kapin M, Varkonyi A, Lorincz A, Bartyik K, Varkonyi T. Adenocarcinoma of the colon developing on the basis of Crohn’s disease in childhood. Eur J Pediatr. 2001 Mar;160(3):168-72.
12. Vogelstein B. Genetic testings for cancer: the surgeon’s critical role. Familial colon cancer . J Am Coll Surg. 1999 Jan;188(1):74-9.
13. Pratt CB, Rivera G, Shanks E, Johnson WW, Howarth C, Terrell W, et al. Colorectal carcinoma in adolescents implications regarding etiology . Cancer 1977 Nov;40(5 Suppl):2464-72.
14. Radhakrishnan CN, Bruce J. Colorectal cancers in children without any predisposing factors. A report of eight cases and review of the literature . Eur J Pediatr Surg. 2003 Feb;13(1):66-8.
15. Bhatia S, Pratt CB, Sharp GB, Robison LL. Family history of cancer in children and young adults with colorectal cancer . Med Pediatr Oncol. 1999 Nov;33(5):470-5.
16. Liang JT, Huang KC, Cheng AL, Jeng YM, Wu MS, Wang SM. Clinicopathological and molecular biological features of colorectal cancer in patients less than 40 years of age . Br J Surg. 2003 Feb;90(2):205-14.
17. Hoerner MT. Carcinoma of the colon and rectum in persons under twenty years of age . Am J Surg. 1958 Jul;96(1):47-53.
18. Andersson A, Bergdahl L. Carcinoma of the colon in children: a report of six new cases and a review of the literature . J Pediatr Surg. 1976 Dec;11(6):967-71.
19. Rao BN, Pratt CB, Fleming ID, Dilawari RA, Green AA, Austin BA. Colon carcinoma in children and adolescents. A review of 30 cases . Cancer. 1985 Mar 15; 5(6):1322-6.
20. Kravarusic D, Feigin E, Dlugy E, Steinberg R, Baazov A, Erez I, et al. Colorectal carcinoma in childhood: a retrospective multicenter study . J Pediatr Gastroenterol Nutr. 2007 Feb;44(2):209-11.
21. Middelkamp JN, Haffner H. Carcinoma of the colon in children . Pediatrics. 1963 Oct;32(4):558-71.
22. Cain AS, Longino LA. Carcinoma of the colon in children . J Pediatr Surg. 1970 Oct;5(5):527-32.
23. Kaplan MA, Isikdogan A, Gumus M, Arslan UY, Geredeli C, Ozdemir N, et al. Childhood, adolescents, and young adults (</=25 y) colorectal cancer: study of Anatolian Society of Medical Oncology . J Pediatr Hematol Oncol. 2013 Mar;35(2):83-9. doi: 10.1097/MPH.0b013e31827e7f20.
24. Al-Tonbary Y, Darwish A, El-Hussein A, Fouda A. Adenocarcinoma of the colon in children: case series and mini-review of the literature . Hematol Oncol Stem Cell Ther. 2013 Mar;6(1):29-33. doi: 10.1016/j.hemonc.2013.02.003.
25. Berger KL, Nicholson SA, Dehdashti F, Siegel BA. FDG PET evaluation of mucinous neoplasms: correlation of FDG uptake with histopathologic features . Am J Roentgenol. 2000 Apr;174(4):1005-8.
26. Angel CA, Pratt CB, Rao BN, Schell MJ, Parham DM, Lobe TE, et al. Carcinoembryonic antigen and carbohydrate 19-9 antigen as markers for colorectal carcinoma in children and adolescents . Cancer. 1992 Mar 15;69(6):1487-91.
27. American Joint Committee on Cancer Staging Handbook. En: Edge S, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A, eds. AJCC Cancer Staging Manual. Vol 7th. Springer: American Joint Committee on Cancer; 2010.
28. Salas-Valverde S, Lizano A, Gamboa Y, Vega S, Barrantes M, Santamaria S, et al. Colon carcinoma in children and adolescents: prognostic factors and outcome-a review of 11 cases . Pediatr Surg Int. 2009 Dec;25(12):1073-6. doi: 10.1007/s00383-009-2491-y.
29. Lewis CT, Riley WE, Georgeson K, Warren JH. Carcinoma of the colon and rectum in patients less than 20 years of age . South Med J. 1990 Apr;83(4):383-5.
30. Ferrari A, Rognone A, Casanova M, Zaffignani E, Piva L, Collini P, et al. Colorectal carcinoma in children and adolescents: the experience of the Istituto Nazionale Tumori of Milan, Italy . Pediatr Blood Cancer. 2008 Mar;50(3):588-93.
31. Goldberg J, Furman WL. Management of colorectal carcinoma in children and young adults . J Pediatr Hematol Oncol. 2012 May; 4 Suppl 2:S76-9. doi: 10.1097/ MPH.0b013e31824e38c1.
32. Madajewicz S, Petrelli N, Rustum YM, Campbell J, Herrera L, Mittelman A, et al. Phase I-II trial of high-dose calcium leucovorin and 5-fluorouracil in advanced colorectal cancer . Cancer Res. 1984 Oct;44(10):4667-9.
33. Van Cutsem E1, Nordlinger B, Cervantes A; ESMO Guidelines Working Group. Advanced colorectal cancer: ESMO Clinical Practice Guidelines for treatment . Ann Oncol. 2010. May;21 Suppl 5:v93-7. doi: 10.1093/annonc/mdq222.
34. Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer . N Engl J Med. 2004 Jun 3;350(23):2335-42.
35. Minsky BD, Cohen AM, Kemeny N, Enker WE, Kelsen DP, Reichman B, et al. Enhancement of radiation-induced downstaging of rectal cancer by fluorouracil and high-dose leucovorin chemotherapy . J Clin Oncol. 1992 Jan;10(1):79-84.
36. Minardi AJ Jr, Sittig KM, Zibari GB, McDonald JC. Colorectal cancer in the young patient . Am Surg. 1998 Sep;64(9):849-53.
37. Yamamoto T, Matsumoto K, Iriyama K. Colorectal cancer in a patient younger than 20 years of age: report of a case and a review of the Japanese literature . Surg Today. 1996;26(10):810-3.
38. Kim G, Baik SH, Lee KY, Hur H, Min BS, Lyu CJ, et al. Colon carcinoma in childhood: review of the literature with four case reports . Int J Colorectal Dis. 2013 Feb;28(2):157-64. doi: 10.1007/s00384-012-1603-7.
39. Sultan I, Rodriguez-Galindo C, El-Taani H, Pastore G, Casanova M, Gallino G, et al. Distinct features of colorectal cancer in children and adolescents: a population-based study of 159 cases. Cancer. 2010 Feb;116(3):758-65. doi: 10.1002/cncr.24777.
40. Narla LD, Hingsbergen EA, Jones JE. Adult diseases in children . Pediatr Radiol. 1999 Apr;29(4):244-54.
Correspondencia: Liliana Vásquez Ponce
E-mail: lilianavasq@gmail.com














