Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.34 no.4 Lima Oct. 2014
Esprúe colágeno: ¿entidad secundaria o independiente de la enfermedad celíaca?
Collagenous sprue: secondary or independent from celiac disease?
Carlos Alventosa Mateu ¹, Laura Larrey Ruiz ¹, Maria Dolores Pérez Zahonero ¹, Atilio Javier Navarro Gonzales ², Pilar Canelles Gamir ¹, José María Huguet Malavés ¹, María Soledad Luján Sanchís ¹, Miguel Ángel Martorell Cebollada ², Enrique Medina Chuliá ¹
¹ Servicios de Patología Digestiva, Consorcio Hospital General Universitario de Valencia. Valencia, España.
² Servicios de Anatomía Patológica, Consorcio Hospital General Universitario de Valencia. Valencia, España.
RESUMEN
El esprúe colágeno es una entidad poco prevalente que cursa con diarrea persistente con pérdida de peso y malabsorción por afectación del intestino delgado, principalmente duodeno y yeyuno proximal, necesitando para el diagnóstico la presencia de una clínica y una histología compatible con atrofia y depósito subepitelial de colágeno. Su etiología no es totalmente conocida, aunque su origen más propuesto es el autoinmune, ya que está ampliamente relacionada con la enfermedad celíaca e incluso se ha propuesto que se trate de una evolución de celiaquía refractaria a dieta sin gluten. En relación a esta incertidumbre presentamos el caso de una paciente con diarrea malabsortiva e importante repercusión clínica por esprúe colágeno, la cual tuvo una buena respuesta a corticoides orales (prednisona), pero hubo que añadir azatioprina. Además mejoró inicialmente con nutrición parenteral central domiciliaria.
Palabras clave: Esprúe colágeno; Enfermedad celíaca; Enfermedades del colágeno (fuente: DeCS BIREME).
ABSTRACT
Collagenous sprue is a rare disease that goes with persistent diarrhea, weight loss and bad absortion, because it affects the small intestine, mainly duodenum and proximal jejunum. Diagnosis is made by having clinical signs and histological proof of atrophy and subepitelial deposit of collagenous material. Its etiology is not known completely, it is proposed that the origin is autoimmune because its relationship with celiac disease. Also there is a proposal that is a celiac evolution to gluten free diet. Is because this is not clear that we present a case of a patient with bad absorptive diarrhea and a clinical expression of collagenous sprue, that had a great clinical response to corticosteroids (prednisone) but we had to add azatioprine. Also, initially improved with home parenteral nutrition center.
Key words: Collagenous sprue; Celiac disease; Collagen diseases (source: MeSH NLM).INTRODUCCIÓN
El esprúe colágeno (EsCo) es una enfermedad infrecuente y poco conocida en la que persisten sin aclarar aspectos sobre su etiología, diagnóstico y tratamiento, con menos de 200 casos publicados en la literatura (1-6), siendo la serie más larga de 30 pacientes (6). Esta entidad cursa con diarrea con pérdida de peso por malabsorción intestinal y por tanto se engloba en su diagnóstico diferencial (1,7). Está íntimamente relacionada con la enfermedad celiaca (EnCe) y existe debate sobre si es una enfermedad secundaria a una EnCe refractaria a dieta sin gluten o si es independiente de la misma (1,6,8). A este propósito presentamos un caso clínico de una paciente recientemente diagnosticada de EsCo en nuestro centro, haciendo especial hincapié en el complejo proceso diagnóstico y terapéutico.
CASO CLÍNICO
Se trata de una mujer de 71 años con antecedentes de hipertensión arterial y fibrilación auricular paroxística en tratamiento únicamente con betabloqueantes que inicia estudio 20 meses antes en otro centro con historia de 2 meses de evolución de deposiciones diarreicas en número de entre 5-10 al día, incluyendo nocturnas, de consistencia semilíquida, sin productos patológicos y sin fiebre, junto con astenia, vómitos ocasionales y pérdida de peso de unos 20 kg desde el inicio del cuadro. La paciente no había realizado viajes recientes, cambios en su tratamiento ni había tomado AINEs o antibióticos. En la exploración física destacaba un leve derrame pleural y edemas tibio-maleolares con fóvea en miembros inferiores. En los análisis de laboratorio, existían parámetros de malabsorción con alteración de la coagulación y déficit de proteínas totales, albúmina, calcio, fosforo, hierro, magnesio y colesterol. La paciente precisa varios ingresos hospitalarios, uno en Unidad de Cuidados Intensivos por deshidratación severa con acidosis metabólica y otros dos poco después por hipopotasemia y por clínica de tetania por marcada hipocalcemia.
Para el estudio de la diarrea se realizan coprocultivos y parásitos en heces y se determinan antitransglutaminasa- IgA, elastasa fecal, hormonas tiroideas, inmunoglobulinas, ACTH, ácido vanilmandélico, ácido 5-hidroxi- indolacético, catecolaminas, VIH, IgE-anisakis, cortisol y serología de virus de hepatitis, siendo todo normal. Se le practicó una gastroscopía con biopsias de duodeno y colonoscopía con biopsias, sin hallazgos patológicos. La diarrea no respondió a los anti-diarreicos habituales, ni a tratamientos empíricos con antibióticos (ciprofloxacino y metronidazol) y octreótido.
Una posterior TAC y entero-RMN sugerían la posibilidad de enfermedad de Crohn de intestino delgado (ID), por lo que se administró tratamiento con corticoides orales (con buena respuesta) y se realizó una enteroscopía de doble balón por vía oral con toma de biopsias, que objetivó una mucosa ligeramente atrófica en tramos proximales de ID con histología de componente inflamatorio mononuclear en el corion con focos de actividad neutrofílica y atrofia focal de vellosidades en las zonas más inflamadas. En estas exploraciones no se observaron estenosis, aftas o ulceraciones que sugieran enfermedad de Crohn. El cuadro clínico es finalmente catalogado de enteritis crónica inespecífica inflamatoria.
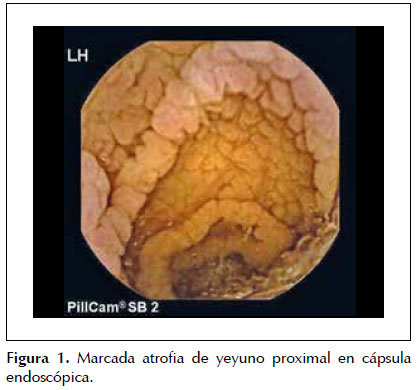
A los 8 meses del inicio de los síntomas la paciente acude por primera vez a nuestras consultas refiriendo recidiva clínica al reducir la dosis de corticoides por debajo de 15 mg diarios de prednisona, precisando ingreso hospitalario. Para descartar otras causas de diarrea se realiza estudio de autoanticuerpos (ANA, patrón IFI, AMA, Ac LKM, Ac antimúsculo liso, Ac anticélulas parietales y Ac antienterocitos) que es negativo. Decidimos efectuar una nueva gastroscopía con biopsias duodenales apreciando una mucosa de aspecto atrófico y micronodular con histología de atrofia severa y presencia de linfocitosis intraepitelial y fibrosis subepitelial moderada. Además se practica un tránsito de ID que observa divertículos yeyunales y un asa de yeyuno de aspecto atrófico. Por ello, realizamos una enteroscopía por vía oral que confirma esta atrofia, siendo las biopsias de enteritis crónica atrófica (Marsh 3C), con cultivo y PCR de micobacterias y determinación de T. Whipplei negativos en las mismas. También se realizan un aspirado yeyunal, que no muestra microorganismos patógenos y biopsias de recto que descartan depósito de amiloide. Sin embargo, el tipaje HLA celiaquía es positivo para DQ2 (con antitransglutaminasa sérica negativa), por lo que una vez ya descartadas otras causas de atrofia intestinal se inicia dieta sin gluten y sin lactosa manteniendo el tratamiento con prednisona oral.
Pasados 3 meses de iniciar dieta sin gluten la paciente reingresa en nuestro servicio por diarrea de 5-6 deposiciones diarias, líquidas, con edema de miembros inferiores, astenia, persistencia de la pérdida de peso, anemia con necesidad transfusional y datos de malabsorción en los análisis, pese a los suplementos que tomaba en domicilio, precisando nutrición parenteral periférica y reposición de albúmina y electrolitos para corregir estos déficits. Este empeoramiento clínico coincide nuevamente con la reducción de esteroides, por lo que al alta se aumenta la dosis de prednisona y se añade azatioprina a dosis de 50 mg/día por corticodependencia.
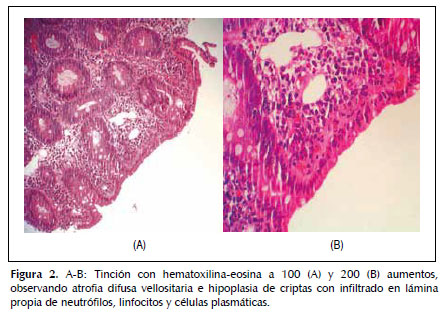
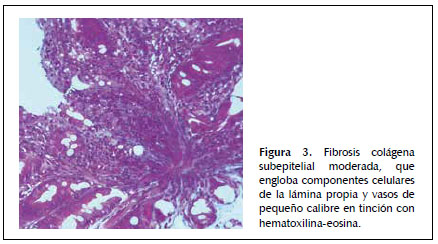
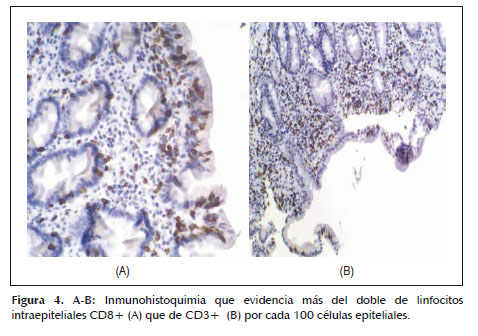
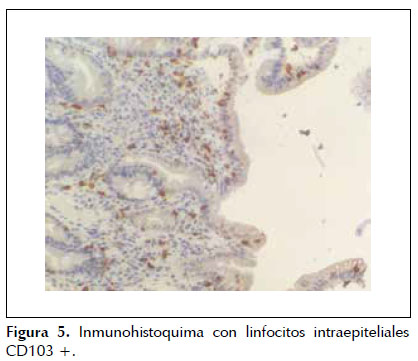
Dado que la paciente cumplía estrictamente la dieta sin gluten, ante la sospecha de celiaquía refractaria al tratamiento (aunque aún no llevaba 6 meses con esta dieta) se practica una cápsula endoscópica para obtener un estudio completo de ID, que evidencia atrofia de predominio en duodeno y yeyuno proximal sin signos de enfermedad de Crohn y descarta otras patologías como linfoma intestinal, yeyunoileitis ulcerativa o adenocarcinoma (Figura 1). Posteriormente se procede a un nuevo estudio histológico mediante biopsias de yeyuno obtenidas por enteroscopía vía oral, que muestran una mucosa con atrofia vellositaria total e hipoplasia críptica, junto con presencia de linfocitos intraepiteliales en cantidad moderada y fibrosis estrómica con depósito de colágeno que engloba vasos de pequeño calibre (Figuras 2 y 3). En la inmunohistoquímica de las biopsias se observan linfocitos intraepiteliales con positividad para CD3, CD8 y CD103, siendo negativos para CD4 y CD56, además de presentar expresión anómala citoplasmática de CD3 sin acompañarse de expresión anómala de la relación CD3/CD8 (Figuras 4 y 5), todo ello compatible con enfermedad de EsCo.
En ese momento la paciente presentaba desnutrición grave con pérdida de 36 Kg desde el inicio del cuadro, lo que corresponde a más del 40% de su índice de masa corporal. Por ello, además de dieta sin gluten, corticoides, azatioprina y suplementos nutricionales se decide colocación de reservorio venoso subclavio para nutrición parenteral central, con buena respuesta clínica y con aumento de 6 Kg en 20 días, pero el reservorio se tuvo que retirar al mes de su colocación por infección del catéter venoso. En la actualidad, la paciente está clínicamente controlada y con ganancia progresiva de peso con dieta sin gluten, azatioprina 50 mg/día, suplementos vitamínicos y nutricionales y dosis mínimas de corticoides. Se ha intentado la sustitución de prednisona por budesonida, sin haber obtenido respuesta.
DISCUSIÓN
El EsCo es una enfermedad infrecuente y que predomina en mujeres caucasianas de edad media o avanzada, como nuestra paciente (7). Su etiología no es bien conocida, pero la más relacionada es la autoinmune, dada la asociación del EsCo con otras enfermedades entre las que destaca la celiaquía y su respuesta a fármacos inmunomoduladores (4,6,8). Ante la asociación observada entre ambas y la semejanza de la clínica, la histología y las posibles complicaciones como el linfoma intestinal, hay autores que consideran el EsCo como una forma de enfermedad celíaca refractaria, que se define como la ausencia de mejoría clínica e histológica tras 6 a 12 meses de dieta sin gluten estricta, tras descartar otras causas de falta de respuesta a esta dieta (especialmente la falta en su cumplimentación, bien consciente o inadvertidamente) y el desarrollo de complicaciones malignas como el linfoma intestinal (9-11). Sin embargo, también existen datos que sugieren que se trata de dos enfermedades independientes como la ausencia de serología y tipaje HLA positivo para EnCe en algunos casos de esprúe (HLA positivo con antitransglutaminasa negativa en nuestra paciente), así como diferencias histológicas (6-9). Por esto se considera que el EsCo podría ser causado por una afectación intestinal de un estado de desregulación autoinmune (8). Otras etiologías propuestas son la inflamatoria y la paraneoplásica, aunque con menor evidencia científica (8,12). También ha relacionado recientemente el EsCo con la toma de un fármaco ARA-II, el olmesartán (13); aunque nuestra paciente lleva tratamiento hipertensivo, este se engloba dentro de la familia de los betabloqueantes. La clínica es de malabsorción grave, generalmente acompañada de diarrea crónica sin productos patológicos ni fiebre. Asocia déficits nutricionales en las determinaciones de laboratorio (anemia, hipoproteinemia, déficits vitamínicos, alteraciones en la coagulación, etc.) y marcado cuadro constitucional, pudiendo producir un importante impacto en la calidad de vida del paciente, como se aprecia en nuestro caso (7,12). Suele afectar al intestino delgado, especialmente duodeno y yeyuno proximal, correlacionándose la repercusión clínica con la longitud de intestino afecto (7). En ocasiones, la afectación puede extenderse al resto del tubo digestivo originando colitis o gastritis colágena, situación que se descartó en nuestra paciente (12,13).
El diagnóstico precisa de una combinación de clínica y hallazgos endoscópicos e histológicos compatibles. En la endoscopía destaca atrofia vellositaria con mucosa edematosa y granular y en ocasiones, con patrón en mosaico, aunque estos cambios no siempre están presentes (12,14). La histología se caracteriza por depósito subepitelial de colágeno en la lámina propia y atrofia de las vellosidades intestinales tras descartar otras causas de atrofia, como la infección por VIH o la enfermedad de Crohn, cuyo diagnóstico se planteó en nuestro caso. La afectación es parcheada en la mayoría de las ocasiones (15). El depósito de colágeno forma una banda cuyo grosor es variable dentro de la misma biopsia y cuyo espesor medio mínimo para obtener el diagnóstico es objeto de debate, aunque esta medida no se relaciona con la severidad de la clínica (4,6,15). Para la determinación de este grosor se precisa de microscopía electrónica, de la cual no disponemos en nuestro centro, por lo que no pudimos realizar esta medida en nuestro paciente.
Cabe destacar que en el EsCo los linfocitos intraepiteliales no suelen estar aumentados si no se trata de un paciente con EnCe y en éste la banda de colágeno no suele estar presente y si lo está, no es tan llamativa como en el EsCo (6,7,8,12). La EnCe refractaria al tratamiento (y por su asociación pensamos que podría extrapolarse al EsCo) se clasifica en tipo I, con bajo riesgo de progresión a linfoma por ausencia de expansión anómala y monoclonalidad del linfocito T y en tipo II, que sí presenta estas alteraciones linfocíticas, aumentando el riesgo de progresión a linfoma y con una menor respuesta al tratamiento y un peor pronóstico (11). Nuestro caso se englobaría dentro del tipo I o con baja progresión a linfoma.
Queremos remarcar la importancia del diagnóstico diferencial de la atrofia de ID, puesto que inicialmente la sospecha en nuestro paciente fue de enfermedad de Crohn e incluso de malabsorción por sobrecrecimiento bacteriano tras evidenciar múltiples divertículos en ID. Posteriormente se diagnosticó de EnCe, ya que presentaba un tipaje HLA positivo, aunque la antitransglutaminasa en sangre fue repetidamente normal (antes de la dieta sin gluten) y la histología no presentaba hallazgos iniciales típicos de esta enfermedad como la presencia de linfocitos intraepiteliales (aunque sí que aparecieron en las siguientes biopsias) y por contra sí presentaba fibrosis subepitelial en las primeras biopsias duodenales realizadas en nuestro centro, hallazgo más característico del EsCo. Por todo ello, existen dudas de si se trata de un paciente con EsCo no relacionado con la EnCe o bien un EsCo secundario a una EnCe refractaria, aunque bien es cierto que nuestra paciente no llegó a cumplir 6 meses de dieta sin gluten antes del diagnóstico final. En nuestro caso, el estudio de la paciente creemos que apoya más la segunda hipótesis.
En cualquier caso hay que tener presente que ante un paciente con EnCe que no responde clínica o serológicamente a una dieta sin gluten durante 6-12 meses, antes de proceder al diagnóstico de EnCe refractaria hay que descartar patologías como ingesta de gluten (incluso si es inadvertida), otras intolerancias alimentarias (como a la lactosa o fructosa), sobrecrecimiento bacteriano, colitis microscópica, insuficiencia pancreática o síndrome de intestino irritable, así como complicaciones derivadas de la EnCe como yeyunoileitis ulcerativa, adenocarcinoma o linfoma intestinal. Además, en caso de que estas se descarten, se recomienda la realización de un nuevo estudio endoscópico con toma de biopsias y si persiste la atrofia vellosa, valorar otras patologías que cursan con atrofia intestinal como enteropatía autoinmune, inmunodeficiencia variable común, enfermedad de Crohn o EsCo, aunque como hemos visto en nuestro paciente, este diagnóstico diferencial puede ser complejo. Una técnica que ha demostrado gran utilidad para estos casos es la cápsula endoscópica, que además dirige la vía de abordaje para la obtención de biopsias (11).
El EsCo se ha considerado como una enfermedad de mal pronóstico. La dieta sin gluten suele fracasar, pero el hecho de que algunos pacientes sí responden a la misma, incluso no celiacos, aconseja situarla en el primer escalón terapéutico (6,8). Si fracasa, la asociación de fármacos inmunomoduladores ha obtenido resultados esperanzadores con glucocorticoides y con azatio- prina (1,2,4,5,6,12), tanto clínica como histológicamente, con desaparición de la banda de colágeno (6,8). Dado que la retirada progresiva de glucocorticoides no siempre es posible, la budesonida oral es una buena opción terapéutica (3,4). En todo aquel paciente que lo requiera o en aquellos en que estos tratamientos han fracasado, la nutrición parenteral domiciliaria parece ser una medida eficaz (3,14).
En nuestro caso la paciente no presentó respuesta inicial a dieta sin gluten, pero sí a corticoides orales (prednisona), aunque desarrolló un fenómeno de corticodependencia que obligó a añadir azatioprina e impidió la retirada de prednisona. Finalmente, con nutrición parenteral central domiciliaria, se controlaron los síntomas y empezó a ganar peso y a disminuir los parámetros de malabsorción, pero hubo que retirarla por infección del catéter. En estos momentos, la paciente está clínicamente asintomática y con unos valores nutricionales dentro de la normalidad con dosis mínimas de prednisona y azatioprina.
BIBLIOGRAFÍA
1. Busto-Bea V, Crespo L, García-Miralles N, Ruiz del Árbol L, Cano A. Esprúe colágeno: no olvidemos el tejido conectivo en la evaluación de la diarrea crónica. Rev Esp Enferm Dig. 2013;105(3):171-4.
2. Cuoco L, Villanacci V, Salvagnini M, Bassotti G. Collagenous sprue with associated features of refractory celiac disease. Rev Esp Enferm Dig. 2012;104(4):223-5.
3. Maguire AA, Greenson JK, Lauwers GY, Ginsburg RE, Williams GT, Brown IS, et al. Collagenous sprue: a clinicopathologic study of 12 cases. Am J Surg Pathol. 2009;33(10):1440-9. doi: 10.1097/PAS.0b013e3181ae2545.
4. Vakiani E, Arguelles-Grande C, Mansukhani MM, Lewis SK, Rotterdam H, Green PH, et al. Collagenous sprue is not always associated with dismal outcomes: A clinicopathologic study of 19 patients. Mod Pathol. 2010;23(1):12-26. doi:10.1038/modpathol.2009.151.
5. Sannier A, Lazure T, Bouhnik Y, Cazals-Hatem D. A long history of diarrhea due to collagenous sprue. Virchows Arch. 2(3):361-3. doi: 10.1007/s00428-012-1361-5.
6. Rubio-Tapia A, Talley NJ, Gurudu SR, Wu TT, Murray JA. Gluten-free diet and steroid treatment are effective therapy for most patients with collagenous sprue. Clin Gastroenterol Hepat. 2010;8(4):344-9. doi: 10.1016/j.cgh.2009.12.023.
7. Zhao X, Johnson RL. Collagenous sprue: a rare, severe small-bowel malabsorptive disorder. Arch Pathol Lab Med.2011;135(6):803-9. doi: 10.1043/2010-0028-RS.1.8. Freeman HJ, Davis JE, Myers DM. Complete histological resolution of collagenous sprue. Can J Gatroenterol. 2004;18(5):333-6.
9. Daum S, Cellier C, Mulder CJ. Refractory celiac disease. Best Pract Res Clin Gastroenterol. 2005;19(3):413-24.10. Jain A, Sebastian K, Quigley B. Collagenous sprue, an enigma amongst the spectrum of celiac disease. Clin Gastroenterol Hepatol. 2014;12(1):e2-3. doi: 10.1016/j.cgh.2013.05.031.
11. Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA; American College of Gastroenterology. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol 2013;108(5):656-76. doi: 10.1038/ajg.2013.79.
12. Busto Bea V, Crespo Pérez L, Cano Ruiz A. [Update on collagenous sprue: connective tissue as a cause of chronic diarrhea]. Med Clin (Barc). 2013;140(9):415-9. doi: 10.1016/j.medcli.2012.11.011. [Article in Spanish]
13. Rubio-Tapia A, Herman ML, Ludvigsson JF, Kelly DG, Mangan TF, Wu TT, et al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc. 2012;87(8):732-8. doi: 10.1016/j.mayocp.2012.06.003.
14. Xiao Z, Dasari VM, Kirby DF, Bronner M, Plesec TP, Lashner BA. Collagenous sprue: a case report and literature review. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):418-24.
15. Robert ME, Ament ME, Weinstein WM. The histologic spectrum and clinical outcome of refractory and unclassified sprue. Am J Surg Pathol. 2000;24(5):676-87.
Correspondencia:
Carlos Alventosa Mateu
Servicio de Patología Digestiva. Consorcio Hospital General
Universitario de Valencia.
Av. Tres Cruces nº2. C.P: 46014. Valencia, España. E-mail: almacar84@hotmail.com
Recibido: 06-03-2014
Aprobado: 02-10-2014