Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.35 no.1 Lima ene. 2015
ARTÍCULOS DE REVISIÓN
Cáncer gástrico hereditario difuso
Hereditary diffuse gastric cancer
Xavier Melo Pezo1, Hector Medrano Samamé2, Eliana Torres Rosas1
1 Hospital II Huamanga. Ayacucho, Perú.
2 Servicio de Cirugía, Hospital Alberto Sabogal. Callao, Perú.
RESUMEN
El cáncer gástrico hereditario difuso (CGHD) es un síndrome autosómico dominante asociado a la mutación del gen CDH1, que afecta al menos al 30% de los miembros de las familias CDH1+, con una penetrancia de alrededor del 80% hacia los 80 años, y cuya estirpe celular suele estar determinada por la presencia de focos múltiples de células en anillo de sello. El tratamiento indicado es la realización de una gastrectomía total de forma profiláctica con reconstrucción en Y de Roux, de no ser admitida la realización de la misma el seguimiento endoscópico es necesario y ante el mínimo indicio de malignidad la gastrectomía es más que imperativa.
Palabras clave: Cáncer gástrico; Gastrectomía; Carcinoma de células en anillo de sello (fuente: DeCS BIREME).
ABSTRACT
Hereditary diffuse gastric cancer is an autosomal dominant syndrome associated to CDH1 gene mutation that affects at least 30% of CDH1+ families, with a penetrance of 80% at 80 years, and multifocal signed ring cell in most of the cases. The suggested treatment is a prophylactic total gastrectomy with Roux-en-Y esophagojejunostomy, but if this is rejected, it is necessary endoscopic surveillance and if there is a minimum malignancy sing must be imperative a gastrectomy.
Key words: Gastric cancer; Gastrectomy; Carcinoma, signet ring cell (source: MeSH NLM).
El cáncer gástrico (CG) es una enfermedad con etiopatogenia diversa que va desde la dieta y estilo de vida a la genética y etnia, es así, que nuestro conocimiento sobre la complejidad del cáncer gástrico ha ido evolucionando en el transcurso de los últimos años. Actualmente es uno de los tipos de cáncer con mayor incidencia y la segunda causa de muerte por neoplasia a nivel mundial (1,2).
El cáncer gástrico aparece principalmente de forma esporádica; sin embargo, 1-3% de los afectados presentan algún tipo de herencia familiar, por ello es importante diferenciar los diversos síndromes de cáncer gástrico con componente hereditario (cáncer colorrectal hereditario no polipósico, síndrome de poliposis denomatosa familiar, síndrome de Peutz, Jeguers, etc) del cáncer gástrico hereditario difuso (CGHD) cuyo diagnóstico está dado por los siguientes criterios (3,4):
· Dos o más casos documentados de cáncer gástrico difuso (CGD) en familiares de 1° o 2° grado de consanguinidad, con al menos uno de ellos diagnosticado antes de los 50 años.
· Tres o más casos documentados de CGD en familiares de 1° o 2° grado, independientemente de la edad de presentación.
El cáncer gástrico hereditario difuso es un síndrome autosómico dominante descrito inicialmente por Guilford et al. en los miembros de una familia Maori en Nueva Zelanda el año 1998 (5). Alrededor del 30% de los individuos que cumplen criterios para CGHD presentan la mutación del gen supresor CDH1, gen que está ubicado en el brazo corto del cromosoma 16, el cual codifica la proteína de adhesión intercelular, E-Cadherina; actualmente se han identificado más de 100 mutaciones germinales del gen; los tipos de mutaciones hallados comúnmente corresponden a pequeñas inserciones. Dicha mutación del gen CDH1 generará desorganización celular con la consecuente infiltración tumoral hacia los tejidos adyacentes (6,7).
Se ha determinado que la penetrancia de la mutación del gen CDH1 es mayor al 80% a los 80 años, dicho de otro modo hay un riesgo mayor al 80% de desarrollar la enfermedad en los sujetos que presenten dicha mutación, aunque alrededor del 50% desarrollarán la enfermedad entre los 30 y 50 años de una forma bastante agresiva. Por otro lado, es interesante señalar que estas mutaciones son más que raras en países como Japón y Corea donde hay altas tasas cáncer gástrico (8).
CONSEJERÍA Y TEST GENÉTICO
La consejería genética es una parte esencial de la evaluación y manejo del CGHD, dicha evaluación debe ser cuidadosa y deberá incluir a por lo menos tres generaciones; este proceso no solo consiste en la evaluación genética per se, sino que deberá ser efectuada por un grupo multidisciplinario (cirugía, gastroenterología, patología, nutrición).
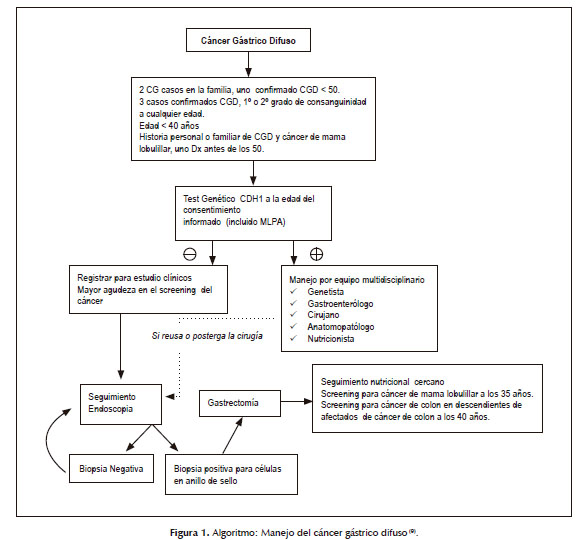
El año 1999 el Consorcio Internacional Ligado al Cáncer Gástrico (IGCLC siglas en inglés) que acuña el nombre y definición de cáncer gástrico hereditario difuso, da las primeras directivas para el diagnóstico y manejo del mismo, y en el 2009 se publica una actualización de la guía clínica en la que se amplían los criterios para la búsqueda de mutaciones del gen CDH1, siendo estas las siguientes: (9) (Figura 1)
· Dos o más casos de CG en familiares de 1° grado con al menos 1 caso confirmado de CGD antes de los 50 años.
· Tres o más casos de CGD en familiares de 1° grado cualquiera sean las edades.
· Individuos con CGD con menos de 40 años sin necesidad de historia familiar.
· Individuos y familias con diagnóstico de CGD (1 caso diagnosticado antes de los 50 años) y cáncer lobulillar de mama en el mismo individuo.
En lo que respecta al estudio molecular, debe ser hecho a partir de una muestra sanguínea, más precisamente, del ADN extraído de los linfocitos; sin embargo un 4% de las mutaciones no van a ser detectadas por secuencias de ADN convencionales, en cuyo caso, se debe optar por buscarlas mediante métodos alternativos como el MLPA (Multiplex ligation dependent probe amplification). En cuanto a la edad para la realización del test, esta deberá realizarse idealmente entre los 16 y 20 años, ya que a esta edad el riesgo de desarrollar CGHD es menor al 1%, sin embargo, se realizará el test a cualquier edad una vez cumpla los criterios para el mismo; en tanto, la necesidad de estudiar un caso antes de los 16 años se deberá evaluar de forma individual (10).
ENDOSCOPÍA
Una vez identificados los miembros de una familia con CGHD que presentan las mutaciones del gen CDH1, el consenso del IGCLC es la realización de una gastrectomía profiláctica cualquiera sean los hallazgos endoscópicos; sin embargo, ya que la decisión asertiva para una cirugía de tal magnitud es difícil, el momento de la realización de la misma puede variar mucho; dependiendo de la edad, el estado físico, y la psicología del paciente; por tanto, durante este lapso de espera el seguimiento endoscópico es esencial.
En los individuos que rechacen la gastrectomía se debe hacer el seguimiento endoscópico cada 6 meses advirtiendo de lo imperativo de la gastrectomía ante la aparición de cualquier tipo de lesión maligna, además de informar sobre la naturaleza de la multifocalidad de la enfermedad (9).
Al respecto, diferentes estudios han demostrado la alta prevalencia y multifocalidad de la enfermedad al momento de la cirugía profiláctica, evidenciado en el análisis exhaustivo de la pieza operatoria (Figura 2). Hebbard et al. cuyo trabajo presenta al momento el mayor número de casos de pacientes gastrectomizados de forma profiláctica a la fecha; el estudio muestra que de 23 pacientes intervenidos sólo 2 presentaron biopsias positivas preoperatorias, sin embargo, 22 de los 23 evidenciaron focos de carcinoma en el análisis patológico; en otro estudio presentado por Chen et al. quien presentó 18 pacientes CDH1 positivo gastrectomizados, de los cuales 17 presentaron focos con células en anillo de sello, 13 se presentaron asintomáticos, y 2 tuvieron endoscopías positivas, pero 12 de los 13 asintomáticos arrojaron focos carcinoma en el análisis anátomo-patológico (11,12).
Una endoscopía tendrá que ser realizada previa a la cirugía en búsqueda de focos tumorales.
La endoscopía deberá ser realizada con un endoscopio de luz blanca de alta definición, la utilización de mucolíticos como la acetil-cisteina será de gran utilidad para mejorar la visión. Se tomarán biopsias de zonas sospechosas y por lo menos 6 biopsias de cada una de las siguientes áreas estomacales (antro, zona de transición, fondo, cardias) obteniéndose como mínimo 30 muestras (13). Figura 2.
GASTRECTOMÍA PROFILÁCTICA
La alta penetrancia (>80%) de la mutación del gen CDH1, hace imperativa la realización de una gastrectomía profiláctica; Seevaratan y cols en una revisión de 70 artículos al respecto, encontró que de 169 pacientes CDH1 positivo gastectomizados, 147 (87%) presentaron histopatología positiva para cáncer, siendo el principal hallazgo la presencia de focos de células en anillo de sello. La evidencia actual sugiere que existe un periodo en que estos focos no progresan por un bajo índice proliferativo, lo que explicaría por qué la mayoría de los pacientes gastrectomizados presentan un estadiaje T1N0 (14). Sin embargo, aún es debatible la edad de realización de la gastrectomía profiláctica; el consenso actual de la IGCLC propone que la misma debería de ser realizada entre la segunda y tercera década, ya que como se expuso, el riesgo de presentar CGHD antes de los 20 años es menor al 1%, riesgo que hacia los 30 años aumenta a un 4% (15). Realizar la gastrectomía antes de los 20 años no es recomendada, sin embargo, si el familiar más joven diagnosticado de CGHD se encontrara en los primeros años de la segunda década, se debería tomar en cuenta realizar la gastrectomía a una edad al menos 5 años antes de la presentación del miembro más joven afectado, aunque cada caso deberá ser tomado individualmente.
El tipo de cirugía recomendado es la gastrectomía total con reconstrucción en Y de Roux y podrá realizarse vía laparoscópica o abierta, siendo primordial la clara identificación de los bordes esofágico y duodenal en la pieza operatoria; con respecto a la linfadenectomía el IGCLC recomienda la disección D1 (9). Es preciso mencionar que en estudios experimentales con cultivos de células de sujetos portadores de mutaciones del gen CDH1 se evidenció un defecto en la cicatrización que podría potencialmente aumentar el riesgo de fístulas, por lo que la cirugía tendrá que ser efectuada con especial cuidado (16).
Al momento no se cuenta con datos de sobrevida en este tipo de profilaxis dada la reciente identificación de esta patología (15 años); sin embargo, en series sur coreanas se reportaron tasas de supervivencia de alrededor del 90% a los 10 años en pacientes gastrectomizados por cáncer gástrico temprano con células en anillo de sello, dato que podría ser extrapolado ya que los focos hallados en el CGHD se encuentran normalmente limitados a la mucosa (17).
PATOLOGÍA
Un estudio sistemático y detallado de las piezas de acuerdo a un protocolo es necesario, dadas las características especiales de multifocalidad y localización que presenta el CGHD.
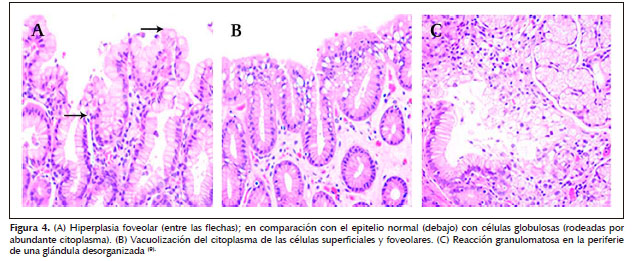
Los focos hallados se encuentran normalmente en la parte profunda de la mucosa, respetando la capa muscular de la mucosa y los ganglios, estas se acompañan de lesiones neoplásicas caracterizadas por células mucosecretoras con aspecto de células en anillo de sello pero que no invaden la membrana basal (18).
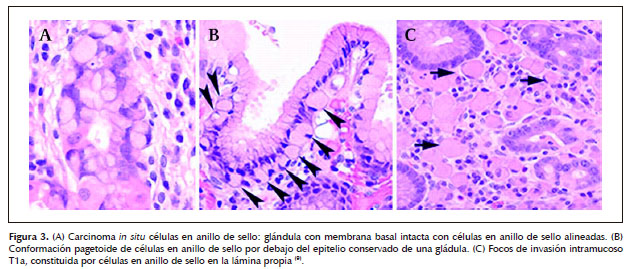
Especial atención debe ser puesta en 2 tipos de lesiones precursoras de carcinoma invasivo de células en anillo de sello: (Figuras 3 y 4)
- Carcinoma in situ de células en anillo de sello, que corresponde a la presencia de las mismas dentro de la membrana basal de la mucosa generalmente con núcleos hipercromáticos.
- Distribución pagetoide de las células en anillo de sello por debajo del epitelio preservando las glándulas y foveola.
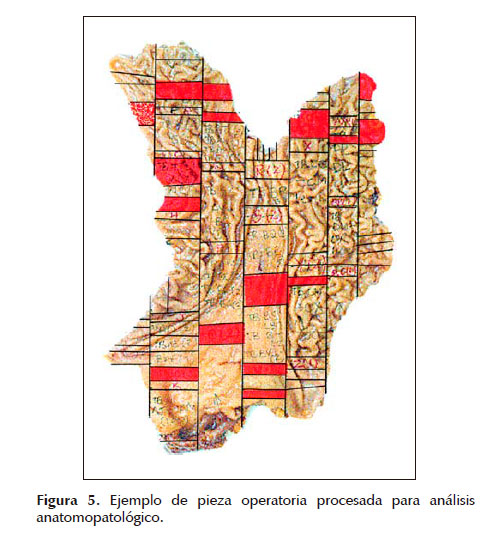
La pieza deberá ser aperturada por la curvatura mayor y extendida para su análisis macroscópico y marcado en trazos de 2 cm x 0,3 cm que serán luego cortados e incluidos para el respectivo análisis microscópico de cada una de las piezas, que resultarán entre 100 y 300 bloques por estómago; la localización exacta de cada bloque deberá ser marcada en un mapa hecho en el estómago. Figura 5.
El análisis microscópico debe comprender:
· Características del tipo de invasión: localización anatómica, tipo histológico (clasificación de Lauren), invasión linfática, venosa y neural (presencia o ausencia), identificación de lesiones precursoras (carcinoma in situ o extendidos pagetoides), estado de márgenes y reacción estromal.
· Características generales de la mucosa no neoplásica: inflamación crónica, actividad, presencia de H. pylori, linfocitos intraepiteliales, metaplasia, displasia.
· Características específicos de focos de mucosa no neoplásica: cambios hiperplásicos, vacuolización de la superficie, úlceras erosiones, granulomas, etc.
CONCLUSIÓN
Al ser el CGHD un síndrome autosómico dominante con una alta penetrancia, y en el que la prevención del desarrollo de la enfermedad es posible, la búsqueda de las mutaciones germinales del gen CDH1 es determinante en las familias afectadas; además, es necesario difundir y establecer pautas claras para su detección, manejo, diagnóstico y tratamiento mediante un equipo multidisciplinario. Conflictos de interés: Los autores declaran que el presente artículo no presenta conflicto de intereses.
BIBLIOGRAFÍA
1. Guggenheim DE, Shah MA. Gastric cancer epidemiology and risk factors. J Surg Oncol. 2013 Mar;107(3):230-6. doi: 10.1002/jso.23262. [ Links ]
2. Mathers CD, Loncar D. Projection of global mortality and burden of disease from 2002 to 2030. PLOS PLoS Med. 2006 Nov;3(11):e442. [ Links ]
3. La Vecchia C, Negri E, Franceschi S, Gentile A. Family History and the risk of stomach and colorectal cancer. Cancer. 1992 Jul 1;70(1):50-5. [ Links ]
4. Caldas C, Carneiro F, Lynch HT, Yokota J, Wiesner GL, Powell SM, et al. Familial gastric cancer: overview and guidelines for management. J Med Genet. 1999 Dec;36(12):873-80. [ Links ]
5. Guilford P, Hopkins J, Harraway J, McLeod M, McLeod N, Harawira P, et al. E-cadherin germline mutations in familial gastric cancer. Nature. 1998 Mar 26;392(6674):402-5. [ Links ]
6. Guilford P, Humar B, Blair V. Hereditary diffuse gastric cancer: translation of CDH1 germline into clinical practice. Gastric Cancer. 2010 Mar;13(1):1-10. doi: 10.1007/s10120-009- 0531-x. [ Links ]
7. Graziano F, Humar B, Guilford P. The role of the E-cadherine gene (CDH1) in diffuse gastric cancer susceptibility: from the laboratory to clinical practice. Ann Oncol. 2003 Dec;14(12):1705-13. [ Links ]
8. Pharoah PD1, Guilford P, Caldas C; International Gastric Cancer Linkage Consortium. Incidence of gastric cancer and breast cancer in CDH 1 (E-cadherine) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology. 2001 Dec;121(6):1348-53. [ Links ]
9. Fitzgerald RC, Hardwick R, Huntsman D, Carneiro F, Guilford P, Blair V, et al. Hereditary diffuse gastric cancer: updated consensus guideline for clinical management and directions for future research. J Med Genet. 2010 Jul;47(7):436-44. doi: 10.1136/jmg.2009.074237. [ Links ]
10. Oliveira C, Senz J, Kaurah P, Pinheiro H, Sanges R, Haegert A, et al. Germline CDH1 deletions in hereditary diffuse gastric cancer families. Hum Mol Genet. 2009 May 1;18(9):1545- 55. doi: 10.1093/hmg/ddp046. [ Links ]
11. Hebbard PC, Macmillan A, Huntsman D, Kaurah P, Carneiro F, Wen X, et al. Prophylactic total gastrectomy (PTG) for hereditary diffuse gastric cancer (HDGC): the Newfoundland experience with 23 patients. Ann Surg Oncol. 2009 Jul;16(7):1890-5. doi: 10.1245/s10434-009-0471-z. [ Links ]
12. Chen Y, Kingham K, Ford JM, Rosing J, Van Dam J, Jeffrey RB, et al. A prospective study of total gastrectomy for CDH1- positive hereditary diffuse gastric cancer. Ann Surg Oncol. 2011 Sep;18(9):2594-8. doi: 10.1245/s10434-011-1648-9. [ Links ]
13. Barber ME, Save V, Carneiro F, Dwerryhouse S, Lao-Sirieix P, Hardwick RH, et al. Histopathological and molecularanalysis of gastrectomy specimens from hereditary diffuse gastric cancer patients has implications for endoscopic surveillance of individuals at risk. J Pathol. 2008 Nov;216(3):286-94. doi: 10.1002/path.2415. [ Links ]
14. Seevaratnam R, Coburn N, Cardoso R, Dixon M, Bocicariu A, Helyer L. A systematic review of the indications for genetic testing and prophylactic gastrectomy amog patients with hereditary diffuse gastric cancer. Gastric Cancer. 2012 Sep;15 Suppl 1:S153-63. [ Links ]
15. Barber M, Murrell A, Ito Y, Maia AT, Hyland S, Oliveira C, et al. Mechanisms and sequelae of E-cadherine silencing in hereditary diffuse gastric cancer. J Pathol. 2008 Nov;216(3):295-306. doi: 10.1002/path.2426. [ Links ]
16. Hanby AM, Chinery R, Poulsom R, Playford RJ, Pignatelli M. Downregulation of E-cadherine in reparative ephitelium of the human gastrointestinal tract. Am J Pathol. 1996 Mar;148(3):723-9. [ Links ]
17. Hyung WJ, Noh SH, Lee JH, Huh JJ, Lah KH, Choi SH, et al. Early gastric carcinoma with signet ring cell histology. Cancer. 2002 Jan 1;94(1):78-83. [ Links ]
18. Carneiro F, Huntsman DG, Smyrk TC, Owen DA, Seruca R, Pharoah P, et al. Model of the early diffuse gastric cancer in E-cadherine mutation carriers and its implication for patient screening. J Pathol. 2004 Jun;203(2):681-7. [ Links ]
19. Charlton A, Blair V, Shaw D, Parry S, Guilford P, Martin IG. Hereditary diffuse gastric cancer: predominance of multiple foci of signet ring cell carcinoma in distal stomach and transitional zone. Gut. 2004 Jun;53(6):814-20. [ Links ]
Correspondencia:
E-mail: xavier_melo@yahoo.es
Recibido:: 07-10-2014
Aprobado: 11-12- 2014