Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.36 no.1 Lima Jan./Mar. 2016
ARTÍCULOS ORIGINALES
Prevalencia de Helicobacter pylori en pacientes sintomáticos de consulta externa de la Red Rebagliati (EsSalud), Lima, Perú, en el período 2010 - 2013
Prevalence of Helicobacter pylori in symptomatic outpatients in Red Rebagliati (EsSalud) from 2010 to 2013, Lima, Peru
Ofelia Castillo Contreras1a, Jorge Maguiña Quispe2b, Harold Benites Goñi1c, Alfonso Chacaltana Mendoza1a, Edson Guzmán Calderón1a,2b, Milagros Dávalos Moscol1a,3b Oscar Frisancho Velarde1a
1 Departamento de Aparato Digestivo del HNERM – EsSalud. Lima, Perú.
2 Escuela de Medicina, Universidad Peruana de Ciencias Aplicadas. Lima, Perú.
3 Facultad de Medicina, Universidad San Martín de Porres. Lima, Perú.
a Médico asistente b Profesor c Médico residente
RESUMEN
Objetivo: Determinar la prevalencia de Helicobacter pylori en pacientes sintomáticos de consulta externa en la Red Rebagliati (EsSalud) en el período 2010-2013. Materiales y métodos: Estudio observacional, transversal y analítico. Se revisaron los registros de pacientes ambulatorios con la prueba en aliento con urea-13C diagnóstica de Helicobacter pylori en el período 2010-2013. Resultados: De los 1711 pacientes, la prevalencia global de Helicobacter pylori fue 45,5% (IC 95%: 43,17- 47,89), siendo mayor en mujeres que en varones (47,1% vs. 42,1%, p=0,056). Hubo diferencias significativas en la edad entre infectados y no infectados (44 vs. 39, p<0,05), con asociación entre la edad y presencia de Helicobacter pylori (p<0,001). La prevalencia estimada en la población pediátrica fue 36,3% y se encontró resultado positivo en 201 (51,1%) mujeres en edad fértil. La mayoría (43,9%) procedían del sector financiero de la ciudad. Conclusiones: La prevalencia de Helicobacter pylori en la población de estudio fue similar en ambos sexos y tuvo relación con la edad. El nivel socioeconómico medio de Lima mantiene la prevalencia de Helicobacter pylori reportada en los últimos años.
Palabras clave: Helicobacter pylori; Epidemiología; Ureasa; Tests respiratorios (fuente: DeCS BIREME).
ABSTRACT
Objective: To determine the prevalence of Helicobacter pylori in symptomatic outpatients in Red Rebagliati (EsSalud) from 2010 to 2013. Material and methods: An observational, transversal and analytical study. Records of outpatients with diagnostic 13C-urea breath test of Helicobacter pylori in the period 2010-2013 were reviewed. Results: Of the 1711 patients, the overall prevalence of Helicobacter pylori was 45.5% (95% CI: 43.17-47.89) being higher in women than in men (47.1% vs. 42.1%, p=0.056). There were significant differences in age between infected and uninfected (44 vs. 39, p<0.05), with association between age and the presence of Helicobacter pylori (p<0.001). The estimated prevalence in the pediatric population was 36.3% and was found positive in 201 (51.1%) women of childbearing age. Most (43.9%) came from the financial sector of the city. Conclusions: The prevalence of Helicobacter pylori in the study population was similar in both sexes and is related to age. The average socioeconomic status of Lima maintains the prevalence of Helicobacter pylori reported in the last years.
Key words: Helicobacter pylori; Epidemiology; Urease; Breath test (source: MeSH NLM).
INTRODUCCIÓN
La prevalencia de infección por Helicobacter pylori (Hp) varía entre 10-30% en países desarrollados hasta 80-90% en países en vías de desarrollo (1). En el Perú no se encontraron diferencias en la prevalencia de Hp entre las tres regiones geográficas (costa, sierra y selva) en el nivel socioeconómico bajo (2). Las características epidemiológicas y clínicas de la infección por Hp en nuestro país están cambiando considerablemente, así en la población de bajo nivel socioeconómico ha permanecido invariable (>80%); mientras que en los estratos socioeconómicos medio y alto de Lima hubo una disminución sostenida (de 83,3% a 58,7%) (3). Entre 1985–2002, la prevalencia de Hp en pacientes con gastritis crónica, úlcera duodenal y úlcera gástrica disminuyó significativamente (4,5). Durante la última década, algunos autores señalan que existe una relación entre la infección por Hp y varios desórdenes extragástricos como anemia por déficit de hierro en la población pediátrica (6) y durante el embarazo se enfocaron en la relación del Hp con la hiperémesis gravídica (7).
La prueba en aliento con urea-13C (PAU-13C) detecta la actividad de la enzima ureasa del Hp con elevada sensibilidad y especificidad (8,9), siendo un método diagnóstico confiable empleado en comunidades sanas (10) y en lactantes (11). En nuestro país se reportó un estudio de prevalencia con esta prueba en niños menores de 30 meses (11). El Hospital Nacional Edgardo Rebagliati Martins (HNERM) realiza esta prueba para pacientes procedentes de la Red Rebagliati (EsSalud), que incluye 24 establecimientos, por ello planteamos desarrollar esta investigación por la amplia jurisdicción en Lima y el interés de la prevalencia de esta infección en nuestro medio.
El objetivo del presente estudio fue determinar la prevalencia de infección por Hp en asegurados de la Red Rebagliati (EsSalud) con la PAU-13C, estimando el porcentaje en la población pediátrica y en mujeres en edad fértil (MEF) durante el período 2010-2013. Asimismo fueron objetivos del estudio, el análisis de la prevalencia de Hp según las características socio-demográficas, clínicas y lugar de procedencia de la población.
MATERIALES Y MÉTODOS
Estudio observacional, transversal y analítico.
Población: Pacientes que se atienden en la Red Rebagliati a quienes se les realizó la PAU-13C durante el período 2010-2013. La prueba tiene criterio diagnóstico de Hp según la guía de práctica clínica de EsSalud (12) en pacientes de 6 a 40 años con dispepsia no investigada sin signos de alarma mayor a 2 semanas que no mejoran con uso de terapia empírica; y en pacientes sintomáticos con endoscopía y biopsia negativas (gastritis crónica) menor a 2 años y alta sospecha de infección por Hp.
Muestra: Se incluyeron solamente los pacientes con PAU-13C con objetivo diagnóstico de Hp (casos nuevos), realizados en el HNERM entre el 1 de enero del 2010 al 31 de diciembre del 2013, por lo que no hubo una selección aleatoria.
Criterios de inclusión:
Pacientes atendidos por consulta externa con PAU- 13C diagnóstica en la Red Rebagliati en el período 2010-2013.
Criterios de exclusión:
Datos incompletos en los registros sobre edad, lugar de procedencia y resultado de la PAU-13C.
Pacientes con PAU-13C de control post-tratamiento erradicador y/o repetición de la prueba en el mismo paciente durante el período de estudio.
Variables
Características socio-demográficas y clínicas: edad, sexo, sector de procedencia e indicación del examen. Las MEF están comprendidas entre 15 a 49 años (13). Se considera como población pediátrica a los menores de 15 años que son atendidos por gastroenterólogos pediatras en el HNERM.
Infección por Hp: infección bacteriana de mucosa gástrica por Hp, demostrado por PAU-13C (Helikit TM, Isodiagnostika Inc, Perú). Un valor de lectura deltaover-baseline menor de 3,5% se consideró negativo.
Sector de procedencia: según la conformación distrital de la Municipalidad de Lima Metropolitana fueron los siguientes:
Sector financiero (Pueblo Libre, Jesús María, Magdalena, Lince, La Victoria, San Luis, San Isidro, Miraflores, Surquillo, Barranco, San Miguel, San Borja, Santiago de Surco y Chorrillos); Cono norte (Carabayllo, Puente Piedra, San Martín de Porres, Los Olivos, Comas, Independencia, San Juan de Lurigancho); Cono sur (San Juan de Miraflores, Villa María del Triunfo, Villa El Salvador y Lurín); Cono este (Santa Anita, Ate y La Molina), Lima cercado (Cercado de Lima, Breña, Rímac y El Agustino); Zona sub-urbana campestre (Chosica, Chaclacayo, Cieneguilla y Pachacamac); Provincia del Callao (Ventanilla, Callao, Carmen de la Legua, Bellavista y La Perla); Balnearios de Lima (Ancón) y Provincias (provincias de Tumbes, Piura, Ancash, Lima, Ica, Arequipa, Cusco, Ayacucho y otros departamentos).
Prueba en aliento con urea±13C: Consistió en la toma de una primera muestra de aire exhalado, luego la ingesta de urea marcada con13C (Helikit ™) con 50 mL de agua, y la segunda muestra de aire exhalado 30 minutos después de la ingesta de urea-13C. Estas muestras son analizadas en un espectrofotómetro para medir el nivel de CO2 exhalado marcado (delta) y determinar cuantitativamente la presencia de Hp. La prueba utiliza un isótopo natural no radiactivo ( 13C), y no está contraindicada en gestantes y pacientes pediátricos. La prueba está indicada desde los 6 años (12), pero puede realizarse en todas las edades (incluso lactantes) en los que se obtiene la muestra si pueden soplar o con uso de mascarillas especiales (14).
Análisis estadístico: Los datos se ingresaron en una base de datos Excel 2010 (Microsoft Office para Windows XP) y posteriormente se procesaron con el paquete estadístico STATA v.11.1 (STATA Corp. LP, College Station, TX, USA). Las pruebas comprendieron estadística descriptiva (medias, medianas, rangos y desviación estándar, según corresponda). Las variables continuas fueron expresadas como medias ± desviación estándar o mediana y rango intercuartil (RIC). Se realizó además un análisis comparativo entre los grupos Hp positivo y negativo, que comprendió una prueba de Chi2 de Fisher, una prueba de T-student para la comparación de proporciones y UMann Whitney para las variables cuantitativas. Un valor de p<0,05 fue asumido como significativo.
Aspectos éticos: se respetaron los principios éticos de la Declaración de Helsinki con el respeto a la confidencialidad de la información. El proyecto fue aprobado por el comité de ética del HNERM. No fue necesario el uso de consentimiento informado porque los datos se obtuvieron retrospectivamente.
RESULTADOS
Un total de 3835 PAU-13C se realizaron entre el 2010 y el 2013. De ellas solamente 1832 fueron pruebas diagnósticas (criterio de inclusión), excluyéndose 8 (4 varones y 4 mujeres) por presentar información incompleta en los registros y 113 por tratarse de repeticiones de la prueba en un mismo paciente. Finalmente, se evaluaron 1711 individuos, la infección por Hp fue detectada en 779 con una prevalencia global de 45,5% (IC 95%: 43,17-47,89).
De los 1711 pacientes, 1170 (68,4%) fueron mujeres (rango de edad: 2-90 años) y 541 varones (rango de edad: 3-97 años). Las frecuencias de un resultado positivo de la PAU-13C fue 47,1% (IC 95%: 44,23-49,96) en mujeres y 42,1% (IC 95%: 37,97-46,32) en varones, sin encontrar diferencia significativa entre ellas (p=0,056). Se encontraron diferencias significativas (p<0,05) en las medianas de la edad entre los sujetos infectados por Hp y los no infectados (44 años RIC 17-57 y 39 años RIC 12-57, respectivamente). Al categorizar la variable edad se observa una asociación estadísticamente significativa entre la infección por Hp y la edad (p<0,001), que cambia con el incremento de la edad. La Tabla 01 muestra las características de la población estudiada según la presencia o ausencia del Hp.
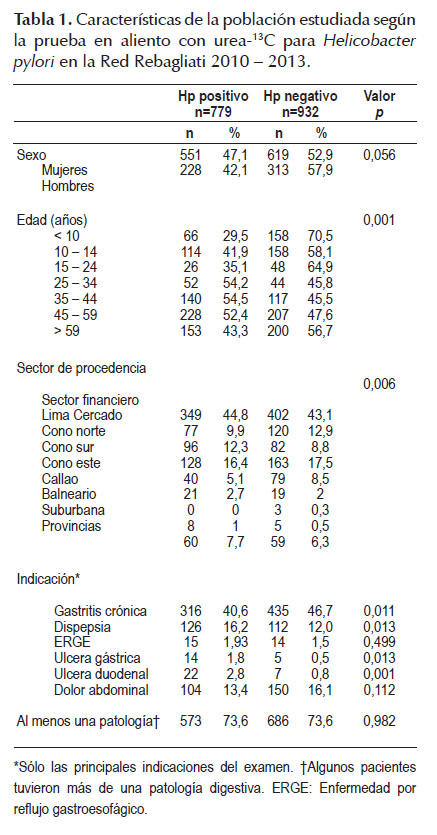
La distribución de los pacientes con infección por Hp muestra diferencias por grupo de edad (Figura 01). La prevalencia más elevada se encuentra entre los 35 a 44 años (54,5%) y la mayoría de los infectados por Hp fueron mayores de 35 años (66,9%).
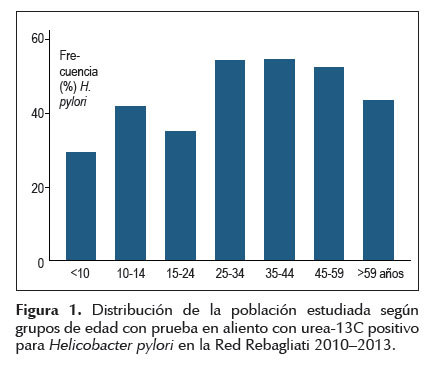
La población estudiada procedente del sector financiero de Lima Metropolitana representó el 43,9%, y de los sectores de Lima cercado, conos norte y sur, zona sub-urbana campestre y provincias sumaron el 46,6%. La Tabla 01 muestra que la mayoría de los sujetos evaluados con Hp positivo se encontraron en el sector financiero (44,8%), seguido por los conos sur y norte (16,4% y 12,3%, respectivamente). Sin embargo, al analizar separadamente por sectores se encontró que la zona sub-urbana campestre (8/13, 61,5%), el cono norte (96/178, 53,9%) y Callao (21/40, 52,5%) tuvieron las mayores frecuencias de pacientes con resultados positivos (Figura 02).
La Tabla 01 muestra que según la indicación de la PAU-13C hubo asociación significativa entre la presencia de dispepsia y la infección por Hp (16,2% vs. 12,0%, p=0,013). Se halló una menor frecuencia de infección por Hp en los pacientes con el diagnóstico previo de gastritis crónica (40,6% vs. 46,7%, p=0,011). Además se encontró relación estadísticamente significativa entre infección por Hp con la indicación del examen por úlcera duodenal (p=0,001) y úlcera gástrica (p=0,013), pero con un tamaño de muestra pequeño. Hubo pacientes con más de una patología como indicación del examen y 452 sujetos (206 Hp positivos y 246 Hp negativos) no tuvieron datos de la misma.
La prevalencia estimada en la población pediátrica fue 36,3% (IC 95%: 32,04-40,54) y ellos presentaron el delta más alto de positividad (Tabla 02). Las MEF fueron 393 y se halló resultado positivo en 51,1% (IC 95%: 46,18-56,11). Se observaron diferencias significativas en la mediana de edad de las mujeres con PAU-13C positivo en relación a los varones (47 años vs. 35 años, p<0,001). El sexo masculino tuvo un valor delta signifi 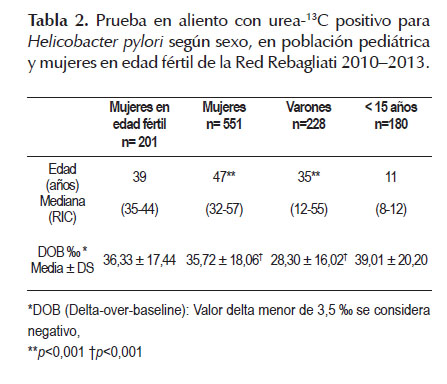
Nosotros encontramos una prevalencia global de infección por Hp de 45,5% que es similar a la reportada en Lima en el 2005 y 2010 (19-21). Prochazka y col. en un estudio realizado en una clínica privada (nivel socioeconómico medio-alto) mediante la prueba rápida de la ureasa hallaron una prevalencia de 38,5% que es la menor reportada a nivel nacional (21), pero incluyó a pacientes tratados o que recibían inhibidores de la bomba de protones (IBP). Sin embargo, cuando excluye estos pacientes y restringe el análisis a pacientes con dispepsia, encuentra una cifra similar a la nuestra (44%). Esto explica la prevalencia hallada en nuestro estudio en pacientes de nivel socioeconómico medio y con diferentes diagnósticos pero principalmente dispepsia y gastritis crónica.
La población asegurada (EsSalud) está constituida por trabajadores dependientes con ingreso económico fijo que pertenecen al nivel socioeconómico medio basado en el acceso a la salud como indicador de la situación socioeconómica familiar (22). En los ochenta no había diferencia en la prevalencia de Hp entre niveles socioeconómicos pero luego se observó disminución en el nivel medio y alto hasta 58,3% (3). Esto contrasta con la prevalencia de 75,2% en pacientes dispépticos sometidos a endoscopía alta en un hospital nacional de Lima en 1998 (23) y hasta 93% de positividad con PAU-14C en pobladores dispépticos de un asentamiento humano de Lima en el 2003 (24). Una explicación del porqué disminuye la prevalencia en el nivel socioeconómico medio y alto es el consumo de agua potable; mientras, que la población de nivel bajo adquiere el agua de pozos, ríos y acequias.
Nuestro estudio encontró una prevalencia de Hp mayor en mujeres (47,1%) que en varones (42,1%) pero sin diferencia significativamente estadística. RamírezRamos y col. hallaron una prevalencia de 71,2% en varones y 69,1% en mujeres (p=0,23) con gastritis crónica activa de 1985-2002 (3). En el 2007, Montes y col. hallaron una prevalencia de 65,3% en pacientes con úlcera péptica en un hospital nacional y 67,8% fueron de sexo masculino (25). La discrepancia entre estudios que encontraron mayor prevalencia en los varones fue atribuido a diferencias en la higiene durante la infancia y juventud (16), señalando mayor riesgo de infección en el sexo masculino (26); mientras que la mujer sería transmisora de la infección por contacto materno (27,28). La mayoría de estudios señala ausencia de diferencias significativas en la prevalencia de Hp entre ambos sexos o un ligero predominio en el sexo masculino (3,10).
Encontramos que el principal sector de procedencia fue el sector financiero (43,9%) que es la zona comercial tradicional y ubicación de los centros financieros de la ciudad, cuya población corresponde al estrato socioeconómico medio y alto de Lima. Por ello, observamos una mayor frecuencia (44,8%) de pacientes con resultado positivo de PAU-13C en este sector, ya que la muestra estuvo constituida mayoritariamente por pacientes del sector financiero. Los distritos en los que ejerce mayor influencia la Red Rebagliati son los que pertenecen al sector financiero, lo que explicaría una mayor afluencia de pacientes de este sector. Cabe mencionar que consideramos el lugar de residencia del paciente, que algunas veces no coincidía con la consignada en el seguro social, encontrando diversos sectores de procedencia. Al analizar por sectores, los porcentajes más altos fueron de aquéllos considerados de nivel socioeconómico medio-bajo (zona sub-urbana campestre y cono norte), lo que concuerda con la prevalencia de 72,9% reportada por Otoya y col. en un estudio con PAU-13C en la Red Almenara (EsSalud) conformado por distritos con menor desarrollo social en Lima (29).
Encontramos que las principales indicaciones de PAU-13C fueron dispepsia y gastritis crónica, pero este último término usado como diagnóstico clínico es erróneo por ser gastritis un diagnóstico histológico. Hubo mayor porcentaje de pacientes con diagnóstico de gastritis crónica sin infección por Hp (p=0,011). Probablemente estos pacientes acudieron a la consulta por síntomas digestivos altos y debido al antecedente de gastritis crónica con endoscopía alta y biopsia negativa menor a 2 años se recomendara PAU-13C para detección de Hp (12). También pueden ser sujetos sintomáticos que tuvieron infección previa por Hp erradicada o adultos mayores con gastritis crónica atrófica en los que es poco probable encontrar la bacteria (17).
A diferencia de lo que sucede con la gastritis crónica, al analizar la presencia de dispepsia con la infección por Hp se encontró una asociación estadísticamente significativa (p=0,013). Existen reportes de prevalencias de Hp en pacientes dispépticos que varían entre 57,3% hasta 93% según el nivel socioeconómico (30,31) y con una predominancia del género femenino (31). La mayor representación de las mujeres en nuestra muestra (68,4%) sugiere diferencias en los patrones de consulta médica. Uno de los principales motivos de consulta en la especialidad es la dispepsia, y esto explica el mayor número de mujeres en nuestro estudio. Por otro lado, la asociación de dolor abdominal recurrente y la presencia de Hp son controversiales. Algunos autores encontraron relación entre Hp y dolor abdominal inespecífico o recurrente en niños (32,33); sin embargo, Masoodpoor reportó que la prevalencia de Hp entre niños con dolor abdominal recurrente y niños saludables de 12 a 15 años fue similar sin diferencia significativa (34). La mayor prevalencia de infección por Hp en pacientes con úlcera duodenal y gástrica ha sido demostrada en otros estudios (4,25), pero nuestra cantidad de pacientes afectados es pequeña y no permite establecer asociaciones definitivas.
Existe una relación entre edad y prevalencia en nuestro estudio. La infección por Hp en el Perú se produce a edades tempranas y se incrementa con la edad (28). Encontramos un pico en la prevalencia de Hp entre los 35 a 44 años y una disminución a partir de los 60 años. En poblaciones con baja prevalencia se observa relación directa entre edad y frecuencia de infección por Hp (efecto de cohorte); mientras que en zonas con alta prevalencia se encuentra relación inversa con tendencia descendente en relación a la edad y esto se explicaría porque la bacteria produciría gastritis crónica atrófica que es un medio hostil para su sobrevivencia (17).
En nuestro estudio la prevalencia de Hp en menores de 15 años fue 36,3%. En 1994 se reportó una prevalencia en sujetos entre 2 meses a 12 años de 48% mediante la PAU-13C (35). Probablemente los cambios de estilo de vida y mejoras sanitarias en Lima estén modificando la prevalencia y edad de adquisición de la infección en la infancia. Muñoz y col. (32) observaron en el año 2008 que los niños infectados con Hp tuvieron mayor edad que los Hp negativos (11 vs. 8,9 años, p<0,005). Nosotros encontramos que en la población estudiada en general, hubo mayor edad entre los pacientes infectados por Hp (44 vs. 39 años, p<0,05). También se observó un pico de infección por Hp entre 10 a 14 años, luego la prevalencia disminuyó entre los 15 a 24 años y posteriormente se incrementó sugiriendo posibles reinfecciones en la etapa adulta (24).
La prevalencia estimada de Hp en mujeres en edad fértil resultó 51,1%. No hemos encontrado estudios que evalúen la prevalencia de Hp en esta población, siendo importante conocer el porcentaje de mujeres en riesgo de desarrollar manifestaciones extragástricas del Hp durante la gestación (5). También se observó que la edad de las mujeres con infección por Hp fue mayor que los varones, siendo esta diferencia significativa (p<0,001). Esto puede explicarse porque las mujeres del nivel socioeconómico medio-alto permanecen en ambientes protegidos con adecuadas condiciones sanitarias; mientras que los varones tienen mayor riesgo de infección a través del agua y alimentos contaminados fuera del hogar (30,36). Aunque no fue un propósito del estudio evaluar los mecanismos patogénicos del Hp, observamos una mayor positividad (delta) en la población pediátrica, esto sugiere que el desarrollo del sistema inmune tendría un rol en la densidad bacteriana gástrica (32). Asimismo, la influencia hormonal (sexo femenino) podría participar en la respuesta del huésped a la bacteria, lo que deberá evaluarse en futuros estudios.
Las diferencias de prevalencia también dependen del método diagnóstico empleado .El método ideal de diagnóstico primario para la infección por Hp es la endoscopía, la cual permite la obtención de biopsia para cultivo y análisis histológico. Los métodos no invasivos incluyen la detección de anticuerpos (serología), antígeno en heces y prueba en aliento con urea marcada (13C, 14C), que por su cualidad radioactiva se recomienda evitar el uso de 14C en niños y gestantes (37). La PAU-13C alcanza una sensibilidad del 98,2% (IC 95%: 94,8-99,6%) y una especificidad del 97,9% (IC 95%: 88,9-99,9%) comparado con un patrón de referencia basado en métodos invasivos (8). La ventaja de utilizar la PAU-13C en estudios epidemiológicos es que es un método no invasivo que muestrea la totalidad del estómago y refleja el estado de infección activa (37,38). Algunos estudios encontraron disminución del rendimiento diagnóstico de histología y prueba de ureasa en pacientes que recibían IBP (21). En nuestra institución, la guía de práctica clínica recomienda suspender IBP por 2 semanas y antibióticos 30 días previos a la PAU-13C, disminuyendo la tasa de falsos negativos (12).
Las limitaciones del estudio fueron que la muestra procedía principalmente del sector financiero de Lima y estuvo basado en la PAU-13C como único método diagnóstico sin confirmación histológica, salvo en algunos casos en los que se solicitó endoscopía alta y biopsia. Si bien el HNERM comprende en su jurisdicción a los distritos de nivel socioeconómico medio-alto de Lima, también por ser hospital de referencia a nivel nacional brinda atención a pacientes referidos de provincias de Lima y del Perú. Aunque no empleamos una escala de medición del nivel socioeconómico, existen agrupaciones distritales por sectores que se relaciona con los niveles socioeconómicos de Lima, información que tomamos en cuenta en la interpretación de los resultados (22).
En conclusión, la prevalencia de la infección por Hp en la población de estudio fue similar en ambos sexos y tuvo relación con la edad. El nivel socioeconómico medio de Lima mantiene la prevalencia de la infección por Hp similar a otros estudios realizados en los últimos años. Es importante continuar con el estudio de la epidemiología del Hp para una adecuada implementación de medidas de salud pública y desarrollar líneas de investigación para un control efectivo de la infección.
Conflicto de interés: los autores declaran no tener ningún conflicto de intereses.
Agradecimientos: a la empresa DIVCOM S.A.C por su apoyo en el HNERM.
BIBLIOGRAFÍA
1. Huang R, Xiao S, Megraud F, León-Barúa F, Bazzoli F, Van der Merwe S, et al. Helicobacter pylori in developing countries. WGO practice guidelines. 2010. http://www.worldgastroenterology.org/assets/downloads/en/pdf/guidelines/11_helicobacter_pylori_developing_countries_en.pdf [ Links ]
2. The Gastrointestinal Physiology Working Group of the Cayetano Heredia and The Johns Hopkins University. Ecology of Helicobacter pylori in Peru: infection rates in coastal, high altitude and jungle communities. Gut.1992;33(5):604-5. [ Links ]
3. Ramírez-Ramos A, Chinga E, Mendoza D, Leey J, Segovia M, Otoya C. Variación de la prevalencia del H. pylori en el Perú período (1985-2002), en una población de nivel socioeconómico medio y alto. Rev Gastroenterol Perú. 2003;23(2):92-8. [ Links ]
4. Ramírez-Ramos A, Gilman R, Watanabe J, Rosas A. Estudio de la epidemiología del Helicobacter pylori en el Perú: 20 años después. Acta Gastroenterol Latinoam. 2004;34(2):69- 78. [ Links ]
5. Ramírez-Ramos A, Watanabe-Yamamoto J, Takano-Morón J, Gilman RH, Recavarren Arce S, Arias-Stella J, et al. Decrease in prevalence of peptic ulcer and gastric adenocarcinoma at the Policlínico Peruano Japonés, Lima, Peru, between the years 1985 and 2002. Analysis of 31,446 patients. Acta Gastroenterol Latinoam. 2006;36(3):139-46. [ Links ]
6. Franceschi F, Succalà G, Roccarina D, Gasbarrini A. Clinical effects of Helicobacter pylori outside the stomach. Nat Rev Gastroenterol Hepatol. 2014;11(4):234-42. [ Links ]
7. Cardaropoli S, Rolfo A, Todros T. Helicobacter pylori and pregnancy-related disorders. World J Gastroenterol. 2014;20(3):654-64. [ Links ]
8. Gatta L, Vakild N, Ricci C, Osborn J, Tampieri A, Perna F, et al. A rapid, low-dose, 13C-urea tablet for the detection of Helicobacter pylori infection before and after treatment. Aliment Pharmacol Ther. 2003;17(6):793-8. [ Links ]
9. Ortiz N, Morán S, Gallardo I, Blancas J, Cabrera L. Validación de método simplificado de la prueba en aliento con urea-13C para diagnóstico de infección por Helicobacter pylori. Rev Esp Enferm Dig. 2007;99(7):392-7. [ Links ]
10. Sánchez F, Taxonera C, García M, Alba C, Sainz de los Terreros L, Díaz-Rubio M. Prevalencia de la infección por Helicobacter pylori en población sana en la comunidad de Madrid. Rev Esp Enferm Dig. 2007;99(9):497-501. [ Links ]
11. Klein PD, Gilman RH, Leon-Barua R, Diaz F, Smith EO, Graham DY. The epidemiology of Helicobacter pylori in Peruvian children between 6 and 30 months of age. Am J Gastroenterol. 1994;89(12):2196-200. [ Links ]
12. Grupo de trabajo de la guía de práctica clínica de EsSalud. Guía de Práctica Clínica de Enfermedad Gastroduodenal por Helicobacter pylori en EsSalud. EsSalud, Gerencia Central de Prestaciones de Salud y Gerencia de Prestaciones Hospitalarias. Lima, Perú: EsSalud; 2012. [ Links ]
13. Perú, Ministerio de Salud. Normas de atención integral de salud de la mujer en los servicios descentralizados (comunidad, puestos y centros de salud). Documento normativo de referencia nacional. Lima: Fondo de comunicación y publicaciones, MINSA; 1986. [ Links ]
14. Queiroz D, Saito M, Rocha G, Rocha A, Melo F, Checkley W, et al. Helicobacter pylori infection in infants and toddlers in South America: concordance between [13C]urea breath test and monoclonal H. pylori stool antigen test. J Clin Microbiol. 2013;51(11):3735-40. [ Links ]
15. McColl K. Helicobacter pylori infection. N Engl J Med. 2010;362:1597-604. [ Links ]
16. Ozaydin N, Turkyilzman S, Cali S. Prevalence and risk factors of Helicobacter pylori in Turkey: a nationally representative, cross-sectional, screening with 13C-urea breath test. BMC Public Health. 2013;13:1215. [ Links ]
17. Ortega J, Espino A, Calvo A, Verdugo P, Pruyas M, Nilsen E, et al. Infección por Helicobacter pylori en pacientes sintomáticos con patología gastroduodenal benigna. Análisis de 5664 pacientes. Rev Med Chile. 2010;138(5):529-35. [ Links ]
18. Ramírez-Ramos A, Sánchez R. Contribución de Latinoamérica al estudio del Helicobacter pylori. Acta Gastroenterol Latinoam. 2009;39(3):197-218. [ Links ]
19. Ramírez-Ramos A, Gilman R, Watanabe J, Takano J, AriasStella J, Yoshiwara E, et al. Comparación de la prevalencia de la infección del estómago por el Helicobacter pylori en el Perú en población japonesa y peruana. Acta Gastroenterol Latinoam. 2005;35(4):219-24. [ Links ]
20. Rodríguez W, Pareja A, Yushimito L, Ramírez-Ramos A, Gilma R, Watanabe J, et al. Tratamiento del Helicobacter pylori con Omeprazol, Amoxicilina y Claritromicina en esquemas de 7 y 10 días. Rev Gastroenterol Peru. 2003;23(3):177-83. [ Links ]
21. Prochazka R, Salazar F, Barriga E, Salazar F. Prevalencia de Helicobacter pylori en una Clínica Privada de Lima. Sensibilidad de las biopsias de antro y el cuerpo, y la prueba rápida de la ureasa. Rev Gastroenterol Peru. 2010;30(1):33-9. [ Links ]
22. Asociación Peruana de Empresas de Investigación de Mercado. Niveles Socioeconómicos en Lima Metropolitana y Callao. Lima: APEIM; 2005. [ Links ]
23. Gonzáles P, Díaz J, Monge E. Grupos sanguíneos ABO como factor de riesgo en la infección por Helicobacter pylori. Rev Gastroenterol Peru. 2000;20(4):370-5. [ Links ]
24. Soto G, Bautista C, Roth D, Gilman R, Velapatiño B, Ogura M, et al. Helicobacter pylori reinfection is common in Peruvian adults after antibiotic erradication therapy. J Infect Diseases. 2003;188(9):1263-75. [ Links ]
25. Montes P, Salazar S, Monge E. Cambios en la epidemiología de la úlcera péptica y su relación con la infección con Helicobacter pylori. Hospital Daniel Carrión 2000-2005. Rev Gastroenterol Perú. 2007;27(4):382-88. [ Links ]
26. Replogle M, Glaser S, Hiatt S, Parsonner J. Biologic sex as risk factor for Helicobacter pylori infection in healthy young adults. Am J Epidemiol. 1995;142(8):856-63. [ Links ]
27. Alvarado-Esquivel C. Seroepidemiology of Helicobacter pylori infection in pregnant women in Rural Durango, Mexico. Int J Biomed Sci. 2013;9(4):224-9. [ Links ]
28. Ramírez-Ramos A y Sánchez-Sánchez R. Helicobacter pylori 25 años después (1983-2008): epidemiología, microbiología, patogenia, diagnóstico y tratamiento. Rev Gastroenterol Peru. 2009;29(2):158-70. [ Links ]
29. Otoya G, Malca L, Díaz H. Experiencia con el test del aliento con Carbono 13 (C13) para la detección de Helicobacter pylori en la Red Hospitalaria EsSalud “Guillermo Almenara I”. Comunicación libre al XXI Congreso Peruano de Enfermedades Digestivas. Lima, Perú: Sociedad de Gastroenterología del Perú; 2008. [ Links ]
30. Ramírez-Ramos A, Gilman R, Recavarren S, Watanabe J, Miyaghi J, León-Barúa R, et al. Contribución al estudio de la epidemiología del Helicobacter pylori en el Perú. Análisis de 3005 casos. Rev Gastroenterol Peru. 1999;19(3):208-15. [ Links ]
31. Ayala S, Pichilingue O, Capcha T, Alba M, Pichilingue C. Dispepsia: Características clínicas, hallazgos endoscópicos e histológicos en pacientes atendidos en el Hospital Nacional Hipólito Unánue, Lima, Perú, durante el año 2010. Rev Gastroenterol Peru. 2013;33(1):28-33. [ Links ]
32. Muñóz A, Cok J, Busalleu A, Cetraro D, Maruy A, Takami F. Helicobacter pylori en niños atendidos en el Hospital Nacional Cayetano Heredia durante los años 2003-2006. Rev Gastroenterol Peru. 2008;28(2):109-18. [ Links ]
33. Jara L, Sánchez C, Santana D, León F, Cubas F. Frecuencia de Helicobacter pylori y características clínicas en niños con endoscopía digestiva alta de un hospital de Lambayeque: 2007-2010. Rev Cuerpo Med HNAAA. 2013;6(3):28-32. [ Links ]
34. Masoodpoor N, Sheikhvatan D. Helicobacter pylori in Iranian children with recurrent abdominal pain. Tropical Gastroenterology. 2008;29(4):221-3. [ Links ]
35. Klein PD, Graham DY, Gaillour A, Opekun AR, Smith EO. Water source as a risk factor for Helicobacter pylori infection in Peruvian children. Lancet. 1991;337(8756):1503-6. [ Links ]
36. Helicobacter pylori and gastritis in Peruvian patients: relationship to socioeconomic level, age, and sex. Am Gastroenterol. 1990;85(7):819-23. [ Links ]
37. Aguilar C, Saavedra P, Mendoza G, Bussalleu A, Cok J, Martinez F, et al. Estudio de la prueba de la ureasa o test de aliento (TA) y correlación con biopsia gástrica para la detección de Helicobacter pylori (Hp) en pacientes dispépticos del Hospital Nacional Cayetano Heredia – Lima. Rev Gastroenterol Peru. 2007;27(2):172-6. [ Links ]
38. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, et al. Management of Helicobacter pylori infection–the Maastricht IV/Florence Consensus Report. Gut. 2012;61(5):646-64. [ Links ]
Correspondencia: Ofelia Brisaida Castillo Contreras
E-mail: brisaida2@yahoo.es
Recibido: 24-06-2015
Aprobado: 12-08-2015













