Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.36 no.2 Lima abr./jun. 2016
ARTÍCULOS ORIGINALES
Enfermedad celíaca vs. atrofia villositaria serológicamente negativa: similitudes y diferencias histológicas y en el perfil inmunohistoquímico de linfocitos CD3, CD4, CD8 y CD56
Celiac disease and negative serology villous atrophy: histological comparison and immunohistochemical study of CD3, CD4, CD8 and CD56 lymphocytes
Fernando Arévalo Suárez1,2,3,4, Sabino Portugal2,5, Carlos Barreda2, Pedro Montes1,4, María Teresa Perez-Narrea1, Omar Rodríguez1, Greys Vergara1, Eduardo Monge1,3,4,5
1 Hospital Nacional Daniel A Carrión. Lima, Perú.
2 Clínica Ricardo Palma. Lima, Perú.
3 Universidad Nacional Mayor de San Marcos. Lima, Perú.
4 Universidad Peruana de Ciencias. Lima, Perú.
5 Universidad Cayetano Heredia. Lima, Perú.
RESUMEN
Existe un grupo de enteropatía conocidas como AVSN que pueden simular enfermedad celíaca. Objetivo: El objetivo de este estudio es describir los hallazgos histológicos y de inmunohistoquímica en pacientes con enfermedad celíaca y AVSN. Material y métodos: 15 biopsias de pacientes con enfermedad celíaca y 19 biopsias con AVSN fueron reexaminados. Se estudió características histológicas tales como atrofia severa, hiperplasia de criptas, número de células plasmáticas, número de eosinófilos y presencia de neutrófilos. Asimismo, a través de inmunohistoquímica se estudió la presencia de linfocitos CD4, CD8, CD3, CD56. Resultados: Se encontró diferencia significativa en la mayor presencia de hiperplasia de criptas (p=0,0348) y mayor número de células plasmáticas (p=0,0348) en las biopsias de enfermedad celíaca que en las catalogadas como AVSN. El número de linfocitos CD8, CD4, CD56 y su distribución fue similar en ambos grupos. El porcentaje de linfocitos intraepiteliales CD3 positivos (p=0,0144) fue mayor en pacientes con AVSN. Conclusión: Los hallazgos histológicos e inmunohistoquímicos muestran más similitudes que diferencias. La diferencia hallada en nuestro estudio sugiere mayor respuesta inmune humoral en pacientes con enfermedad celiaca que en AVSN.
Palabras clave: Enfermedad celíaca; Antígenos CD8; Antígenos CD4; Antígenos CD56; Hiperplasia (fuente: DeCS BIREME).
ABSTRACT
There is a group of enteropathies recently known as seronegative villous atrophy (SNVA), which can simulate celiac disease. Objective: The aim of this study was to describe histological and immunohistochemical differences between a group of Celiac disease and SNVA patients. Material and methods: Microscopy reexamination and Immunohistochemistry study were performed for a group of 15 celiac patients and 19 SNVA patients. Histological features as severe atrophy, crypt hyperplasia, plasma cells number, eosinophils number, neutrophils presence were studied; CD4, CD8, CD3, and CD56 markers were studied through immunohistochemistry. Results: There was a significant difference between the frequency of observation of crypt hyperplasia (p=0.0348) and plasma cells (p=0.0348) in celiac disease patients than SNVA patients. In celiac disease was bigger. The number and distribution of CD 8, CD4 and CD56 lymphocytes was similar in both groups. The percentage of CD3 positive intraepithelial lymphocytes (p=0.0144) was higher in SNVA. Conclusion: Histological and immunohistochemical evaluation shows more similarities than differences. The differences found in this study suggest more humoral immune response in celiac disease than in SNVA.
Key words: Celiac disease; Antigens, CD8; Antigens, CD4; Antigens, CD56; Hyperplasia (source: MeSH NLM).
INTRODUCCIÓN
El diagnóstico de enfermedad celiaca está basado en una asociación de hallazgos clínicos serológicos e histológicos (1,2).
La histopatología de la enfermedad celíaca se caracteriza por: 1) aumento en la cantidad de linfocitos intraepiteliales y 2) la atrofia de las vellosidades de la mucosa del duodeno.
Los linfocitos intraepiteliales son predominantemente linfocitos citotóxicos CD8+, con capacidad de inducir a la apoptosis de las células epiteliales (3-5) y posteriormente a la atrofia de las vellosidades. En la lámina propia se describe por otro lado un incremento de linfocitos colaboradores CD4+ y una disminución de linfocitos CD56+ (6,7).
El diagnóstico de enfermedad celíaca se confirma con la presencia de anticuerpos antiendomisio tipo IgA y anticuerpos antitransglutaminasa (1,2). El estudio serológico es importante porque existen otras enteropatías que son histológicamente muy similares a enfermedad celíaca.
Dado que los linfocitos intraepiteliales son parte del sistema inmune intestinal es esperable que estos linfocitos se incrementen por una variedad de antígenos reconocidos como extraños. Como resultado existen diferentes enteropatías muy parecidas histológicamente a enfermedad celíaca (8,9). Enteropatías como Sprue tropical, alergia alimentaria, sobrecrecimiento bacteriano intestinal, Sprue colagenoso, giardiasis o enteropatía autoinmune son conocidos por ser simuladores histológicos de enfermedad celíaca. Recientemente este grupo de enteropatías han sido denominados como atrofia villositaria seronegativa (AVSN) (8,9).
Algunas de las patologías incluidas en el grupo AVSN presentan algunos elementos histológicos que permiten identificar la etiología. Por ejemplo, la duodenitis péptica, muestra metaplasia gástrica foveolar, o el Sprue colagenoso, que muestra una membrana basal engrosada. Sin embargo, en otras enteropatías como Sprue tropical, Sobrecrecimiento bacteriano intestinal o enteropatía autoinmune, la diferenciación con enfermedad celíaca es casi imposible basado solo en las características histológicas.
En un estudio previo encontramos que 60% con histología compatible con enfermedad celíaca eran serológicamente negativas para Antitransglutaminasa y antiendomisio (10). El estudio serológico para enfermedad celíaca no es muy accesible en nuestro medio y realizarlo a todos los pacientes con atrofia de vellosidades y linfocitosis intraepitelial no es posible en la práctica diaria. Por lo tanto, estos casos de AVSN representan un desafío diagnóstico tanto para patólogos y gastroenterólogos.
El objetivo de este estudio es investigar si la biopsia duodenal puede mostrar algunas diferencias histológicas e inmunohistoquímicas entre un grupo de pacientes con enfermedad celiaca y otro con AVSN.
MATERIAL Y MÉTODOS
Diseño: Estudio retrospectivo, transversal comparativo.
Población de estudio: Se seleccionaron pacientes con diagnóstico de incremento en los linfocitos intraepiteliales y atrofia de vellosidades en mucosa duodenal. Los Pacientes provenían de dos centros hospitalarios y fueron recolectados a lo largo de 5 años (2009-2013). Las biopsias fueron 4 en promedio por cada paciente tomadas de la segunda porción duodenal.
Se recolectaron datos clínicos como edad, sexo, presencia de diarrea, dolor abdominal, valores de hemoglobina.
Criterios de inclusión: Los casos de enfermedad celiaca se diagnosticaron usando los siguientes criterios:
1. Incremento de linfocitos intraepiteliales, se definió como 30 o más linfocitos por cada 100 células epiteliales; o 12 o más linfocitos en la punta de la vellosidad en secciones de 4 micras de espesor (11,12). El número de LE se contó en 3 áreas al azar. Se consideró el promedio de las 3 zonas examinadas.
2. Atrofia de vellosidades, definida como una relación vellosidad/cripta menor de 3/1 en un corte adecuadamente orientado (4 o más criptas en paralelo). La atrofia se catalogó como leve (relación menor de 3/1 pero mayor de 1/1), moderada (relación 1/1) o severa cuando la cripta era más larga que la vellosidad (relación 0/1). El diagnóstico de atrofia se realizó en una muestra debidamente orientada, definida como 5 vellosidades en una fila, en un corte transversal no tangencial (13)
3. Positividad de anticuerpos antiendomisio y/o de antitransglutaminasa tisular. El anticuerpo antitransglutaminasa IgA humano fue determinado usando una prueba de ELISA indirecta mediante el paquete comercial InmuLisa (IMMCO Diagnosis). El valor de corte utilizado fue de 20 U/ml. Los anticuerpos antiendomisio se determinaron utilizando esófago de mono como sustrato y una prueba de inmunofluorescencia indirecta (Scimex corporation). El valor de corte en este caso fue de 1:5 de dilución.
Los casos de AVSN se definieron como aumento de LIE, atrofia vellositaria y serología negativa para ambos anticuerpos. En esta categoría se incluyeron casos de Sprue tropical, fue definido como atrofia seronegativa con buena respuesta con el uso de antibióticos.
SOBIA, fue definido como atrofia con Test de Hidrógenos espirado positivo.
Alergias alimentarias y enteropatía autoinmune no pudieron ser evaluadas en este estudio.
Se excluyeron del presente estudio los casos cuyo diagnóstico histológico sugería enteritis péptica, enteritis colagenosa, linfoma o enfermedad de Crohn.
Estudio microscópico: Las láminas de biopsias fueron revisadas por 3 patólogos en forma independiente. Las características histológicas, como numero de eosinófilos, neutrófilos, células plasmáticas en la lámina propia; así como la hiperplasia de criptas, el recuento de linfocitos intraepiteliales y la atrofia de vellosidades fueron anotados para ambos grupos.
El recuento de eosinófilos y células plasmáticas se realizó en los campos de 40x antes descritos y se tomó el promedio como recuento final (14).
Estudio inmunohistoquímico: Cortes de cada paciente fueron teñidos para CD3 (utilizando anticuerpos monoclonales de conejo - DAKO), CD56, CD4 y CD8 (con anticuerpos monoclonales de ratón), usando para todas las muestras procedimientos de inmunohistoquímica convencionales. La evaluación se hizo a través del porcentaje de células resaltadas por el marcador.
Análisis estadístico: El análisis estadístico se realizó con la ayuda de Stata 10.0 (StataCorp, TX). El test de Fisher y el χ² se usaron para variables categóricas si la frecuencia esperada fuera menor de 5. El test de Wilcoxon rank-sum fue usado para comparar las medias de los 2 grupos. Se usó un valor de p menor a 0,05 para determinar diferencia estadísticamente significativa.
RESULTADOS
Identificamos 19 casos de pacientes con AVSN y 15 pacientes con enfermedad celíaca.
En la mayoría de los casos con AVSN, no pudimos reconocer la etiología de la atrofia de vellosidades, esos casos fueron indeterminados.
Un caso asociado a medicación fue sospechado en un paciente consumidor habitual de enalapril (14). Otras etiologías diagnosticadas en grupo de AVSN fueron Sprue tropical (21%) y sobrecrecimiento bacteriano (5,2%).
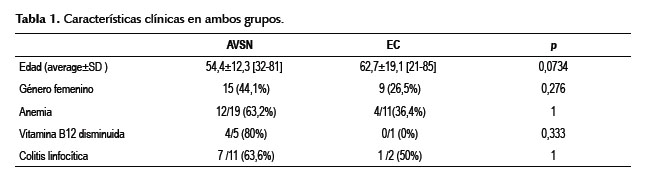
En la Tabla 1 se compara las características clínicas en ambos grupos. Algunas características no pudieron ser estudiadas en todos los pacientes como los niveles de vitamina B12 o coexistencia de colitis linfocítica.
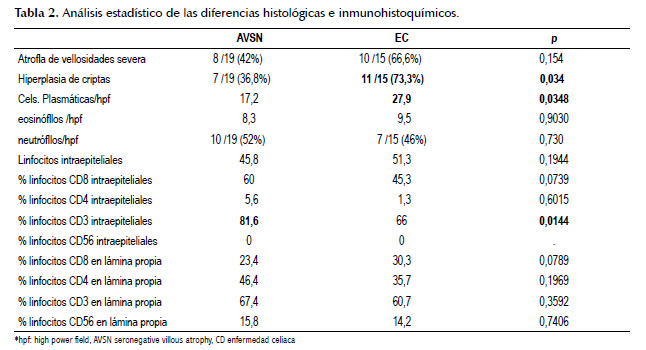
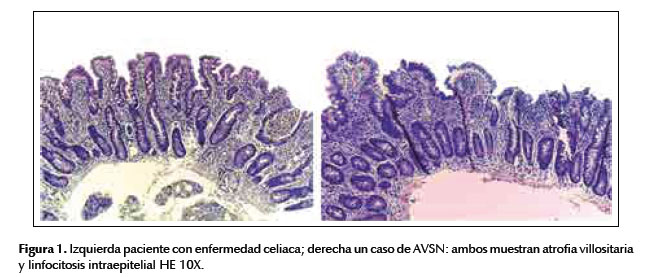
La mayoría de las características histológicas e inmunohistoquímicas fueron similares a ambos grupos excepto en hiperplasia de criptas y en el número de células plasmáticas, estas diferencias se detallan en la Tabla 2. En la Figura 1, podemos apreciar un caso de enfermedad celíaca y AVSN, los cuales se ven bastantes similares.
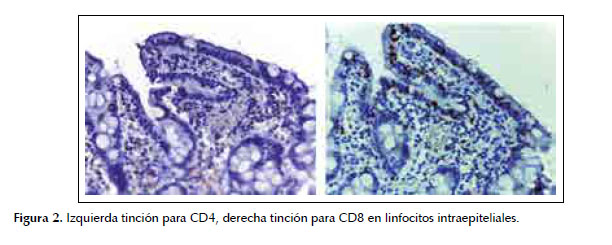
Respecto a los hallazgos inmunohistoquímicos, en ambos grupos los linfocitos intraepiteliales fueron predominantemente CD8 positivo (60% en AVSN y 45% en enfermedad celíaca) mientras los linfocitos en lámina propia fueron predominantemente CD4 positivo (46,4% en AVSN y 35,7% en los casos de enfermedad celíaca), estos hallazgos se ilustran en las fotos microscópicas de la Figura 2. La expresión CD56 fue muy similar en ambos, todas fueron positivas en lámina propia y negativos en el epitelio.
DISCUSION
El objetivo de este estudio fue encontrar diferencias histológicas e inmunohistoquímicas en biopsias duodenales de pacientes con enfermedad celíaca y pacientes con AVSN.
Después de la evaluación histológica de un grupo heterogéneo de pacientes con enfermedad celiaca y AVSN, sólo se pudo encontrar las siguientes diferencias estadísticamente significativas a) el mayor número de células plasmáticas y mayor presencia de hiperplasia de criptas en la enfermedad celíaca y b) un mayor número de linfocitos CD3+ en pacientes con AVSN.
La presencia de células plasmáticas se correlaciona con la producción de inmunoglobulinas, es decir el componente humoral de la respuesta inmunológica. En enfermedad celíaca, la importancia de la inmunidad humoral se manifiesta en el diagnóstico, con el uso de anticuerpos tipo antitransglutaminasa y antiendomisio (1,2). En Sprue tropical (enteropatía dentro del grupo AVSN) las células plasmáticas reemplazan a los linfocitos en relación a la duración de la enfermedad y conforme se incrementa la atrofia (15). En síndrome
de sobrecrecimiento bacteriano, el incremento de células plasmáticas IgA en comparación con pacientes normales. (16). En nuestro estudio, el promedio de células plasmáticas fue menor en AVSN que en enfermedad celíaca. Esta diferencia podría representar una mayor participación de la respuesta humoral en enfermedad celíaca que en AVSN.
En mucosa duodenal, la atrofia de las vellosidades y consecuente hiperplasia de criptas es resultado de la actividad citotóxica de los linfocitos intraepiteliales CD8+(13). Asimismo, diferentes autores han descrito que la atrofia de vellosidades es más severa en enfermedad celíaca en comparación con otras enteropatías como Sprue Tropical o sobrecrecimiento bacteriano (1719). En nuestro estudio, la atrofia de vellosidades severa e hiperplasia de criptas fueron efectivamente, más frecuentes en enfermedad celíaca, pero solo la hiperplasia de criptas fue estadísticamente significativa. Estas diferencias podrían estar en relación a un mayor o más prolongado daño epitelial por linfocitos citotoxicos en enfermedad celíaca que en AVSN. En la evaluación histológica, estos datos podrían ayudar en la aproximación diagnóstica inicial; sin embargo, más estudios se requieren para determinar su aplicación general.
Algunos autores han resaltado que la presencia de eosinófilos y neutrófilos son más característicos en enteropatías AVSN, como sobrecrecimiento, alergia alimentaria o Sprue tropical (18,20). En el presente estudio ni los eosinófilos, ni los neutrófilos fueron más frecuentes en el grupo AVSN. Además, observamos 2 casos de enfermedad celíaca con alto conteo de eosinófilos en lámina propia (>=20 en campo de alto poder); este hecho puede ser considerado una enteritis eosinofílica secundaria. La asociación entre enfermedad celíaca y trastornos eosinofílicos gastrointestinales ha sido descrita recientemente, en particular con esofagitis eosinofílica (21).
En ambos grupos, el linfocito intraepitelial predominante fue el linfocito T citotóxico CD3+; CD8+. El rol del linfocito citotóxico CD8 en la patogénesis de enfermedad celíaca consiste en inducir apoptosis en las células epiteliales y eventualmente conducir a la atrofia de vellosidades (1,3). En el grupo AVSN, existen pocas investigaciones al respecto. Goldstein y col. demostraron un incremento de linfocitos intraepiteliales CD4 y CD8 en un pequeño grupo de 7 pacientes con AVSN (22). No hemos encontrado ningún trabajo sobre la participación de linfocitos CD8+ en síndrome de sobrecrecimiento bacteriano o Sprue tropical.En nuestro trabajo encontramos marcada presencia de estos linfocitos CD8 intraepiteliales en nuestro 19 casos de AVSN. En ese contexto, es posible suponer que la participación de linfocitos CD8+ en AVSN pueda ser similar al de enfermedad celiaca y debería ser estudiado en el futuro.
El linfocito más frecuentemente hallado en lámina propia fue el linfocito T CD4+ en ambos grupos. Es conocido que, en enfermedad celíaca, estos linfocitos son CD4 TH1 y tienen la capacidad de liberar IFN gamma, el cual contribuye también al desarrollo de atrofia y la activación de la inmunidad humoral. En alergia alimentaria, estos linfocitos son CD4 tipo TH2 (22,23). No hemos encontrado ningún estudio sobre la participación de estos linfocitos en Sprue tropical o sobrecrecimiento bacteriano. Sería interesante tipificar los linfocitos T CD4+, en el grupo AVSN.
Los linfocitos CD3 se encontraron más frecuentemente en AVSN que en enfermedad celíaca. Linfocitos intraepiteliales CD3 negativos de naturaleza incierta han sido descritos en enfermedad celíaca. En enfermedad celíaca refractaria, se reporta un incremento de éstos linfocitos CD3 negativos que en ese contexto son llamados aberrantes. Es posible que la presencia de éstos linfocitos CD3 negativos en enfermedad celíaca explique la mayor presencia de linfocitos CD3+ en AVSN. Más estudios deben hacerse para establecer la importancia clínica de ésta diferencia.
La expresión de CD56 es una característica de los linfocitos llamados natural Killer, los cuales participan principalmente en la inmunidad natural contra virus y células tumorales. En enfermedad celíaca, han sido reportados disminuidos (24). Aparentemente estos linfocitos disminuirían en presencia de interferón gamma, el cual se sabe está aumentado en enfermedad celíaca (25). Sprue tropical se cree puede ser el resultado de una infección viral, es ese sentido, podría esperarse un incremento de linfocitos CD56. No pudimos encontrar ninguna diferencia en ambos grupos respecto a los linfocitos CD56. Más aún, la presencia de los linfocitos CD56 fue leve y sólo en la lámina propia en ambos grupos.
Ninguno de nuestros casos tuvo estudio HLADQ2/ DQ8. Por lo tanto, no podemos excluir totalmente la posibilidad de estar frente a casos de enfermedad celíaca serológicamente negativos. Sin embargo, ninguno de nuestros casos AVSN presento sintomatología en relación al consumo de gluten. Lamentablemente no pudo realizarse una biopsia control en estos pacientes.
En conclusión, nuestros resultados muestran más similitudes que diferencias entre enfermedad celíaca y AVSN. Los resultados sugieren una mayor o más prolongada respuesta humoral y citotóxica en pacientes con enfermedad celiaca que en los AVSN. Son necesarios más estudios para precisar la importancia estos hallazgos en pacientes AVSN.
BIBLIOGRAFÍA
1. Antonioli DA. Celiac disease: a progress report. Mod Pathol. 2003;16(4):342-6. [ Links ]
2. Walker MM, Murray JA. An update in the diagnosis of coeliac disease. Histopathology. 2011;59(2):166-79. [ Links ]
3. Moss SF, Attia L, Scholes JV, Walters JR, Holt PR. Increased small intestinal apoptosis in coeliac disease. Gut. 1996;39(6):811-7. [ Links ]
4. Schuppan D, Junker Y, Barisani D. Celiac disease: from pathogenesis to novel therapies. Gastroenterology. 2009;137(6):1912-33. [ Links ]
5. Shalimar DM, Das P, Sreenivas V, Gupta SD, Panda SK, Makharia GK. Mechanism of villous atrophy in celiac disease role of apoptosis and epithelial regeneration. Arch Pathol Lab Med. 2013;137(9):1262-9. [ Links ]
6. Calleja S, Vivas S, Santiuste M, Arias L, Hernando M, Nistal E, et al. Dynamics of non-conventional intraepithelial lymphocytes-NK, NKT, and γδ T-in celiac disease: relationship with age, diet, and histopathology. Dig Dis Sci. 2011;56(7):2042-9.
7. Lefrancois L. Phenotypic complexity of intraepithelial lymphocytes of the small intestine. J Immunol. 1991;147(6):1746-51. [ Links ]
8. Pallav K, Leffler DA, Tariq S, Kabbani T, Hansen J, Peer A, et al. Noncoeliac enteropathy: the differential diagnosis of villous atrophy in contemporary clinical practice. Aliment Pharmacol Ther. 2012;35(3):380-90. [ Links ]
9. DeGaetani M, Tennyson CA, Lebwohl B, Lewis SK, Abu Daya H, Arguelles-Grande C, et al. Villous atrophy and negative celiac serology: a diagnostic and therapeutic dilemma. Am J Gastroenterol. 2013;108(5):647-53. [ Links ]
10. Arévalo F, Roe E, Arias-Stella-Castillo J, Cárdenas J, Montes P, Monge E. Low serological positivity in patients with histology compatible with celiac disease in Perú. Rev Esp Enferm Dig. 2010;102(6):372-5. [ Links ]
11. Brown I, Mino-Kenudson M, Deshpande V, Lauwers GY. Intraepithelial lymphocytosis in architecturally preserved proximal small intestinal mucosa: an increasing diagnostic problem with a wide differential diagnosis. Arch Pathol Lab Med. 2006;130(7):1020-5. [ Links ]
12. Mahadeva S, Wyatt JI, Howdle PD. Is a raised intraepithelial lymphocyte count with normal duodenal villous architecture clinically relevant? J Clin Pathol. 2002;55(6):424-8. [ Links ]
13. Serra S, Jani PA. An approach to duodenal biopsies. J Clin Pathol. 2006;59(11):1133-50. [ Links ]
14. Barak N, Hart J, Sitrin MD. Enalapril-induce eosinophilic gastroenteritis. J Clin Gastroenterol. 2001;33(2):157-8. [ Links ]
15. Montgomery RD, Shearer AC. The cell population of the upper jejunal mucosa in tropical sprue and postinfective malabsorption. Gut. 1974;15(5):387-91. [ Links ]
16. Riordan SM, McIver CJ, Wakefield D, Duncombe VM, Thomas MC, Bolin TD. Small intestinal mucosal immunity and morphometry in luminal overgrowth of indigenous gut flora. Am J Gastroenterol. 2001;96(2):494-500. [ Links ]
17. Lappinga PJ, Abraham SC, Murray JA, Vetter EA, Patel R, Wu TT. Small intestinal bacterial overgrowth: histopathologic features and clinical correlates in an underrecognized entity. Arch Pathol Lab Med. 2010;134(2):264-70. [ Links ]
18. Brown IS, Bettington A, Bettington M, Rosty C. Tropical sprue: revisiting an underrecognized disease. Am J Surg Pathol. 2014;38(5):666-72. [ Links ]
19. Ghoshal UC, Mehrotra M, Kumar S, Ghoshal U, Krishnani N, Misra A, et al. Spectrum of malabsorption syndrome among adults & factors differentiating celiac disease & tropical malabsorption. Indian J Med Res. 2012;136(3):451-9. [ Links ]
20. Owens SR, Greenson JK. The pathology of malabsorption: current concepts. Histopathology. 2007;50(1):64-82. [ Links ]
21. Stewart MJ, Shaffer E, Urbanski SJ, Beck PL, Storr MA. The association between celiac disease and eosinophilic esophagitis in children and adults. BMC Gastroenterol. 2013;13:96. [ Links ]
22. Goldstein NS. Non-gluten sensitivity-related small bowel villous flattening with increased intraepithelial lymphocytes: not all that flattens is celiac sprue. Am J Clin Pathol. 2004;121(4):546-50. [ Links ]
23. Bellanti JA, Zeligs BJ, Malka-Rais J, Sabra A. Abnormalities of Th1 function in non-IgE food allergy, celiac disease, and ileallymphonodular hyperplasia: a new relationship? Ann Allergy Asthma Immunol. 2003;90(6 Suppl 3):84-9. [ Links ]
24. Dunne MR, Elliott L, Hussey S, Mahmud N, Kelly J, Doherty DG, et al. Persistent changes in circulating and intestinal γδ T cell subsets, invariant natural killer T cells and mucosalassociated invariant T cells in children and adults with coeliac disease. PLoS One. 2013;8(10):e76008.
25. Deignan T, Curry MP, Doherty DG, Golden-Mason L, Volkov Y, Norris S, et al. Decrease in hepatic CD56(+) T cells and V alpha 24(+) natural killer T cells in chronic hepatitis C viral infection. J Hepatol. 2002;37(1):101-8. [ Links ]
Correspondencia: Fernando Arévalo Suárez
E-mail: histodiagnostico1303@hotmail.com
Recibido: 31-7-2015
Aprobado: 22-11-2015