Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.36 no.3 Lima jul./set. 2016
ARTÍCULOS ORIGINALES
Frecuencia y susceptibilidad antiparasitaria in vitro de Blastocystis hominis en pacientes admitidos en el Hospital Regional Lambayeque, Perú
Frequency and in vitro susceptibility antiparasitic of Blastocystis hominis from patients admitted to the Hospital Regional Lambayeque, Peru
Heber Silva-Díaz1a,b; Lorena Flores-Esqueche2a; Dunalia Llatas-Cancino2c,d; Génesis Guevara Vásquez1e; Teresa Silva-García2a
1 Laboratorio de Parasitología, Metaxénicas y Zoonosis, Hospital Regional Lambayeque. Lambayeque, Perú.
2 Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruíz Gallo. Lambayeque, Perú.
a Biólogo-microbiólogo,
b Doctor en ciencias,
c Biólogo,
d Maestro en ciencias,
e Estadístico
RESUMEN
Objetivo. Describir la frecuencia y susceptibilidad antiparasitaria in vitro de Blastocystis hominis en pacientes admitidos en el Hospital Regional Lambayeque, Perú. Material y métodos. Se realizó un estudio transversal entre enero y agosto del 2015 en 313 pacientes de todas las edades. La detección de B. hominis se realizó en muestras seriadas de heces mediante examen microscópico directo y microcultivo en solución de Locke modificada. La prueba de susceptibilidad in vitro frente a los fármacos metronidazol, nitazoxanida, trimetoprim-sulfametoxazol y eritromicina, se realizó en 24 cepas de B. hominis, a los cuales se los cultivó (método del microcultivo), en 10 concentraciones dobles de cada antimicrobiano (desde 256 ug/ mL hasta 0,5 ug/mL), además de un control. Resultados. El 46,3% (145/313) de la muestra tuvo B. hominis, además se observó que, la edad entre 12 a 17 años y más de 60 años estuvo asociado con la mayor frecuencia del parásito (OR: 2,93 y 2,62 respectivamente). La concentración inhibitoria mínima (CIM) 90 del metronidazol y nitazoxanida fue de 3,19 ug/mL y 11,19 ug/mL respectivamente, mientras que el CIM-90 del trimetoprim-sulfametoxazol y eritromicina fueron superiores a 256 ug/mL. Conclusiones. B. hominis se presenta en alta frecuencia en pacientes admitidos en el Hospital Regional de Lambayeque, mostrando ser importante y un problema de salud pública en la región. Asimismo, los B. hominis aislados de estos pacientes mostraron ser susceptibles in vitro a bajas concentraciones de metronidazol y nitazoxanida por lo que podrían ser de elección para el tratamiento de este parásito.
Palabras clave: Blastocystis hominis; Metronidazol; Combinación trimetoprim y sulfametoxazol; Eritromicina (fuente: DeCS BIREME).
ABSTRACT
Objective. To describe the frequency and antiparasitic in vitro susceptibility of Blastocystis hominis in patients admitted to the Hospital Regional Lambayeque, Peru. Material and methods. A cross-sectional study was conducted from January to August 2015 at 313 patients of all ages. B. hominis detection was performed on serial fecal samples by direct microscopic examination and microculture in modified Locke solution. The in vitro susceptibility testing against the drug metronidazole, nitazoxanide, trimethoprim-sulfamethoxazole and erythromycin was performed in 24 strains of B. hominis, which grew up (microculture method) in 10 double concentrations of each antimicrobial (from 256 ug/ml to 0.5 ug/mL) plus a control. Results. 46.3% (145/313) of the sample had B. hominis, also the age between 12 to 17 years and 60 years was associated with higher frequency of parasites (OR: 2.93 and 2.62). The minimum inhibitory concentration (MIC) 90 of metronidazole and nitazoxanide was 3.19 ug/mL and 11.19 ug/ml, respectively, whereas the MIC 90 of trimethoprim-sulfamethoxazole and erythromycin were above 256 ug/mL. Conclusions. B. hominis occurs in high frequency in patients admitted to the Hospital Regional in Lambayeque, proving to be an important problem of public health in the region. Also B. hominis isolated from these patients were shown to be susceptible in vitro to low concentrations of metronidazole and nitazoxanide so they could be chosen for treatment of this parasite.
Keywords: Blastocystis hominis; Metronidazole; Sulfamethoxazole drug combination; Erythromycin (source: MeSH NLM).
INTRODUCCIÓN
Blastocystis hominis es un protozoario anaerobio frecuente en el intestino del hombre y animales, considerado un parásito patógeno emergente y potencial zoonótico(1,2). El microorganismo es pleomórfico, caracterizado por presentar cuatro formas: vacuolar, ameboide, granular y quística. Las dos primeras formas predominan en cultivos, mientras las dos últimas lo son en las heces, no obstante, es posible tener todas las formas en ambos ambientes(3-6).
Las manifestaciones clínicas más frecuentes asociadas a la infección por B. hominis son el dolor y balonamiento abdominal, diarrea, náuseas y flatulencia(7,8). Asimismo, B. hominis también ha sido asociado al síndrome de intestino irritable(9,10), urticaria y angiodema(11,12). El microorganismo y los síntomas han sido descritos tanto en individuos inmunocompetentes e inmunodeprimidos(13), no obstante, se ha evidenciado que el estrés exacerba la infectividad y la patogenicidad del parásito(14). El rol patogénico y las manifestaciones clínicas de la infección por B. hominis han sido relacionadas con el tipo morfológico, subtipo y el número de parásitos por campo microscópico(5,15-17).
Frecuencias altas y variables de B. hominis han sido reportadas en países de América Latina como México (61%)(18), Venezuela (25,9 a 45,6%) (19,20), y Chile (42,3 a 63,3%) (21); así como en varias regiones de Perú (9,9 a 34,3%)(22-5). La transmisión del parásito se ha relacionado a las pobres condiciones sanitarias y el consumo de agua y alimentos contaminados (8,26-28). Los hallazgos antes mencionados evidencian la necesidad de más estudios con el fin de conocer no solo la frecuencia actual del parásito en la región, sino también su distribución y la importancia clínica en la población expuesta.
Por otra parte, las pruebas de susceptibilidad antimicrobiana son de vital importancia clínica en el manejo del paciente, por cuanto el conocimiento del patrón de comportamiento del microorganismo frente a los antimicrobianos permite un tratamiento eficaz y controlado. Las pruebas de susceptibilidad in vitro de B. hominis frente a fármacos antiparasitarios ha sido escasamente estudiado (29-31), desconociéndose aún en gran parte los fármacos y las dosis de elección para asegurar el tratamiento. Sumado a esto, los fenómenos de resistencia exigen la necesidad de establecer los perfiles de susceptibilidad en cada región.
Frente a esta realidad, el presente estudio determinó la susceptibilidad in vitro de B. hominis frente a cuatro fármacos de uso común, asimismo describió la frecuencia y algunas características clínicas asociadas a infección por B. hominis en pacientes admitidos en el Hospital Regional de Lambayeque.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional de corte transversal analítico entre los meses de enero y agosto del 2015 en pacientes admitidos en el Hospital Regional Lambayeque (HRL), Chiclayo, Perú. El HRL es un hospital de alta complejidad, que atiende pacientes referidos de la región Lambayeque y regiones aledañas.
Población y muestra
Para el estudio de la frecuencia de B. hominis, la población fue constituida por los pacientes con solicitud de exámenes coprológicos procedentes de consultorio externo, medicina y emergencias del HRL. Se utilizó un muestreo bietápico, la primera etapa correspondió a un muestreo sistemático constituido por 313 participantes, el cual se calculó usando el estadístico de tamaño de muestra para estimar una proporción cuando la población es desconocida. Se consideró un nivel de confianza de 0,95, un error de 0,05 y una proporción “p” esperada de 0,284 (24); seleccionando un participante cada 6 pacientes. La segunda etapa, correspondiente a susceptibilidad antiparasitaria, se aplicó un diseño no probabilístico de todas las cepas aisladas por cultivo en la etapa previa, constituida por 24 de ellas seleccionadas aleatoriamente.
Detección de Blastocystis hominis a partir de muestras fecales
Los datos personales y características clínicas fueron recolectados mediante un cuestionario estructurado, aplicado por personal capacitado a los padres de familia o apoderados. En cuanto a la detección de B. hominis en muestras fecales, se solicitó tres muestras seriadas de heces para su respectivo análisis mediante examen microscópico directo (EMD) y cultivo parasitológico, realizados en el Laboratorio de Parasitología, Metaxénicas y Zoonosis del Hospital Regional Lambayeque.
El EMD se realizó tal como se ha descrito previamente por Beltrán et al. (2003) (32); mientras que el cultivo parasitológico se realizó mediante el método de microcultivo descrito por Zerpa et al. (1999) (33). Se utilizó como medio de cultivo la solución de Locke (usada en la fase líquida del Medio Boeck-Drbohlav modificado) (34), a la que, una vez esterilizada, se le suplementó con los siguientes componentes estériles: almidón de arroz (Difco®) (1 mg/mL), pencicilina G (Sigma-Aldrich®) (1000 UI/mL), estreptomicina (Sigma-Aldrich®) (100 ug/ mL), gentamicina (100 ug/mL), y suero fetal bovino (Sigma-Aldrich®) (5%).
La técnica consistió en inocular 50 mg o 50 uL de heces en el fondo de cada pocillo (Corning-Costar®) e incubar a 36 ºC durante 48 a 72 horas. Pasado este tiempo se realizaron lecturas de los cultivos mediante examen microscópico directo, mezclando 10 ul del cultivo del fondo de cada pocillo con 10 ul de colorante azul de Tripán (Sigma-Aldrich®), el cual permitió verificar el crecimiento y viabilidad del parásito.
Prueba de susceptibilidad antiparasitaria in vitro
La susceptibilidad antiparasitaria de B. hominis fue evaluada frente a los fármacos metronidazol, nitazoxanida, trimetoprim-sulfametoxazol y eritromicina, con el fin de determinar la concentración inhibitoria mínima (CIM), en una forma similar al método desarrollado en bacteriología. Los fármacos fueron pesados, preparados y agregados al medio de cultivo, de tal manera de obtener 10 concentraciones de cada droga, desde 256 ug/mL hasta 0,50 ug/mL mediante diluciones dobles (35).
El inóculo, preparado a partir de un cultivo de 48 horas, se ajustó a una concentración de 200 mil células viables por mililitro mediante recuento en cámara de Neubauer con azul de Tripán. Posteriormente, 30 uL del inóculo homogenizado fue dispensado en cada uno de los pocillos con medio sin fármaco (control) y con fármaco (10 concentraciones de cada uno).
Las siembras se incubaron a 36 °C durante 48 horas, después del cual se realizaron las lecturas, así como lo descrito anteriormente. La inhibición del crecimiento de B. hominis se determinó comparando el desarrollo del parásito en el pocillo control con los que contienen los fármacos.
El estudio fue revisado y aprobado por el comité de ética del Hospital Regional Lambayeque. La participación en el estudio fue voluntaria y aceptada a través de la firma de un consentimiento informado. Para el análisis estadístico se utilizaron los programas informáticos SPSS 22.0 e Infostat/E. Se calculó la frecuencia absoluta y relativa de B. hominis en relación a las variables independientes, así como el intervalo de confianza para la proporción. Asimismo, el análisis bivariado se realizó mediante las pruebas de Chi cuadrado, exacta de Fisher y OR. En cuanto al estudio de la susceptibilidad antiparasitaria, para determinar la concentración inhibitoria mínima 90 y 50 (CIM-90 y CIM-50), se realizó un análisis de regresión Probit. La CIM-90 y CIM-50 fue la concentración mínima de fármaco necesario para inhibir el 90 y 50% de las cepas de B. hominis respectivamente. En ambos casos se consideró significativo un valor de p<0,05.
RESULTADOS
Frecuencia de Blastocystis hominis
Se investigaron 313 pacientes mayores de 6 meses de edad atendidos en el Hospital Regional Lambayeque, Chiclayo, Perú. La muestra tuvo una mediana de edad de 28 años (rango intercuartíleo de 10 a 53), y se caracterizó por el predominio del género femenino (57,5%) y grupo etario de 30 a 59 años (28,1%) (Tabla 1). En el 46,3% (145/313) de la muestra se demostró B. hominis por alguno de los dos métodos usados (IC95%: 41,1%-52,1%), asimismo 40,7% (59/145) de éstos también presentaron otro parásito intestinal (59,3% solo B. hominis). El 42,1% de casos positivos se presentaron con una densidad parasitaria alta (más de 5 células por campo microscópico de 400 aumentos).
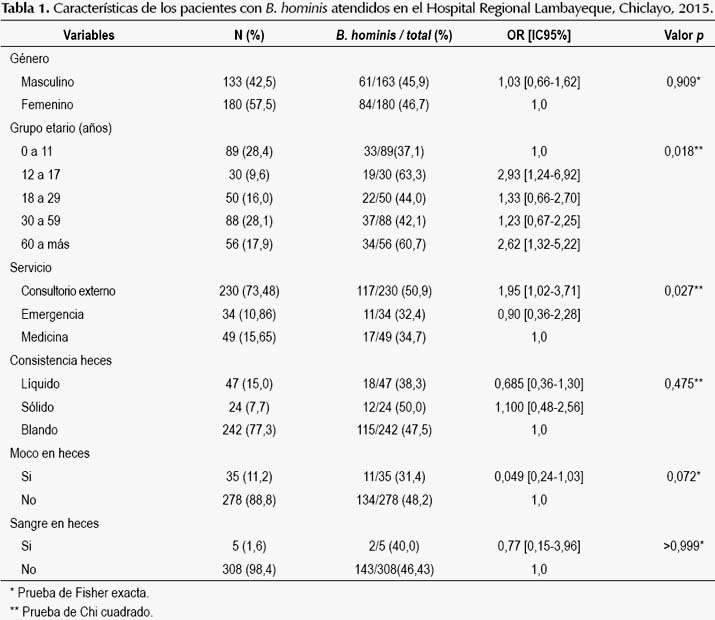
El análisis bivariado entre las variables independientes y la blastocystosis, mostró que, presentar entre 12 a 17 y más de 60 años estuvo asociado con la mayor frecuencia del parásito (OR: 2,93 y 2,62 respectivamente), al igual que los pacientes que procedieron de consultorio externo (OR: 1,95) (Tabla 1). No se observó asociación entre la mayor densidad parasitaria (5 a más células por campo microscópico) con la presencia de moco (p=0,527), sangre (p=0,175), consistencia líquida de las heces (p=0,196) o presencia de otro parásito (p=0,496).
Susceptibilidad antiparasitaria in vitro
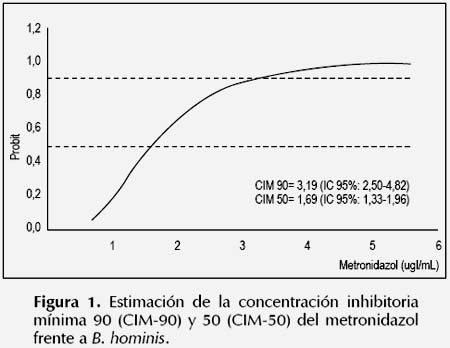
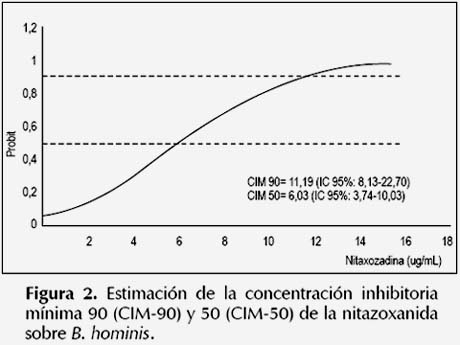
La susceptibilidad antiparasitaria in vitro de B. hominis frente al metronidazol y nitazoxanida se muestran en las Figuras 1 y 2. Se observó una CIM90 y CIM-50 del metronidazol de 3,19 y 1,60 ug/ mL respectivamente; mientras que la CIM-90 y CIM50 de la nitazoxanida fueron de 11,19 y 6,03 ug/mL respectivamente. En cuanto a la susceptibilidad al trimetoprim-sulfametoxazol y eritromicina, se observó que la CIM-90 y CIM-50 fueron superiores a 256 ug/ mL, que fue la máxima concentración ensayada de los fármacos en el experimento. Pues solo el 29% (7/24) y el 13% (3/24) de cepas de B. hominis fueron susceptibles a 256 y 128 ug/mL de trimetoprimsulfametoxazol respectivamente. De manera similar, solo el 8% (2/24) de cepas fueron susceptibles a 256 ug/mL de eritromicina.
DISCUSIÓN
La frecuencia de 46,3% de blastocystosis intestinal, observada en nuestro estudio, fue alta en comparación a lo reportado a un estudio previo en Lambayeque (12,3%) (36) y otros estudios en Lima (34,3%) (22), Puno (9,9%) (23), Amazonas (28,4%) (24) y Cajamarca (22,2%) (25). Estas diferencias podrían explicarse por las distintas características de la población en estudio y condiciones sociodemográficas, así como por los distintos métodos usados para la detección del parásito. La alta frecuencia de B. hominis encontrado en éste estudio es concordante con resultados obtenidos en otros países de América Latina (18-21), lo que refleja el problema común y las similares condiciones predisponentes.
En nuestro estudio se observó que los pacientes entre 12 a 17 y más de 60 años tuvieron mayor probabilidad de presentar B. hominis, lo que podría sugerir la relación de B. hominis con los cambios hormonales y condición inmunológica del huesped. La mayor frecuencia del parásito en adultos en relación a los niños también ha sido reportada en otros estudios (37,38). La evidencia de no asociación entre B. hominis o su mayor densidad (5 a más células por campo microscópico) con la presencia de moco, sangre y consistencia líquida de las heces, indica la presentación asintomática de la infección independientemente de la densidad parasitaria y, por tanto, la presencia del estado de portador. Estos resultados concuerdan con estudios previos (5,13).
B. hominis fue susceptible al metronidazol a una CIM90 y CIM-50 de 3,19 ug/mL y 1,60 ug/mL respectivamente, valores inferiores a los obtenidos por Zerpa et al. 2012 (30) (CIM-90: 64 ug/mL y CIM-50: 2 ug/mL). Asimismo, la CIM-90 y CIM-50 mayores de 256 ug/mL obtenidos para el trimetoprim-sulfametoxazol y eritromicina fueron altos respecto al estudio citado anteriormente (CIM-90: 128 ug/mL y CIM-50: 64 ug/mL), además prueba la resistencia in vitro de éste parásito a los fármacos en mención. En cuanto a la nitazoxanida, se observó que B. hominis es susceptible al fármaco a bajas concentraciones (CIM-90: 11,19 ug/mL y CIM-50: 6,03 ug/mL).
Sin embargo, un estudio reciente concluye una baja susceptibilidad in vitro de B. hominis al metronidazol y nitazoxanida y describe al trimetoprim-sulfametoxazole, ivermectina como potenciales drogas para el tratamiento de la Blastocystosis (31). Estas diferencias de susceptibilidad in vitro a las drogas, revelado por varios estudios, podrían responder al distinto perfil de susceptibilidad del parásito por la diferente presión selectiva antimicrobiana a los que fueron sometidos en cada población estudiada. También es posible que las diferencias en los métodos y componentes de los medios de cultivo usados hayan inducido comportamientos distintos en los experimentos.
Es necesario estudios de eficacia clínica in vivo para validar los resultados aquí obtenidos; sin embargo, los realizados previamente muestran resultados variables y aún abiertos a la discusión (39-42). No obstante, lo mencionado anteriormente, nuestros resultados son una evidencia útil en el contexto clínico y epidemiológico, debido a que el trimetoprim-sulfametoxazol es de amplio uso médico en el tratamiento de enfermedad diarreica aguda en niños y adultos. Asimismo, la eritromicina es un macrólido usado para el tratamiento de protozoos como Cryptosporidium sp.; sin embargo, carece de acción contra a B. hominis bajo las condiciones in vitro. Del estudio de susceptibilidad se desprenden tres consecuencias:
1. La utilidad del ensayo para evaluar el perfil de susceptibilidad antimicrobiana de B. hominis y otros protozoos intestinales.
2. La potencial aplicación clínica en cuanto a la elección de los fármacos y la dosis requerida para el tratamiento adecuado.
3. La posibilidad de realizar seguimiento y vigilancia a los eventos de resistencia que posiblemente se presenten en futuro.
Se concluye que la infección por B. hominis se presenta en alta frecuencia en pacientes admitidos en el Hospital Regional Lambayeque, lo que evidencia la importancia de esta parasitosis como problema de salud pública en la región y el país. Asimismo, B. hominis aislados de estos pacientes mostraron ser susceptibles a bajas concentraciones de metronidazol y nitazoxanida; sin embargo, fueron resistentes a altas concentraciones de trimetoprim-sulfametoxazol y eritromicina. Si bien es necesario estudios complementarios de eficacia in vivo, los dos primeros fármacos podrían ser recomendados para el tratamiento de esta parasitosis en la población objeto de estudio.
Agradecimientos:
Los autores agradecen al Dr. Carlos Hidalgo Tunque, médico gastroenterólogo, por su opinión profesional a los resultados obtenidos y su implicancia clínica. Asimismo, agradecemos a la Dirección de Investigación del Hospital Regional Lambayeque por el financiamiento en cuanto al uso de infraestructura y equipamiento de laboratorio.
BIBLIOGRAFÍA
1. Scanlan PD, Stensvold CR, Rajilić-Stojanović M, Heilig HG, De Vos WM, O’Toole PW, et al. The microbial eukaryote Blastocystis is a prevalent and diverse member of the healthy human gut microbiota. FEMS Microbiol Ecol. 2014;90(1):326-30.
2. Duda A, Kosik-Bogacka D, Lanocha N, Szymanski S. [Blastocystis hominis-parasites or commensals?] Ann Acad Med Stetin. 2014;60(1):23-8. [Article in Polish] [ Links ]
3. Velarde del Río LT, Mendoza Romo MA. Prevalencia de Blastocystis hominis en menores de 12 años de una población mexicana urbana. Rev Cubana Pediatr. 2006;78(4). [ Links ]
4. Gallegos L, González A, López-Urbina T, Gonzales-Gustavson E, Gómez-Puerta L, Arroyo G. Comparación de la eficacia de tres medios de cultivo in vitro para el desarrollo de Blastocystis spp. Rev Inv Vet Peru. 2013;24(4):480-8. [ Links ]
5. Hernández AK, Barrios EE, Sánchez L, Araque W, Delgado V. Tipos morfológicos, número de parásitos por campo y carga parasitaria de Blastocystis sp proveniente de pacientes sintomáticos y asintomáticos. Salus. 2012;16(3):013-6. [ Links ]
6. Zerpa R, Huicho L, Náquira C, Espinoza I. A simplified cuture method for Blastocystis hominis. Rev Mex Patol Clin. 2000;47(1):17-9. [ Links ]
7. Stenzel DJ, Boreham PF. Blastocystis hominis revisited. Clin Microbiol Rev. 1996;9(4):563-84. [ Links ]
8. Barahona Rondón L, Maguiña Vargas C, Náquira Velarde C, Terashima I A, Tello R. Blastocystosis Humana: estudio Prospectivo, sintomatología y factores epidemiológicos asociados. Rev Gastroenterol Peru. 2003;23(1):29-35. [ Links ]
9. Nagel R, Traub RJ, Kwan MMS, Bielefeldt-Ohmann H. Blastocystis specific serum immunoglobulin in patients with irritable bowel syndrome (IBS) versus healthy controls. Parasit Vectors. 2015;8(1):453. [ Links ]
10. Ragavan ND, Kumar S, Chye TT, Mahadeva S, Shiaw-Hooi H. Blastocystis sp. in Irritable Bowel Syndrome (IBS) - Detection in Stool Aspirates during Colonoscopy. PLoS One. 2015;10(9):e0121173. [ Links ]
11. Casero RD, Mongi F, Sánchez A, Ramírez JD. Blastocystis and urticaria: Examination of subtypes and morphotypes in an unusual clinical manifestation. Acta Trop. 2015;148:156-61. [ Links ]
12. Micheloud D, Jensen J, Fernandez-Cruz E, Carbone J. Angioedema crónico e infección por Blastocystis hominis. Rev Gastroenterol Peru. 2007;27(2):191-3. [ Links ]
13. Salinas JL, Vildozola Gonzales H. Infección por Blastocystis: una revisión. Rev Gastroenterol Peru. 2007;27(3):264-74. [ Links ]
14. Chandramathi S, Suresh K, Sivanandam S, Kuppusamy UR. Stress exacerbates infectivity and pathogenicity of Blastocystis hominis: in vitro and in vivo evidences. PLoS One. 2014;9(5):e94567. [ Links ]
15. Rajamanikam A, Govind SK. Amoebic forms of Blastocystis spp. - evidence for a pathogenic role. Parasit Vectors. 2013;6(1):295. [ Links ]
16. Ertuğ S, Malatyalı E, Ertabaklar H, Özlem Çalışkan S, Bozdoğan B. [Subtype distribution of Blastocystis isolates and evaluation of clinical symptoms detected in Aydin province, Turkey]. Mikrobiyol Bul. 2015;49(1):98-104. [Article in Turkish] [ Links ]
17. Barrios EE, Guevara D, Ojeda O, Pinto V, Araque W, Delgado V, et al. Morfología y respuesta de anticuerpos IgM e IgG anti-Blastocystis sp. en pacientes con síntomas gastrointestinales. Salus. 2013;17(3):19-26. [ Links ]
18. Rodríguez E, Mateos B, Gonzáles JC, Aguilar YM, Alarcón E, Mendoza AA, et al. Transición parasitaria a Blastocystis hominis en niños de la zona centro del estado de Guerrero, México. Parasitol Latinoam. 2008;63(1-2-3-4):20-8. [ Links ]
19. Lemus-Espinoza D, Maniscalchi MT, Kiriakos D, Pacheco F, Aponte C, Villarroel O, et al. Enteroparasitosis en niños menores de 12 años del estado Anzoátegui, Venezuela. Rev Soc Ven Microbiol. 2012;32(2):139-47. [ Links ]
20. Calchi La Corte M, Rivero de Rodríguez Z, Bracho Mora A, Villalobos R, Acurero de Yamarte E, Maldonado A, et al. Prevalencia de Blastocystis sp. y otros protozoarios comensales en individuos de Santa Rosa de Agua, Maracaibo, estado Zulia. Rev Soc Ven Microbiol. 2013;33(1):66-71. [ Links ]
21. Mercado R, Schenone H. Blastocistosis: enteroparasitosis más frecuente en Chile. Rev Med Chile. 2004;132(8):1015-6. [ Links ]
22. Pajuelo-Camacho G, Lujan-Roca D, Paredes-Perez B. Estudio de enteroparásitos en el Hospital de Emergencias Pediátricas, Lima-Perú. Rev Med Hered. 2005;16(3):178-83. [ Links ]
23. Maco Flores V, Marcos Raymundo LA, Terashima Iwashita A, Samalvides Cuba F, Gotuzzo Herencia E. Distribución de la entereoparasitosis en el Altiplano Peruano: estudio en 6 comunidades rurales del departamento de Puno, Perú. Rev Gastroenterol Peru. 2002;22(4):304-9. [ Links ]
24. Ibáñez N, Jara C, Guerra A, Díaz E. Prevalencia del Enteroparasitismo en escolares de comunidades nativas del Alto Marañon, Amazonas, Perú. Rev Peru Med Exp Salud Publica. 2004;21(3):126-33. [ Links ]
25. Silva-Díaz H, López-Orbegozo J. Enteroparasitosis en el centro poblado rural Bella Unión, influenciado por el río San Lucas, Cajamarca, Perú. Fiat Lux. 2012;8(1):61-70. [ Links ]
26. Pérez-Cordón G, Rosales MJ, Gavira M del M, Valdez RA, Vargas F, Córdova O. Hallazgo de Blastocystis sp. en bivalvos del género Donax. Rev Peru Biol. 2007;14(2):301-2. [ Links ]
27. Pérez-Cordón G, Rosales MJ, Valdez RA, Vargas-Vásquez F, Cordova O. Detección de parásitos intestinales en agua y alimentos de Trujillo, Perú. Rev Peru Med Exp Salud Publica. 2008;25(1):144-8. [ Links ]
28. Cárdenas M, Martínez R. Protozoarios parásitos de importancia en salud pública transportados por Musca domestica Linnaeus en Lima, Perú. Rev Peru Biol. 2004;11(2):149-53. [ Links ]
29. Dunn LA, Boreham PF. The in-vitro activity of drugs against Blastocystis hominis. J Antimicrob Chemother. 1991;27(4):507-16. [ Links ]
30. Zerpa R, Espinoza Y, Huiza AF. Prueba de susceptibilidad antiparasitaria in vitro para Blastocystis hominis, Entamoeba histolytica-E. dispar, Balantidium coli. An Fac Med. 2012;73(1):47-9. [ Links ]
31. Roberts T, Bush S, Ellis J, Harkness J, Stark D. In Vitro Antimicrobial Susceptibility Patterns of Blastocystis. Antimicrob Agents Chemother. 2015;59(8):4417-23. [ Links ]
32. Beltrán M, Náquira-Velarde C, Tello-Casanova R. Manual de procedimientos de laboratorio para el diagnóstico de los parásitos intestinales del hombre. Lima: Instituto Nacional de Salud (Perú); 2003. [ Links ]
33. Zerpa R, Mircin L, Lucho J. Micrométodo para cultivo de Blastocystis hominis [resumen]. XIII Congr Latinoam Patol Clínica. Rev Mex Patol Clin. 1999;46(2):113. [ Links ]
34. Técnicas de laboratorio en Parasitología médica. En: Botero D, Restrepo M. Parasitosis humanas. Quinta Ed. Medellin: Corporación para Investigaciones Biológicas; 2013. p. 455-84. [ Links ]
35. Técnicas para la obtención de la concentración inhibitoria mínima. En: Sacsaquispe R, Velásquez J. Manual de procedimientos para la prueba de sensibilidad antimicrobiana por el método de disco difusión. Lima: Instituto Nacional de Salud; 2002. p. 58-65. [ Links ]
36. Mera-Olivares A, Ganosa-Granados L, Arce-Gil Z, Alarcón-Benavides E, Moreno-Echeandía G, León-Jimenez F. Distribución de las enteroparasitosis en un pueblo joven de Lambayeque. Rev Cuerpo Med HNAA. 2013;6(3):22-7. [ Links ]
37. Belleza MLB, Cadacio JLC, Borja MP, Solon JAA, Padilla MA, Tongol-Rivera PN, et al. Epidemiologic Study of Blastocystis Infection in an Urban Community in the Philippines. J Environ Public Health. 2015;2015:1-7. [ Links ]
38. Calderaro A, Montecchini S, Rossi S, Gorrini C, De Conto F, Medici M, et al. Intestinal parasitoses in a tertiary-care hospital located in a non-endemic setting during 2006-2010. BMC Infect Dis. 2014;14(1):264. [ Links ]
39. Rossignol J-F, Kabil SM, Said M, Samir H, Younis AM. Effect of nitazoxanide in persistent diarrhea and enteritis associated with Blastocystis hominis. Clin Gastroenterol Hepatol. 2005;3(10):987-91. [ Links ]
40. Heyland K, Friedt M, Buehr P, Braegger CP. No advantage for antibiotic treatment over placebo in Blastocystis hominispositive children with recurrent abdominal pain. J Pediatr Gastroenterol Nutr. 2012;54(5):677-9. [ Links ]
41. Nigro L, Larocca L, Massarelli L, Patamia I, Minniti S, Palermo F, et al. A placebo-controlled treatment trial of Blastocystis hominis infection with metronidazole. J Travel Med. 2003;10(2):128-30. [ Links ]
42. Cimerman S, Ladeira MCT, Iuliano WA. Blastocistose: nitazoxanida como nova opção terapêutica. Rev Soc Bras Med Trop. 2003;36(3):415-7. [ Links ]
Conflictos de interés: Los autores declaran no tener conflicto de interés.
Correspondencia:
Heber Silva-Díaz
Dirección de Investigación del Hospital Regional Lambayeque.
Av. Vía de Evitamiento Norte con Av. El Progreso. Chiclayo, Perú.
E-mail: hsilva@hrlamb.gob.pe
Recibido: 19-10-2015
Aprobado: 26 -2-2016













