Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.36 no.4 Lima oct./dic. 2016
ARTÍCULO DE REVISIÓN
Diarrea crónica en el diabético. Una revisión de la literatura
Chronic diarrhea in the diabetic. A review of the literature
Juan Sebastián Frías Ordoñez1, William Otero Regino2
1 Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
2 Unidad de Gastroenterología, Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
RESUMEN
Desde hace más de 70 años se conoce la asociación de diarrea con diabetes mellitus. En pacientes diabéticos su prevalencia es de alrededor del 20%. Sus manifestaciones clínicas son diversas, y representa un reto diagnóstico y terapéutico. Existen ciertos diagnósticos de mayor prevalencia en pacientes diabéticos que en la población general. Las distintas etiologías relacionadas pueden ser diagnosticadas adecuadamente a través de la historia clínica y pruebas diagnósticas complementarias. Los medicamentos utilizados por el paciente diabético para el manejo de su enfermedad, frecuentemente causan diarrea crónica, por lo que se debe profundizar en los antecedentes farmacológicos al momento de estudiar la diarrea. Los pacientes diabéticos pueden presentar otras condiciones patológicas asociadas, como enfermedad celíaca o colitis microscópica, cuya molestia única es la diarrea. La función del páncreas exocrino puede estar disminuida en el paciente diabético, frecuentemente llevando a insuficiencia pancreática exocrina. Factores dietarios, como los edulcorantes libres de azúcar y otros agentes, pueden causar diarrea en el paciente diabético. La presencia de condiciones como la neuropatía autonómica y neuropatía periférica secundarias a la diabetes mellitus, pueden explicar desordenes como la disfunción anorrectal y la incontinencia fecal. Finalmente, la enteropatía diabética per se o con sobrecrecimiento bacteriano asociado, puede causar diarrea. Lograr un control glicémico adecuado constituye el pilar del tratamiento de la diarrea en el diabético, después de esto existen medidas adicionales que se aplican según el contexto especifico del paciente. En el presente artículo se revisan las causas de mayor incidencia diarrea en el paciente diabético y los mecanismos fisiopatológicos implicados.
Palabras clave: Diarrea; Diabetes mellitus; Colitis; Insuficiencia pancreática exocrina (fuente: DeCS BIREME).
ABSTRACT
The association of diarrhea with diabetes mellitus has been known for more than 70 years. In diabetic patients its prevalence is around 20%.Its clinical manifestations are diverse, and represents a diagnostic and therapeutic challenge.There are certain diagnoses of higher prevalence in diabetic patients than in the general population.The different related etiologies can be adequately diagnosed through the clinical history and complementary diagnostic tests.The medications used by the diabetic patient to manage their disease often cause chronic diarrhea, so the pharmacological background should be studied at the time of the study of diarrhea.Diabetic patients can present other associated pathological conditions, such as celiac disease or microscopic colitis, which only discomfort is diarrhea.Exocrine pancreatic function may be decreased in the diabetic patient, frequently leading to exocrine pancreatic insufficiency. Dietary factors, such as sugar-free sweeteners and other agents, can cause diarrhea in the diabetic patient.The presence of conditions such as autonomic neuropathy and peripheral neuropathy secondary to diabetes mellitus may explain disorders such as anorectal dysfunction and faecal incontinence. Finally, diabetic enteropathy alone or with associated bacterial overgrowth can cause diarrhea.Achieving adequate glycemic control is the pillar of the treatment of diarrhea in the diabetic, after which there are additional measures that are applied according to the specific context of the patient.This article reviews the causes of higher diarrhea incidence in the diabetic patient and the pathophysiological mechanisms involved.
Keywords: Diarrhea; Diabetes mellitus; Colitis; Exocrine pancreatic insufficiency (source: MeSH NLM).
INTRODUCCIÓN
La asociación de diarrea con diabetes mellitus se conoce desde hace más de 70 años, cuando Dooleyet al. asignaron el término "diarrea diabética" a aquellos pacientes con diabetes que desarrollaban diarrea crónica (1). En pacientes con diabetes mellitus su prevalencia varía entre un 8% a 22% (2,3). Ocurre de modo típico en pacientes de edad media, particularmente hombres (relación hombre: mujer 3:2), con diabetes de larga data (mayor de 8 años de diagnóstico) y pobremente controlada (3). En la mayoría de pacientes, está presente la neuropatía periférica y es común la neuropatía autonómica al momento de su aparición (4). La diarrea en el diabético se presenta de modo severo, y es descrita comúnmente como explosiva. Las deposiciones suelen ser voluminosas, de color marrón, acuosas, y ocasionalmente acompañadas de esteatorrea (5,6). A veces es episódica, libre de dolor y de predominio nocturno (7). Se ha demostrado una correlación fuerte entre control glicémico y la prevalencia de síntomas diarreicos (definidos como más de tres evacuaciones al día, urgencia defecatoria, o la presencia de deposiciones acuosas o de consistencia blanda) (7,8). Pacientes con adecuado control glucémico presentan prevalencia del 12,3% para síntomas diarreicos, mientras que aquellos con glucometrías inapropiadas muestran prevalencia del 32,4% (8). Teniendo en cuenta que, la diarrea en el paciente diabético es de diversas etiologías, que pueden ser diagnosticadas mediante una historia clínica exhaustiva y pruebas diagnósticas pertinentes, el presente artículo plantea revisar lo más reciente acerca de las causas de diarrea de mayor incidencia en el paciente diabético y los mecanismos fisiopatológicos implicados, al igual que mencionar aspectos básicos acerca del diagnóstico y manejo.
DIAGNÓSTICO DE DIARREA EN EL DIABÉTICO
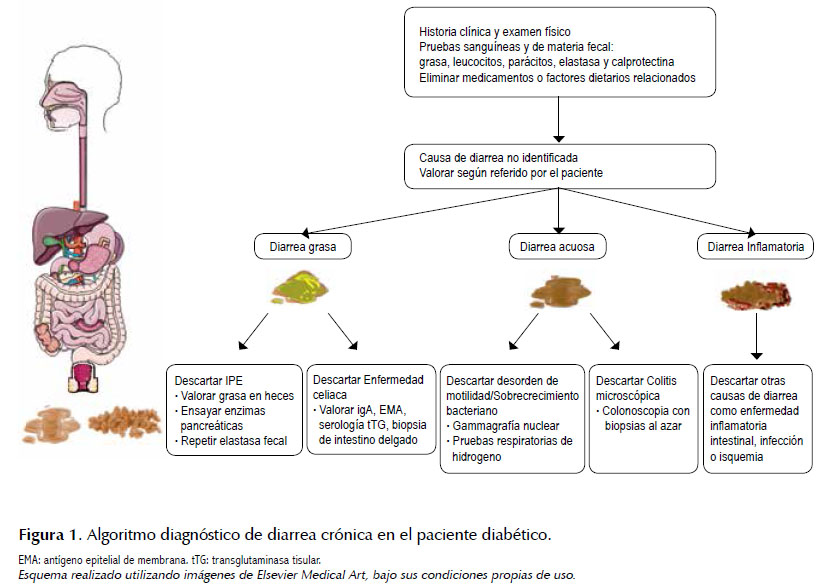
Si bien su diagnóstico es de exclusión, la valoración incluye la obtención de una historia clínica y examen físico completos (5-7). La diarrea en el diabético ocurre por lo general en pacientes insulino-dependientes con por lo menos 8 años de diagnóstico de diabetes, muchos de ellos sufren de neuropatía autonómica y periférica (3,9). En cuanto a su forma de presentación, esta es típicamente acuosa, voluminosa y explosiva, con o sin esteatorrea. Algunas otras características incluyen la ausencia de dolor abdominal, la incontinencia fecal, la presentación episódica y el predominio nocturno de los síntomas. Se debe indagar acerca de los medicamentos y factores dietarios posiblemente relacionados, dado que la diarrea en el diabético frecuentemente se asocia al uso de metformina (10). La evaluación diagnóstica incluye llevar a cabo pruebas serológicas y en materia fecal, que incluyen la búsqueda de grasa, leucocitos, parásitos, elastasa, y calprotectina (11). Si no se ha identificado la causa de la diarrea, se debe evaluar la posible etiología de acuerdo a lo referido por el paciente (6,11). Si la diarrea es de consistencia grasa, se deben descartar insuficiencia pancreática exocrina y enfermedad celiaca. Para insuficiencia pancreática exocrina se debe evaluar la grasa en materia fecal, ensayar la suplencia de enzimas pancreáticas y repetir la prueba de elastasa fecal. Mientras que para enfermedad celiaca es necesario conocer los niveles de IgA, antígeno epitelial de membrana (EMA) o serología para tranglutaminasa tisular, y la obtención de biopsia de intestino delgado. En el caso que el paciente refiere diarrea de consistencia acuosa, es necesario descartar enteropatía diabética con sobrecrecimiento bacteriano y también colitis microscópica. Mediante las pruebas respiratorias de hidrógeno se podrá descartar la presencia de enteropatía diabética con sobrecrecimiento bacteriano, mientras que la colonoscopia con biopsias al azar permitirán evaluar colitis microscópica. Si lo descrito por el paciente es diarrea inflamatoria es necesario buscar otros diagnósticos como enfermedad inflamatoria intestinal, infección o isquemia (12). Finalmente, si hay historia significativa de incontinencia, se puede considerar realizar manometría anorrectal para evaluar la función defecatoria (13). Figura 1.
DIARREA INDUCIDA POR MEDICAMENTOS
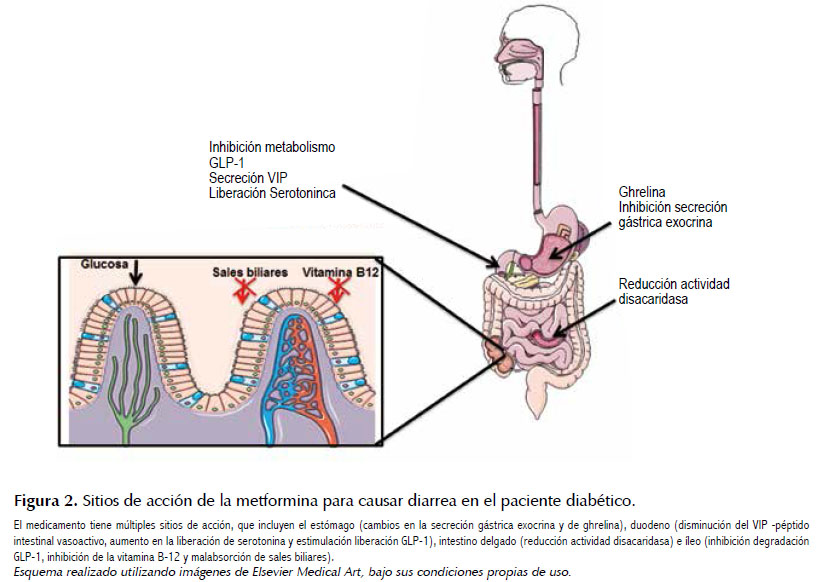
En pacientes con diabetes, así como en cualquier paciente, es importante revisar la lista de medicamentos suministrados al momento de evaluar una potencial causa de diarrea (12). La metformina, biguanida que comúnmente se utiliza para el control glucémico en pacientes con diabetes tipo 2, es el medicamento que más causa diarrea en esta población (3). Aunque la fisiopatología de la diarrea por metformina aún no es muy bien entendida, se ha llegado a establecer que a nivel intestinal interfiere en el balance serotoninérgico y de ácidos biliares, reduce la actividad disacaridasa en el borde en cepillo, modifica la secreción de ghrelina posterior a la carga de glucosa, y estimula la secreción de GLP-1. Figura 2 (14). En un 10-53% de los pacientes puede llevar a diarrea por malabsorción (15) Incluso, puede causar diarrea aun cuando el paciente haya mantenido dosis estables del medicamento por largos períodos de tiempo (10). En un estudio longitudinal a pacientes diabéticos, se llegó a establecer que la metformina presenta OR de 3,08 (IC 95%: 1,29-7,36; p<0,02) para diarrea (16).
Otros de los medicamentos relacionados con diarrea en el paciente diabético, en alrededor del 30% de los casos, son los inhibidores de la -glucosidasa (17). La acarbosa y el miglitol al inhibir la -glucosidasa intestinal, llevan a la prevención del rompimiento de las cadenas de carbohidratos, disminuyéndose la producción y absorción de monosacáridos (18). La probabilidad de presentar diarrea se disminuye con la menor dosis posible al inicio del tratamiento y ajustes según necesidad (19).
Los agonistas del receptor de GLP-1, principalmente exenatide y liraglutide, utilizados en pacientes con diabetes mellitus tipo 2. Se prescribe de modo combinado con metformina y/o sulfonilurea para mejorar el control glicémico. La incidencia de diarrea y otros eventos adversos gastrointestinales es mayor respecto a los inhibidores de la DPP-4. Su mecanismo se explica por la estimulación de la secreción de GLP- 1, junto a los efectos que pueden producir los otros medicamentos con los cuales se suelen prescribir (20). En tres estudios aletorizados de fase III, se reportó diarrea en el 13% de los pacientes que se administró exenatide, mientras en el grupo placebo esto ocurrió en el 6% de los casos (21).
Otro medicamento utilizado por algunos pacientes diabéticos es el orlistat, administrado para disminuir de peso y mejorar perfil lipídico. Actúa inhibiendo las lipasas gástrica y pancreática, el clivaje de triglicéridos, y previene la absorción de la grasa ingerida hasta un 30% (22-24). En un estudio observacional de cohorte de 16,021 pacientes, la diarrea fue el segundo motivo para suspender el tratamiento por 12 semanas, presentándose en el 2,3% de los casos durante el primer mes de inicio del medicamento, y siendo superada solo por la percepción de inefectividad con el 4% de los casos (24).
ENFERMEDAD CELÍACA
La enfermedad celiaca está presente en 3% a 8% de los pacientes con diabetes tipo1, durante el período de tiempo comprendido entre 1951 a 2001 la incidencia de enfermedad celiaca aumentó, en concordancia con el aumento de incidencia de diabetes mellitus tipo 1 (25,26). Sin embargo, la enfermedad celiaca persiste siendo subdiagnosticada, se recomienda el tamizaje para enfermedad celiaca en niños con diabetes tipo 1, ya que constituye una medida costo-efectiva (27). La enfermedad celiaca suele manifestarse después de establecerse la diabetes. En un estudio de cohortes, se realizó tamización a pacientes menores de 20 años con diagnóstico de diabetes tipo 1, y se encontró que un 6% adicional desarrollaban enfermedad celiaca los siguientes 5 años después del tamizaje inicial. Por lo que se afirma que el tamizaje durante el diagnóstico de diabetes tipo 1 y de modo anual por al menos 2 años posterior a este, puede ser una estrategia adecuada, la valoración inicial de anticuerpos anti-endomisio seguida por biopsia de intestino delgado confirmatoria para diagnóstico es adecuada (28).
En cuanto a los mecanismos fisiopatológicos, se establece que la -gliadina, polipeptido que se mantiene sin digerir en intestino delgado, dado el alto contenido de prolina y glutamina del gluten, inicia una respuesta inmune innata y adaptativa que lleva a infiltrados inflamatorios en intestino delgado con destrucción vellosa. El mecanismo causante del defecto epitelial aún no es muy bien entendido, pero se ha propuesto que se asocia a infección (29,30). A nivel de lámina propia, la transglutaminasa tisular, un auto- antígeno celiaco, se liga a la gliadina e intensifica su afinidad por las moléculas HLA DQ2 y DQ8 en células presentadoras de antígeno relacionadas con respuesta inmune humoral y mediadas por células, llevando a una respuesta inmune que acarrea inflamación significativa en intestino delgado, así como en órganos distantes. De modo simultáneo, la activación de linfocitos intraepiteliales inicia una respuesta inmune innata que contribuye a la patología. Finalmente, la destrucción de enterocitos en intestino delgado conllevará a atrofia vellosa con alteración en la absorción de nutrientes, produciendo diarrea por malabsorción (28-30).
El primer paso para evaluar la enfermedad celiaca son las pruebas serológicas, y el diagnóstico definitivo se confirma con biopsias de duodeno en el contexto de exposición al gluten. Actualmente, los anticuerpos Ig A transglutaminasa tisular constituye la prueba serológica de preferencia para enfermedad celiaca, basado en múltiples estudios la especificidad puede ser mayor al 95%, con sensibilidad con valores del 89% al 96% (31,32). Los anticuerpos antiendomisio tienen un perfil similar, pero su realización es de mayor costo (6). Los anticuerpos antigliadina son de valor diagnóstico limitado dado que presentan menor sensibilidad y especificidad (33). Ante la presencia de pruebas serológicas positivas, se recomienda realizar endoscopia de vías digestivas altas con biopsia de bulbo duodenal y duodeno distal para confirmar el diagnóstico (32). Si las pruebas de serología iniciales son negativas pero existe alta sospecha clínica es recomendable realizar endoscopia alta (32,34). La exposición a gluten previo a la toma de muestra mejorará la precisión (34).
El mecanismo que explica el aumento de incidencia de enfermedad celiaca en pacientes con diabetes mellitus tipo 1 aún no está completamente entendido. Se ha sugerido que ambas son condiciones autoinmunes, que comparten genes de susceptibilidad HLA y no-HLA, y que existe la probabilidad en algunas familias de llegar a presentar tanto diabetes como enfermedad celiaca (35,36). En la práctica pediátrica se realiza de rutina tamización para enfermedad celiaca en pacientes asintomáticos con diabetes mellitus tipo 1, aunque sigue siendo tema de controversia, se afirma que a futuro esto podría ayudar a desarrollar nuevos tratamientos para la enfermedad (37).
COLITIS MICROSCÓPICA
La colitis microscópica hace referencia a un grupo de desórdenes inflamatorios del colon, cuyo diagnóstico solo puede obtenerse con la valoración microscópica a partir de biopsias de mucosa colónica (38-40). Alrededor del 30%-50% de los pacientes con colitis microscópica presentan condiciones autoinmunes asociadas. Dentro de ellas, las más comunes son enfermedad celíaca (2%-20%) enfermedad tiroidea (10%-20%), seguidas por otras como artritis reumatoide, síndrome de Sjögren, colitis ulcerativa y enfermedad de Crohn (41). El mecanismo exacto de diarrea en colitis microscópica no es muy claro, dado que se ha demostrado que la diarrea puede ser tanto secretoria como osmótica. El componente secretorio se basa en la disminución de la absorción de sodio y cloro, secundaria a lesión en células epiteliales y engrosamiento de la capa de colágeno,
actuando como barrera de difusión, y causando secreción adicional activa de cloro (42). Por otro lado, el ayuno se ha asociado a reducir los episodios diarreicos, siendo sugestivo de un componente osmótico en algunos pacientes (43). E,l tratamiento de esta entidad incluye loperamida, colestiramina, budesonida, aminosalicilatos, y terapia inmunosupresora. A su vez, budesonida es el tratamiento mejor documentado, asociado a mejoría de los síntomas y de la calidad de vida (44-46). Sin embargo, debe administrarse con precaución en población diabética, dado que puede provocar hiperglicemia (12).
INSUFICIENCIA PANCREÁTICA EXOCRINA (IPE)
Hay varias posibles explicaciones para el desarrollo de IPE en el diabético. Esta se debe a la perdida de los efectos tróficos de la insulina en las células acinares, que incluso pueden presentarse a pesar de la administración subcutánea de insulina. La insulina actúa tanto estimulando el crecimiento de las células acinares, así como en la liberación de amilasa estimulada por la colecistoquinina (CCK) (7). Probablemente, la microangiopatía diabética llevaría a isquemia del páncreas exocrino, con disminución del trofismo de células acinares (47). Sin embargo, la evidencia no permite afirmar el rol de la microangiopatía en diabetes tipo 1 o tipo 2 con la atrofia de páncreas exocrino (48-50). Por otro lado, las porciones exocrinas y endocrinas del páncreas pueden estar comprometidas por destrucción autoinmune. Aquellos con anticuerpos anti- células de islote presentan peor compromiso exocrino (12). La evidencia sugiere que los autoanticuerpos son responsables de la insuficiencia exocrina en pacientes con diabetes. Investigadores en Japón evaluaron el rol de los autoanticuerpos contra los antígenos de la anhidrasa carbónica II (CA II) y la lactoferrina en diabéticos, estos antígenos son el objetivo en la pancreatitis autoinmune. Los autoanticuerpos para CA II y lactoferrina se encontraron en pacientes con diabetes tipo 1, pero no en diabetes tipo 2 (51). La pérdida de la función exocrina podría ser considerada como posible causa de pobre control glicémico, y requerirá entonces ajustes en el manejo con insulina (52). Mientras que se recomienda la terapia enzimática ante niveles de elastasa fecal menores a 100 μg/g (53).
Los pacientes con diabetes mellitus reflejan deficiencia exocrina dada por esteatorrea y elastasa fecal disminuida (51,52). Adicionalmente, la colangiopancreatografía retrograda endoscópica (CPRE) demuestra evidencia de anomalías en conductos pancreáticos (54). La IPE se encuentra de modo predominante en diabéticos tipo 1, mientras que la evidencia de IPE en diabéticos tipo 2 es controversial. La incidencia estimada de IPE en diabetes dependerá entonces de cómo se defina la insuficiencia pancreática. La disminución en concentración de elastasa fecal ha sido reportada en un 26-40% de los pacientes con diabetes tipo 1, y en un 30% de los pacientes con diabetes tipo 2, alcanzando niveles que sugieren disfunción pancreática exocrina severa en un tercio de los casos (definida como niveles de elastasa fecal<100 μg/g) (55-57). En un estudio prospectivo, Nunes et al. encontraron que el 36% de los pacientes con diabetes comparado con 5% del grupo control tenían niveles de elastasa fecal menores a 200 μg/g (p<0,05) (58). Otro estudio en el que se tuvo en cuenta más de 1000 pacientes diabéticos, confirmó un aumento en la incidencia de disminución de elastasa fecal. En pacientes con diabetes tipo 1 y tipo 2, la concentración de elastasa fecal era normal (>200 μg/g) en el 59,3% de los casos, y muy baja (<100 μg/g) en el 22,9% de los casos (59).
FACTORES DIETARIOS
Dentro de los principales factores dietarios en el paciente diabético se encuentran los edulcorantes libres de azúcar o artificiales. Los pacientes diabéticos al tratar de controlar el peso y reducir calorías ingieren gran cantidad de edulcorantes libres de azúcar, algunos de ellos como el manitol, sorbitol y xilitol, que pueden causar diarrea osmótica (12). Dentro de estos el más conocido es el sorbitol. El sorbitol es un hexa-hidroxi alcohol, isómero del manitol, que en la mayoría de casos es malabsorbido, causando diarrea que puede estar asociada a síntomas adicionales, como bloating, calambres o pérdida de peso (60). La frecuencia de malabsorción del sorbitol es directamente proporcional a la cantidad ingerida. En un estudio con pacientes sanos, utilizando las pruebas respiratorias de hidrogeno, se observó malabsorción de sorbitol en el 90% de los casos en que los pacientes ingirieron 10 g de sorbitol, y en el 100% de los casos en que la cantidad ingerida fue 20 g, al igual que se observó diarrea o síntomas adicionales en el 40% de los casos de los pacientes que ingirieron 10 g de sorbitol (61).
Por otro lado, se debe mencionar que se han encontrado efectos anti-diarreicos con los esteviosidos y derivados, procedentes de la planta Steviarebaudiana, original de Paraguay (62). Se ha observado que estos inhiben el regulador transmembrana de la fibrosis quística (CFTR – Cystic fibrosis transmembraneregulator) de modo reversible, actuando a nivel de riñones, páncreas e intestino, sin afectar la secreción de ión cloruro activada por calcio, reduciendo la secreción luminal de ión cloruro, con disminución de la osmolaridad intestinal, y posterior mejoría de diarrea (63).
DISFUNCIÓN ANORRECTAL E INCONTINENCIA FECAL
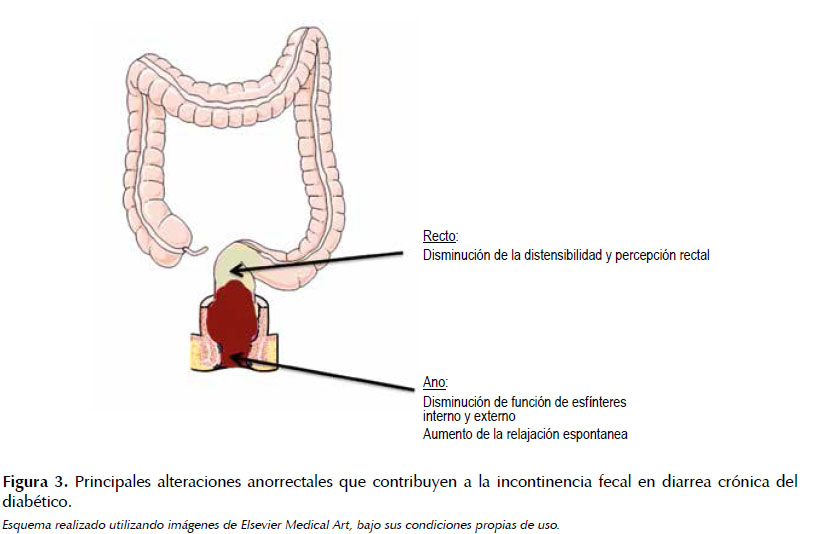
La neuropatía diabética puede llevar a incontinencia fecal, así como causar diarrea. Se estima que la incidencia en la población general es de alrededor del 1%, aunque aumenta con la edad (64). Si bien existen múltiples mecanismos para mantener la continencia fecal, también se requiere de la participación de diversas noxas para alterarla. La incontinencia fecal puede ser primaria, causada por disfunción anorrectal, o secundaria, como resultado de la diarrea. Al momento de evaluar la etiología de la diarrea se debe tener en cuenta realizar coprocultivos, y la inspección endoscópica de la mucosa colónica en búsqueda de inflamación o alteraciones estructurales relacionadas (65). El diagnóstico definitivo de disfunción anorrectal se establece con la manometría anorrectal. Los pacientes diabéticos con incontinencia fecal presentan tono de reposo anormal en esfínter anal interno, responsable de mantener la continencia. La sensación de distensión rectal puede estar disminuida, alterando el reflejo anorrectal, llevando a relajación del esfínter anal interno (66). Además, estudios han demostrado que la hiperglicemia aguda por si sola altera el tono del esfínter anal interno y distensibilidad rectal, contribuyendo a déficits ulteriores (13). Y a partir de esto se puede afirmar que control glicémico se asocia a mejoría de la incontinencia fecal. Medicamentos antidiarreicos como la loperamida, el difenoxilato atropina y la colestiramina se asocian a mejoría de la continencia y manejo de síntomas modestos (6).
Con la terapia de biofeedback se busca que los movimientos de los músculos anorrectales sean realizados de modo más consciente y controlado (6,67) En un estudio en el que se evaluó el sensorio anorrectal y la función motora de pacientes diabéticos con incontinencia fecal, en pacientes diabéticos continentes, pacientes no-diabéticos incontinentes, y pacientes no-diabéticos con incontinencia fecal, los investigadores encontraron que los pacientes diabéticos con incontinencia fecal requirieron de un volumen significativamente mayor para percibir sensación rectal respecto a los otros grupos. El biofeedback fue efectivo en disminuir el manchado fecal y mejorarla continencia (67).
A partir del modelo de la diabetes inducida por estreptozotocina en ratones se ha logrado aclarar acerca de los mecanismos para disfunción ano-rectal. En un estudio en el cual se aplicó este modelo se observó disminución de las presiones del esfínter anal a menos de la mitad de la presión control a los 60 días después de la inducción. A los ratones diabéticos se les administró entonces antagonistas de la óxido-nítrico sintetasa por enema, lo que llevó a que presentaran aumentos significativos de las presiones en el esfínter. Estos hallazgos sugieren que el óxido nítrico está relacionado en la disminución de las presiones del esfínter anal en ratones con diabetes (68). También se ha reportado incontinencia fecal en pacientes diabéticos que toman metformina, presentando OR de 1,95 (IC95%: 1,10-3,47; p<0,05) comparado con pacientes diabéticos que no toman metformina (16). Figura 3.
ENTEROPATÍA DIABÉTICA Y SOBRE CRECIMIENTO BACTERIANO INTESTINAL
El mecanismo de degeneración de neuronas entéricas en diabetes mellitus aún no está claro, de modo convencional se mencionan dos mecanismos principalmente implicados. El primer mecanismo hace referencia a alteración en la regulación adrenérgica del transporte de fluidos y electrolitos secundario a disminución en estímulos aferentes 2- adrenergicos, mientras que el segundo mecanismo hace referencia a enlentecimiento en tránsito intestinal con sobrecrecimiento bacteriano subsecuente (11). En cuanto a su etiología, esta es multifactorial, implica procesos reversibles e irreversibles. La alteración en la glicemia perturba de modo reversible el metabolismo y señalización de las neuronas entéricas, de manera que revierten al obtener adecuado control glicémico (12). Otro de los procesos relacionados es el compromiso de musculo liso en neuropatía entérica. Un factor potencialmente importante son las células intersticiales de Cajal, estas actúan como marcapasos, regulando la motilidad intestinal y participando en la neurotransmisión en el tracto gastro-intestinal (4). La pérdida de las células intersticiales de Cajal puede ser causada por la reducción de niveles de factores tróficos como factores estimulantes de células madre (stem- cell factor), normalmente producidos en células de musculo liso a nivel intestinal (69). La disminución en la producción de los factores estimulantes de células madre (stem-cell factor) ocurre con las alteraciones en la señalización de la insulina y del IGF-1(insulin- likegrowth factor 1), llevando a atrofia de musculo liso intestinal (70).
Otras etiologías potencialmente relacionadas son la hipoxia e isquemia producto de la enfermedad microvascular en tracto gastrointestinal, la disfunción mitocondrial, la formación avanzada e irreversible de productos finales de glicosilación, el daño mediado por especias reactivas de oxígeno a endotelio y neuronas entéricas (71).
De modo colectivo, la perdida de las células intersticiales de Cajal, la neuropatía autonómica, y el desbalance en células inhibitorias y excitatorias en neuronas entéricas, alteran funciones motoras como el peristaltismo, la relajación reflexiva, el tono esfinteriano, flujo vascular y segmentación intestinal (72).
Dadas estas complicaciones, ocurren cambios significativos en función intestinal, conduciendo a sobrecrecimiento bacteriano, caracterizado por alteración en el tipo y la cantidad de bacterias en el intestino delgado, los cambios significativos en la microbiota también pueden llevar a otros síntomas como bloating, dolor abdominal y flatulencia, e incluso a deficiencia nutricional (6). El cultivo de aspirado yeyunal es el goldstandard para el diagnóstico, definiendo la enfermedad con valores mayores a 100 000 unidades formadoras de colonias en intestino delgado, comparado con el valor normal de menos de 10 000 unidades formadoras de colonia, sin embargo los costos que implican hacen que no sea de práctica rutinaria (73). Actualmente, las pruebas respiratorias de hidrogeno se utilizan para el diagnóstico, no obstante presentan problemas en precisión diagnóstica (74). La prueba respiratoria de glucosa-hidrogeno presenta sensibilidad reportada del 27% al 93%, y especificidad del 30% al 86%, mientras que la prueba respiratoria de lactulosa se ha reportado sensibilidad del 17% al 89%, y especificidad del 44% al 100% (74-76). Estas pruebas pueden presentar falsos positivos por malabsorción de carbohidratos e inadecuada adherencia del paciente a dieta baja en fibra (76). Mientras que el tratamiento antibiótico reciente y la escasez de bacterias productoras de H2 pueden dar resultados falsos negativos (77). Se debe aclarar que el factor que más afecta la precisión diagnóstica de las pruebas respiratorias es la variabilidad del tránsito intestinal (74,75). El tránsito intestinal rápido es la anormalidad más común en pacientes diabéticos con diarrea, implicando un enfoque terapéutico distinto al sobrecrecimiento bacteriano (78).
MANEJO DE LA DIARREA EN EL DIABÉTICO
La piedra angular del tratamiento de la diarrea en el diabético es lograr un control glicémico adecuado (79). La identificación de la etiología específica de diarrea en el diabético provee una oportunidad para iniciar una terapia efectiva teniendo en cuenta las comorbilidades. Es importante conocer los medicamentos o factores dietarios que exacerben el cuadro de diarrea, dado que su suspensión se asocia a mejoría de los síntomas (5-8,79). Aquellos casos de enteropatía diabética con sobrecrecimiento bacteriano se benefician de tratamiento antibiótico. La rifaximina, agente antimicrobiano que se concentra en tracto gastrointestinal, tiene un amplio espectro contra gérmenes gram-positivos, aerobios gram-negativos y anaerobios, con bajo riesgo de inducir resistencia bacteriana (80,81). Se ha demostrado erradicación del sobrecrecimiento bacteriano en alrededor del 84% de los casos (82). Otros antibióticos utilizados para tratar la diarrea en el diabético incluyen amoxicilina- clavulonato, doxiciclina, ciprofloxacina, metronidazol, neomicina y norfloxacina (79). La terapia con loperamida, difenoxilato atropina y sulfato de codeína, así como suplementación con fibra, son agentes antidiarreicos estándar que se pueden tener en cuenta como tratamiento inicial empírico. Ocasionalmente se puede requerir de opiáceos más potentes. En pacientes no respondedores, la clonidina, un agonista 2-adrenergico, puede proporcionar estímulos adrenérgicos para facilitar el tránsito intestinal y la absorción de electrolitos a nivel intestinal, sin embargo, debe ser utilizada con precaución dado su potencial para hipotensión (83). El octeotrido, un análogo de larga acción de la somatostatina, es otra opción para el paciente diabético con dificultad para controlar la diarrea, no obstante, puede enlentecer la motilidad a nivel intestinal y aumentar el riesgo de sobrecrecimiento bacteriano (84). También, cabe mencionar que el octeotrido es inhibidor del glucagón y la insulina, lo que hace que el paciente con diabetes tenga riesgo de hiperglicemia e hipoglicemia al mismo tiempo (85).
Conclusiones
La asociación de diarrea con diabetes mellitus se conoce desde hace mucho tiempo, es una de las complicaciones gastrointestinales más comunes de la diabetes, en su fisiopatología puede verse involucrado cualquier órgano del tracto gastrointestinal, y afecta de modo directo la calidad de vida del paciente. A pesar de los avances recientes en el conocimiento de su fisiopatología, en algunas entidades sus mecanismos fisiopatológicos no son aún claros.
El diagnóstico de la diarrea crónica en el diabético sigue siendo de exclusión, se requiere de una historia clínica exhaustiva y pruebas diagnósticas complementarias. Al momento de abordarla, se debe tener en cuenta especialmente a aquellos pacientes con diagnóstico de diabetes ya conocido de larga data (mayor a 8 años), y que presenten compromiso neuro-sensitivo asociado, dados por neuropatía autonómica y periférica.
Existen ciertos diagnósticos de mayor prevalencia en pacientes diabéticos en comparación a la población general, y que al momento de estudiarla se deben tener en cuenta en primera instancia como posibles causas de diarrea. Sin embargo, no se deben olvidar las causas que pueden afectar a la población en general, ya que también pueden estar presentes, algunas de ellas como infección, intolerancia a la lactosa y enfermedad inflamatoria intestinal.
Se puede afirmar que la hiperglicemia es el principal factor contribuyente en su etiopatogenia, y lograr control glicémico adecuado seguirá siendo la piedra angular en su manejo, tanto de la diarrea como de la diabetes.
BIBLIOGRAFÍA
1. Bargen JA, Bollman JL, Kepler EJ. The "diarrhea of diabetes" and steatorrhea of pancreatic insufficiency. Mayo Clin Proc. 1936;11:737-42. [ Links ]
2. Feldman M, Schiller LR. Disorders of gastrointestinal motility associated with diabetes mellitus. Ann Int Med. 1983;98(3):378-84. [ Links ]
3. Lysy J, Israeli E, Goldin E. The prevalence of chronic diarrhea among diabetic patients. Am J Gastroenterol. 1999;94(8):2165-70. [ Links ]
4. Yarandi SS, Srinivasan S. Diabetic gastrointestinal motility disorders and the role of enteric nervous system: current status and future directions. Neurogastroenterol Motil. 2014;26(5):611-24. [ Links ]
5. Bytzer P, Talley NJ, Leemon M, Young LJ, Jones MP, Horowitz M. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15,000 adults. Arch Intern Med. 2001;161(16):1989-96. [ Links ]
6. Boland BS, Edelman SV, Wolosin JD. Gastrointestinal complications of diabetes. Endocrinol Metab Clin North Am. 2013;42(4):809-32. [ Links ]
7. Ebert EC. Gastrointestinal complications of diabetes mellitus. Dis Mon. 2005;51(12):620-63. [ Links ]
8. Vinik A, ErbasT. Recognizing and treating diabetic autonomic neuropathy. Cleve Clin J Med. 2001;68(11):928-30, 932, 934-44. [ Links ]
9. Miller LJ. Small intestinal manifestations of diabetes mellitus. Yale J Biol Med. 1983;56(3):189-93. [ Links ]
10. Foss MT, Clement KD.Metformin as a cause of late-onset chronic diarrhea. Pharmacotherapy. 2001;21(11):1422-4. [ Links ]
11. Sellin JH, Chang EB. Therapy insight: gastrointestinal complications of diabetes—pathophysiology and management. Nat Clin Pract Gastroenterol Hepatol. 2008;5(3):162-71. [ Links ]
12. Gould M, Sellin JH. Diabetic diarrhea. Curr Gastroenterol Rep. 2009;11(5):354-9. [ Links ]
13. Russo A, Botten R, Kong MF, Chapman IM, Fraser RJ, Horowitz M, et al. Effects of acute hyperglycaemia on anorectal motor and sensory function in diabetes mellitus. Diabet Med. 2004;21(2):176-82. [ Links ]
14. Bouchoucha M, Uzzan B, Cohen R. Metformin and digestive disorders. Diabetes Metab. 2011;37(2):90-6. [ Links ]
15. Berchtold P, Dahlqvist A, Gustafson A, Asp NG. Effects of a biguanide (Metformin) on vitamin B12 and folic acid absorption and intestinal enzyme activities. Scand J Gastroenterol. 1971;6(8):751-4. [ Links ]
16. Bytzer P, Talley NJ, Jones MP, Horowitz M. Oralhypoglycaemic drugs and gastrointestinal symptoms in diabetes mellitus. Aliment Pharmacol Ther. 2001;15(1):137-42. [ Links ]
17. Kumar RV, Sinha VR. Newer insights into the drug delivery approaches of α-glucosidase inhibitors. Expert Opin Drug Deliv. 2012;9(4):403-16.
18. Ratnaike RN, Jones TE. Mechanisms of drug-induced diarrhoea in the elderly. Drugs Aging. 1998;13(3):245-53. [ Links ]
19. Aoki K, Muraoka T, Ito Y, Togashi Y, Terauchi Y. Comparison of adverse gastrointestinal effects of acarbose and miglitol in healthy men: a crossover study. Intern Med. 2010;49(12):1085-7. [ Links ]
20. Karagiannis T, Paschos P, Paletas K, Matthews DR, Tsapas A. Dipeptidyl peptidase-4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting: systematic review and meta-analysis. BMJ. 2012;344:e1369. doi: 10.1136/bmj. e1369. [ Links ]
21. Iltz JL, Baker DE, Setter SM, Keith Campbell R.Exenatide: an incretin mimetic for the treatment of type 2 diabetes mellitus. Clin Ther. 2006;28(5):652-65. [ Links ]
22. Jacob S, Rabbia M, Meier MK, Hauptman J. Orlistat 120 mg improves glycaemic control in type 2 diabetic patients with or without concurrent weight loss. Diabetes Obes Metab. 2009;11(4):361-71. [ Links ]
23. Drent ML, van der Veen EA. Lipase inhibition: a novel concept in the treatment of obesity. Int J Obes Relat Metab Disord. 1993;17(4):241-4. [ Links ]
24. Acarya NV, Wilton LV, ShakirSA. Safety profile of orlistat: results of a prescription-event monitoring study. Int J Obes(Lond). 2006;30(11):1645-52. [ Links ]
25. Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, DragoS, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med. 2003;163(3):286-92. [ Links ]
26. Ludvigsson JF, Rubio-Tapia A, van Dyke CT, Melton LJ 3rd, Zinsmeister AR, Lahr BD, etal. Increasing incidence of celiac disease in a North American population. Am J Gastroenterol. 2013;108(5):818-24. [ Links ]
27. Dretzke J, Cummins C, Sandercock J, Fry-Smith A, Barrett T, Burls A.Autoantibody testing in children with newly diagnosed type 1 diabetes mellitus. Health Technol Assess. 2004;8(22):iii–xi, 1-183. [ Links ]
28. Larsson K, Carlsson A, CederwallE,Jönsson B, Neiderud J, JonssonB, et al. Annual screening detects celiac disease in children with type 1 diabetes. Pediatr Diabetes. 2008;9(4 Pt 2):354-9. [ Links ]
29. Green PH, Cellier C. Celiac disease. N Engl J Med. 2007;357(17):1731-43. [ Links ]
30. Kagnoff MF. Celiac disease: pathogenesis of a model immunogenetic disease. J Clin Invest. 2007;117(1):41-9. [ Links ]
31. van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE. Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review. JAMA. 2010;303(17):1738-46. [ Links ]
32. Rostom A, Murray JA, Kagnoff MF. American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease. Gastroenterology. 2006;131(6):1981-2002. [ Links ]
33. Hvas CL, Jensen MD, Reimer MC, Riis LB, Rumessen JJ, Skovbjerg H, et al. Celiac disease: diagnosis and treatment. Dan Med J. 2015;61(4):C5051. [ Links ]
34. Rostom A, Dube C, Cranney A, Saloojee N, Sy R, Garritty C, et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology. 2005;128(4 Suppl 1):S38-46. [ Links ]
35. Smyth DJ, Plagnot V, Walker NM, Cooper JD, Downes K, Yang JH, et al. Shared and distinct genetic variants in type 1 diabetes and celiac disease. N Engl J Med. 2008;359(26):2767-77. [ Links ]
36. Sud S, Marcon M, Assor E, Palmert MR, Daneman D, Mahmud FH. Celiac disease and pediatric type 1 diabetes: diagnostic and treatment dilemmas. Int J Pediatr Endocrinol. 2010;2010:161285.doi: 10.1155/2010/161285. [ Links ]
37. Plenge RM .Shared genetic risk factors for type 1 diabetes and celiac disease. N Engl J Med. 2008;359(26):2837-8. [ Links ]
38. Nyhlin N, Bohr J, Eriksson S, Tysk C. Systematic review: microscopic colitis. Aliment Pharmacol Ther. 2006;23(11):1525-34. [ Links ]
39. Pardi DS, Kelly CP. Microscopic colitis. Gastroenterology. 2011;140(4):1155-65. [ Links ]
40. Münch A, Aust D, Bohr J, Bonderup O, Fernández Bañares F, Hjortswang H, et al. Microscopic colitis: current status, present and future challenges: statements of the European Microscopic Colitis Group. J Crohns Colitis. 2012;6(9):932-45. [ Links ]
41. Vigren L, Tysk C, Ström M, Kilander AF, Hjortswang H, Bohr J, et al. Celiac disease and other autoimmune diseases in patients with collagenous colitis. Scand J Gastroenterol. 2013;48(8):944-50. [ Links ]
42. Bürgel N, Bojarski C, Mankertz J, Zeitz M, Fromm M, Schulzke JD. Mechanisms of diarrhea in collagenous colitis. Gastroenterology. 2002;123(2):433-43. [ Links ]
43. Bohr J, Järnerot G, Tysk C, Jones I, Eriksson S. Effect of fasting on diarrhoea in collagenous colitis. Digestion. 2002;65(1):30-4. [ Links ]
44. Tysk C, Bohr J, Nyhlin N, Wickbom A, Eriksson S. Diagnosis and management of microscopic colitis. World J Gastroenterol. 2008;14(48):7280-8. [ Links ]
45. Miehlke S, Heymer P, Bethke B, Bästlein E, Meier E, Bartram HP, et al .Budesonide treatment for collagenous colitis: a randomized, double-blind, placebo-controlled, multicenter trial. Gastroenterology. 2002;123(4):978-84. [ Links ]
46. Chande N, McDonald JW, Macdonald JK. Interventions for treating lymphocytic colitis. Cochrane Database SystRev. 2008;(2):CD006096. doi: 10.1002/14651858.CD006096.pub3. [ Links ]
47. Terzin V, Varkonyi T, Szabolcs A, Lengyel C, Takács T, Zsóri G, et al. Prevalence of exocrine pancreatic insufficiency in type 2 diabetes mellitus with poor glicemic control. Pancreatology. 2014;14(5):356-60. [ Links ]
48. Mossner J, Logsdon CD, Williams JA, Goldfine ID. Insulin, via its own receptor, regulates growth and amylase synthesis in pancreatic acinar AR42J cells. Diabetes. 1985;34(9):891-7. [ Links ]
49. Czako L, Hegyi P, Rakonczay JZ, Wittmann T, Otsuki M. Interactions between the endocrine and exocrine pancreas and their clinical relevance. Pancreatology. 2009;9(4):351-9. [ Links ]
50. Pollak OJ. Human pancreatic atherosclerosis. Ann N Y Acad Sci. 1968;149(2):928-39. [ Links ]
51. Hardt PD, Ewald N, Bröckling K, Tanaka S, Endo T, Kloer HU, etal.Distinct autoantibodies against exocrine pancreatic antigens in European patients with type 1 diabetes mellitus and nonalcoholic chronic pancreatitis. JOP. 2008;9(6):683-9. [ Links ]
52. Hardt PD, Hauenschild A, Jaeger C, Teichmann J, Bretzel RG, Kloer H, et al. High prevalence of steatorrhea in 101 diabetic patients likely to suffer from exocrine pancreatic insufficiency according to low fecal elastase 1 concentrations: a prospective multicenter study. Dig Dis Sci. 2003;48(9):1688-92. [ Links ]
53. Pezzili R, Andriulli A, Bassi C, Balzano G, Cantore M, Delle Fave G, et al. Exocrine pancreatic insufficiency in adults: A shared position statement of the Italian Association for the Study of the pancreas. World J Gastroenterol. 2013;19(44):7930-46. [ Links ]
54. Nakanishi K, Kobayashi T, Miyashita H, Okubo M, Sugimoto T, Murase T, et al. Exocrine pancreatic ductograms in insulin-dependent diabetes mellitus. Am J Gastroenterol. 1994;89(5):762-6. [ Links ]
55. Hardt PD, Brendel MD, Kloer HU, Bretzel RG. Is pancreatic diabetes (type 3c diabetes) underdiagnosed and misdiagnosed? Diabetes Care. 2008;31(Suppl 2): S165-9. [ Links ]
56. Andren-Sandberg A, Hardt PD. Second Giessen International Workshop on Interactions of Exocrine and Endocrine Pancreatic Diseases. Castle of Rauischholzhausen of the Justus-Liebig-university, Giessen (Rauischholzhausen), Germany. March 7–8, 2008. JOP. 2008;9(4):541-75. [ Links ]
57. Keller J, Aghdassi AA, Lerch MM, Mayerle JV, Layer P. Tests of pancreatic function – clinical significance in pancreatic and non-pancreatic disorders. Best Pract Res Clin Gastroenterol. 2009;23(3):425-39. [ Links ]
58. Nunes ACR, Pontes JM, Rosa A, Gomes L, Carvalheiro M, Freitas D. Screening for pancreatic exocrine insufficiency in patients with diabetes mellitus. Am J Gastroenterol. 2003;98(12):2672-5. [ Links ]
59. Hardt PD, Hauenschild A, Nalop J, Marzeion AM, Jaeger C, Teichmann J, et al.High prevalence of exocrine pancreatic insufficiency in diabetes mellitus. A multicenter study screening fecal elastase 1 concentrations in 1,021 diabetic patients. Pancreatology. 2003;3(5):395-402. [ Links ]
60. Bauditz J, Norman K, Biering H, Lochs H, Pirlich M. Severe weight loss caused by chewing gum. BMJ. 2008;336(7635):96-7. [ Links ]
61. Corazza GR, Strocchi A, Rossi R, Sirola D, Gasbarrini G. Sorbitolmalabsorption in normal volunteers and in patients with coeliac disease. Gut. 1988;29(1):44-8. [ Links ]
62. Tandel KR. Sugar substitutes: Health controversy over perceived benefits. J Pharmacol Pharmacother. 2011;2(4):236-43. [ Links ]
63. Pariwat P, Homvisasevongsa S, Muanprasat C, Chatsudthipong V. A natural plant-derived dihydroisosteviol prevents cholera toxin-induced intestinal fluid secretion. J Pharmacol Exp Ther. 2008;324(2):798-805. [ Links ]
64. Parlesak A, Klein B, Schecher K, Bode JC, Bode C. Prevalence of small bowel bacterial overgrowth and its association with nutrition intake in nonhospitalized older adults. J Am Geriatr Soc. 2003;51(6):768-73. [ Links ]
65. Rao SS. Diagnosis and management of fecal incontinence. American College of Gastroenterology Practice Parameters Committee. Am J Gastroenterol. 2004;99(8):1585-604. [ Links ]
66. Schiller LR, Santa Ana CA, Schmulen AC, Hendler RS, Harford WV, Fordtran JS. Pathogenesis of fecal incontinence in diabetes mellitus: evidence for internal-anal-sphincter dysfunction. N Engl J Med. 1982;307(27):1666-71. [ Links ]
67. Wald A, Tunuguntla AK. Anorectal sensorimotor dysfunction in fecal incontinence and diabetes mellitus. Modification with biofeedback therapy. N Engl J Med. 1984;310(20):1282-7. [ Links ]
68. Fillmann HS, Llessuy S, Marroni CA, Llessuy S. Diabetes mellitus and anal sphincter pressures: an experimental model in rats. Dis Colon Rectum. 2007;50(4):517-22. [ Links ]
69. Horvath VJ, Vittal H, Leorincz A, Chen H, Almeida-Porada G, Redelman D, et al. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130(3):759-70. [ Links ]
70. Horvath VJ, Vittal H, Ordog T. Reduced insulin and IGF-I signaling, not hyperglycemia, underlies the diabetes- associated depletion of interstitial cells of Cajal in the murine stomach. Diabetes. 2005;54(5):1528-33. [ Links ]
71. Bodi N, Talapka P, Poles MZ, Hermesz E, Jancso Z, Katarova Z, et al. Gut regionspecific diabetic damage to the capillary endothelium adjacent to the myenteric plexus. Microcirculation. 2012;19(4):316-26. [ Links ]
72. Sanders KM, Koh SD, Ro S, Ward SM. Regulation of gastrointestinal motility–insights from smooth muscle biology. Nat Rev Gastroenterol Hepatol. 2012;9(11):633-45. [ Links ]
73. Bures J, Cyrany J, Kohoutova D, Förstl M, Rejchrt S, Kvetina J, et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol. 2010;16(24):2978-90. [ Links ]
74. Kerlin P, Wong L.Breath hydrogen testing in bacterial overgrowth of the small intestine. Gastroenterology. 1988;95(4):982-8. [ Links ]
75. MacMahon M, Gibbons N, Mullins E, O'Moore RR, Keane CT, Walsh JB, et al.Arehydrogen breath tests valid in the elderly? Gerontology. 1996;42(1):40-5. [ Links ]
76. Stotzer PO, Kilander AF. Comparison of the 1-gram (14)C-D- xylose breath test and the 50-gram hydrogen glucose breath test for diagnosis of small intestinal bacterial overgrowth. Digestion. 2000;61(3):165-71. [ Links ]
77. Riordan SM, McIver CJ, Walker BM, Duncombe VM, Bolin TD, Thomas MC. The lactulose breath hydrogen test and small intestinal bacterial overgrowth. Am J Gastroenterol. 1996;91(9):1795-1803. [ Links ]
78. Sellin JH, Hart R. Glucosemalabsorption associated with rapid intestinal transit. Am J Gastroenterol. 1992;87(5):584-9. [ Links ]
79. Krishnan B, Babu S, Walker J, Walker AB, Pappachan M. Gastrointestinal complications of diabetes mellitus. World J Diabetes. 2013;4(3):51-63. [ Links ]
80. Jiang ZD, DuPont HL. Rifaximin: in vitro and in vivo antibacterial activity--a review. Chemotherapy. 2005;51Suppl 1:67-72 . [ Links ]
81. Gerard L, Garey KW, DuPont HL. Rifaximin: a nonabsorbablerifamycin antibiotic for use in nonsystemic gastrointestinal infections. Expert Rev Anti Infect Ther. 2005;3(2):201-11. [ Links ]
82. Pimentel M. Review of rifaximin as treatment for SIBO and IBS. Expert Opin Investig Drugs. 2009;18(3):349-58. [ Links ]
83. Fedorak RN, Field M, Chang EB. Treatment of diabetic diarrhea with clonidine. Ann Intern Med. 1985;102(2):197-9. [ Links ]
84. Mourad FH, Gorard D, Thillainayagam AV, Colin-Jones D, Farthing MJ. Effective treatment of diabetic diarrhoea with somatostatin analogue, octreotide. Gut. 1992;33(11)1578-80. [ Links ]
85. Meyer C, O’Neal DN, Connell W, Alford F, Ward G, Jenkins AJ.Octreotide treatment of severe diabetic diarrhoea. Intern Med J. 2003;33(12)617-8.
Correspondencia:
Juan Sebastián Frías Ordoñez
Calle 96 No. 46 – 58, Torre 1, apartamento 617, Bogotá D.C – Colombia
E-mail: jsfriaso@unal.edu.co
Recibido: 07-11-2015
Aprobado: 26-05-2016