Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.1 Lima ene./mar. 2017
ARTÍCULOS ORIGINALES
Validación del test rápido de la ureasa para la detección del Helicobacter pylori en el Hospital Nacional Cayetano Heredia, Lima, Perú
Validation of the rapid urease test for the detection of Helicobacter pylori in a Peruvian hospital
Vladimir Espinoza Ildefonso1a, Harold Tabori Peinado1a, Claudia Meza Borja3b, Alejandra Bussalleu Cavero3c, Luis Vásquez Elera6,7d, Víctor Aguilar Sánchez4d, José Luis Pinto Valdivia4d,1f, Jaime Cok5e,1h, Alejandro Bussalleu Rivera4d,1f
1 Facultad de Medicina Alber to Hur tado, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Facultad de Enfermería, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Facultad de Ciencias y Filosofía Alber to Cazorla Talleri, Universidad Peruana Cayetano Heredia. Lima, Perú.
4 Servicio de Gastroenterología, Hospital Cayetano Heredia. Lima, Perú.
5 Servicio de Patología, Hospital Cayetano Heredia. Lima, Perú.
6 Clínica Internacional San Miguel, Piura, Perú.
7 Clínica AUNA Miraflores, Piura, Perú
a Médico cirujano; b Licenciada en Enfermería; c Bachiller en Biología;
d Médico Gastroenterólogo; e Médico Patólogo; f Docente
RESUMEN
Objetivos: Validar un test rápido de la ureasa (TRU) en el Hospital Cayetano Heredia (HCH) de Lima, Perú Materiales y métodos: Estudio observacional prospectivo. Se incluyó 181 pacientes mayores de 18 años de edad con síntomas dispépticos, que fueron sometidos a endoscopía digestiva alta en el Servicio de Gastroenterología del HCH y que no hubiesen recibido durante las últimas cuatro semanas inhibidores de la bomba de protones (IBPs), bismuto o antibióticos. Se tomó dos biopsias de antro una para hacer el TRU (Sensibacter pylori test®) y otra para anatomía patológica con el fin de determinar la presencia de la infección por H. pylori por ambos métodos. Finalmente se comparó el resultado de la anatomía patológica (patrón de oro) con el de TRU. Resultados: Se evaluó 181 pacientes, la edad promedio fue 52,8±13,5 años. La sensibilidad, especificidad, valor predictivo negativo (VPN), valor predictivo positivo (VPP) a los 20 minutos fueron de 86,8%, 98,5%, 81,5% y 99% y a las 24 horas 97,3%, 99,5%, 95,7% y 99,1% respectivamente. Conclusión: El TRU es un test confiable, accesible y de fácil aplicación para hacer el diagnóstico de la infección por H. pylori.
Palabras clave: Validez de los tests; Ureasa; Helicobacter pylori; Dispepsia (fuente: DeCS BIREME).
ABSTRACT
Objective: To validate a rapid urease test (RUT) in Cayetano Heredia Hospital (HCH) in Lima, Peru. Materials and methods: This is a prospective observational study that included 181 patients over 18 years old with dyspeptic symptoms. All of them underwent upper gastrointestinal endoscopy at the Department of Gastroenterology at HCH. They had not received, during the last four weeks, proton pump inhibitors (PPIs), bismuth or antibiotics. Two biopsies of antrum were taken, one to perform the TRU (Sensibacter pylori test®) and the other one for pathology, in order to determine by both methods the presence of H. pylori infection. TRU’s results were compared with pathology´s (gold standard). Results: 181 patients, average age 52.8±13.5 years, were evaluated. The sensitivity, specificity, negative predictive value (NPV), positive predictive value (PPV) at 20 minutes were 86.8%, 98.5%, 81.5% and 99% and at 24 hours 97.3%, 99.5%, 95.7% y 99.1% respectively. Conclusion: The rapid urease test is a reliable, accessible and easy to apply test for the diagnosis of H. pylori infection.
Keywords: Validity of tests; Urease; Helicobacter pylori; Dyspepsia (source: MeSH NLM).
INTRODUCCIÓN
Helicobacter pylori (H. pylori) es una bacteria espirilada, gram negativa, microaerofílica que suele infectar la mucosa del estómago y le produce una serie de cambios que predisponen al desarrollo de úlceras gastroduodenales, gastritis crónica activa y cáncer gástrico (1-5). Es bien conocido que la infección por esta bacteria produce una serie de acontecimientos en la mucosa gástrica denominada como la "cascada de Pelayo Correa" (5,6). La infección produce un proceso inflamatorio que en un principio es superficial, posteriormente se hace profunda con la presencia de células linfomononucleares y polimorfonucleares, esta última también denominada "actividad" dando lugar a lo que se denomina gastritis crónica activa. Esta con el tiempo y probablemente condicionado por una serie de factores propios de la bacteria, del huésped y ambientales genera cambios, que pueden ir muy rápido en algunos casos o lentamente en otros, que llevan a atrofia y metaplasia intestinal, consideradas estas dos como condiciones premalignas, que a su vez producen displasia y eventualmente neoplasia (6-9). Por otro lado, la infección por H. pylori produce también, por mecanismos mediados por secreción de ácido gástrico y gastrina, úlcera duodenal y gástrica (10-12).
Los estudios realizados en Perú y Latinoamérica demuestran que la infección ocurre a temprana edad y está relacionado a ciertos factores como tener viviendas con piso de tierra, falta de agua potable y hacinamiento, siendo todo esto propio de una condición socioeconómica baja (13). Esta relación entre infección y estrato socioeconómico fue estudiada por Ramírez Ramos et al. en la población peruana, donde la prevalencia en los estratos socioeconómicos bajos no ha cambiado y continúa siendo alta, ocurriendo lo contrario en los estratos socioeconómico medio y alto (14,15). Según el último estudio realizado por Prochazka y col. encontraron una prevalencia de 38,54% en pacientes dispépticos de nivel socio económico medio y alto, siendo la más baja encontrada en el país hasta el momento (16).
Existen diversos métodos diagnósticos que se pueden agrupar en dos tipos: los invasivos, que requieren una endoscopia, como el estudio histopatológico, el test rápido de ureasa (TRU), el cultivo y la reacción en cadena de polimerasa; y los no invasivos como el test del aliento, serología y antígenos en heces (2,17).
Entre las pruebas de mayor especificidad y sensibilidad destaca el TRU que además es de bajo costo y de fácil aplicación. El TRU necesita de una biopsia de mucosa gástrica y basándose en el hecho de que la bacteria H. pylori produce grandes cantidades de la enzima ureasa que hidroliza la urea convirtiéndola en dióxido de carbono y amonio (5), este último alcaliniza el medio y mediante un indicador de pH hace que el medio cambie de color (17-19).
En Perú existen dos estudios que usaron el TRU, bajo la denominación comercial de HpTest®, uno del Dr. Prochazka y el otro del Dr. Eduar Bravo (16,20), pero hasta el momento ningún estudio ha estado dirigido a validar este examen en nuestro país. Cabe resaltar que en el Perú el TRU es ampliamente utilizado por los gastroenterólogos, una razón para ello es que se ofrece gratuitamente por un laboratorio farmacéutico como servicio y apoyo al médico y lo hace con mayor frecuencia a aquellos que laboran en las provincias del Perú donde puede ser difícil tener la colaboración de un patólogo para hacer el diagnóstico histológico de la infección por H. pylori. Por eso hemos considerado necesario demostrar la eficacia diagnóstica de esta importante herramienta en un hospital general de nuestro país.
La validación es un proceso que determina la capacidad de una prueba para un fin concreto, en el caso de este estudio se determinara la existencia o no de la infección por H. pylori, teniendo como componentes la estimación de la sensibilidad, que es la capacidad de una prueba para identificar correctamente a aquellos que tienen la enfermedad; la especificidad, que es la capacidad de una prueba para identificar correctamente a aquellos que no tienen la enfermedad. Así mismo se incluirá la estimación del valor predictivo positivo (VPP), que es la probabilidad de tener la enfermedad habiendo salido positivo para la prueba diagnóstica y el valor predictivo negativo, que es la probabilidad de no tener la enfermedad habiendo salido negativa para la prueba diagnóstica (21).
En este estudio se validará la prueba Sensibacter pylori test®, que según estudios previos, realizados en Colombia, dan excelentes resultados a los 20 minutos logrando diagnosticar la infección rápidamente, a bajo costo y de esta manera permite iniciar inmediatamente el tratamiento antibiótico.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional prospectivo en 181 pacientes con síntomas dispépticos que voluntariamente aceptaron participar, firmando un consentimiento informado. Dicho estudio se llevó a cabo en el Servicio de Gastroenterología del Hospital Cayetano Heredia desde marzo del 2014 hasta febrero del 2015. Se incluyó a todo paciente dispéptico mayor de 18 años que fue sometido al procedimiento de endoscopía digestiva alta (EDA) y se excluyó a aquel que recibió inhibidores de bombas de protones (IBPs), bismuto o antibióticos durante las últimas 4 semanas. A todo paciente incluido en el estudio se le extrajo dos biopsias del antro gástrico, una para realizar el TRU y la otra para patología, que fue definida como patrón de oro (biopsia de antro gástrico con tinción Hematoxilina- Eosina).
La biopsia sometida a TRU se leyó a los 0, 5, 10, 15, 20 minutos y 24 horas, considerándose como una lectura positiva cuando viraba de amarillo a fucsia- morado y negativa cuando no ocurría dicho cambio. Estos resultados se compararon con el patrón de oro, cuya lectura se realizó por un único patólogo experto. Por otro lado, el resultado del TRU fue interpretada por un único investigador, quien fue previamente entrenado por gastroenterólogos del servicio para la identificación del cambio de coloración del medio.
Para el análisis estadístico se usó una tabla de validación cruzada en Microsoft Excel 2013® para hallar la sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN) y razones de verosimilitud del TRU a los 5, 10, 15 y 20 minutos y a las 24 horas teniendo como referencia el patrón de oro. Se incluyó los intervalos de confianza al 95%. El protocolo de investigación fue evaluado y aprobado por el Comité de Ética de la UPCH y el HCH.
RESULTADOS
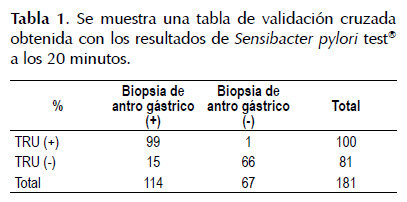
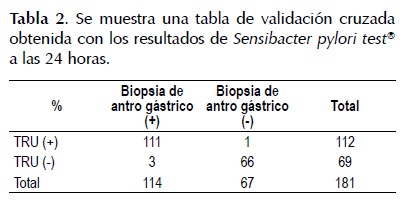
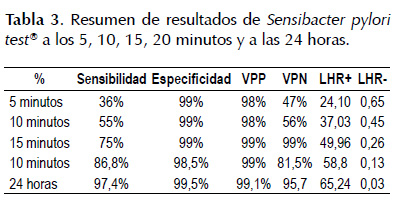
Fueron evaluados 181 pacientes, 58 (32%) hombres y 123 (68%) mujeres. La edad promedio fue 52,8±13,5 (18-84) años. La frecuencia de H. pylori en las biopsias de antro gástrico fue de 62,9%. La sensibilidad, especificidad, valor predictivo negativo (VPN) y valor predictivo positivo (VPP) fueron: a los 5 minutos 36% (IC 0,33-0,39), 99% (IC 0,98-0,99), 47% (IC 0,44-0,51), 98% (IC 0,97-0,98) respectivamente. A los 10 minutos 55% (0,52-0,59), 99% (IC 0,98-0,99), 56% (IC 0,53- 0,60), 98% (IC 0,98-0,99) respectivamente. A los 15 minutos 75% (IC 0,72-0,77), 99% (IC 0,98-0,99), 69% (IC 0,66-0,73), 99% (IC 0,99-0,99). A los 20 minutos 86,8% (IC 0,85-0,89), 98,5% (IC 0,98-0,99), 81,5% (IC 0,79-0,84) y 99% (IC 0,989-0,991). A las 24 horas 97,4% (IC 0,97-0,98), 99,5% (IC 0,98-0,99), 95,7% (IC 0,95-0,96) y 99,1% (IC 0,99-0,992). Las tablas de validación cruzada con los mejores parámetros medios se muestran en la Tabla 1 y Tabla2.
Las razones de verosimilitud o likelihood ratio (LHR) de Sensibacter pylori tes®: A los 5 minutos el LHR+ es 24,1 (IC 3,39-171,18), esto quiere decir que el hallazgo positivo del test es 24,1 veces más frecuente en pacientes con la enfermedad que los que no la tienen. A los 10 minutos el LHR+ es 37,03 (IC 5,25- 260,84), esto quiere decir el hallazgo positivo del test es 37,03 veces más frecuente en pacientes con la enfermedad que los que no la tienen. A los 15 minutos el LHR+ es 49,96 (IC 7,12-350,5), esto quiere decir que el hallazgo positivo del test es casi 50 veces más frecuente en pacientes con la enfermedad que los que no la tienen. A los 20 minutos el LHR+ es 58,18 (IC 8,3-407,56), esto quiere decir que el hallazgo positivo del test es 58,18 veces más frecuente en pacientes con la enfermedad que los que no la tienen. A las 24 horas el LHR+ es 65,24 (IC9,3-456,47), que quiere decir que el hallazgo positivo del test es 65,24 veces más frecuente en pacientes con la enfermedad que los que no la tienen. Por otro lado, a los 5 minutos el LHR- es 1,5 (IC 0,56- 0,75), que quiere decir que el hallazgo negativo del test es 1,5 veces más frecuente en pacientes que no tienen la enfermedad que en los que la tienen. A los 10 minutos el LHR- es 0,45 (IC 0,37-0,55), que quiere decir que el hallazgo negativo del test es 2,2 veces más frecuente en pacientes que no tienen la enfermedad que en los que la tienen. A los 15 minutos el LHR- es 0,26 (IC 0,18- 0,35), que quiere decir que el hallazgo negativo del test es 3,8 veces más frecuente en pacientes que no tienen la enfermedad que en los que la tienen. A los 20 minutos el LHR- es 0,13 (IC 0,083-0,21), que quiere decir que el hallazgo negativo del test es 7,5 veces más frecuente en pacientes que no tienen la enfermedad que en los que la tienen y a las 24 horas LHR- es 0,03 (IC 0,009- 0,082), que quiere decir que el hallazgo negativo del test es 37,4 veces más frecuente en pacientes que no tienen la enfermedad que en los que la tienen (ver Tabla 3).
DISCUSIÓN
El TRU se basa en la actividad de la enzima ureasa del H. pylori, que se encarga de hidrolizar la urea para luego convertirla en CO2 y NH4+. La liberación de amonio incrementa el pH del medio, observándose así un cambio de coloración a fucsia-morado (5,17-19). La observación original de la utilidad de este método fue publicado en 1989, en el cual participaron 1445 pacientes usando el caldo modificado de Christensen, donde reportaron una sensibilidad y especificidad de 96%, comparado al cultivo y la anatomía patológica (19). Barry Marshal agregó a un agar gel, que contenía urea y un indicador de pH, un agente antibacteriano y lo patentó con el nombre de CLOtest (Campylobacter-like organism), luego de este se fueron produciendo otros como el Hpfast®, PiloryTek®, varios otros como Jatrox®- Hp.test, HelicotecUT®, ProntoDry test®, UTF 300® (Ultrafast rapid ureasa) y Uretest® (19,22). La sensibilidad y especificidad del test rápido de ureasa varía según las series estudiadas entre 70% y 100% (16,18-20,22-38).
Entre los artículos peruanos que probaron el test rápido de ureasa, se encuentran el de Prochazka et al., el cual encontró una sensibilidad de 84,46%, en este estudio se incluyeron a pacientes usuarios de inhibidores de bomba de protones, bismuto y antibióticos (16). Bravo et al., describe que la sensibilidad y especificidad fueron de 89,6% y 73,3%, respectivamente, en pacientes con hemorragia digestiva alta (20). La sensibilidad hallada en el presente estudio (86,8%) a los 20 minutos se encuentra ligeramente subestimada probablemente por haber extraído solo una biopsia de antro, ya que esta es la zona donde es más frecuente encontrar la bacteria H. pylori, y podría ser incluso mayor si se hubiese tomado adicionalmente una biopsia de cuerpo para el TRU, es así que en algunas series estudiadas recomiendan tomar biopsias de antro y cuerpo para mejorar la sensibilidad de la prueba (22,24). Esto relacionado a la densidad bacteriana para la detección, necesitando el TRU de aproximadamente 104-105 H. pylori en la muestra para que esta cambie de color (17,23,24) a diferencia de la Reacción en Cadena de Polimerasa (PCR) que solo necesita 10 organismos para que sea positiva (25). Por otro lado, en el presente estudio no se tomó en cuenta el tamaño de la biopsia que se usó para el TRU, reportándose en la literatura como la más apropiada de 3,3 mm (24,26).
Existen trabajos que documentan el uso de las biopsias que previamente fueron usadas para TRU, sirviendo estas como muestra tanto para el estudio histológico, reacción en cadena de polimerasa (PCR) e incluso para cultivo. Windsor HM et al, recomiendan mantener entre dos a cuatro horas a 4 °C la muestra que se encuentra en TRU para posteriormente cultivarlas (27). Linpisarn S et al, recomiendan que se puede realizar PCR a las biopsias que se encuentran en TRU (25), así como también Woo Chul Chung et al., realizó un trabajo similar (28). Yuan Li et al, reportaron que las biopsias que fueron sometidas a TRU y luego guardadas a 37 °C podrían usarse para métodos diagnósticos moleculares y cultivo para evaluar la susceptibilidad del H. pylori a la claritromicina (37). El uso de las biopsias tomadas para histopatología le agrega un valor complementario al diagnóstico de la infección, ya que se podría demostrar si existe gastritis crónica activa, metaplasia, displasia o cáncer gástrico, es así que incluso hay series como la de Cusma- Quintana T et al., y Vela-Velásquez César Tadeo et al., que reportan una mejor eficacia diagnóstica en biopsias procesadas 24 horas después de haber sido tomadas y que fueron guardadas en frascos estériles a temperatura ambiente, es posible pensar que esto se deba a que las biopsias tengan condiciones necesarias para favorecer el crecimiento de H. pylori (39,40).
Ahora bien, existen especímenes que podrían dar falsos positivos al TRU, debido a que también producen la enzima ureasa, como Helicobacter heilmanni y entre los que fueron reportados por Giovanni Brandi et al, se encuentran: Streptococcus salivarous, Lactococcus lactis, Lactococcus cremoris, Gardenerella vaginalis, Enterococcus durans y Staphylococcus capitis urealiticum, siendo este último el que posee la más fuerte actividad de la enzima ureasa, pero estas cepas productoras de ureasa no son tan frecuentes de encontrar en el estómago (30).
En la serie reportada por Fabián Emura et al. en Colombia que también usaron Sensibacter pylori test®, reportan que a los 20 minutos obtuvieron los mejores parámetros de sensibilidad y especificidad (18), sin embargo, la sensibilidad encontrada en el presente estudio es 86,8% y el valor predictivo positivo a los 20 minutos y 24 horas es de 99%, lo cual nos indica que si la prueba saliese positiva tenemos un 99% de probabilidad que sea realmente positiva, indicando infección por H. pylori y de esta manera se podría dar la prescripción médica para iniciar inmediatamente el tratamiento de erradicación, tan pronto como a los 20 minutos y así el paciente no tendría que esperar al resultado de la patología, que toma mucho tiempo en nuestro sistema de salud. Así mismo si el TRU fuese negativo a los 20 minutos, se pediría al paciente que regrese al día siguiente en donde si el examen fuese positivo, con un VPP muy alto, el paciente se beneficiaría de iniciar el tratamiento sin tener que esperar el resultado de la histología.
Los mejores valores de razones de verosimilitud que reportamos en el presente estudio son: LRH+ a los 20 minutos y 24 horas de 58,18 y 65,24 respectivamente, siendo ambos valores excelentes para confirmación diagnóstico, así como también el LHR- a los 20 minutos y 24 horas es de 0,13 y 0,03 respectivamente, siendo mejor como test de descarte a las 24 horas.
Finalmente, Sensibacter pylori test® tiene una sensibilidad, especificidad y valores predictivos comparables a otros TRU; sin embargo, existen kits que dan resultados dentro de 1 hora, cuya medición no se realizó y que podría ser un tema de futuros ensayos. A modo de conclusión Sensibacter pylori test® es un buen test para confirmación diagnóstica a los 20 minutos y 24 horas; sin embargo, es un mejor test para confirmación y descarte diagnostico a las 24 horas.
Conflicto de intereses: no existe conflicto de intereses para la elaboración de la presente investigación, así como para su publicación.
Financiamiento: el trabajo no contó con ningún tipo de financiamiento para su realización.
REFERENCIAS BIBLIOGRÁFICAS
1. Dunn B, Cohen H, Blaser M. Helicobacter pylori. Clin Microbiol Rev. 1997;10(4):720-41. [ Links ]
2. Taylor D, Blaser M. The epidemiology of Helicobacter pylori infection. Epidemiol Rev. 1991;13:42-59. [ Links ]
3. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1(8390):1311-5. [ Links ]
4. Keilberg D, Ottemann KM. How Helicobacter pylori senses, targets, and interacts with the gastric epithelium. Environ Microbiol. 2016;18(3):791-806. [ Links ]
5. Mobley HL. The role of Helicobacter pylori urease in the pathogenesis of gastritis and peptic ulceration. Aliment Pharmacol Ther. 1996;10(Suppl1):57-64. [ Links ]
6. Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer epidemiology. Lancet. 1975;2(7924):58-60. [ Links ]
7. Correa P, Piazuelo MB. The gastric precancerous cascade. J Dig Dis. 2012;13(1):2-9. [ Links ]
8. Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48(13):3554-60. [ Links ]
9. Recavarren-Arce S, León-Barúa R, Cok J, Berendson R, Gilman RH, Ramírez-Ramos A, et al. Helicobacter pylori and progressive gastric pathology that predisposes to gastric cancer. Scand J Gastroenterol Suppl. 1991;181:51-7. [ Links ]
10. El-Omar EM, Penman ID, Ardill JE, Chittajallu RS, Howie C, McColl KE. Helicobacter pylori infection and abnormalities of acid secretion in patients with duodenal ulcer disease. Gastroenterology. 1995;109(3):681-91. [ Links ]
11. Calam J. The somatostatin-gastrin link of Helicobacter pylori infection. Ann Med. 1995;27(5):569-73. [ Links ]
12. León-Barúa R, Berendson-Seminario R, Recavarren-Arce S, Gilman RH. Geographic factors probably modulating alternative pathways in Helicobacter pylori-associated gastroduodenal pathology: a hypothesis. Clin Infect Dis. 1997;25(5):1013-6. [ Links ]
13. Porras C, Nodora J, Sexton R, Ferreccio C, Jimenez S, Dominguez RL, et al. Epidemiology of Helicobacter pylori infection in six Latin American countries (SWOG Trial S0701). Cancer Causes Control. 2013;24(2):209-15. [ Links ]
14. Ramírez Ramos A, Gilman R, Watanabe J, Rosas A. Estudio de la epidemiología de la infección por el Helicobacter pylori en el Perú: 20 años después. Acta Gastroenterol Latinoam. 2004;34(2):69-78. [ Links ]
15. Ramírez Ramos A, Mendoza Requena D, Leey Casella J, Guerra Valencia J. Estudio del Helicobacter pylori en el Perú. Rev Peru Med Exp Salud Publica. 2002;19(4):209-14. [ Links ]
16. Prochazka Zárate R, Salazar Muente FA, Barriga Calle E, Salazar Cabrera F. Prevalencia de Helicobacter pylori en una clínica privada de Lima. Sensibilidad de las biopsias del antro y cuerpo, y la prueba rápida de la ureasa. Rev Gastroenterol Peru. 2010;30(1):33-9. [ Links ]
17. Mégraud F, Bessède E, Lehours P. Current methods used for the diagnosis of Helicobacter pylori infection. In: Buzás GM. eds. Helicobacter pylori - A Worldwide Perspective 2014. Oak Park: Bentham Science, 2014. p. 234-58. [ Links ]
18. Emura F, Garcia J, Sabbagh L. Características operativas de Sensibacter Pylori Test® a los 5, 10, 15 y 20 minutos para la detección de Helicobacter pylori en la sala de Endoscopía [Internet]. Bogotá: Laboratorio Microanalisis Ltda.; 2009 [citado el 15 de enero de 2016]. Disponible en: http:// microanalisislabs.com/wp-content/uploads/2015/06/Estudio- de- Validacion-ii.pdf
19. McNulty CA, Dent JC, Uff JS, Gear MW, Wilkinson SP. Detection of Campylobacter pylori by the biopsy urease test: an assessment in 1445 patients. Gut. 1989;30(8):1058-62. [ Links ]
20. Bravo Paredes E, Guzmán Rojas P, Gallegos López R, Corzo Maldonado M, Zegarra Chang A, Surco Ochoa Y, et al. Utility of urease rapid test for detection of Helicobacter pylori in patients with upper gastrointestinal bleeding from peptic ulcer. Rev Gastroenterol Peru. 2011;31(1):17-20. [ Links ]
21. Gordis L. Epidemiologia. 3a ed. Madrid: Elsevier; 2005. [ Links ]
22. Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, et al. Dual specimens increase the diagnostic accuracy and reduce the reaction duration of rapid urease test. World J Gastroenterol. 2010;16(23):2926-30. [ Links ]
23. Kumar Patel S, Bhan Pratap C, Kumar Jain A, Kumar Gulati A, Nath G. Diagnosis of Helicobacter pylori: What should be the gold standard? World J Gastroenterol. 2014;20(36):12847-59. [ Links ]
24. Wong A, Ching SS, Long AS. The use of a second biopsy from the gastric body for the detection of Helicobacter pylori using rapid urease test. Singapore Med J. 2014;55(12):644-7. [ Links ]
25. Linpisarn S, Koosirirat C, Prommuangyong K, Suwan W, Lertprasertsuke N, Phornphutkul K. Use of different PCR primers and gastric biopsy tissue from CLO test for the detection of Helicobacter pylori. Southeast Asian J Trop Med Public Health. 2005;36(1):135-40. [ Links ]
26. Uotani T, Graham DY. Diagnosis of Helicobacter pylori using the rapid urease test. Ann Transl Med. 2015;3(1):9-15. [ Links ]
27. Windsor HM, Ho GY, Marshall BJ. Successful recovery of H. pylori from rapid urease tests (CLO tests). Am J Gastroenterol. 1999;94(11):3181-3. [ Links ]
28. Chung WC, Jung SH, Oh JH, Kim TH, Cheung DY, Kim BW, et al. Dual-priming oligonucleotide-based multiplex PCR using tissue samples in rapid urease test in the detection of Helicobacter pylori infection. World J Gastroenterol. 2014;20(21):6547-53. [ Links ]
29. Li Y, Rimbara E, Thirumurthi S, Trespalacios A, Reddy R, Sabounchi S, et al. Detection of clarithromycin resistance in Helicobacter pylori following noncryogenic storage of rapid urease tests for 30 days. J Dig Dis. 2012;13(1):54-9 [ Links ]
30. Brandi G, Biavati B, Calabrese C, Granata M, Nannetti A, Mattarelli P, et al. Urease-Positive Bacteria Other than Helicobacter pylori in Human Gastric Juice and Mucosa. Am J Gastroenterol. 2006;101(8):1756-61. [ Links ]
31. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, et al. United rapid ureasa test is superior than separate test in detecting Helicobacter pylori at the gastric antrum and body specimens. Clin Endosc. 2012;45(4):392-6. [ Links ]
32. Chumpitaz R. Caldo-urea modificado para la detección de Helicobacter pylori en pacientes con dispepsia no ulcerosa [Tesis de especialidad para Laboratorio Clínico]. Lima, Perú: Facultad de Medicina Hipolito Unanue, Universidad Nacional Federico Villareal; 1993. [ Links ]
33. Vaira D, Vakil N, Gatta L, Ricci C, Perna F, Saracino I, et al. Accuracy of a new ultrafast rapid urease test to diagnose Helicobacter pylori infection in 1000 consecutive dyspeptic patients. Aliment Pharmacol Ther. 2010:31(2):331-8. [ Links ]
34. Shahidi MA, Fattahi MR, Farshad S, Alborzi A. Validation of an in-house made rapid urease test Kit againts the comercial CLO- test in detecting Helicobacter pylori infection in the patients with gastric disorders. J Res Med Sci. 2012;17(3):212-6. [ Links ]
35. Moncayo J, Santacruz J, Álvarez A, Franco B, López M, Ángel A, et al. Comparación de métodos diagnósticos en la infección por Helicobacter pylori en Quindío, Colombia. Colombia Médica. 2006;37(3):203-212. [ Links ]
36. Kazemi S, Tavakkoli H, Habizadeh MR, Emami MH. Diagnostic values of Helicobacter pylori diagnostic test: stool antigen test, urea breath test, rapid urease test, serology and histology. J Res Med Sci. 2011;16(9):1097-104. [ Links ]
37. Pourakbari B, Ghazi M, Mahmoudi S, Mamishi S, Azhdarkosh H, Najafi M, et al. Diagnosis of Helicobacter pylori infection by invasive and noninvasive tests. Braz J Microbiol. 2013;44(3):795-8. [ Links ]
38. Jeon SJ, Shin SJ, Lee KM, Lim SK, Lee YC, Lee MH, et al. Can the 1.8 mm transnasal biopsy forceps instead of standard 2.2 mm alter rapid urease test and histological diagnosis? J Gastroenterol Hepatol. 2012;27(8):1384-7. [ Links ]
39. Vela-Velásquez CT. Comparación entre las biopsias gástricas sin fijar 24 horas frente a la biopsia convencional para el diagnóstico de Helicobacter pylori en un hospital de referencia de Perú. Rev Peru Med Exp Salud Publica. 2011;28(1):42-6. [ Links ]
40. Cusma-Quintana T, Vilela-Desposorio C, Miñano-García C, Abad-Licham M. Comparación entre las biopsias gástricas con fijación inmediata y diferida para la detección de Helicobacter pylori. Rev Esp Patol. 2016;49:87-93. [ Links ]
Correspondencia:
Vladimir Tomas Espinoza Ildefonso
Jr. Loma de los Pensamientos 119 Dpto 301, Urb. Prolongación Benavides, Santiago de Surco. Lima, Perú.
E-mail:vladimir.espinoza.i@upch.pe; vladimir.espinoza.i@gmail.com
Recibido: 19-3-2016
Aprobado: 4-7-2016