Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.1 Lima ene./mar. 2017
ARTÍCULO DE REVISIÓN
Alteración en la regulación de microRNAs en el cáncer gástrico: sobrerregulación de miR-21 y miR-106
Deregulation of microRNAs in gastric cancer: up regulation by miR-21 and miR-106
Luis Alejandro Arias Sosa1a, Andrés Felipe Cuspoca Orduz1a, Bibiana Matilde Bernal Gómez1b
1 Grupo de Investigación biomédica y de Patología (GIBP), Escuela de Medicina, Universidad Pedagógica y Tecnológica de Colombia. Boyacá, Colombia.
a Estudiante; b Docente
RESUMEN
El cáncer gástrico presenta una de las tasas de mortalidad más importante a nivel mundial, situación que es aún más preocupante en Colombia cuyas tasas son históricamente altas y en nuestro contexto regional particularmente para Boyacá, en la región nororiental de Colombia, es la primera causa de muerte por cáncer y aporta el segundo lugar a la mortalidad por esta enfermedad en el país. La detección temprana y la atención primaria idónea es fundamental en la supervivencia de las personas con cáncer gástrico, por lo que, con el presente artículo, queremos proponer la validación en Latinoamérica de microRNAs (miRNA) como biomarcadores de diagnóstico precoz, pronóstico y seguimiento de esta enfermedad. Gracias a la suficiente evidencia científica de que los miRNA se ven desregulados durante la aparición y el desarrollo del cáncer gástrico ya sea como oncogenes o supresores tumorales, su medida en conjunto para investigaciones clínicas puede hacerlos candidatos específicos de cáncer; por último, resaltar la asociación de dos miRNA (miR-21 y miR-106b) que muestran sus niveles significativamente altos en pacientes con cáncer gástrico.
Palabras clave: Cáncer gástrico; Apoptosis; Proliferación de la célula; Oncogenes (fuente: DeCS BIREME).
ABSTRACT
Gastric cancer (GC) exhibits significant rates of mortality worldwide, a situation that is even more disturbing in Colombia, because it has had historically high rate for that disease; At regional context we have found that Boyacá has the second place of gastric cancer mortality rate in the country, with displeasing numbers. Early detection is critical to the survival of people, so in this article, major based on world literature search, we show that the microRNA could be a useful tool for the diagnosis, prognosis and can be designed as important therapeutic target. Aims to this are demonstrate howmiRNAs are deregulated during the emergence and development of gastric cancer and how their biological functions can place them as oncogenes or tumor suppressors; finally, we showed that two microRNAs (miR-21 and miR-106b) are significantly upregulated in the disease and may have a pro-oncogenic action, blocking normal cell cycle, apoptosis and migration.
Keywords: Gastric cáncer; Apoptosis; Cell proliferation; Oncogenes (source: MeSH NLM).
INTRODUCCIÓN
El cáncer gástrico es una de las enfermedades oncológicas que ha disminuido su incidencia en el mundo, incluyendo áreas con tasas de morbilidad y mortalidad históricamente altas como lo es Colombia; Sin embargo, esta enfermedad sigue siendo relevante debido a su gran mortalidad puesto que sólo en 2012 se presentaron 951 600 nuevos casos y 723 100 muertes alrededor del globo, principalmente en hombres (1). En Colombia, el cáncer gástrico es la principal causa de muerte por cáncer (2); ocasionando 43 759 muertes de 2000 a 2009. Cifras preocupantes en departamentos como Boyacá, con un segundo lugar a nivel nacional en cuanto a mortalidad, con un estimado de 127 muertes anuales (3). Estos datos confirman la necesidad de estudios sobre esta enfermedad a nivel regional, nacional y mundial.
La incidencia de cáncer gástrico se ha relacionado con una multiplicidad de factores de riesgo como lo son la infección por Helicobacter pylori, el alto consumo de sal y de alimentos en conservas poco industrializadas, así como de alimentos quemados, y particularmente en Colombia en algunos grupos poblacionales o familiares con antecedentes de la enfermedad (4).
El diagnóstico temprano afecta positivamente la esperanza de vida de los pacientes; ya que, si el cáncer gástrico es detectado en estadio oncológico I, la tasa de supervivencia a 5 años después de la resección quirúrgica es del 90%, cayendo drásticamente al 5% cuando se diagnostica en estadio oncológico IV (5). En Colombia, el diagnóstico se hace en estadios muy avanzados (6). Debido a este problema de salud pública, ha surgido la necesidad de estudiar sus causas locales y desarrollar propuestas para nuevos métodos de detección precoz que puedan servir de seguimiento y evaluación de tratamientos. Es en este punto donde como grupo de estudio y profundizando la línea de investigación en biomarcadores, hemos elegido como candidatos a los microRNA. Los microRNA son pequeñas partículas de RNA que no son codificantes y que tienen funciones en la regulación negativa de los genes y se ha propuesto, que están involucrados en la tumorigénesis gástrica e incluso en la invasión y progresión a metástasis (6,7). La utilidad de las nuevas herramientas y tecnologías de la información, como la biología de sistemas y la bioinformática, permiten escoger biomarcadores candidatos con alta sensibilidad de estudios experimentales asociados a cáncer gástrico (8).
Desde el auge de la genómica y la proteómica, se ha propuesto una nueva clasificación de cáncer gástrico de acuerdo a sus características moleculares, a su expresión genética y a su asociación con virus de Epstein–Barr gracias a numerosos estudios experimentales donde se han identificado clonas de inestabilidad genética, cambios en los perfiles de RNA mensajero e inestabilidad de micro satélites y cromosomas (9). Simultáneamente continúa diagnosticándose con base en descripciones morfológicas que aún no se correlacionan del todo con su pronóstico. Con la presente búsqueda queremos demostrar algo de certeza en la literatura médica de la influencia de los microRNAs en el origen y desarrollo del cáncer gástrico, así como pretendemos sugerir que la medición de cambios en sus niveles en muestras sanguíneas, de saliva o de heces, pudiesen reflejar su aparición o cambio en el estadio de la enfermedad, lo que ayudaría a su convalidación clínica.
METODOLOGÍA
Se buscó en la literatura mundial usando las bases de datos de Pubmed, Scopus y Science Direct artículos con la unión de las palabras clave gastric cancer & microRNA y de estos, los que fueran meta-análisis, experimentales y estudios clínicos, así como búsquedas específicas en inglés así: gastric cancer oncogene & miR-21 y con miR-106b.
Se seleccionaron los artículos entre el 2009-2016. Con el objetivo de adquirir un conocimiento más ordenado los distribuimos en las siguientes preguntas 1) ¿Es posible escoger como candidatos biomarcadores de cáncer gástrico a los miRNA?, 2) ¿Se han utilizado los miRNA como biomarcadores en cáncer gástrico?
Para esta revisión se incluyeron artículos originales con diseño experimental (7), revisiones con la metodología Cochrane (9) y metaanálisis (4); se excluyeron los artículos anteriores al 2009, los que se refiriesen al linfoma gástrico y se sacaron del texto los relacionados con otros tipos de cáncer en el estómago, sólo se tuvieron en cuenta los adenocarcinomas, por ser estos subtipos histológicos, el de tipo intestinal y el de tipo de células en anillo de sello, los más relacionados con nuestro problema de salud pública.
RESULTADOS
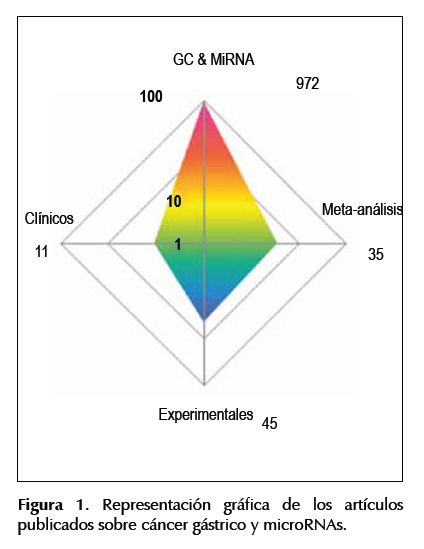
Los artículos publicados sobre cáncer gástrico y microRNAs obtenidos en marzo de 2016 en Pubmed fueron: 972 estudios de tipo revisión bibliográfica,
35 con título de meta análisis y 56 estudios de tipo experimental, sólo 11 de ellos son de tipo clínico (Figura 1).
Desregulación de los microRNA en el cáncer gástrico: probables biomarcadores
Los microRNAs (miRNAs), son pequeños RNA de aproximadamente 22 nucleótidos, que regulan la expresión génica de forma negativa, al inhibir la traducción del RNA mensajero de genes específicos (10); se pueden transportar en la corriente sanguínea dentro de micropartículas (vesículas pro-inflamatorias) (11) o unidos a lipoproteínas de alta densidad (12) y sus niveles pueden ser medidos mediante técnicas como la reacción en cadena de la polimerasa (qRT-PCR).
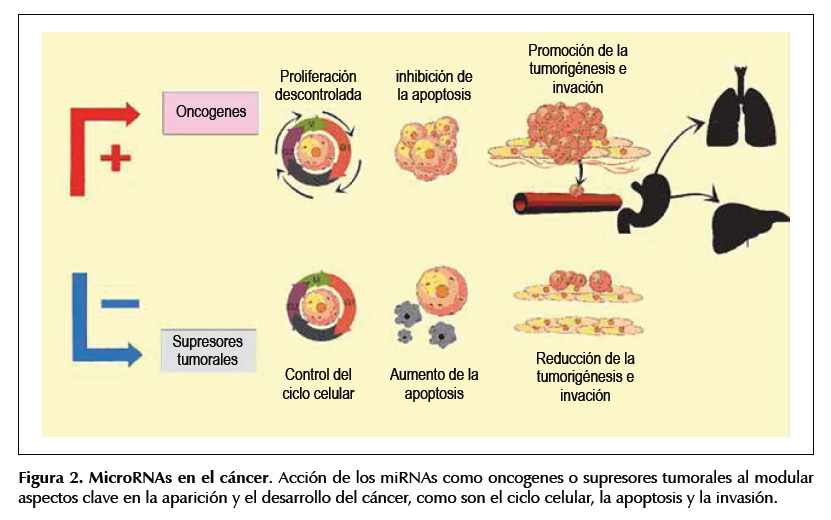
Los cambios significativos en sus niveles séricos pueden ser predictores de su función a nivel hístico, como oncogenes o supresores tumorales (ver Figura 2). La facilidad de obtenerlos del plasma o del suero, la alta estabilidad que poseen y la posibilidad de medirlos cambios que presentan sus niveles durante el desarrollo de cáncer gástrico, los hacen promisorios como biomarcadores tempranos (13).
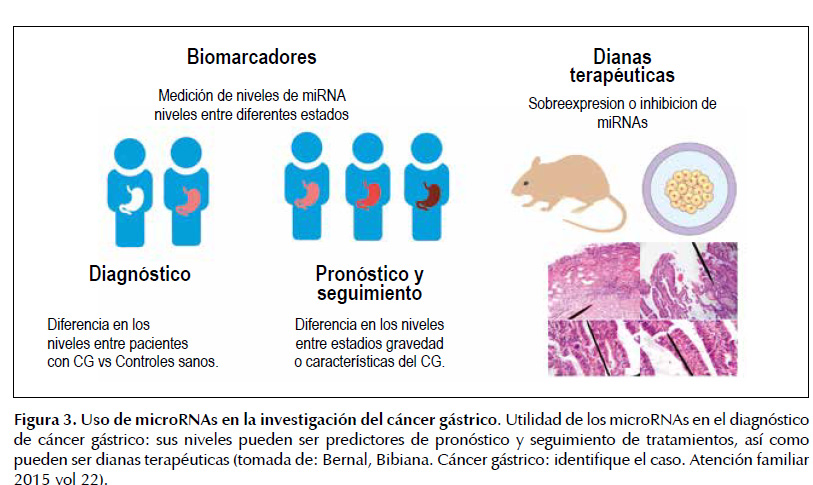
Por lo tanto, cada día existen nuevos estudios postulando miRNAs de utilidad en el pronóstico, diagnóstico y tratamiento del cáncer gástrico (ver Figura 3) (14,15). No obstante, la acción de los miRNA en el cáncer depende del contexto hístico y puede variar de acuerdo al tipo histopatológico de cáncer, al estado de progresión de la enfermedad y a la población donde se estudie. Aunque no está completamente claro el rol de algunos de ellos en la fisiopatogenia, como ocurre con miR-183 en cáncer gástrico, que ha sido reportado con niveles más altos de lo normal (sobreexpresado) por su acción inhibidora sobre la acción del gen de la proteína PDCD4 (Programmed Cell Death 4) (16), o de manera opuesta, con niveles significativamente disminuidos en la misma enfermedad como supresor de la invasión tumoral y de las metástasis debido a la acción que tiene sobre la regulación de Ezrin (17), y Bmi-1 (18). Estas discrepancias en su función se deben probablemente a que los miRNAs puede tener varios genes como objetivo y que el miR-183 puede actuar tanto como oncogén o supresor tumoral de acuerdo al tipo histológico de cáncer gástrico (17).
A pesar del vacío de información se han encontrado que los microRNA detectables en plasma pueden ser útiles en el estudio de la enfermedad (13,15,19); y un ejemplo de esto es el estudio de miR-23b, que muestra mayores niveles en pacientes con cáncer gástrico que en sus controles y dichos niveles, muestran tener un valor directamente proporcional a su pronóstico (20). De manera similar, la evaluación de microRNA en los tejidos puede ser significativa para el seguimiento de la enfermedad, como lo evidencia un estudio reciente llevado a cabo por Liu et al. (2016), donde se muestra que la medición de niveles de miR-124 tiene un valor predictivo para encontrar metástasis en ganglios linfáticos con una sensibilidad similar y una mayor especificidad que técnicas más estandarizadas como lo es la tomografía computarizada; así mismo encontraron que la evaluación de este microRNA puede diferenciar entre estadios del tumor y alcanza hasta un 80% de especificidad y sensibilidad, con significancia estadística (21).
Actualmente se evalúa el uso de terapias moleculares en el tratamiento de la enfermedad, con base en diseños experimentales en modelos murinos y líneas celulares, como es el caso de la realizada por Zhou y colaboradores en 2016, quienes encontraron que al sobre-expresar por transfección los niveles de miR- 375, era mayor la sensibilidad a Cisplatino en células cancerígenas gástricas, disminuyendo la proliferación e incrementado la apoptosis (22). De manera similar Lin et al. (2016) lograron reducir la proliferación y migración de células de cáncer gástrico, en este caso mediante la transfección de un inhibidor sintético del miR-1290 (pro- oncogénico) (23). Por otra parte, la sobreexpresión ectópica de microRNAs que actúan como supresores tumorales en modelos animales de ratón knockout, han mostrado buenos resultados suprimiendo la tumorigénesis y previniendo el crecimiento y la metástasis tumoral (24,25).
Como se ha podido observar existen múltiples microRNA de interés en el cáncer gástrico, entre los cuales están miR-21 y miR-106b, de los más estudiados y de los que mejor se conoce su acción biológica, por lo que se dará una descripción más detallada de ellos y su implicación en la enfermedad pues la desregulación de un microRNA puede originar un tumor de acuerdo a la Figura 2.
Mir-21
Mir-21 es una diana de interés en cáncer gástrico y un buen candidato biomarcador con valor diagnóstico en tejido y plasma (19,26,27), con opción de seguimiento y pronóstico. Su sobreexpresión se asocia a una menor diferenciación del tumor, metástasis en los ganglios linfáticos y entre más alto son sus niveles, con un peor pronóstico (26). Además, su grado de expresión es mayor en pacientes con cáncer gástrico en etapa I que, en controles sanos, lo que podría permitir su uso en la predicción temprana del cáncer, aunque necesita el uso de cohortes clínicas (15).
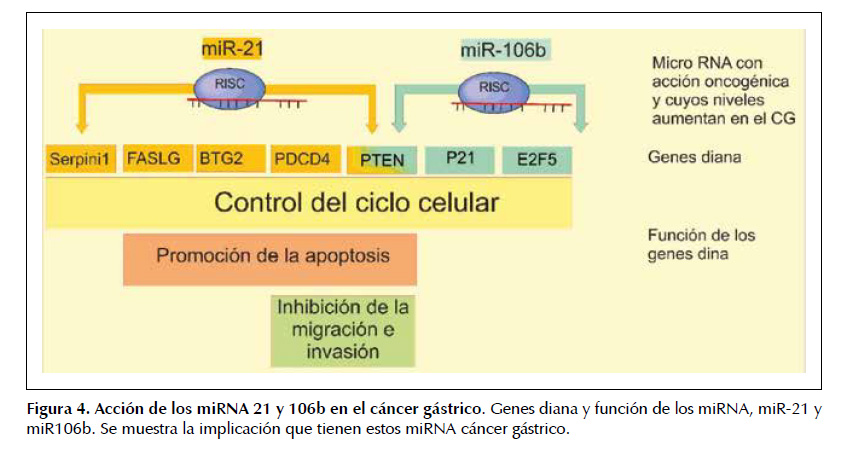
La acción oncogénica de miR-21 en el cáncer gástrico se debe a su regulación en la expresión de genes como Serpin1 (gen de PAI-1), un supresor tumor al que controla la fase G1 del ciclo celular (28) y dañado favorece la proliferación. Así como al inhibir al ligando Fas, inductor de la muerte celular por apoptosis y BTG2 (B-cell translocation gene 2) (29), pues su sobre- expresión, aumenta el número de células en fase G0/ G1, decrece la proporción de células en etapa S y aparentemente incrementa la apoptosis celular (30).
También se ha visto que miR-21 inhibe a PTEN (fosfatidilinositol-3,4,5-trisfosfato 3-fosfatasa), un supresor tumoral cuyos niveles disminuyen en el cáncer gástrico y que tiene efectos en el control de la proliferación y migración (31); adicionalmente se ha encontrado que PTEN disminuye la metástasis en adenocarcinoma, pues inhibe la expresión de FAK (quinasa de adhesión focal), la cual promueve la migración y la invasión celular (32). Otro estudio igualmente mostró que miR-21 inhibe la expresión de las proteínas PTEN y PDCD4 (Programmed cell death protein 4), causando una mayor invasión y migración (33).
MIR-106B
De igual forma miR-106b se expresa de acuerdo al grado de desdiferenciación de cáncer gástrico con niveles significativamente elevados y propuesto como un buen candidato en pronóstico y diagnóstico (13,34,35). Su efecto oncogénico se ha asociado a un aumento en la migración e invasión del cáncer, por su acción inhibidora sobre la enzima PTEN (36).
También se ha reportado que su sobrexpresión promueve el aumento de la proliferación de células tumorales, al acortar la fase G0/G1, acelerando el ciclo celular, mediante la regulación de los supresores tumorales p21 (inhibidor de la cinasa dependiente de ciclina) y el factor de transcripción E2F5 (37). Lo cual es entendible ya que se ha observado que la disminución en los niveles de p21 en el CG, está asociado con la diferenciación, invasión tisular, invasión vascular y metástasis ganglionar del tumor (38) y por su parte E2F5 tiene un importante papel en el control del ciclo celular y en la transcripción de otros supresores tumorales. Aun así, se ha encontrado que bajo ciertas condiciones p-21 también puede actuar como un oncogén, recalcando la importancia del contexto celular en el análisis de factores genéticos del cáncer.
La asociación de este miRNA con el estado, tamaño, diferenciación, invasión y metástasis del CG junto a su evidente desregulación entre pacientes sanos, con tumores benignos y con tumores malignos lo vuelven un promisorio objetivo para la detección y seguimiento de esta enfermedad (39,40).
En la parte terapéutica el estudio de Zhang et al. (2016) mostro que al inhibir a miR-106b y otros miRNA en líneas celulares humanas de cáncer gástrico; se disminuía significativamente la proliferación, migración e invasión (41), lo que da indica que la supresión de miR-106b puede ser una opción en el tratamiento de pacientes en un futuro.
DISCUSIÓN
La desregulación de miRNAs al igual que del resto de maquinaria epigenética y genética es un factor importante en el desarrollo del cáncer gástrico y su estudio puede darnos nuevas oportunidades de manejo de la enfermedad, pues losmiRNA pueden tener un importante valor en el diagnóstico, seguimiento, pronóstico y evaluación del tratamiento de la enfermedad (Figuras 3 y 4). Actualmente se han hecho grandes avances en el uso de estas moléculas como biomarcadores del cáncer gástrico, mediante la evaluación de sus niveles en muestras de tejido o plasma; siendo este último método de mayor interés, pues la medición de niveles de miRNA en sangre es un método menos invasivo, factible de ser usado como tamizaje, incluso en países en vía de desarrollo.
Gracias al incremento en la investigación sobre este tópico, la disminución gradual en los costos de los análisis moleculares y el interés que han despertado los resultados positivos, permitirán en un futuro la estandarización en programas de salud pública. Muchos de estos miRNA reportados como desregulados y biomarcadores, también son importantes dianas en el tratamiento; sin embargo, dado que la investigación en este tema es bastante reciente, no se cuenta con la evidencia clínica de que la terapia de modularlos (por inhibición o sobrexpresión) sea beneficiosa, a pesar de que se observa en modelos animales y cultivos celulares. Los miRNA 21 y 106b son considerados oncogenes de interés. Dado los altos índices de cáncer gástrico en las Américas es importante enfatizar en la importancia de la investigación biomédica sobre esta patología y el reto está en qué y cómo medirlos.
Conflicto de intereses: Los autores no declaran ningún conflicto de interés.
Financiamiento: Este trabajo no ha recibido soporte financiero alguno para su elaboración.
REFERENCIAS BIBLIOGRÁFICAS
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87-108. [ Links ]
2. Otero Regino W, Gómez MA, Castro D. Gastric carcinogenesis. Rev Colomb Gastroenterol. 2009;24(3):314-29. [ Links ]
3. Pardo C, Cendales R. Incidencia, mortalidad y prevalencia de Cáncer en Colombia 2007-2011. 1st ed. Bogotá: Instituto Nacional de Cancerología; 2015. [ Links ]
4. Daza Duque D. Cáncer gástrico en Colombia entre 2000 y 2009. Bogotá: Universidad Del Rosario – Universidad CES; 2012. [ Links ]
5. Wang R, Wen H, Xu Y, Chen Q, Luo Y, Lin Y, et al. Circulating microRNAs as a novel class of diagnostic biomarkers in gastrointestinal tumors detection: a meta-analysis based on 42 articles. PLoS One [Internet]. 2014 [citado el 25 de febrero de 2016];9(11):e113401. Disponible en: http://journals. plos.org/plosone/article?id=10.1371/journal.pone.0113401 [ Links ]
6. Zhang Z, Dai Z, Yin X, Li S, Li S, Ge H. Meta-analysis shows that circulating tumor cells including circulating microRNAs are useful to predict the survival of patients with gastric cancer. BMC Cancer. 2014;14(1):773. [ Links ]
7. Lan H, Lu H, Wang X, Jin H. MicroRNAs as potential biomarkers in cancer: opportunities and challenges. Biomed Res Int. 2015;2015:125094. [ Links ]
8. Yan W, Wang S, Sun Z, Lin Y, Sun S, Chen J, et al. Identification of microRNAs as potential biomarker for gastric cancer by system biological analysis. Biomed Res Int. 2014;2014:901428. [ Links ]
9. Bass AJ, Thorsson V, Shmulevich I, Reynolds SM, Miller M, Bernard B, et al. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513(7517):202-9. [ Links ]
10. Graves P, Zeng Y. Biogenesis of mammalian microRNAs: a global view. Genomics. 2012;10(5):239-45. [ Links ]
11. Diehl P, Fricke A, Sander L, Stamm J, Bassler N, Htun N, et al. Microparticles: major transport vehicles for distinct microRNAs in circulation. Cardiovasc Res. 2012;93(4):633-44. [ Links ]
12. Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nat Cell Biol. 2011;13(4):423-33. [ Links ]
13. Cai H, Yuan Y, Hao Y-F, Guo T-K, Wei X, Zhang Y-M. Plasma microRNAs serve as novel potential biomarkers for early detection of gastric cancer. Med Oncol. 2013;30(1):452. [ Links ]
14. Fesler A, Zhai H, Ju J. miR-129 as a novel therapeutic target and biomarker in gastrointestinal cancer. Onco Targets Ther. 2014;7:1481-5. [ Links ]
15. Li B, Zhao Y, Guo G, Li W, Zhu E, Luo X, et al. Plasma microRNAs, miR-223, miR-21 and miR-218, as novel potential biomarkers for gastric cancer detection. PLoS One [Internet]. 2012 [citado el 25 de febrero de 2016];7(7):e41629. Disponible en: http://www.pubmedcentral.nih.gov/articlerender.fcgi?arti d=3408505&tool=pmcentrez&rendertype=abstract [ Links ]
16. Gu W, Gao T, Shen J, Sun Y, Zheng X, Wang J, et al. MicroRNA-183 inhibits apoptosis and promotes proliferation and invasion of gastric cancer cells by targeting PDCD4. Int J Clin Exp Med. 2014;7(9):2519-29. [ Links ]
17. Cao L-L, Xie J-W, Lin Y, Zheng C-H, Li P, Wang J-B, et al. miR- 183 inhibits invasion of gastric cancer by targeting Ezrin. Int J Clin Exp Pathol. 2014;7(9):5582-94. [ Links ]
18. Xu L, Li Y, Yan D, He J, Liu D. MicroRNA-183 inhibits gastric cancer proliferation and invasion via directly targeting Bmi-1. Oncol Lett. 2014;8(5):2345-51. [ Links ]
19. Zhu X, Lv M, Wang H, Guan W. Identification of circulating microRNAs as novel potential biomarkers for gastric cancer detection: a systematic review and meta-analysis. Dig Dis Sci. 2014;59(5):911-9. [ Links ]
20. Zhuang K, Han K, Tang H, Yin X, Zhang J, Zhang X, et al. Up-Regulation of Plasma miR-23b is Associated with Poor Prognosis of Gastric Cancer. Med Sci Monit. 2016;22:356-61. [ Links ]
21. Liu L, Ye J-X, Qin Y-Z, Chen Q-H, Ge L-Y. Evaluation of miR- 29c, miR-124, miR-135a and miR-148a in predicting lymph node metastasis and tumor stage of gastric cancer. Int J Clin Exp Med. 2015;8(12):22227-36. [ Links ]
22. Zhou N, Qu Y, Xu C, Tang Y. Upregulation of microRNA-375 increases the cisplatin-sensitivity of human gastric cancer cells by regulating ERBB2. Exp Ther Med. 2016;11(2):625-30. [ Links ]
23. Lin M, Shi C, Lin X, Pan J, Shen S, Xu Z, et al. sMicroRNA-1290 inhibits cells proliferation and migration by targeting FOXA1 in gastric cancer cells. Gene. 2016;582(2):137-42. [ Links ]
24. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, et al. MicroRNA-1225-5p inhibits proliferation and metastasis of gastric carcinoma through repressing insulin receptor substrate-1 and activation of β-catenin signaling. Oncotarget. 2016;7(4):4647-63. [ Links ]
25. Yin H, Song P, Su R, Yang G, Dong L, Luo M, et al. DNA Methylation mediated down-regulating of MicroRNA-33b and its role in gastric cancer. Sci Rep. 2016;6:18824. [ Links ]
26. Wang Z, Cai Q, Jiang Z, Liu B, Zhu Z, Li C. Prognostic role of microRNA-21 in gastric cancer: a meta-analysis. Med Sci Monit. 2014;20:1668-74. [ Links ]
27. Zeng Z, Wang J, Zhao L, Hu P, Zhang H, Tang X, et al. Potential role of microRNA-21 in the diagnosis of gastric cancer: a meta-analysis. PLoS One [Internet]. 2013 [citado el 25 de febrero de 2016];8(9):e73278. Disponible en: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3762732&tool=pmcentrez&rendertype=abstract [ Links ]
28. Yamanaka S, Olaru A V, An F, Luvsanjav D, Jin Z, Agarwal R, et al. MicroRNA-21 inhibits Serpini1, a gene with novel tumour suppressive effects in gastric cancer. Dig Liver Dis [Internet]. 2012;44(7):589-96. [ Links ]
29. Yang Q, Xu E, Dai J, Wu J, Zhang S, Peng B, et al. miR-21 regulates N-methyl-N-nitro-N’-nitrosoguanidine-induced gastric tumorigenesis by targeting FASLG and BTG2. Toxicol Lett [Internet]. 2014;228(3):147-56.
30. Zhang L, Huang H, Wu K, Wang M, Wu B. Impact of BTG2 expression on proliferation and invasion of gastric cancer cells in vitro. Mol Biol Rep. 2010;37(6):2579-86. [ Links ]
31. Zhang BG, Li JF, Yu BQ, Zhu ZG, Liu BY, Yan M. microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN. Oncol Rep. 2012;27(4):1019-26. [ Links ]
32. Zhang L-L, Liu J, Lei S, Zhang J, Zhou W, Yu H-G. PTEN inhibits the invasion and metastasis of gastric cancer via downregulation of FAK expression. Cell Signal. 2014;26(5):1011-20. [ Links ]
33. Li L, Zhou L, Li Y, Lin S, Tomuleasa C. MicroRNA-21 stimulates gastric cancer growth and invasion by inhibiting the tumor suppressor effects of programmed cell death protein 4 and phosphatase and tensin homolog. J BUON. 2014;19(1):228-36. [ Links ]
34. Wang J-L, Hu Y, Kong X, Wang Z-H, Chen H-Y, Xu J, et al. Candidate microRNA biomarkers in human gastric cancer: a systematic review and validation study. PLoS One [Internet]. 2013 [citado el 25 de febrero de 2016];8(9):e73683. Disponible en: http://journals.plos.org/plosone/ article?id=10.1371/journal.pone.0073683 [ Links ]
35. Tsujiura M, Ichikawa D, Komatsu S, Shiozaki A, Takeshita H, Kosuga T, et al. Circulating microRNAs in plasma of patients with gastric cancers. Br J Cancer. 2010;102(7):1174-9. [ Links ]
36. Yang T-S, Yang X-H, Chen X, Wang X-D, Hua J, Zhou D-L, et al. MicroRNA-106b in cancer-associated fibroblasts from gastric cancer promotes cell migration and invasion by targeting PTEN. FEBS Lett. 2014;588(13):2162-9. [ Links ]
37. Yao Y-L, Wu X-Y, Wu J-H, Gu T, Chen L, Gu J-H, et al. Effects of microRNA-106 on proliferation of gastric cancer cell through regulating p21 and E2F5. Asian Pac J Cancer. 2013;14(5):2839-43. [ Links ]
38. Luo D-H, Zhou Q, Hu S-K, Xia Y-Q, Xu C-C, Lin T-S, et al. Differential expression of Notch1 intracellular domain and p21 proteins, and their clinical significance in gastric cancer. Oncol Lett. 2014;7(2):471-8. [ Links ]
39. Xiao B, Guo J, Miao Y, Jiang Z, Huan R, Zhang Y, et al. Detection of miR-106a in gastric carcinoma and its clinical significance. Clin Chim Acta. 2009;400(1-2):97-102. [ Links ]
40. Zeng Q, Jin C, Chen W, Xia F, Wang Q, Fan F, et al. Downregulation of serum miR-17 and miR-106b levels in gastric cancer and benign gastric diseases. Chin J Cancer Res. 2014;26(6):711-6. [ Links ]
41. Zhang R, Li F, Wang W, Wang X, Li S, Liu J. The effect of antisense inhibitor of miRNA 106b∼25 on the proliferation, invasion, migration, and apoptosis of gastric cancer cell. Tumour Biol. 2016;37(8):10507-15.
Correspondencia:
Bibiana Matilde Bernal Gómez
E-mail:bibiana.bernal@uptc.edu.co
Recibido: 22-4-2016
Aprobado: 14-7-2016