Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.2 Lima abr./jun. 2017
ARTÍCULO DE REVISIÓN
Una actualización de pancreatitis crónica: artículo de revisión
Update on chronic pancreatitis: review article
Frank Czul1, Emmanuel Coronel2, Jean A. Donet 3
1 Gastroenterology, Presbyterian Healthcare Services. Albuquerque, EE UU.
2 Division of Gastroenterology, University of Chicago. Chicago, EE UU .
3 Division of Gastroenterology, University of Miami Miller School of Medicine. Miami, EE UU.
RESUMEN
La pancreatitis crónica es una enfermedad fibro-inflamatoria progresiva del páncreas caracterizada por la fibrosis irreversible de la glándula con el eventual fallo de las funciones exocrinas y endocrinas. Las características distintivas de la enfermedad son el dolor abdominal, la malabsorción, la desnutrición, la diabetes mellitus y las calcificaciones pancreáticas. En muchos pacientes el origen de esta enfermedad se debe a una compleja mezcla de factores ambientales (por ejemplo, alcohol, cigarrillos y productos químicos en el trabajo), factores genéticos y en algunos casos origen hereditario o autoinmune. El manejo incluye enfoques médico, endoscópico y quirúrgico con la necesidad de la interacción entre diversas especialidades para dar un enfoque multidisciplinario coordinado. Esta revisión ofrece una visión general de los estudios recientes resumiendo la epidemiología, etiología, fisiopatología, manifestaciones clínicas, diagnóstico y tratamiento de la enfermedad.
Palabras clave: Pancreatitis crónica; Páncreas; Revisión (fuente: DeCS BIREME).
ABSTRACT
Chronic pancreatitis is a progressive fibro-inflammatory disease of the pancreas characterized by irreversible fibrosis of the gland with eventual failure of exocrine and endocrine functions and hallmark features of abdominal pain, malabsorption, malnutrition, diabetes mellitus and pancreatic calcifications. In many patients this disease results from a complex mix of environmental (eg, alcohol, cigarettes, and occupational chemicals), genetic factors and a few patients with hereditary or autoimmune disease. The management includes medical, endoscopic and surgical approaches with the need for interaction between various specialties, calling for a concerted multidisciplinary approach. This review provides the reader with a comprehensive overview of the studies summarizing the epidemiology, etiology, physiopatology, clinical manifestation, diagnosis and treatments of the disease.
Keywords: Pancreatitis chronic; Pancreas; Review (source: MeSH NLM).
Introducción
La pancreatitis crónica (PC) es una enfermedad largo de las últimas tres décadas de aproximadamente inflamatoria crónica progresiva irreversible en la cual 4/100 000 personas-año (7). La incidencia y prevalencia el parénquima secretor del páncreas es destruído y de la PC en Latinoamérica no es bien conocida, aunque reemplazado por tejido fibroso llevando a una pérdida se cree que su frecuencia ha aumentado en las últimas permanente de las funciones endocrinas y exocrinas de la décadas. glándula (1). Dos son las formas hasta ahora reconocidas, aquella asociada con la calcificación de conductos de mayor calibre (2) y la variante de enfermedad de conductos pequeños (3,4). Las características distintivas de esta enfermedad son principalmente el dolor abdominal, mal absorción intestinal, la diabetes y la , es presencia de calcificaciones pancreáticas (5). A pesar de los avances en los métodos de diagnóstico, la pancreatitis crónica continúa representando uno de los mayores desafíos de la gastroenterología y su etiología sigue siendo difícil de establecer.
Epidemiología
La PC es una enfermedad poco común con una prevalencia anual reportada de 42/100 000 y 26/100 000 casos en Estados Unidos y Europa respectivamente (6,7) y una incidencia global que ha permanecido estable a lo largo de las últimas tres décadas de aproximadamente 4/100 000 personas-año (7). La incidencia y prevalencia de la PC en Latinoamérica no es bien conocida, aunque se cree que su frecuencia ha aumentado en las últimas décadas.
Fisiopatología
Desde la década de 1950, los estudios experimentales han demostrado que un ataque de pancreatitis comienza como pancrea-estasis (8) ,es decir, un bloqueo de la exocitosis apical de las células acinares pancreáticas (9).
Varios de los hallazgos fisiopatológicos descritos son:
1) Aumento precoz de la secreción de calcio y enzimas, con una disminución del inhibidor de la proteasa de serina tipo Kazal 1 (SPINK 1), bicarbonato y citrato (2).
2) Aumento de las concentraciones de los radicales libres de oxidación en los fluidos pancreáticos (10), lo que sugiere la progresión del estrés electrofílico y en un aparente intento de compensación, aumentan las concentraciones de los antioxidantes naturales (11) tales como la lactoferrina y la mucina (12).
3) Alteración de las concentraciones de dos proteínas del estrés (13), PAP/regIII que se activa por el estrés electrofílico y PSP/reg, la cual tiende a formar un enrejado fibroso a la digestión parcial por la tripsina (2).
4) Aumento de la GP-2, un componente secretado por la membrana del gránulo de cimógeno (14).
5) Aumento de las concentraciones de enzimas lisosómicas en el fluido ductal e interrupción de la vía del metabolismo de la metionina (15,16).
Desde el punto de vista histológico, las características que suelen ser identificadas son: la pérdida de los acinos pancreaticos, la infiltración de células mononucleares y finalmente la fibrosis (17). Las primeras lesiones suelen distribuirse en parches, por lo tanto, el aspecto normal en el material extraído con aguja no es confiable. Cada ataque inflamatorio puede causar focos de necrosis grasa que pueden dar lugar tanto a los pseudoquistes como a la fibrosis de la glándula (18) . Los nervios muestran rupturas del perineuro adyacente a los focos inflamatorios, al mismo tiempo que se produce una mayor expresión de sustancias químicas en las terminaciones nerviosas nocioceptivas (19).
La fibrosis es un signo de que en la PC las células estrelladas intersticiales están activas; estas células representan una parte importante en la progresión de la enfermedad, ya que controlan la síntesis y la degradación de las proteínas de la matriz extracelular (20,21). La activación de estas células está aumentada por las citoquinas de los leucocitos y las células acinares dañadas (21) . La etapa final de la PC se identifica por la pérdida de todo el tejido secretor, la desaparición de las células inflamatorias y una intensa fibrosis (22,23).
Etiología
Anteriormente se creía que el 90-95% de los pacientes adultos con PC, a excepción de aquellos con fibrosis quística, tenía como causa una enfermedad alcohólica o idiopática de fondo (1,24,25) sin embargo recientemente, el Grupo Norteamericano para el Estudio de la Pancreatitis (NSP2) reportó que el actual perfil epidemiológico de la PC en los Estados Unidos difiere de los datos históricos previos, mostrando que menos de la mitad, 44%, fueron asignados al consumo excesivo de alcohol, 27% tenían una etiología no alcohólica y el 29% eran de origen idiopático (26,27). La Tabla 2 resume las causas de PC.
La PC es de 2 a 4 veces más frecuente en el hombre y la edad promedio al momento del diagnóstico oscila entre los 35 y los 55 años (24,25). En la población pediátrica las causas más frecuentes son las de origen genético y por malformaciones anatómicas. Estudios realizados en Italia, China y Japón informan de una asociación con los cálculos biliares hasta en el 30% de los casos (28,29).
a) Alcohol
La PC esta asociada, en su mayoría, a un consumo crónico de alcohol de al menos 150 gramos al día por 6 a 12 años (24,25). A pesar de que el consumo crónico a sido considerado como el factor etiológico más importante, es interesante resaltar que solo un 3% de los adultos con dependencia o abuso al alcohol desarrolla la enfermedad (30,31) lo cual sugiere como otros factores podrian jugar un papel importante en el desarrollo de la misma.
El páncreas es capaz de procesar el alcohol de forma eficiente a través de una vía no oxidativa que produce ésteres etílicos de los ácidos grasos y por la oxidación por la vía del acetaldehído. In vitro, sus metabolitos dañan las células acinares y activan las células estrelladas (20,32), sin embargo, el consumo prolongado de alcohol no induce a la PC (32,33). En un estudio experimental, la exposición solamente al alcohol causa un daño mínimo a nivel pancreático, pero sensibiliza los acinos a lesiones debido a otros factores de estrés (34,35). Por ejemplo, un defecto a nivel adaptativo intracelular de las proteínas de respuesta desplegada (UPR) puede influir en los trastornos inducidos por el alcohol a nivel de los acinospancreáticos. Normalmente, la UPR es importante para manejar las proteínas plegadas
o desplegadas que se producen en respuesta a un estímulo nocivo, siendo fundamental para conservar la integridad de los acinos pancreáticos. En ratones, la administración crónica de alcohol induce a un estrés oxidativo pancreático y activa la UPR, pero la deficiencia inducida genéticamente de la misma particularmente a la proteína X-box unión 1 (XBP1), resulta en una UPR defectuosa y por ende en un aumento de la muerte de las células acinares (36-38). En otros modelos animales, las dosis pequeñas de alcohol inducen la CYP2E1, lo que aumenta la toxicidad de otras sustancias químicas a las que a la vez es expuesto el animal (39).
En un estudio metacéntrico realizado en Alemania durante el consumo de cerveza en el Múnich Oktoberfest, no se registró un aumento de los ingresos hospitalarios debido a casos de pancreatitis aguda y las personas con pancreatitis aguda atribuida al alcohol eran grandes consumidores de alcohol crónicos. Sin embargo, la editorial que acompaña este estudio hace énfasis en que los ataques de pancreatitis aguda pudieron haber sido provocados por la abstinencia de alcohol luego de un gran consumo en lugar del consumo activo (40,41).
Por lo tanto, se cree que el alcohol necesita más cofactores celulares para provocar una respuesta patológica. Posiblemente existan factores genéticos y/o ambientales todavía no bien conocidos que puedan llegar a alterar la capacidad de adaptación/protección de las células pancreáticas a la exposición al alcohol llevando a la muerte celular.
b) Tabaquismo
El humo del cigarrillo se ha convertido en un factor de riesgo importante e independiente de la PC. En un estudio sueco, el tabaquismo aumenta el riesgo de pancreatitis aguda no biliar, sobre todo cuando este está asociado al consumo de al menos 400 gramos de alcohol mensuales comparado a niveles menores. Además, en este mismo estudio se evidenció, que el riesgo de pancreatitis aguda no biliar debido al hábito de fumar fue influenciado más por la duración del tabaquismo que por el número de cigarrillos diarios. Aun no se ha establecido una relación entre el tabaquismo y la pancreatitis aguda relacionada a cálculos biliares (42). Un estudio danés publicado en el 2011, identificó al tabaquismo como el factor más importante relacionado a la progresión de la pancreatitis aguda a la crónica (43).
c) Autoinmune
La pancreatitis autoinmune (PAI) es una enfermedad inflamatoria crónica en la que se observa una infiltración linfocítica asociada a fibrosis llevando a la disfunción del páncreas (44). Esta fue reconocida por primera vez por Sarles et al. en 1961 (45) pero no fue hasta la década de los 90 luego de la publicación de varios casos clínicos que el conocimiento de esta enfermedad fue creciendo. En el 2001, Hamano et al. asociaron la presencia de niveles elevados de IgG4 con la PAI, y, seguidamente a esto, este ha surgido como un marcador bastante robusto, tanto a nivel sanguíneo como a nivel de tejido pancreático (46).
La PAI ha sido clasificada básicamente en 2 tipos: 1) el tipo 1 o esclerosante linfoplasmático y 2) tipo 2 o ducto-céntrica idiopática (47,48). Actualmente, la prevalencia de la PAI oscila entre un 5% y un 6% (49). La PAI es al menos dos veces más común en los hombres y la edad al momento del diagnóstico oscila entre los 45-50 años (50).
Czul F, et al
En un estudio reciente, fueron validados los criterios diagnósticos histopatológicos para los tipos de PAI 1 y 2. A pesar de encontrar cierto traslape entre ellas se encontraron ciertas características que ayudan a diferenciarlos. En el Tipo 1 se encontró un denso infiltrado linfoplasmático con fibrosis y flebitis obliterante, mientras que el tipo 2 las lesiones epiteliales granulocíticas eran más abundantes (51) . También se ha señalado que el tipo 1 es una enfermedad sistémica comúnmente asociada a la colangitis esclerosante, linfadenopatías y niveles elevados de IgG4, mientras que el tipo 2, se limita únicamente al páncreas y los niveles de IgG4 tienden a estar en rangos normales (52).
d) Hereditaria/Genética
La pancreatitis hereditaria (PH) es una forma de PC que se hereda de forma autosómica dominante con aproximadamente 80% de penetrancia y con una expresión variable (53-55). La mayoría de individuos afectados desarrolla síntomas antes de los 20 años de edad (56) y se ha asociado con un riesgo mayor de adenocarcinoma pancreático (57).
Los estudios genéticos de la enfermedad en los últimos 15 años han dado lugar a la identificación de cuatro genes de susceptibilidad firmemente establecidos, estos son: PRSS1 (58), SPNIK1 (59), CTRC (60) y CFTR (61).
Los estudios genéticos dieron por primera vez al descubrimiento en 1996 de un gen de alta penetrancia, el PRSS1, el cual esta asociado a la activación prematura del tripsinógeno. Una vez identificado, se observó que mientras las mutaciones con ganancia de función del PRSS1 causaban PC, la pérdida de la función protegían contra esta. La mutación PRSS1 no ha sido asociada con la pancreatitis crónica por alcohol o tropical (58).
Posteriormente a este, otros estudios han conducido a la identificación de otros genes relacionados a la PC tales como el SPINK1 (59), un gen de penetrancia intermedia y el CTRC (60), un gen de penetrancia baja. La pérdida de mutaciones funcionales en estos dos genes reduce la capacidad de estas proteínas para inhibir o degradar la tripsina activada prematuramente dentro del páncreas generando una respuesta inflamatoria en el mismo. Normalmente, si el tripsinógeno se activa prematuramente en el páncreas, es inhibido por SPINK1 y luego se autodestruye o es degradado por las proteasas de tripsina activadas (56,62).
Aunque la identificación de los tres genes antes mencionados proporciona un fuerte apoyo a la hipótesis de un siglo de antigüedad la cual sostiene que la pancreatitis es una enfermedad auto-digestiva, la identificación de otros genes tales como el CFTR y el CASR como genes de susceptibilidad podrían arrojar una explicación útil de las circunstancias que podrían promover la activación prematura del tripsinógeno (56).
La PC idiopática se ha asociado con una mutación en el gen CFTR. Los pacientes pueden tener un alelo recesivo anormal, pero la posesión de dos confiere unas 40 veces más de riesgo de desarrollar PC idiopática, que se eleva a 500 veces en pacientes que también tienen una mutación en el gen SPINK1 (63).
Pocos casos de PH han sido reportados en Latinoamérica, el más reciente, el de un niño venezolano de 11 años con episodios recurrentes de pancreatitis y episodios severos de dolor abdominal diagnosticado con PC. Luego de estudios genéticos se encontró que portaba la mutación del gen PRSS1 R122H (64).
La PH es una enfermedad compleja causada por interacciones complejas entre un número indeterminado de genes y factores ambientales. La base genética de una gran fracción de los pacientes con pancreatitis crónica todavía sigue sin explicación.
Manifestaciones clínicas
Las dos manifestaciones clínicas primarias de la PC son el dolor abdominal y la insuficiencia pancreática. a) Dolor abdominal: típicamente epigástrico, a
menudo irradia hacia atrás y es ocasionalmente asociado con náusea y vómito. Este a menudo es peor 15 a 30 minutos después de comer y temprano en el curso puede ocurrir en ataques discretos; cuando la condición progresa, el dolor tiende a ser continuo (65,66). Dos patrones han sido bien identificados, el primero consiste en repetidos brotes de dolor separados por intervalos libres predominante en los casos idiopáticos/hereditarios de aparición tardía y usualmente es manejado conservadoramente. El segundo patrón, predomina en los casos de PC asociados al alcohol o idiopático/ hereditarios de aparición temprana. Este consiste en períodos prolongados de dolor persistente con exacerbaciones. Este usualmente se relaciona a complicaciones locales como pseudoquistes
o colestasis obstructiva y se ha descrito que aproximadamente 60% de los casos requiere cirugía como tratamiento (67,68). Un estudio multicéntrico prospectivo concluyó que los pacientes que experimentan dolor constante tienen una calidad de vida inferior y mayores tasas de utilización de la discapacidad y de los recursos que los pacientes que experimentan dolor intermitente (69).
La biopatología del dolor sigue siendo enigmático, pero los factores patogénicos incluyen inflamación perineural, encapsulamiento fibrótico de los nervios sensoriales, aumento de la presión dentro del sistema ductal y la isquemia recurrente del parénquima (70). Otras hipótesis incluyen la proliferación de fibras nerviosas amielínicas y un aumento de la regulación de los mediadores del dolor, tales como la sustancia P y el gen del péptido relacionado a la calcitonina con el factor de crecimiento nervioso y dependiente de nocioreceptores (71).
b) Insuficiencia pancreática: la mayoría de los pacientes con PC desarrollará insuficiencia pancreática en algún momento debido a la pérdida del parénquima. La secreción de la lipasa pancreática es una de las primeras afectadas en la insuficiencia exocrina del páncreas conduciendo a la malabsorción de grasa o esteatorrea representado por la producción de heces de gran volumen, que tienden a tener mal olor, grasa, y difícil de limpiar, posiblemente dejando un borde de grasa en el inodoro. Se cree que la esteatorrea se desarrolla debido a la disminución de la hidrólisis luminar de la grasa dietética sólo cuando los niveles de lipasa llegan a menos del 10% y el 90% de los acinospancreáticos han sido destruidos (72). La malabsorción de grasa esta normalmente acompañada de pérdida de peso y deficiencia de las vitaminas liposolubles A-D-E y K al igual que de la vitamina B-12. Concerniente a la insuficiencia endocrina, en un estudio reciente, en 445 pacientes con PC, la prevalencia de diabetes mellitus fue del 52% a los 20 años después del inicio de la enfermedad y del 28% después de recibir cualquier intervención endoscópica o quirúrgica (73). Estos datos son consistentes con la prevalencia global de la diabetes del 47% (74) en la PC y la creciente incidencia de la diabetes con el tiempo, que va desde 0% hasta 22% al inicio de los síntomas y aumenta a más de 80% 25 años después de la aparición (67). Predictores independientes de la diabetes han sido identificados. En los pacientes con cirugía previa estos son la pancreatectomía distal y el tabaquismo y en aquellos sin cirugía serían las calcificaciones pancreáticas, la edad al inicio de la PC (temprana), el tabaquismo y el dolor crónico (75).
Basado en un reciente estudio de cohorte danés, las personas con PC tienen un mayor riesgo de muerte por cáncer (cáncer de páncreas en particular) y tienen una mayor incidencia de comorbilidades que las personas sin PC. El análisis mostró un gran aumento de la tasa de mortalidad, con una esperanza de vida que era de aproximadamente ocho años menos entre los casos de PC en comparación con los controles de la población. (Mortality, Cancer, and Comorbidities Associated with Chronic Pancreatitis-a Danish Nationwide Matched-Cohort Study. Gastroenterology.2013Dec31. pii:S0016-5085(13)01847-7.doi:10.1053/j. gastro.2013.12.033).
El impacto de la PC sobre la calidad de vida parece considerable, esta parece ser similar o peor a la de muchas enfermedades crónicas (76).
Diagnóstico
El diagnóstico de la PC se basa en la presentación clínica y estudios de imagen especialmente en estadios avanzados de la enfermedad. El estudio histológico es difícil de realizar de manera segura debido a la localización retroperitoneal de la glándula y este puede no proporcionar información fiable.
Varias clasificaciones y criterios diagnósticos para el diagnóstico de la PC han sigo descritos, entre ellos, Rosemont, Mayo, Ammann’s entre otras, sin embargo estas no han sido validadas (23,67,77).
Clínico
La presencia de dolor abdominal crónico en especial en la población con factores de riesgo debe hacer sospechar sobre la presencia de PC. Desgraciadamente esta forma de presentación no es la más habitual, y son frecuentes los casos de PC con síntomas dispépticos inespecíficos o con dolor abdominal vago sin clara relación con la ingesta de alimentos. En pacientes con enfermedad avanzada estos se presentan con signos y síntomas de mal absorción con esteatorrea y/o diabetes mellitus.
Estudio de imágenes
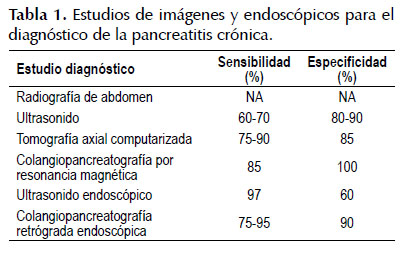
La presencia de calcificaciones pancreáticas en la radiografía simple de abdomen y/o en el ultrasonido es un hallazgo tardío y la ausencia de éstas, no debe nunca permitir que se excluya el diagnóstico de PC.
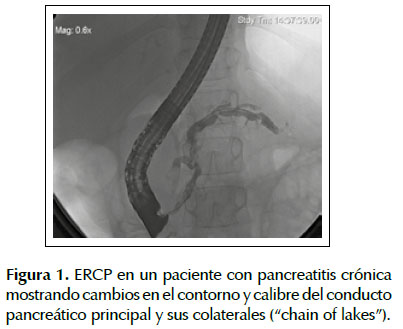
La tomografía axial computarizada (TAC) puede demostrar la presencia de un conducto pancreático dilatado junto con una glándula aumentada o disminuida de tamaño de contornos irregulares. Hallazgos patognomónicos revelan calcificaciones dentro de los conductos pancreáticos, pseudoquistes, dilatación ductal, trombosis, pseudoaneurismas, necrosis y atrofia parénquima (24,78). El método de imagen más sensible es la colangiopancreatografía retrógrada endoscópica (CPRE), esta permite detectar cambios mínimos en el contorno y calibre del conducto pancreático principal y sus colaterales, como se muestra en la Figura 1 . Debido al alto riesgo de complicaciones, la CPRE es raramente recomendada para el diagnóstico (1,79). Por no ser invasiva, la colangiopancreatografía por resonancia magnética está suplantando a la CPRE diagnóstica, sin embargo, su sensibilidad para la visualización de las ramas pancreáticas de segundo y tercer orden es claramente inferior a la CPRE (80).
Otra técnica utilizada es el ultrasonido endoscópico (EUS) el cual tiene una sensibilidad del 97% y una especificidad del 60%. El EUS ha surgido como una prueba de diagnóstico de primera línea para los estadios tempranos y para la evaluación de las lesiones quísticas o masas. Dando un pretest-probability del 50%, el 70% de los pacientes con un EUS positivo tiene PC y el 95% con una prueba negativa no. Las tasas de complicación del EUS son bajas; 2 a 3% de los pacientes desarrollan pancreatitis, y menos de 1% desarrolla hemorragia y/o infección (81-83).
La Tabla 1 muestra la sensibilidad y especifidad de los estudios por imágenes y endoscópicos en forma comparativa.
Funcional
El test de mayor eficacia diagnóstica y "Gold estándar" en el diagnóstico funcional de la enfermedad es el test de secreción de la secretina pancreática (84). Sin embargo, la invasividad de esta prueba, la dificultad en el manejo correcto de las muestras de secreción duodenal obtenidas y la ausencia de estandarización de éste limitan su aplicabilidad clínica.
Clasificación Toxico-metabólicas Factores de riesgo Alcohol Insuficiencia renal crónica Hypercalcemia Hyperlipidemia Medicamentos Tabaco Toxinas Idiopática De iniciotemprano o tardio Pancreatitis tropical Genéticas PRSS-1 SPINK-1 CFTR CTRC Autoinmune Tipo 1 -esclerosantelinfoplasmático Tipo 2 –ductocentricaidiopática Pancreatitis aguda severa y recurrente Irradiación Post-necrótica Pancreatitis aguda recurrente Isquemia Pancreas divisum Obstructiva Disfunción del esfínter de Oddi Obstrucción del ductopancreático
En la PC, las concentraciones séricas de amilasa y lipasa pueden estar ligeramente elevadas, pero generalmente son normales por las siguientes razones: (1) la fibrosis pancreática significativa reduce el nivel de estas enzimas en el páncreas y (2) es una enfermedad focal que sólo eleva mínimamente las enzimas pancreáticas en la sangre (5).
La esteatorrea, si se sospecha, se puede evaluar cualitativamente mediante la tinción de Sudán de las heces. Dado que la prueba cualitativa es bastante insensible, a menos que el paciente tenga una esteatorrea evidente esta se necesita realizar con el paciente en una dieta alta en grasas. La esteatorrea también se puede evaluar cuantitativamente mediante la determinación de la excreción de grasa fecal en 24 horas con el paciente ingiriendo una dieta de 100 g de grasa diarios. Estas pruebas se realizan generalmente por 72 horas y la excreción de más de 7 g de grasa por día se considera diagnóstico de malabsorción (85).
Otro de los métodos para el diagnóstico de la insuficiencia pancreática exocrina es la medición de la elastasa fecal. Valores de menos de 200 mg sugieren una insuficiencia pancreática exocrina. Es importante destacar que valores bajos de elastasa fecal también se observan en un 25% a 30% de los pacientes con enfermedades que involucran el intestino delgado y en pacientes con diabetes mellitus, una complicación común de la PC. Ya que la elastasa fecal disminuida puede ser encontrada en una variedad de otras condiciones del intestino delgado, esta no debería ser utilizada como una herramienta de diagnóstico para la PC (86,87).
La Tabla 3 muestra un resumen de los estudios de laboratorio usados en la evaluación de PC.
Tratamiento
Los objetivos del tratamiento de la PC son aliviar el dolor, calmar el proceso de la enfermedad para prevenir los ataques recurrentes, corregir consecuencias metabólicas como la diabetes o la malnutrición y el tratamiento de las complicaciones que puedan surgir. El tratamiento endoscópico, quirúrgico, o ambos, son necesarios sólo cuando el tratamiento médico óptimo no consigue aliviar el dolor y para tratar las complicaciones específicas asociadas a la PC.
Médico
La base del tratamiento es la modificación del estilo de vida (por ejemplo, el cese de consumo de alcohol y tabaco) y cambios en la dieta (dieta baja en grasa, comer pequeñas comidas) (65). El tratamiento médico gira en torno a los analgésicos, hidratación y suplementación con enzimas pancreáticas. Los antiinflamatorios no esteroideos y el paracetamol son los agentes de primera línea seguido por los opioides débiles tales como el tramadol, los cuales pueden ser asociados a un antidepresivo neuroléptico. La analgesia con narcóticos debe de evitarse al máximo ya que estos medicamentos pueden agravar los síntomas por sus efectos secundarios tales como la gastroparesis y la constipación y por la tolerancia que estos desarrollan. La adicción a estos suele ser una consecuencia común del tratamiento y debe ser monitorizado de cerca (66,88).
Las indicaciones para la terapia de reemplazo con enzimas pancreáticas incluyen la pérdida de peso y la excreción de más de 15 g de grasa fecal diaria en una dieta de 100 g/día de grasa. El papel del reemplazo con esteatorrea asintomática de menos de 15 g / día es polémica. Sobre la base de la literatura antigua, se aconseja que la dosis debe ser duplicada a aproximadamente 90 000 unidades USP de lipasa con las comidas que contienen 25 g o más de grasa (88,89). El momento de administración de las enzimas pancreáticas puede afectar a la eficacia terapéutica y una mezcla adecuada de los alimentos con las enzimas pancreáticas y la motilidad intestinal óptima son cruciales para la digestión satisfactoria de las grasas.
El manejo nutricional de la insuficiencia pancreática exocrina incluye modificación de la dieta, tales como la limitación del contenido de grasa en la dieta, y la administración de las vitaminas liposolubles calcio y vitamina B12. Las vitaminas liposolubles se pueden administrar oralmente usando preparaciones de formas solubles en agua (90).
El octreótido, un sintético de acción prolongada análogo de la somatostatina, inhibe las secreciones pancreáticas directa y también indirectamente mediante el bloqueo de la CCK y la liberación de secretina también, ha sido usado para el tratamiento de la PC. En modelos experimentales, se ha demostrado que tiene propiedades antiinflamatorias y también puede llegar a proteger las células pancreáticas. El octreotido se ha usado para bajar la presión intraductal y disminuir la proteólisis (91). Los expertos, sin embargo, han advertido sobre el aumento del riesgo de hipoglucemia o un control de la glucosa en personas con diabetes más difícil. Dado que el octreotido predispone a estasis biliar, los pacientes deben ser estrechamente monitorizados por el riesgo en la formación de cálculos biliares (92). En general, la terapia con octreotido no se ha aceptado ampliamente debido a las razones anteriores y porque su eficacia no se ha demostrado consistentemente.
Endoscópico
Los expertos creen que el manejo endoscópico tiene un papel importante en los pacientes que no son candidatos óptimos para tratamientos quirúrgicos como una medida primaria terapéutica y en los que el tratamiento médico fracasa (93).
El objetivo de la terapia endoscópica es aliviar la obstrucción del conducto pancreático y reducir la presión en el conducto pancreático. Descompresión del conducto pancreático mediante CPRE incluye la dilatación y stenting de la estenosis del conducto pancreático, que suele ir precedido de una esfinterotomía y la eliminación de la obstrucción del conducto pancreático por cálculos (19). La terapia endoscópica es más apropiada en presencia de una lesión obstructiva única con dilatación ductal más arriba del sitio de la obstrucción y preferiblemente con la piedra más pequeña de 1 cm que se encuentre en el conducto pancreático principal, no demasiado numerosas y fácilmente susceptibles a la manipulación endoscópica (94).
El bloqueo del plexo celiaco por EUS (BPC, bupivacaína más triamcinolona) y la neurolisis del plexo celiaco (NPC, bupivacaína más alcohol) se utiliza cada vez más en lugar de la BPC percutánea guiada por fluorosocpia y la NPC para el tratamiento de la PC dolorosa. En un estudio en pacientes con PC dolorosa tratados con BPC se reportó que más pacientes en el grupo EUS vs percutáneo tuvo mejores puntuaciones de dolor (70 vs 30%, p=0,044) y tenían menos dolor durante más tiempo. Por otra parte, el BPC guiado por EUS produjo un alivio inmediato (26 de 27) y un menor consumo de analgésicos, pero el alivio del dolor disminuyó con el tiempo de modo que ninguno de los pacientes tuvo alivio del dolor a las 24 semanas. Estos datos confirman la impresión clínica de que la BPC ofrece meses de alivio del dolor y tiene un valor en el tratamiento de la PC dolorosa. Generalmente se prefiere evitar el BPC y la NPC para tratar la PC dolorosa debido a la permanencia de la neurolisis y el temor a las complicaciones (95).
La evidencia reciente de Dite et al. sugiere que los resultados quirúrgicos fueron más durables que el tratamiento endoscópico en pacientes con un conducto pancreático dilatado, piedras y/o estenosis (96) . Cahen et al. informaron recientemente de mejores resultados en el control del dolor después de la cirugía que con la intervención endoscópica. Aunque estos estudios indican que la cirugía podría ser una mejor intervención que la endoscopía, hay que señalar que ninguno de esos estudios provenía de centros que utilizan de forma rutinaria la litotripsia endoscópica, que se ha incorporado en el manejo de los pacientes con cálculos pancreáticos (97). Estos resultados fueron corroborados más recientemente por el grupo de Ámsterdam en un ensayo aleatorio que compara la litotripsia endoscópica con el drenaje quirúrgico del conducto pancreático. En este estudio, si bien la tasa de complicaciones, estancia hospitalaria y los cambios en la función pancreática fueron similares en ambos grupos, los pacientes que recibieron tratamiento endoscópico necesitaron más procedimientos que en los pacientes tratados quirúrgicamente (una media de 8 en comparación con 3 cirugías). Al final de los 24 meses de seguimiento, el alivio del dolor completo o parcial se alcanzó en el 32% de los pacientes asignados al drenaje endoscópico, en comparación con el 75% de los pacientes asignados a cirugía (98) . Los mismos investigadores publicaron sus resultados de los últimos 5 años, que confirmó además que la cirugía en el momento de la presentación inicial fue superior a la litotripsia y a la colocación de stents, no sólo en términos de alivio del dolor, pero también en términos de complicaciones y reintervenciones requeridas, sin estar asociado con mayores costos (99). Estos ensayos aleatorizados, aunque criticados por fallas metodológicas, sugieren que la terapia quirúrgica es superior y más duradera en comparación con la terapia endoscópica para determinados pacientes con PC con conducto pancreático dilatado.
Quirúrgico
Para los pacientes que no responden a la terapia médica, la terapia quirúrgica se está convirtiendo en una opción viable, sobre todo para los pacientes con una clara anomalía anatómica corregible. Los objetivos de la cirugía son descomprimir los conductos obstruidos y para preservar el tejido pancreático y órganos adyacentes. El procedimiento de Puestow modificado o pancreato-yeyunostomía lateral, es un procedimiento relativamente sencillo que se realiza con frecuencia. Las estenosis ductales son disecadas permitiendo a las piedras ser eliminadas. Alivio a corto plazo del dolor se observa en aproximadamente 80% de los pacientes, sin embargo, alivio a largo plazo se reduce a 50% en unos 5 años (100).
El procedimiento de Whipple clásico también se utiliza para la resección de lesiones a nivel de la cabeza del páncreas. Este procedimiento es curativo, con resolución completa de los síntomas de la pancreatitis y también se considera si existe una obstrucción duodenal o si el diagnóstico de cáncer no ha podido ser excluido, previo a la cirugía (101); sin embargo, el procedimiento de Whipple sacrifica una porción extensa del parénquima pancreático funcional. Ha habido muchas modificaciones a este procedimiento, tales como la resección de la cabeza pancreática con preservación del duodeno conocido como procedimiento de Beger y el procedimiento de Frey, que apunta a preservar el duodeno y el píloro. Ambos procedimientos se asocian con baja morbilidad y mortalidad y demuestran un alto grado de alivio del dolor (102,103). En general, aunque el alivio del dolor inmediato es similar en los pacientes que recibieron el procedimiento Puestow modificado, el alivio a largo plazo parece ser superior a expensas de más complicaciones peri y postoperatorias (19). Un análisis reciente de la mortalidad después de la pancreatectomía para PC mostró que la pancreatectomía proximal se asoció con un riesgo 2,5 veces mayor de muerte en comparación con la pancreatectomia distal (104).
En resumen, los enfoques quirúrgicos han evolucionado considerablemente en los últimos años, la elección final del procedimiento adecuado debe guiarse, por la experiencia del cirujano individual y del centro médico.
Pancreatectomia total con trasplante autólogo de islotes pancreáticos
El autotrasplante de islotes pancreáticos (IAT) se ha utilizado con éxito para tratar la diabetes 'quirúrgica' luego de la pancreatectomia total (PT) y fue reportado por primera vez hace 30 años (105). Los métodos para el aislamiento de islotes pancreáticos después de la PT han mejorado y se ha adquirido más experiencia, con más de 20 centros en todo el mundo llevando a cabo el procedimiento. Este procedimiento también ha surgido como una opción atractiva para los pacientes con pancreatitis hereditaria, para la prevención de cáncer pancreático que se puede asociar con PH, para la preservación de una cierta función endocrina cuando la destrucción glandular final es inevitable y como último recurso para el tratamiento del dolor refractario. Actualmente, el procedimiento se realiza en pacientes con enfermedad dolorosa refractaria de pequeños conductos (conducto pancreático principal no está dilatado) (106). Se ha sugerido que la TP/IAT debe llevarse a cabo al principio del curso de la PC, evitando así las complicaciones del uso crónico de opioides. Otra ventaja es el reclutamiento más alto de islotes pancreáticos en un parénquima que este menos comprometido por fibrosis o por cirugía previas (107). En otro estudio se ha demostrado que se es capaz de obtener el número suficiente de islotes pancreáticos que cuando trasplantados, aun en pacientes menores de 18 años confiere beneficios para su salud y la oportunidad de lograr la independencia de insulina (108). Con el creciente éxito de TP/IAT, este procedimiento puede ser ofrecido tempranamente en el curso de la historia natural de la PC (109-110).
Conflicto de intereses:Los autores declaran no tener conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Etemad B, Whitcomb DC. Chronic pancreatitis: diagnosis, classification, and new genetic developments. Gastroenterology. 2001. 120(3);682-707. [ Links ]
2. Sarles H. Etiopathogenesis and definition of chronic pancreatitis. Dig Dis Sci. 1986;31(9 Suppl);91S-107S. [ Links ]
3. Walsh TN, Rode J, Theis BA, Russell RC. Minimal change chronic pancreatitis. Gut. 1992;33(11);1566-71. [ Links ]
4. Gupta V, Toskes PP. Diagnosis and management of chronic pancreatitis. Postgrad Med J. 2005;81(958);491-7. [ Links ]
5. Steer ML. Waxman I, Freedman S. Chronic pancreatitis. N Engl J Med. 1995;332(22);1482-90. [ Links ]
6. Lévy P, Barthet M, Mollard BR, Amouretti M, Marion-Audibert AM, Dyard F. Estimation of the prevalence and incidence of chronic pancreatitis and its complications. Gastroenterol Clin Biol. 2006;30(6-7);838-44. [ Links ]
7. Yadav D, Timmons L, Benson JT, Dierkhising RA, Chari ST. Incidence, prevalence, and survival of chronic pancreatitis: a population-based study. Am J Gastroenterol. 2011;106(12);2192-9. [ Links ]
8. Kloppel G, Maillet B. Chronic pancreatitis: evolution of the disease. Hepatogastroenterology. 1991;38(5);408-12. [ Links ]
9. Gaisano HY, Gorelick FS. New insights into the mechanisms of pancreatitis. Gastroenterology. 2009;136(7);2040-4. [ Links ]
10. Santini SA, Spada C, Bononi F, Foschia F, Mutignani M, Perri V, et al. Liver, pancreas and biliary tract enhanced lipoperoxidation products in pure pancreatic juice: evidence for organ-specific oxidative stress in chronic pancreatitis. Dig Liver Dis. 2003;35(12);888-92. [ Links ]
11. Gutteridge JM. Lipid peroxidation and antioxidants as biomarkers of tissue damage. Clin Chem. 1995;41(12 Pt 2);1819-28. [ Links ]
12. Jin CX, Hayakawa T, Kitagawa M, Ishiguro H. Lactoferrin in chronic pancreatitis. JOP. 2009;10(3);237-41. [ Links ]
13. Graf R, Schiesser M, Reding T, Appenzeller P, Sun LK, Fortunato F, et al. Exocrine meets endocrine: pancreatic stone protein and regenerating protein--two sides of the same coin. J Surg Res. 2006;133(2);113-20. [ Links ]
14. Freedman SD, Sakamoto K, Venu RP. GP2, the homologue to the renal cast protein uromodulin, is a major component of intraductal plugs in chronic pancreatitis. J Clin Invest. 1993;92(1);83-90. [ Links ]
15. Braganza JM, Dormandy TL. Micronutrient therapy for chronic pancreatitis: rationale and impact. JOP. 2010;11(2);99-112. [ Links ]
16. Girish BN, Vaidyanathan K, Rao NA, Rajesh G, Reshmi S, Balakrishnan V. Chronic pancreatitis is associated with hyperhomocysteinemia and derangements in transsulfuration and transmethylation pathways. Pancreas. 2010;39(1):e11-6. [ Links ]
17. Shrikhande SV, Martignoni ME, Shrikhande M, Kappeler A, Ramesh H, Zimmermann A, et al. Comparison of histological features and inflammatory cell reaction in alcoholic, idiopathic and tropical chronic pancreatitis. Br J Surg. 2003;90(12):1565-72. [ Links ]
18. Kloppel G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol. 2007;20 Suppl 1:S113-31. [ Links ]
19. Lieb JG, Forsmark CE. Review article: pain and chronic pancreatitis. Aliment Pharmacol Ther. 2009;29(7):706-19. [ Links ]
20. Witt H, Apte MV, Keim V, Wilson JS. Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis, and therapy. Gastroenterology: 2007;132(4):1557-73. [ Links ]
21. Stevens T, Conwell DL, Zuccaro G. Pathogenesis of chronic pancreatitis: an evidence-based review of past theories and recent developments. Am J Gastroenterol. 2004;99(11):2256-70. [ Links ]
22. Ammann RW. Diagnosis and management of chronic pancreatitis: current knowledge. Swiss Med Wkly. 2006;136(11-12):166-74. [ Links ]
23. Buchler MW, Martignoni ME, Friess H, Malfertheiner P. A proposal for a new clinical classification of chronic pancreatitis. BMC Gastroenterol. 2009;9:93. [ Links ]
24. Lin Y, Tamakoshi A, Matsuno S, Takeda K, Hayakawa T, Kitagawa M, et al. Nationwide epidemiological survey of chronic pancreatitis in Japan. J Gastroenterol. 2000;35(2):136-41. [ Links ]
25. Chen WX, Zhang WF, Li B, Lin HJ, Zhang X, Chen HT, et al. Clinical manifestations of patients with chronic pancreatitis. Hepatobiliary Pancreat Dis Int. 2006;5(1):133-7. [ Links ]
26. Yadav D, Whitcomb DC. The role of alcohol and smoking in pancreatitis. Nat Rev Gastroenterol Hepatol. 2010;7(3):131-45. [ Links ]
27. Cote GA, Yadav D, Slivka A, Hawes RH, Anderson MA, Burton FR, et al. Alcohol and smoking as risk factors in an epidemiology study of patients with chronic pancreatitis. Clin Gastroenterol Hepatol. 2011;9(3):266-73; quiz e27. [ Links ]
28. Yan MX, Li YQ. Gall stones and chronic pancreatitis: the black box in between. Postgrad Med J, 2006. 82(966):254-8. [ Links ]
29. Frulloni L, Gabbrielli A, Pezzilli R, Zerbi A, Cavestro GM, Marotta F, et al. Chronic pancreatitis: report from a multicenter Italian survey (PanCroInfAISP) on 893 patients. Dig Liver Dis. 2009;41(4):311-7. [ Links ]
30. Yadav D, Eigenbrodt ML, Briggs MJ, Williams DK, Wiseman EJ. Pancreatitis: prevalence and risk factors among male veterans in a detoxification program. Pancreas. 2007;34(4):390-8. [ Links ]
31. Lankisch PG, Lowenfels AB, Maisonneuve P. What is the risk of alcoholic pancreatitis in heavy drinkers? Pancreas. 2002;25(4):411-2. [ Links ]
32. Pandol SJ, Raraty M. Pathobiology of alcoholic pancreatitis. Pancreatology. 2007;7(2-3):105-14. [ Links ]
33. Li J, Guo M, Hu B, Liu R, Wang R, Tang C. Does chronic ethanol intake cause chronic pancreatitis?: evidence and mechanism. Pancreas. 2008;37(2):189-95. [ Links ]
34. Lu Z, Karne S, Kolodecik T, Gorelick FS. Alcohols enhance caerulein-induced zymogen activation in pancreatic acinar cells. Am J Physiol Gastrointest Liver Physiol. 2002;282(3):G501-7. [ Links ]
35. Gukovsky I, Lugea A, Shahsahebi M, Cheng JH, Hong PP, Jung YJ, et al. A rat model reproducing key pathological responses of alcoholic chronic pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2008;294(1):G68-79. [ Links ]
36. Lugea A, Tischler D, Nguyen J, Gong J, Gukovsky I, French SW, et al. Adaptive unfolded protein response attenuates alcohol-induced pancreatic damage. Gastroenterology. 2011;140(3):987-97. [ Links ]
37. Hess DA, Humphrey SE, Ishibashi J, Damsz B, Lee AH, Glimcher LH, et al. Extensive pancreas regeneration following acinar-specific disruption of Xbp1 in mice. Gastroenterology. 2011;141(4):1463-72. [ Links ]
38. DiMagliano MP. Pancreatic stress and regeneration. Gastroenterology. 2011;141(4):1155-8. [ Links ]
39. Lieber CS. The discovery of the microsomal ethanol oxidizing system and its physiologic and pathologic role. Drug Metab Rev. 2004;36(3-4):511-29. [ Links ]
40. Phillip V, Huber W, Hagemes F, Lorenz S, Matheis U, Preinfalk S, et al. Incidence of acute pancreatitis does not increase during Oktoberfest, but is higher than previously described in Germany. Clin Gastroenterol Hepatol. 2011;9(11):995-1000 e3. [ Links ]
41. DiMagno MJ. Oktoberfest binge drinking and acute pancreatitis: is there really no relationship? Clin Gastroenterol Hepatol. 2011;9(11):920-2. [ Links ]
42. Sadr-Azodi O1, Andrén-Sandberg A, Orsini N, Wolk A. Cigarette smoking, smoking cessation and acute pancreatitis: a prospective population-based study. Gut. 2012;61(2):262-7. [ Links ]
43. Nojgaard C, Becker U, Matzen P, Andersen JR, Holst C, Bendtsen F. Progression from acute to chronic pancreatitis: prognostic factors, mortality, and natural course. Pancreas. 2011;40(8):1195-200. [ Links ]
44. Finkelberg DL, Sahani D, Deshpande V, Brugge WR. Autoimmune pancreatitis. N Engl J Med. 2006;355(25):2670-6. [ Links ]
45. Sarles H, Sarles Jc, Muratore R, Guien C. Chronic inflammatory sclerosis of the pancreas--an autonomous pancreatic disease? Am J Dig Dis. 1961;6:688-98. [ Links ]
46. Hamano H, Kawa S, Horiuchi A, Unno H, Furuya N, Akamatsu T, et al. High serum IgG4 concentrations in patients with sclerosing pancreatitis. N Engl J Med. 2001;344(10):732-8. [ Links ]
47. Park DH, Kim MH, Chari ST. Recent advances in autoimmune pancreatitis. Gut. 2009;58(12):1680-9. [ Links ]
48. Kamisawa T, Notohara K, Shimosegawa T. Two clinicopathologic subtypes of autoimmune pancreatitis: LPSP and IDCP. Gastroenterology. 2010;139(1):22-5. [ Links ]
49. Kim KP, Kim MH, Song MH, Lee SS, Seo DW, Lee SK. Autoimmune chronic pancreatitis. Am J Gastroenterol. 2004;99(8):1605-16. [ Links ]
50. Sah RP, Pannala R, Chari ST, Sugumar A, Clain JE, Levy MJ, et al. Prevalence, diagnosis, and profile of autoimmune pancreatitis presenting with features of acute or chronic pancreatitis. Clin Gastroenterol Hepatol. 2010;8(1):91-6. [ Links ]
51. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T, et al. Histopathologic and clinical subtypes of autoimmune pancreatitis: the Honolulu consensus document. Pancreas. 2010;39(5):549-54. [ Links ]
52. Kamisawa T, Takuma K, Egawa N, Tsuruta K, Sasaki T. Autoimmune pancreatitis and IgG4-related sclerosing disease. Nat Rev Gastroenterol Hepatol. 2010;7(7):401-9. [ Links ]
53. Howes N, Lerch MM, Greenhalf W, Stocken DD, Ellis I, Simon P, et al. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol. 2004;2(3):252-61. [ Links ]
54. Perrault J. Hereditary pancreatitis. Gastroenterol Clin North Am. 1994;23(4):743-52. [ Links ]
55. Whitcomb DC, Preston RA, Aston CE, Sossenheimer MJ, Barua PS, Zhang Y, et al. A gene for hereditary pancreatitis maps to chromosome 7q35. Gastroenterology. 1996;110(6):1975-80. [ Links ]
56. Chen JM, Ferec C. Chronic pancreatitis: genetics and pathogenesis. Annu Rev Genomics Hum Genet. 2009;10:63-87. [ Links ]
57. Lowenfels AB, Maisonneuve P, DiMagno EP, Elitsur Y, Gates LK Jr, Perrault J, et al. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst. 1997;89(6):442-6. [ Links ]
58. Whitcomb DC, Gorry MC, Preston RA, Furey W, Sossenheimer MJ, Ulrich CD, et al. Hereditary pancreatitis is caused by a mutation in the cationic trypsinogen gene. Nat Genet. 1996;14(2):141-5. [ Links ]
59. Witt H, Luck W, Hennies HC, Classen M, Kage A, Lass U, et al. Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet. 2000;25(2):213-6. [ Links ]
60. Masson E, Chen JM, Scotet V, Le Maréchal C, Férec C. Association of rare chymotrypsinogen C (CTRC) gene variations in patients with idiopathic chronic pancreatitis. Hum Genet. 2008;123(1):83-91. [ Links ]
61. Cohn JA, Friedman KJ, Noone PG, Knowles MR, Silverman LM, Jowell PS. Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Engl J Med. 1998;339(10):653-8. [ Links ]
62. Ooi CY, Gonska T, Durie PR, Freedman SD. Genetic testing in pancreatitis. Gastroenterology. 2010;138(7):2202-6, 2206 e1. [ Links ]
63. Cohn JA. Reduced CFTR function and the pathobiology of idiopathic pancreatitis. J Clin Gastroenterol. 2005;39(4 Suppl 2):S70-7. [ Links ]
64. Solomon S, Gelrud A, Whitcomb DC. Low Penetrance Pancreatitis Phenotype in a Venezuelan Kindred with a PRSS1 R122H Mutation. JOP. 2013;14(2):187-9. [ Links ]
65. Ahmed SA, Wray C, Rilo HL, Choe KA, Gelrud A, Howington JA, et al. Chronic pancreatitis: recent advances and ongoing challenges. Curr Probl Surg. 2006;43(3):127-238. [ Links ]
66. Warshaw AL, Banks PA, Fernandez-Del Castillo C. AGA technical review: treatment of pain in chronic pancreatitis. Gastroenterology. 1998;115(3):765-76. [ Links ]
67. Layer P, Yamamoto H, Kalthoff L, Clain JE, Bakken LJ, DiMagno EP. The different courses of early- and late-onset idiopathic and alcoholic chronic pancreatitis. Gastroenterology. 1994;107(5):1481-7. [ Links ]
68. Ammann RW, Muellhaupt B. The natural history of pain in alcoholic chronic pancreatitis. Gastroenterology. 1999;116(5):1132-40. [ Links ]
69. Mullady DK, Yadav D, Amann ST, O'Connell MR, Barmada MM, Elta GH, et al. Type of pain, pain-associated complications, quality of life, disability and resource utilisation in chronic pancreatitis: a prospective cohort study. Gut. 2011;60(1):77-84.
70. Bradley EL 3rd. Pancreatic duct pressure in chronic pancreatitis. Am J Surg. 1982;144(3):313-6. [ Links ]
71. Winston JH, He ZJ, Shenoy M, Xiao SY, Pasricha PJ. Molecular and behavioral changes in nociception in a novel rat model of chronic pancreatitis for the study of pain. Pain. 2005;117(1-2):214-22. [ Links ]
72. DiMagno EP, Go VL, Summerskill WH. Relations between pancreatic enzyme ouputs and malabsorption in severe pancreatic insufficiency. N Engl J Med. 1973;288(16):813-5. [ Links ]
73. Wang W, Guo Y, Liao Z, Zou DW, Jin ZD, Zou DJ, et al. Occurrence of and risk factors for diabetes mellitus in Chinese patients with chronic pancreatitis. Pancreas. 2011;40(2):206-12. [ Links ]
74. Lowenfels AB, Maisonneuve P, Cavallini G, Ammann RW, Lankisch PG, Andersen JR, et al. Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. N Engl J Med. 1993;328(20):1433-7. [ Links ]
75. Malka D, Hammel P, Sauvanet A, Rufat P, OToole D, Bardet P, et al. Risk factors for diabetes mellitus in chronic pancreatitis. Gastroenterology. 2000;119(5):1324-32. [ Links ]
76. Amann ST, Yadav D, Barmada MM, OConnell M, Kennard ED, Anderson M, et al. Physical and Mental Quality of Life in Chronic Pancreatitis: A Case-Control Study From the North American Pancreatitis Study 2 Cohort. Pancreas. 2013;42(2):293-300. [ Links ]
77. Catalano MF, Sahai A, Levy M, Romagnuolo J, Wiersema M, Brugge W, et al. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointest Endosc. 2009;69(7):1251-61. [ Links ]
78. Remer EM, Baker ME. Imaging of chronic pancreatitis. Radiol Clin North Am. 2002;40(6):1229-42, v. [ Links ]
79. Adler DG, Baron TH, Davila RE, Egan J, Hirota WK, Leighton JA, et al. ASGE guideline: the role of ERCP in diseases of the biliary tract and the pancreas. Gastrointest Endosc. 2005;62(1):1-8. [ Links ]
80. Mitchell RM, Byrne MF, Baillie J. Pancreatitis. Lancet. 2003;361(9367):1447-55. [ Links ]
81. Stevens T, Parsi MA. Endoscopic ultrasound for the diagnosis of chronic pancreatitis. World J Gastroenterol. 2010;16(23):2841-50. [ Links ]
82. Morris-Stiff G, Webster P, Frost B, Lewis WG, Puntis MC, Roberts SA. Endoscopic ultrasound reliably identifies chronic pancreatitis when other imaging modalities have been nondiagnostic. JOP. 2009;10(3):280-3. [ Links ]
83. Seicean A. Endoscopic ultrasound in chronic pancreatitis: where are we now? World J Gastroenterol. 2010;16(34):4253-63. [ Links ]
84. Glasbrenner B, Kahl S, Malfertheiner P. Modern diagnostics of chronic pancreatitis. Eur J Gastroenterol Hepatol. 2002;14(9):935-41. [ Links ]
85. Fine KD, Ogunji F. A new method of quantitative fecal fat microscopy and its correlation with chemically measured fecal fat output. Am J Clin Pathol. 2000;113(4):528-34. [ Links ]
86. Keim V, Teich N, Moessner J. Clinical value of a new fecal elastase test for detection of chronic pancreatitis. Clin Lab. 2003;49(5-6):209-15. [ Links ]
87. Beharry S, Ellis L, Corey M, Marcon M, Durie P. How useful is fecal pancreatic elastase 1 as a marker of exocrine pancreatic disease? J Pediatr. 2002;141(1):84-90. [ Links ]
88. DiMagno MJ, DiMagno EP. Chronic pancreatitis. Curr Opin Gastroenterol. 2012;28(5):523-31. [ Links ]
89. Dominguez-Munoz JE. Chronic pancreatitis and persistent steatorrhea: what is the correct dose of enzymes? Clin Gastroenterol Hepatol. 2011;9(7):541-6. [ Links ]
90. Maqbool A, Stallings VA. Update on fat-soluble vitamins in cystic fibrosis. Curr Opin Pulm Med. 2008;14(6):574-81. [ Links ]
91. Lieb JG 2nd, Shuster JJ, Theriaque D, Curington C, Cintrón M, Toskes PP. A pilot study of Octreotide LAR vs. octreotide tid for pain and quality of life in chronic pancreatitis. JOP. 2009;10(5):518-22. [ Links ]
92. Uhl, W., et al. The role of octreotide and somatostatin in acute and chronic pancreatitis. Digestion. 1999;60 Suppl 2:23-31. [ Links ]
93. Weber, A., et al. Endoscopic stent therapy in patients with chronic pancreatitis: A 5-year follow-up study. World J Gastroenterol. 2013;19(5):715-20. [ Links ]
94. Oza VM, Kahaleh M. Endoscopic management of chronic pancreatitis. World J Gastrointest Endosc. 2013;5(1):19-28. [ Links ]
95. Goodman AJ, Gress FG. The endoscopic management of pain in chronic pancreatitis. Gastroenterol Res Pract. 2012;2012:860879. [ Links ]
96. Dite, P., et al. A prospective, randomized trial comparing endoscopic and surgical therapy for chronic pancreatitis. Endoscopy. 2003;35(7):553-8. [ Links ]
97. Cahen DL, van Berkel AM, Oskam D, Rauws EA, Weverling GJ, Huibregtse K, et al. Long-term results of endoscopic drainage of common bile duct strictures in chronic pancreatitis. Eur J Gastroenterol Hepatol. 2005;17(1):103-8. [ Links ]
98. Cahen DL, Gouma DJ, Nio Y, Rauws EA, Boermeester MA, Busch OR, et al. Endoscopic versus surgical drainage of the pancreatic duct in chronic pancreatitis. N Engl J Med. 2007;356(7):676-84. [ Links ]
99. Cahen DL, Gouma DJ, Laramée P, Nio Y, Rauws EA, Boermeester MA, et al. Long-term outcomes of endoscopic vs surgical drainage of the pancreatic duct in patients with chronic pancreatitis. Gastroenterology. 2011;141(5):1690-5. [ Links ]
100. Trikudanathan G, Navaneethan U, Vege SS. Modern treatment of patients with chronic pancreatitis. Gastroenterol Clin North Am. 2012;41(1):63-76. [ Links ]
101. Manzelli A, Petrou A, Lazzaro A, Brennan N, Soonawalla Z, Friend P. Groove pancreatitis. A mini-series report and review of the literature. JOP. 2011;12(3):230-3. [ Links ]
102. Frey CF, Smith GJ. Description and rationale of a new operation for chronic pancreatitis. Pancreas. 1987;2(6):701-7. [ Links ]
103. McClaine RJ, Lowy AM, Matthews JB, Schmulewitz N, Sussman JJ, Ingraham AM, et al. A comparison of pancreaticoduodenectomy and duodenum-preserving head resection for the treatment of chronic pancreatitis. HPB (Oxford). 2009;11(8):677-83. [ Links ]
104. Hill JS, McPhee JT, Whalen GF, Sullivan ME, Warshaw AL, Tseng JF. In-hospital mortality after pancreatic resection for chronic pancreatitis: population-based estimates from the nationwide inpatient sample. J Am Coll Surg. 2009;209(4):468-76. [ Links ]
105. Najarian JS, Sutherland DE, Matas AJ, Goetz FC. Human islet autotransplantation following pancreatectomy. Transplant Proc. 1979;11(1):336-40. [ Links ]
106. Schmulewitz N. Total pancreatectomy with autologous islet cell transplantation in children: making a difference. Clin Gastroenterol Hepatol. 2011;9(9):725-6. [ Links ]
107. Kobayashi T, Manivel JC, Carlson AM, Bellin MD, Moran A, Freeman ML, et al. Correlation of histopathology, islet yield, and islet graft function after islet autotransplantation in chronic pancreatitis. Pancreas. 2011;40(2):193-9. [ Links ]
108. Bottino R, Bertera S, Grupillo M, Melvin PR, Humar A, Mazariegos G, et al. Isolation of human islets for autologous islet transplantation in children and adolescents with chronic pancreatitis. J Transplant. 2012;2012:642787. [ Links ]
109. Walsh RM, Saavedra JR, Lentz G, Guerron AD, Scheman J, Stevens T, et al. Improved quality of life following total pancreatectomy and auto-islet transplantation for chronic pancreatitis. J Gastrointest Surg. 2012;16(8):1469-77. [ Links ]
110. Bramis K, Gordon-Weeks AN, Friend PJ, Bastin E, Burls A, Silva MA, et al. Systematic review of total pancreatectomy and islet autotransplantation for chronic pancreatitis. Br J Surg. 2012;99(6):761-6. [ Links ]
Correspondencia: Jean A. Donet, MD Division of Gastroenterology, University of Miami 1320 S Dixie Hwy, Coral Gables, FL 33146, EE. UU.
E-mail: jeandonet@gmail.com
Recibido: 22-12-2016
Aprobado: 30-1-2016