Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.2 Lima Apr./Jun. 2017
REPORTE DE CASO
Tumor del estroma gastrointestinal en mujer gestante joven
Gastrointestinal stromal tumor in young pregnant woman: case report
Walker del Cid Jove Oblitas1, Miguel Joseph Abril Barreda2
1 Servicio de Gastroenterología, Hospital Regional Honorio Delgado. Arequipa, Perú.
2 Hospital Regional Honorio Delgado. Arequipa, Perú.
a Médico gastroenterólogo; b Residente 3er año de gastroenterología
RESUMEN
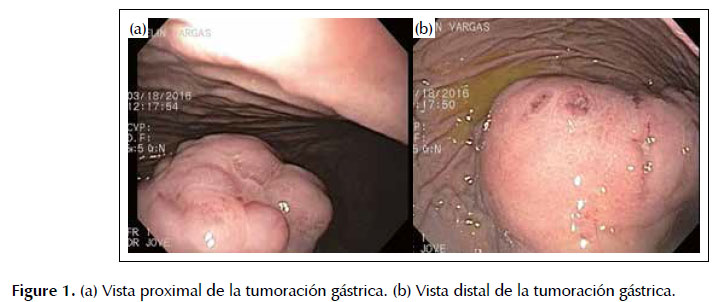
Paciente mujer de 28 años de edad, con gestación de 14 semanas, natural y procedente de Ilo, Moquegua. Acudió con tiempo de enfermedad de 4 días con hematemesis, melenas, epigastralgia y síncope. Antecedente de resección colónica por peritonitis debido a un traumatismo hace 20 años; cuadro de hemorragia digestiva alta hace 3 años; abuelos paternos fallecidos de cáncer gástrico; gastritis crónica diagnosticada desde los 19 años de edad. Dentro de los estudios laboratoriales hemoglobina de 9,2. En el estudio de endoscopia digestiva alta se evidencia ausencia de hemorragia digestiva alta activa, una gran tumoración en cuerpo proximal hacia curvatura mayor y pared posterior, de aproximadamente 8 cm de diámetro, de aspecto lobulado, con la mayor parte de la superficie mucosa indemne, áreas de ulceración de 2 a 3 mm cubiertas de fibrina (de las cuales se toma biopsias), de consistencia dura, signo de la carpa (positivo) y signo del cojín (negativo). No se pudo realizar estudios de imagen como resonancia magnética o tomografía debido a la gestación. En la ecografía abdominal completa sólo se reportó esteatosis hepática de I grado. Los resultados de biopsia endoscópica indicaron proliferación celular de características epitelioides con atipia. Se realizó inmunohistoquímica indicando CD 117 (positivo), CD 34 (negativo), Ki 67 (positivo 1%). El diagnóstico final fue un tumor del estroma gastrointestinal de tipo epitelioide con tasa mitótica menor de 1%. Finalmente se realizó resección quirúrgica del tumor, en la que además se encontró 3 implantes de hasta 1 cm de diámetro en peritoneo que cubrían la superficie pancreática. Presentamos el caso por ser esta una inusual presentación de este tipo de tumor.
Palabras clave: Tracto gastrointestinal; Neoplasias gástricas; Gastritis (fuente: DeCS BIREME).
ABSTRACT
Female patient, 28 years old, with a gestation of 14 weeks, natural and from Ilo-Moquegua. Came with a time of disease 4 days with hematemesis, melena, epigastric pain and syncope. Background of colonic resection for peritonitis due to trauma 20 years ago; upper gastrointestinal bleeding three years ago; paternal grandparents died of gastric cancer; chronic gastritis diagnosed from 19 year old. In laboratory studies hemoglobin of 9.2. In the upper gastrointestinal endoscopy was found absence of active upper gastrointestinal bleeding, a large tumor in proximal body toward greater curvature and posterior wall, 8 cm in diameter approximately, lobed appearance, with most of the mucosal surface unscathed is evidence, areas of ulceration of 2-3 mm covered with fibrin (biopsies taken), hard consistency, tent sign (positive) and cushionsign (negative). Imaging studies such as MRI or CT were not possible due to the pregnancy. In the complete abdominal ultrasound only grade I hepatic steatosis was reported. The results of endoscopic biopsy showed cell proliferation ofepithelioid characteristics with atypia. Immunohistochemistry was performed indicating CD117 (positive), CD 34 (negative), Ki 67 (positive 1%). The final diagnosis was a gastrointestinal stromal tumor epithelioid type with mitotic rate lower of 1%. Finally, surgical resection of the tumor was performed in which addition of 3 implants was found up to 1 cm in diameter in pancreatic peritoneum covering surface. We present the case as this is an unusual presentation of this tumor.
Keywords: Gastrointestinal tract; Stomach neoplasms; Gastritis (source: MeSH NLM).
INTRODUCCIÓN
Los tumores gastrointestinales mesenquimales son raros y representan el 1% al 3% de las neoplasias intestinales, representando los tumores del estroma gastrointestinal (GIST de su sigla en inglés) el 80% de estos (1-3). Los GIST vendrían a ser sarcomas y representan el 5% de ellos (2). Derivan de las células instersticiales de Cajal (células mesenquimales progenitoras situadas en los plexos mientéricos de la pared gastrointestinal que actúan sobre la motilidad intestinal coordinando la peristalsis) (1-3). Su incidencia va de 6-15/1 000 000 y prevalencia de 129/1 000 000 (2,3). Son tumores esporádicos por lo que no existen factores de riesgo. No hay predominancia de género. El pico etáreo se da entre los 55 y 60 años, pero puede presentarse a cualquier edad (1-3). La mayoría se localizan en el estómago (50-60%) y el intestino delgado proximal (20-30%); colon y esófago <5%; pero pueden asentar a cualquier nivel del tracto gastrointestinal, incluyendo el epiplón, el mesenterio o el peritoneo (1-3). Cuando surgen en la segunda o tercera porción duodenal puede ser difícil diferenciarlos con los tumores de la cabeza de páncreas, por su proximidad anatómica (4). El pronóstico depende de la localización anatómica, el tamaño y actividad mitótica del tumor (5,6). Debido a la distribución etárea de los GIST, su diagnóstico durante la gestación es realmente infrecuente, de modo que existen menos de once casos en la bibliografía en los que confluyan un tumor del estroma gastrointestinal y la gestación (7,8).
Se presenta el caso de una paciente gestante joven que acudió a nuestro hospital con un cuadro de hemorragia digestiva alta, cuyo diagnóstico final fue un GIST gástrico.
CASO CLÍNICO
Paciente mujer de 28 años, con gestación de 14 semanas; ama de casa, grado de instrucción superior, natural y procedente de la ciudad de Ilo, Moquegua.
Acude referida a nuestro hospital con una historia de 4 días de hematemesis y melenas en varias oportunidades asociadas a epigastralgia y síncope. Inicialmente acudió a otro hospital en Moquegua donde fue internada y tratada con hidratación parenteral, inhibidores de bomba de protones por vía endovenosa y la transfusión de 2 paquetes globulares (según historia clínica de referencia la hemoglobina llegó hasta 6,5 g/ dl). Finalmente se decidió su referencia a nuestro hospital para manejo especializado.
En el examen físico se encuentra a una paciente en regular estado general, buen estado de hidratación y nutricional; signos vitales PA 100/60 mmHg, FC 110x’, FR 23x’, T 36°C, Sat O2 95%. Palidez de piel y mucosas, dolor a la palpación profunda de epigastrio y útero grávido de 14 cm compatible con la edad gestacional. El resto del examen sin hallazgos significativos.
Antecedente de resección colónica por peritonitis debido a un traumatismo accidental (caída) hace 20 años; cuadro de hemorragia digestiva alta hace 3 años tratada en otra institución hospitalaria y de la cual no se tiene reportes; abuelos paternos fallecidos de cáncer gástrico; gastritis crónica diagnosticada desde los 19 años de edad.
En los exámenes de laboratorio presentaba hemoglobina de 9,2 gr/dl normocítica normocrómica, leve leucocitosis (10 400 leucocitos/μL) con fórmula normal, plaquetas 222 000/μL, el perfil bioquímico y hepático dentro de valores normales. Se solicitaron marcadores tumorales como el CA 19-9, antígeno carcinoembrionario y alfa-feto proteína, todos en rangos normales.
La endoscopía digestiva alta mostró ausencia de hemorragia digestiva alta activa, mucosa de esófago e intestino delgado conservada, presencia de una gran tumoración en cuerpo proximal hacia curvatura mayor y pared posterior, de aproximadamente 8 cm de diámetro, de aspecto lobulado, con la mayor parte de la superficie mucosa indemne, varias áreas de ulceración de 2 a 3 mm cubiertas de fibrina (de las cuales se toma biopsias), de consistencia dura, signo de la carpa (positivo) y signo del cojín (negativo) (9) (Figura 1).
No se pudo realizar estudios de imagen como resonancia magnética o tomografía debido a la gestación (10). No se realizó estudio de ecoendoscopía debido a que no se cuenta con dicho equipo en nuestro hospital. En la ecografía abdominal completa sólo se reportó esteatosis hepática de I grado.
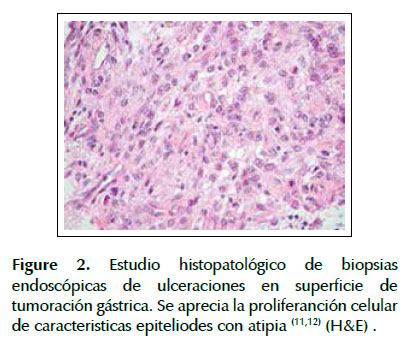
Los resultados de histopatología de biopsia endoscópica indicaron proliferación celular de características epitelioides con atipia (Figura 2). Se realizó estudio de inmunohistoquímica indicando CD 117 (positivo), CD 34 (negativo) (11,12), Ki 67 (positivo 1%) (13). El diagnóstico final fue un tumor del estroma gastrointestinal de tipo epitelioide con tasa mitótica menor de 1% (basado en el Ki 67). No pudo realizarse el índice mitótico por escases de muestra.
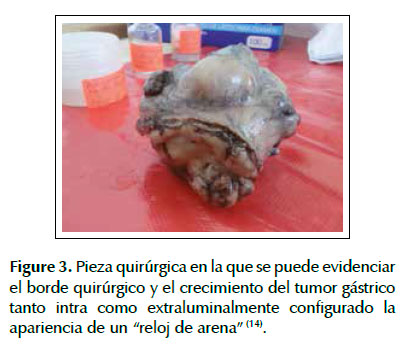
Finalmente se realizó resección quirúrgica del tumor con un margen de seguridad de 1 cm y sin terapia neoadyuvante con imatinib debido a que este fármaco se encuentra catalogado por la FDA como categoría D en el embarazo (14). Dentro de los hallazgos operatorios se encontró una tumoración gástrica proximal de 10 cm de diámetro (Figura 3) (15) y 3 implantes de hasta 1 cm de diámetro en peritoneo que cubrían la superficie pancreática. No se halló ascitis. Se realizó el estudio histopatológico de la pieza quirúrgica y se encontró un índice mitótico de 2 mitosis por 50 campos de gran aumento (HPF de sus siglas en inglés) (16).
La evolución fue sin complicaciones y la paciente salió de alta médica a los 5 días del postoperatorio. Actualmente se espera llegar al 2do o 3er trimestre de edad gestacional para poder realizar una resonancia magnética (10). El plan con la paciente posteriormente son controles periódicos tomográficos (17-19) y terapia biológica adyuvantede por vida con imatinib (3,19).
DISCUSIÓN
Los tumores estromales gastrointestinales (GIST de su sigla en inglés) son una entidad común en la práctica clínica desde su reconocimiento por los estudios de inmunohistoquímica a finales de los noventa (11-13). La mayoría se localizan en el estómago (50-60%) y en intestino delgado proximal (20-30%); el colon y el esófago se ven afectados en <5%, pero pueden asentar a cualquier nivel del tracto gastrointestinal, incluyendo el epiplon, el mesenterio o el peritoneo (2,3). El pico etáreo se da entre los 55 y 60 años, pero puede presentarse a cualquier edad (1-3). Debido a la distribución etárea de los GIST, su diagnóstico durante la gestación es realmente infrecuente, de modo que existen menos de once casos en la bibliografía en los que confluyan un tumor del estroma gastrointestinal y la gestación (7,8). En nuestro caso la paciente tenía apenas 28 años.
La presentación clínica más frecuente de los tumores estromales gástricos es la hemorragia digestiva por ulceración de la capa mucosa. Los GIST se originan en la capa muscular y desde allí se extienden a la submucosa y muscular propia originando una ulceración de la mucosa acompañada de una masa que permite su detección en los estudios endoscópicos (2,3,20).
Los tumores pequeños que no comprometen la mucosa generalmente son hallazgos incidentales de un estudio de imagen o en una endoscopia digestiva. Otras manifestaciones incluyen dolor abdominal, masa palpable y obstrucción intestinal (2,3,20). La endoscopía alta puede ser diagnóstica como lo fue en nuestro caso, la mayor parte de la superficie tumoral no mostró lesiones lo cual aunado al signo de la carpa positivo configuró el diagnóstico endoscópico de un tumor gástrico subepitelial.
El siguiente estudio en ser solicitado vendría a ser una ecoendoscopía la cual nos sirve para tipificar el tipo de tumor subepitelial (21). Típicamente se aprecian como lesiones hipoecoicas y homogéneas con márgenes bien definidos (21). La mayor parte de estos tumores se originan de las muscular propia (21). En tumores de gran tamaño (mayor de 4 cm) pueden aparecer áreas heterogéneas en relación a necrosis (21). Ciertas características endosonográficas son útiles para inferir malignidad como el tamaño del tumor mayor de
4 cm, márgenes irregulares y heterogenicidad (21).
Otro estudio a realizarse es la ecografía abdominal completa, el cual se realizó en nuestro caso y el resultado fue esteatosis hepática I grado. El estudio más útil es la tomografía abdominal con contraste ya que permite estadificar a la tumoración en cuestión (17). Actualmente la tomografía computarizada trifásica permite distinguir los GIST como una masa sólida que en vacío suelen tener una densidad de 30-35 unidades Hounsfield (UH) y después de inyectado el contraste presentan un realce heterogéneo y alcanzan las 50-60 UH, en masas muy grandes (mayores de 10 cm) el rango de densidades es variable por la existencia de necrosis o hemorragia (17). La presencia de necrosis central constituye un criterio radiológico de malignidad (18). Este estudio era inviable debido a la gestación por la que cursaba la paciente. Otro estudio alternativo y que brinda similar información sería la resonancia magnética con gadolinio. Este estudio tampoco fue factible debido a la corta edad gestacional de la paciente. Según una reciente guía de manejo de las hepatopatías en la paciente gestante la resonancia magnética con gadolinio puede ser realizada en el segundo o tercer trimestre (10). En nuestro caso el centro de imagenología por su protocolo nos exigía un mínimo de 19 semanas de edad gestacional.
Las características morfológicas y un adecuado patrón inmunohistoquímico permiten el diagnóstico en la mayoría de casos. Al estudio de H&E la morfología celular de los GIST puede ser de tres tipos: fusiforme en el 70%, epiteloide en el 20% y mixto en el 10% restante (11,12). El 95% de los GIST expresan CD117 (c-Kit), CD34 es positivo en aproximadamente el 80% de los GIST gástricos, pero sólo en el 50% de los GIST del intestino (11,12). Una nueva proteína DOG-1, aún sin función definida, es un marcador inmunohistoquímico más sensible (13). Posee el beneficio adicional de detectar 36% de los GIST c-Kit negativos (13). En nuestro caso la inmunohistoquímica reveló gran positividad para CD 117 lo que se relaciona con buena respuesta a inhibidores de tirosina cinasa como el imatinib.
El 2002 se propuso el índice de Fletcher para estimar el riesgo de malignidad de los tumores GIST basado en el número de mitosis por cada 50 campos de gran aumento (HPF de sus siglas en inglés) y el tamaño del tumor primario que permiten clasificar en categorías de riesgo a los pacientes sometidos a una resección completa de un GIST (22).
Miettinen y Lasota (16) propusieron un nuevo índice en el que incluyeron la localización, siendo de peor pronóstico los de intestino delgado. Según estos autores los GIST gástricos ≤10 cm y ≤5 mitosis por
50 HPF tienen un bajo riesgo de metástasis, mientras que aquellos con >5 mitosis por 50 HPF y de >5 cm de diámetro tienen un alto riesgo de metástasis. Por el contrario, todos los GIST intestinales >5 cm independientes del índice mitótico tienen al menos moderado riesgo de metástasis, y todos los >5 mitosis por 50 HPF tienen un alto riesgo de metástasis. Los GIST intestinales ≤5 cm con ≤5 mitosis por 50 HPF tienen un bajo riesgo de metástasis (16).
Todos los tumores GIST tienen potencial maligno y la resección quirúrgica debe ser considerada la primera opción terapéutica siempre y cuando sea técnicamente posible, no haya evidencia de enfermedad metastásica y conlleve una morbimortalidad aceptable (2,3,5,8). En nuestro caso, se optó por manejo quirúrgico sin los adecuados estudios de imagen valorando el riesgo-beneficio de madre-hijo; considerando el gran tamaño del tumor y las múltiples ulceraciones superficiales, la paciente podría volver a presentar otro cuadro de hemorragia digestiva alta y ésta terminar siendo causa de fallecimiento.
Se ha encontrado que el 50% de los pacientes con resección completa del tumor recaen y se observa una supervivencia a los 5 años de aproximadamente 50% (23); por ello la actitud continua de seguimiento. En caso de pacientes tratados quirúrgicamente con enfermedad localizada no se han establecido pautas de seguimiento (3,23) y depende de la categoría de riesgo; en pacientes de riesgo intermedio y alto se recomienda la tomografía cada 3 a 4 meses los primeros 3 años y luego cada 6 meses hasta los 5 años (19).
En el caso de la paciente, a pesar una localización gástrica, del bajo índice de actividad mitótica (2/50
HPF), un Ki 67 positivo sólo en 1% y un tamaño tumoral de 10 cm, lo que la catalogaría como de bajo riesgo de metástasis (16); vemos como en la práctica se encontró 3 implantes en peritoneo. La conclusión es que nunca se debe olvidar que todos los GIST tienen potencial maligno.
Conflicto de intereses: Los autores niegan cualquier conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Acín D, Pereira F. Tumores estromales gastrointestinales: diagnóstico y tratamiento. Cir Cir. 2012;80:44-51. [ Links ]
2. Quek R, George S. Gastrointestinal stromal tumor: a clinical overview. Hematol Oncol Clin North Am. 2009;23(1):69-78. [ Links ]
3. Ho MY, Blanke CD. Gastrointestinal stromal tumors: disease and treatment updated. Gastroenterology. 2011;140(5):1372-6. [ Links ]
4. Kwon SH, Cha HJ, Jung SW, Kim BC, Park JS, Jeong ID, et al. A gastrointestinal stromal tumor of the duodenum masquerading as a pancreatic head tumor. World J Gastroenterol. 2007;13(24):3396-9. [ Links ]
5. Wu TJ, Lee LY, Yeh CN, Wu PY, Chao TC, Hwang TL, et al. Surgical treatment and prognostic analysis for gastrointestinal stromal tumors (GISTs) of the small intestine: before the era of imatinib mesylate. BMC Gastroenterology. 2006;6:29. [ Links ]
6. Emory TS, Sobin LH, Lukes L, Lee DH, O’Leary TJ. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol. 1999;23(1):82-7.
7. Scherjon S, Lam WF, Gelderblom H, Jansen FW. Gastrointestinal stromal tumor in pregnancy: a case report. Case Report in Medicine. 2009;2009:456402. [ Links ]
8. Cuerva-González MJ, Lacoponi S, de la Calle-Fernández M, Pozo-Krielinger J. Tumor del estroma gastrointestinal en el embarazo y control posterior. Ginecol Obstet Mex. 2010;78(12):697-702. [ Links ]
9. Montes P, Salazar S, Ramos M. Lipoma colónico gigante como causa de hemorragia digestiva baja: reporte de un caso. Rev Gastroenterol Peru. 2007;27(3):307-9. [ Links ]
10. Tran TT, Ahn J, Reau NS. ACG Clinical Guideline: liver disease and pregnancy. Am J Gastroenterol. 2016;111(2):176-94. [ Links ]
11. Mikhael AI, Bacchi CE, Zarbo RJ, Ma CK, Gown AM. CD34 expression in stromal tumors of the gastrointestinal tract. App Immunohistochem. 1994;2:89-93. [ Links ]
12. Miettinen M, Virolainen M, Sarlomo-Rikala M. Gastrointestinal stromal tumors --value of CD34 antigen in their identification and separation from true leiomyomas and schwannomas. Am J Surg Pathol. 1995;19(2):207-16. [ Links ]
13. Sözütek D, Yanik S, Akkoca AN, Sozütek A, Ozdemir ZT, Avşar CU, et al. Diagnostic and prognostic roles of DOG1 and Ki-67, in GIST patients with localized or advanced/metastatic disease. Int J Clin Exp Med. 2014;7(7):1914-22.
14. Pye S, Cortes J, Ault P, Hatfield A, Kantarjian H, Pilot R, et al. The effects of imatinib on pregnancy outcome. Blood. 2008;111(12):5505-8. [ Links ]
15. Oyanedel R, O´Brien A, Pizarro A, Zamora E, Menias C. Tumor estromal gastrointestinal (GIST): formas de presentación. Rev Chil Radiol. 2015;11(1):13-8. [ Links ]
16. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23(2):70-83. [ Links ]
17. Levy AD, Remotti HE, Thompson WM, Sobin LH, Miettinen M. Gastrointestinal stromal tumors: radiologic features with pathologic correlation. Radiographics. 2003;23(2):283-304. [ Links ]
18. Ulusan S, Koc Z, Kayaselcuk F. Gastrointestinal stromal tumours: CT findings. Br J Radiol. 2008;81(968):618-23. [ Links ]
19. ESMO / European Sarcoma Network Working Group. Gastrointestinal stromal tumors: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2012;23 Suppl 7:vii49-55. [ Links ]
20. Miettinen M, Kopczynski J, Makhlouf HR, Sarlomo-Rikala M, Gyorffy H, Burke A, et al. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Phatol. 2003;27(5):625-41. [ Links ]
21. Ferreira F, Lacerda V, Caetano A, Batigália F. Echoendoscopy in digestive subepithelial lesions: review of the literature. Rev Col Bras Cir. 2012;39(5):408-13. [ Links ]
22. Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol. 2002;33(5):459-65. [ Links ]
23. Poveda A, Artigas V, Casado A, Cervera J, García Del Muro X, López-Guerrero JA, et al. Guía de práctica clínica en los tumores estromales gastrointestinales (GIST): actualización 2008. Cir Esp. 2008;84(Supl 1):1-21. [ Links ]
Correspondencia:
Miguel Joseph Abril Barreda
Calle Chachani 110 B. Cerro colorado, Arequipa – Perú.
E-mail: mijoabril@gmail.com
Recibido: 18-4-2016
Aprobado: 22-7-2016