Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.3 Lima jul./sep. 2017
ARTÍCULOS ORIGINALES
Características endoscópicas y patológicas del cáncer gástrico en un hospital público peruano
Endoscopic and pathological characteristics of gastric cancer in a Peruvian public hospital
Lilian Brenda Parillo Durand1,2
1 Servicio de Gastroenterología y Anatomía Patológica, Hospital Nacional Policía Nacional del Perú Gral PNP Luis N. Sáenz. Lima, Perú.
2 Universidad Nacional Mayor de San Marcos. Lima, Perú.
RESUMEN Objetivo: Evaluar las características endoscópicas y patológicas del cáncer gástrico del Hospital Nacional Luis N. Sáenz entre 2008 y 2013. Materiales y métodos: Estudio observacional retrospectivo transversal. Se revisó los informes endoscópicos, de pacientes mayores a 30 años, se ingresó al estudio el diagnóstico histológico de adenocarcinoma gástrico, las variables patológicas como tipo histológico, presencia deH. pylori y de metaplasia intestinal e incompleta. Resultados: Se identificó 92 casos de adenocarcinoma gástrico. Prevalencia promedio 0,6%, prevalencia de 0,34% en 2009 y 0,82% en 2013, sexo masculino 62%, femenino 38%, edad menor de 55 años 16%, mayor a 76 años 42%; presentación endoscópica Borrmann III 57%, II 16,3%, IV 15%, V 7,6%, I 3,3%; presentación distal 8 veces más frecuente que la proximal, tipo histológico intestinal 75%, H. pylori presente en 50% casos, metaplasia intestinal en 40% de casos de cáncer gástrico. Conclusiones: Se encontró una alta prevalencia de cáncer gástrico. Frecuente en sexo masculino y en mayores de 76 años, presentación endoscópica más frecuente fue Borrmann III, la presencia de H. pylori y metaplasia intestinal incompleta asociada a cáncer tipo intestinal.
Palabras clave: Cáncer gástrico; Helicobacter pylori; Metaplasia intestinal; Adenocarcinoma (fuente: DeCS BIREME).
ABSTRACT Objective: The endoscopic and pathological characteristics of gastric cancer in Luis N. Sáenz National Hospital between 2008 and 2013. Materials and methods: retrospective cross-sectional observational study. We reviewed the endoscopic reports of patients older than 30 years, we studied the histological diagnosis of gastric adenocarcinoma, pathological variables such as histological type, presence of H. pylori and complete and incomplete intestinal metaplasia. Results: 92 cases of gastric adenocarcinoma were identified. Average prevalence 0.6%, 0.34% in 2009 and 0.82% in 2013; 62% male, 38% female, age less than 55 years 16%, greater than 76 years 42%; endoscopic presentation Borrmann III 57%, II 16.3%, IV 15%, V 7.6%, I 3.3%; 8 times most frequent presentations distal the proximal v, 75% histologic intestinal type, H. pylori in 50% cases, intestinal metaplasia in 40% of cases of gastric cancer. Conclusion: We found high prevalence of gastric cancer. Common in males, and in people over 76, more frequent endoscopic presentation was Borrmann III, the presence of H. pylori and incomplete intestinal metaplasia associated with intestinal cancer type.
Keywords: Cancer, gastric; Helicobacter pylori; Intestinal metaplasia; Adenocarcinoma (source: MeSH NLM).
INTRODUCCIÓN
El cáncer gástrico a pesar que en las últimas décadas presenta una tendencia mundial a disminuir (1) aún representa un problema de salud pública en el mundo en especial en países en desarrollo como el Perú. A nivel global se ve un incremento progresivo en la incidencia del cáncer proximal a diferencia del distal (2). La presencia de H. pylori en la carcinogénesis aun no es concluyente, hay heterogeneidad en los resultados por regiones y dentro de un mismo país, los programas de erradicación no han logrado ser un factor protector del cáncer gástrico (3). El cáncer gástrico tiene un pobre pronóstico y la sobrevivencia a 5 años solo llega a 20% en estadios avanzados (4), los programas de detección temprana podrían disminuir la mortalidad, pero aún es muy costoso para los programas de salud pública.
A pesar de la evidencia internacional de la asociación del cáncer gástrico e infección crónica H. pylori aun es controversial, por lo que existen reportes contradictorios, Uno de los primeros estudios que muestra la contrariedad de la infección por H. pylori y la incidencia de cáncer gástrico fue hecho por Holcombe en áfrica en 1992, en dicha población la infección por H. Pylori llega a 97% sin embargo la incidencia de cáncer gástrico representa un máximo 3% en relación al resto de tumores malignos; en Uganda, Sudán y Zimbabue, el rol patológico para H. Pylori en África no ha sido demostrado (5). Datos similares en Asia, donde es considerado un enigma, en los diferentes estudios epidemiológicos; similares datos en Tailandia, India, Bangladesh, Pakistán, Irán, Arabia Saudita, Malaysia e Israel (6-9). presentan una alta incidencia de infección por H. pylori sin embargo una baja incidencia de cáncer gástrico. En un estudio realizado por Misra et al. en el norte de la India la prevalencia de H. pylori y cáncer gástrico fue evaluada con la apariencia y tipo histológico, la prevalencia de H. pylori en controles fue ligeramente más alta que en los grupos caso (80% vs 78%), el tipo difuso fue más común que el tipo intestinal (86% vs 68%), una asociación significativa fue encontrada entre la presencia de gastritis y H. pylori, pero falló en demostrar una relación significativa entre el grado tumoral, metaplasia, displasia, sitio tumoral y edad del paciente, por lo cual se infiere que la prevalencia de H. pylori, no está directamente asociada con la patogénesis de cáncer gástrico pero podría ser un cocarcinógeno y hacer la mucosa más susceptible a los carcinógenos (10). Una significante proporción (20%) de H. pylori pueden ser encontrados adheridos a la superficie de las células de mucosa gástrica. Ocasionalmente H. Pylori puede también ser encontrado intracelularmente particularmente en lesiones preneoplásicas y neoplásicas. La adhesión de la bacteria a la capa epitelial es facilitada por una gran familia de 32 proteínas de la membrana externa (hop proteins) que incluyen las adhesinas. Una de las mejor caracterizadas es Bab A. Las cadenas bacterianas que poseen el gen de adherencia BabA2 se adhieren fuertemente a las células epiteliales promueven un fenotipo más agresivo y son asociadas con una mayor incidencia de adenocarcinoma gástrico (11).
El cáncer gástrico en nuestra institución es una patología frecuente de la cual no existen datos de su presentación, por lo cual nuestros objetivos son evaluar la prevalencia, las características endoscópicas y patológicas del cáncer gástrico en el Hospital Nacional Policía Nacional del Perú Gral PNP Luis N. Sáenz entre el 2008 y 2013.
MATERIALES Y MÉTODOS
Estudio descriptivo observacional, retrospectivo, transversal. Estudio de serie de casos que busca evaluar la prevalencia, las características endoscópicas y patológicas del cáncer gástrico en el Servicio de Gastroenterología del Hospital Nacional Policía Nacional del Perú Gral PNP Luis N. Sáenz desde enero 2008 hasta diciembre 2013.
Se revisó el libro de informes endoscópicos, solo se consideró los diagnósticos de cáncer gástrico, luego se revisó los informes endoscópicos de pacientes mayores a 30 años, se ingresó a la base de datos aquellos con diagnóstico histológico de adenocarcinoma gástrico, se revisaron los informes histológicos en el área de anatomopatología, se revisaron las láminas, de estos informes se recogió las variables patológicas como tipo histológico, presencia de H. pylori y de metaplasia completa e incompleta.
En los informes endoscópicos se registró los datos socio demográficos edad, sexo, localización y tipo tumoral del cáncer gástrico. El procesamiento de datos se realizó con el programa estadístico STATA 12.0, los datos fueron procesados y analizados.
Se obtuvo el consentimiento de la institución y de los respectivos departamentos para la revisión del material necesario.
RESULTADOS
Se revisó 13 439 endoscopias realizadas desde enero del 2008 hasta diciembre 2013, se identificó 154 casos con diagnóstico endoscópico de cáncer gástrico avanzado, confirmados por anatomía patológica, 92 casos de adenocarcinoma, no se encontraron los resultados de 33 casos, 27 no fueron compatibles con cáncer, un caso de linfoma y uno de GIST, que fueron excluidos.
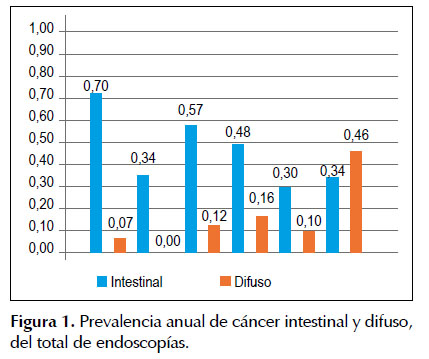
De los 92 casos de adenocarcinoma, las láminas encontradas 79, se revisaron con un anátomo-patólogo, el tejido gástrico no tumoral, se identificó la presencia de metaplasia y Helicobacter pylori, este último dato no sería confiable debido a que no se tomaron de acuerdo al protocolo de Sydney por lo cual, su ausencia en las láminas, no niegan su presencia en el resto de la mucosa gástrica o infección por Helicobacter pylori . En la Figura 1 La prevalencia de cáncer gástrico hallada en la población que acude a consultorio de gastroenterología es de 0,82%. La prevalencia anual de cáncer gástrico con relación a las endoscopias realizadas, muestra un predominio de cáncer tipo intestinal en todos los años. La mayor prevalencia de cáncer gástrico fue en el 2010 y la menor fue en el 2011.
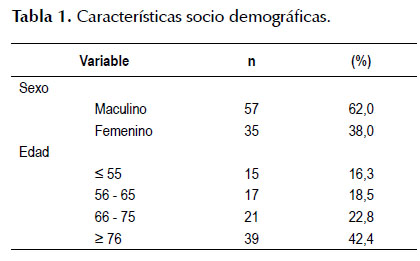
La Tabla 1 muestra las características sociodemográficas, el sexo predominante fue el masculino con 62%, el rango más frecuente de presentación mayor de 76 años, el 65% se presentó en pacientes mayores de 66 años y se presentaron 15 casos de cáncer avanzado en menores a 55 años.
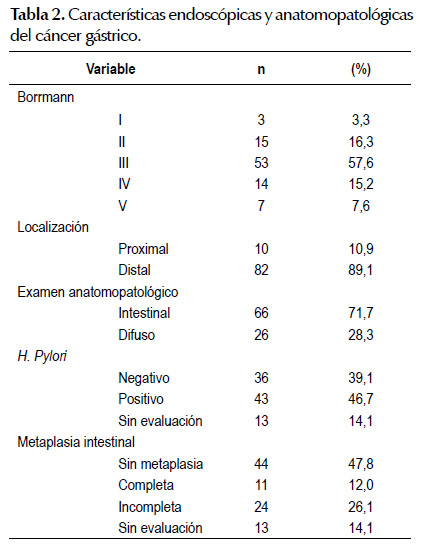
En la Tabla 2 se presentan las características endoscópicas y anatomopatológicas del cáncer gástrico, de acuerdo a la clasificación de Borrmann el más frecuente fue el tipo III con más del 50%. La presentación distal fue casi 8 veces más frecuente que la presentación proximal. El tipo histológico más frecuente fue el intestinal casi 3/4 del total de los casos de adenocarcinoma. Helicobacter pylori presentó casi 40% de negativos, los cuales podrían ser falsos negativos, aun así tenemos datos positivos en cerca al 50% de los casos de cáncer gástrico. La presencia de metaplasia intestinal se encontró en casi el 40% del total de casos de cáncer gástrico, del cual la metaplasia intestinal incompleta fue la más frecuente con 26%.
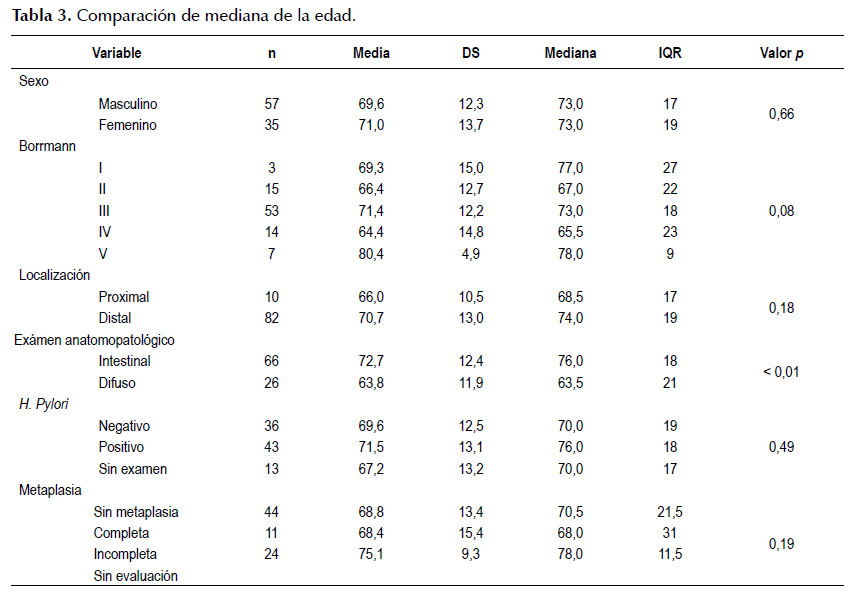
En la Tabla 3 , respecto a la mediana del cáncer gástrico, se observa una diferencia estadísticamente significativa en el cáncer gástrico tipo intestinal con una mediana de 76 años, respecto al difuso con una mediana 63 años.
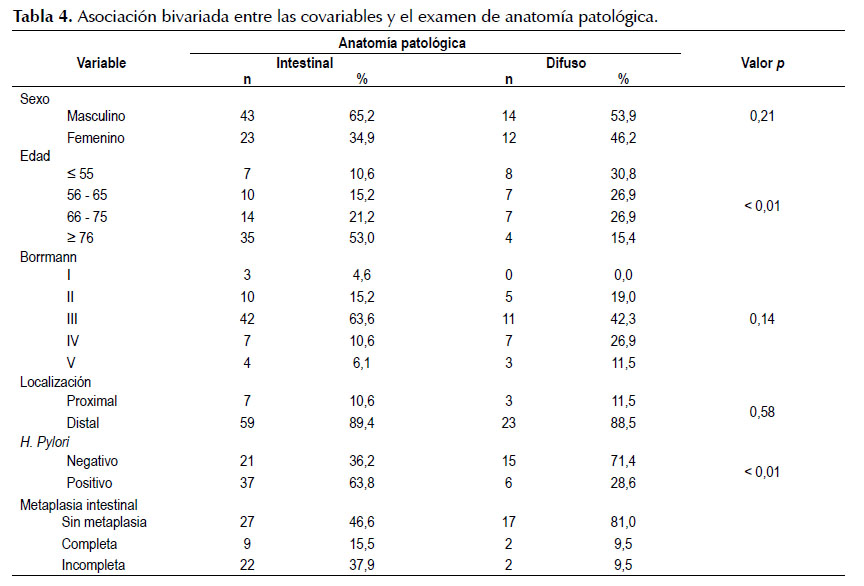
En la Tabla 4 se relacionaron las variables dependientes con las independientes con la prueba exacta de Fisher, respecto al tipo de adenocarcinoma el intestinal corresponde al 71,7% y el tipo difuso 28,3% del total. El cáncer difuso se mantiene estable en los diferentes grupos de edad a diferencia del tipo intestinal el cual aumenta directamente proporcional a la edad, con más del 50% en la población mayor a 75 años, presentación endoscópica más frecuente es el Borrmann III en ambos tipos de cáncer, respecto a la asociación del cáncer gástrico tipo intestinal se encuentra una asociación estadísticamente significativa con la presencia de Helicobacter pylori y metaplasia tipo intestinal.
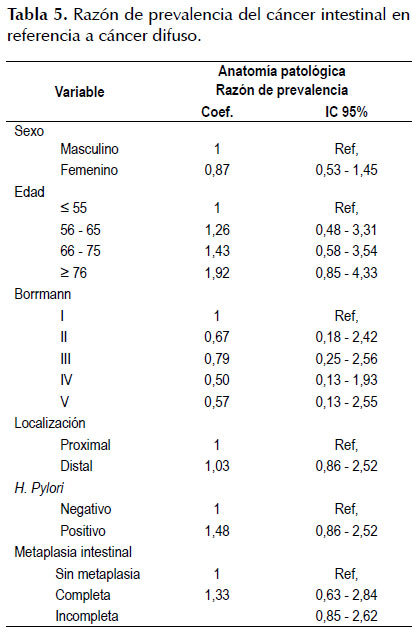
La Tabla 5 mide el grado de asociación del cáncer intestinal respecto al difuso y no se encontró diferencia significativa con ninguna de las variables independientes; sin embargo, podemos rescatar que el cáncer intestinal es 13% más frecuente en varones que en mujeres y el riesgo de infección por Helicobacter pylori es 48% más probable de desarrollar cáncer gástrico tipo intestinal que el tipo difuso y el desarrollo de metaplasia intestinal incompleta tiene 49% más riesgo de desarrollar cáncer gástrico intestinal que el difuso.
DISCUSIÓN
El cáncer gástrico constituye la cuarta neoplasia en frecuencia y la segunda en mortalidad en Perú. Es admitido y descrito que la incidencia ha ido disminuyendo en la mayoría de países industrializados en las últimas tres décadas (12). Un estudio realizado por Ramírez et al. en un policlínico en la ciudad de Lima en el cual también demostraron una disminución en la prevalencia de cáncer gástrico desde 1985 a 2002 en el cual el adenocarcinoma gástrico disminuyó de 3,19% en 1992 a 0,92% en el año 2002 (13). En nuestro estudio la prevalencia anual promedio de cáncer gástrico avanzado en los últimos 6 años fue incluso menor 0,6%. El descenso en la prevalencia de cáncer gástrico es explicado por la paralela disminución de infección de H. pylori (14) y por el tratamiento antibiótico erradicador de la infección de H. pylori actualmente usado en la institución.
La distribución respecto al sexo es predominantemente masculino 62% una relación de casi 3/1 respecto al sexo femenino, a diferencia de estudios nacionales como el de Rodríguez et al. y Candela et al. realizado en hospitales públicos de Lima y Callao la presentación es casi similar en (15,16) varones y mujeres, alrededor del 50% esta diferencia obedece a la población suscrita de atención en nuestra institución la mayoría está constituida por población masculina.
En nuestro estudio más del 80% de cáncer gástrico se presentó en mayores de 56 años, comparando por grupos de edad la mayor incidencia, en el grupo de mayores de 76 años. Estudios similares han mostrado datos similares en nuestro país y en el mundo (16,17). Se ha descrito que la disminución de este cáncer se ha dado a expensas precisamente de este último grupo poblacional, a pesar de que todavía sigue siendo el grupo mayoritario. Un estudio realizado por Uehara et al. en el Hospital Loayza, de Lima Perú, se buscó definir el punto corte de edad para el screening de cáncer gástrico, se encontró que en pacientes mayores de 55 años se perderían 12 casos, en nuestro estudio serían 15 pacientes con cáncer gástrico avanzado, entonces concluyeron que la edad óptima para una adecuado screening de cáncer gástrico, sería tomar como punto de corte los 40 años (18).
La presentación endoscópica macroscópica más frecuente fue Borrmann tipo III, hallazgo similar en diferentes estudios (19,20), asociado con una pobre sobrevida, Nishi et al. en 1969 publicó sus resultados que el pronóstico del Borrmann I-II era mejor que el tipo III-IV (21). Cuando se estudió la relación de profundidad de la invasión del cáncer con pronóstico a 5 años, señalando que el de los Borrmann I y II es peor que el de los Borrmann III y IV con invasión solo hasta la muscular propia, pero este se revierte cuando se traspasa la muscular propia (22).
El cáncer gástrico al compararse la localización, proximal vs distal ha demostrado variabilidad en su presentación respecto a la edad y sexo, en un estudio de 6099 pacientes con adenocarcinoma gástrico, el tipo intestinal del estómago proximal fue 3:1 predominante en varones, esto fue comparado con pacientes con tipo intestinal distal donde los resultados mostraron un ratio 1:1 de incidencia en varones y mujeres respectivamente (23). Datos similares fueron encontrados en nuestro estudio respecto al intestinal, la presentación proximal fue más frecuente en varones que en mujeres con razón 6:1, respecto al distal con leve predominio en varones 1.6:1. Los factores ambientales que incrementan el riesgo de desarrollo de cáncer gástrico no cardial incluyen tabaco, alta ingesta de sal (24) y consumo de alcohol. Estudios prospectivos han demostrado una significante dosis dependiente entre fumar y el riesgo de cáncer gástrico con un ratio para cáncer gástrico distal 1.5 a 2.1 (25,26). En nuestro estudio la presentación más frecuente fue distal con más 80% para ambos tipos, a diferencia del estudio realizado por Rodríguez et al. se evidencia que el 62% fueron proximales y solo 38% son distales (15).
En los diversos estudios el cáncer gástrico, de acuerdo la clasificación de Lauren, el intestinal es el más frecuente, en nuestro estudio este representa el 72% y el difuso el 28%, datos similares fueron encontrados en otros estudios en hospitales públicos del Perú (15,27), sin embargo en Estados Unidos se observa un tendencia a disminuir del cáncer gástrico a expensas del tipo intestinal, mientras que el tipo difuso tiene un progresivo incremento desde 1973, en promedio el tipo intestinal disminuye en 2,4% por año y ha disminuido en 52% desde 1973 hasta 2000, sin mayor intervención planeada, mientras que el difuso se ha incrementado en promedio 3,6% por año y 41% en el mismo periodo (28). Respecto a la edad más del 50% de cáncer tipo intestinal, se presentó en el grupo mayor a 76 años y un incremento progresivo en la frecuencia con el aumento de los años, con una diferencia estadísticamente significativa respecto al difuso el cual se mantiene estable en los diferentes grupos de edad, con una mayor presentación en los menores a los 55 años, en nuestro estudio su presentación es similar en los diferentes sexos, no se evidencia predominio femenino.
Los pacientes con infección por H. pylori tenían un 49% más de riesgo de desarrollar cáncer gástrico. El hallazgo de la bacteria en las biopsias de la mucosa adyacente fue significativamente asociado con el cáncer tipo intestinal que con el tipo difuso. Esto es compatible con la asociación a la progresión multipaso, propuesta por Correa, que es iniciada por la inflamación crónica, como resultado de la infección por H. Pylori; esta enfermedad progresa a través del desarrollo de gastritis crónica, metaplasia, displasia y finalmente en cáncer(29). Se encontró asociación entre cáncer gástrico y H. pylori, este es conocido como un carcinógeno tipo I para cáncer gástrico distal, un estudio publicado por Uemura et al. en un estudio prospectivo de 1526 pacientes con ulcera gástrica duodenal hiperplasia gástrica y displasia gástrica, 1246 fueron positivos para H. pylori. De estos, 36 pacientes progresaron al desarrollo de cáncer gástrico mostrando una incidencia de 2,9%. Esto es contrastado con 280 pacientes que fueron negativos para H. pylori ninguno de los cuales progresó a desarrollar cáncer gástrico (30). Aunque el H. pylori infecta a 2 billones de personas en todo el mundo, menos del 0,5% de individuos infectados desarrollaran cáncer gástrico. Así mismo en regiones de alta frecuencia de infección por H. pylori como África los índices de cáncer gástrico son muy bajas (5). Existen factores adicionales que incrementan el riesgo del desarrollo de cáncer que incluyen tabaco, alimentos altos en sal y consumo de alcohol, que podría afectar el riesgo de cáncer gástrico atribuidos a la infección crónica por H. pylori (31); por lo cual, H. pylori más que un carcinógeno sería considerado un cocarcinógeno necesario para el desarrollo de cáncer gástrico. A nivel molecular, la ingesta de alimentos altos en sal, puede potenciar la expresión de Cag A y aumentar la habilidad del Cag A de trascolarse dentro de las células epiteliales gástricas, con lo que se altera la función epitelial gástrica (32). En nuestro estudio al medir el grado de asociación el riesgo de infección por H. pylori es 48% más probable de desarrollar cáncer gástrico tipo intestinal que el tipo difuso. Esta asociación esta muy por debajo de lo encontrado en un metanálisis de Eslick et al. (33) quien revisó 42 estudios de cohortes y casos y controles después del 1982, identificó un doble (2,04) incremento en el riesgo de desarrollar cáncer gástrico en pacientes en quienes se encontró infección por H. pylori, 74% de los pacientes con cáncer gástrico (3212/4334) versus 57,4% (4527/7887) para los controles, a pesar que no se encontró asociación del cáncer tipo difuso con la presencia de H. pylori, estudios histopatológicos y epidemiológicos (34,35) han mostrado que el desarrollo del cáncer tipo difuso es también cercanamente relacionado a H. pylori. En el presente estudio el tipo difuso no demostró asociación con la presencia de metaplasia. De acuerdo a la hipótesis de Sipponen et al. (36) and Solcia et al. (37) que el tipo de cáncer gástrico difuso ocurre durante la progresión de gastritis atrófica en pacientes con infección H. pylori y es asociado particularmente con gastritis crónica.
La presencia de metaplasia intestinal en nuestro estudio, fue asociado con cáncer gástrico tipo intestinal, este es un paso antes de la displasia; según el estudio de Vries et al. en el 2008 (38) la metaplasia intestinal tiene una progresión anual de 0,25% para el desarrollo de cáncer gástrico tipo intestinal. Un estudio de cohorte del sur de Europa, donde el ratio de cáncer gástrico es alto, mostro que la incidencia de cáncer gástrico en pacientes con metaplasia intestinal fue 16,5 por 1000 personas año (39). El ratio de progresión en países asiáticos parecería ser mayor, con un estudio japonés mostrando que el riesgo relativo de progresión de metaplasia intestinal a cáncer fue 6,4 (30). El mayor determinante de progresión parecería ser la extensión topográfica de la lesión metaplásica. Las lesiones que se extienden a lo largo de la curvatura menor, desde el cardias hasta el píloro y con patrón difuso, que compromete toda la mucosa gástrica excepto la mucosa del fondo, son asociadas con mayor riesgo de cáncer gástrico con OR de 5,7 y 12,2 respectivamente (40). Las guías de la European Society for Gastrointesinal Endoscopy (ESGE) recomiendan que los pacientes con metaplasia intestinal o atrofia en antro y cuerpo deberían programarse controles de seguimiento endoscópico cada 3 años después del diagnóstico (41). Metaplasia intestinal ha sido usada como el biomarcador clave en estudios de H. Pylori o prevención de cáncer gástrico definiendo las lesiones pre neoplásicas a menudo consideradas el punto de no retorno (42). De hecho, desde que el desarrollo de los cánceres gástricos mostró diferenciación intestinal, parecería lógico concluir que el cáncer crece directamente de las células metaplásicas intestinales. La presencia o ausencia de H. pylori después de tratamiento erradicador probablemente no cambia la historia natural de metaplasia intestinal una vez establecida (43,44). Al evaluar el tipo de metaplasia intestinal asociada, en nuestro estudio se encontró asociación positiva con la presencia de metaplasia incompleta, hallazgo similar a otros estudios con asociación significativa entre metaplasia incompleta y riesgo de cáncer gástrico, estos resultados fueron observados en poblaciones con relativo alto riesgo de cáncer gástrico como Portugal, China y Eslovenia, así como en poblaciones de riesgo intermedio como Italia y España (39,45-49). Tres de los estudios que encontraron asociación positiva significativa con la metaplasia incompleta (39,47,48) fueron los más largos y con mayor seguimiento. Nuestros hallazgos son similares a otros estudios transversales, cuando el cáncer gástrico es diagnosticado, la metaplasia incompleta es la lesión más frecuente en la mucosa gástrica adyacente, sugiriendo que este es el fenotipo más pro carcinógeno y uno de los últimos pasos en la cascada de las lesiones pre malignas y podría completar criterios histológicos para ser clasificada como una displasia de bajo grado (50). Pero aún se encuentra en discusión, por lo cual siguen siendo eventos anteriores al desarrollo de cáncer gástrico.
En el presente estudio se encontró una alta prevalencia de cáncer gástrico avanzado. Fue más frecuente en el sexo masculino y en pacientes mayores de 76 años. El hallazgo endoscópico más frecuente fue Borrmann III, el cáncer gástrico tipo intestinal se encuentra asociado a la presencia de H. pylori y metaplasia intestinal incompleta.
Fuente de financiamiento: Los autores no recibieron ningún tipo de financiación para la realización de este estudio.
Conflicto de intereses: Los autores no declaran ningún conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Parkin DM1, Pisani P, Ferlay J. Estimates of the worldwide incidence of eighteen major cancers in 1985. Int J Cancer. 1993;54(4):594-606. [ Links ]
2. Locke GR 3rd, Talley NJ, Carpenter HA, Harmsen WS, Zinsmeister AR, Melton LJ 3rd. Changes in the site- and histology-specific incidence of gastric cancer during a 50- year period. Gastroenterology. 1995;109(6):1750-6. [ Links ]
3. Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, et al. H. pylori eradication to prevent gastric cancer in a highrisk region of China: a randomized controlled trial. JAMA. 2004;291(2):187-94. [ Links ]
4. Ries LAG, Harkins D, Krapcho M, Mariotto A, Miller BA, Feuer EJ, et al. SEER Cancer Statistics Review, 1975-2000. Bethesda, MD: National Cancer Institute; 2003. [ Links ]
5. Holcombe C. H. pylori: the African enigma. Gut. 1992;33(4):429-31. [ Links ]
6. Goh KL. Epidemiology of H. pylori infection in Malaysia- -observations in a multiracial Asian population. Med J Malaysia. 2009;64(3):187-92. [ Links ]
7. Hirai I, Sasaki T, Kimoto A, Yamamoto Y, Azuma T, Mahachai V, et al. Infection of less virulent H. pylori strains in asymptomatic healthy individuals in Thailand as a potential contributing factor to the Asian enigma. Microbes Infect. 2010;12(3):227-30. [ Links ]
8. Bhurgri Y, Pervez S, Kayani N, Haider S, Ahmed R, Usman A, et al. Rising incidence of gastric malignancies in Karachi, 1995- 2002. Asian Pac J Cancer Prev. 2009;10(1):41-4. [ Links ]
9. Graham DY, Lu H, Yamaoka Y. African, Asian or Indian enigma, the East Asian H. pylori: facts or medical myths. J Dig Dis. 2009;10(2):77-84. [ Links ]
10. Misra V, Misra SP, Singh MK, Singh PA, Dwivedi M. Prevalence of H. pylori in patients with gastric cancer. Indian J Pathol Microbiol. 2007;50(4):702-7. [ Links ]
11. Feldman M, Friedman LS, Brandt LJ. Sleisenger and Fordtrans gastrointestinal and liver disease. 9a ed. Philadelphia: Saunders Elsevier; 2010. [ Links ]
12. International Agency for Research on Cancer. GLOBOCAN 2012: Estimated cancer incidence, mortality and prevalence worldwide in 2012 [Internet]. Lyon, France: IARC; c2014 [citado el 16 de abril de 2014]. Disponible en: http:// globocan.iarc.fr/Pages/fact_sheets_cancer.aspx [ Links ]
13. Ramírez-Ramos A, Watanabe-Yamamoto J, Takano-Morón J, Gilman RH, Recavarren Arce S, Arias-Stella J, et al. Decrease in prevalence of peptic ulcer and gastric adenocarcinoma at the Policlínico Peruano Japonés, Lima, Peru, between the years 1985 and 2002. Analysis of 31,446 patients. Acta Gastroenterol Latinoam. 2006;36(3):139-46. [ Links ]
14. Ramírez Ramos A, Chinga Alayo E, Mendoza Requena D, Leey Casella J, Segovia Castro MC, Otoya C. Variación de la prevalencia del H. pylori en el Perú Período (1985-2002), en una población de nivel socioeconómico medio y alto. Rev Gastroenterol Peru. 2003;23(2):92-8. [ Links ]
15. Rodriguez B, Arevalo F, Monge E, Montes P. Carateristicas histológicas y endoscópicas del cáncer gástrico diagnosticado en un hospital nacional del callao Perú. Rev Peru Med Exp Salud Publica. 2013;30(1):12-7. [ Links ]
16. Candela R, Pineda R, Gálvez G, Nago A, Curioso W, Huaman C, et al. Cáncer gástrico: estudio multicéntrico en seis hospitales de Lima y Callao. Rev Gastroenterol Peru. 1986;6(2):92-6. [ Links ]
17. Chirinos JL, Carbajal LA, Segura MD, Combe J, Akib S. Cáncer Gástrico: Perfil Epidemiológico 2001-2007 en Lima, Perú. Rev Gastroenterol Peru. 2012;32(1):58-64. [ Links ]
18. Uehara G, Nago A, Espinoza R, Vargas G, Astete A, Moran L, et al. Edad óptima para el despistaje endoscópico de cáncer gástrico en pacientes con dispepsia sin síntomas de alarma. Rev Gastroenterol Peru. 2007;27(4):339-48. [ Links ]
19. Zhang XF, Huang CM, Lu HS, Wu XY, Wang C, Guang GX, et al. Surgical treatment and prognosis of gastric cancer in 2 613 patients. World J Gastroenterol. 2004;10(23):3405-8. [ Links ]
20. Yan S, Li B, Bai ZZ, Wu JQ, Xie DW, Ma YC, et al. Clinical epidemiology of gastric cancer in Hehuang valley of China: A 10-year epidemiological study of gastric cancer. World J Gastroenterol. 2014;20(30):10486-94. [ Links ]
21. Nishi M, Nanasawa T, Seki H. On the five year survival rate of stomach cancer: with special reference to advanced cancer. Stomach and Intestine. 1969;4:1087-100. [ Links ]
22. Llorens Sabater P. Cáncer gástrico: capítulos escogidos. Santiago de Chile: Editorial Iku; 2001. [ Links ]
23. Wilkinson NW, Howe J, Gay G, Patel-Parekh L, Scott-Conner C, Donohue J. Differences in the pattern of presentation and treatment of proximal and distal gastric cancer: results of the 2001 gastric patient care evaluation. Ann Surg Oncol. 2008;15(6):1644-50. [ Links ]
24. Wang XQ, Terry PD, Yan H. Review of salt consumption and stomach cancer risk: epidemiological and biological evidence. World J Gastroenterol. 2009;15(18):2204-13. [ Links ]
25. Gonzalez CA, Lujan-Barroso L, Bueno-de-Mesquita HB, Jenab M, Duell EJ, Agudo A, et al. Fruit and vegetable intake and the risk of gastric adenocarcinoma: a reanalysis of the European Prospective Investigation into Cancer and Nutrition (EPIC-EURGAST) study after a longer follow-up. Int J Cancer. 2012;131(12):2910-9. [ Links ]
26. Koizumi Y, Tsubono Y, Nakaya N, Kuriyama S, Shibuya D, Matsuoka H, et al. Cigarette smoking and the risk of gastric cancer: a pooled analysis of two prospective studies in Japan. Int J Cancer. 2004;112(6):1049-55. [ Links ]
27. Cienedes D, Cok J, Bussalleu A. Tipos histológicos de cáncer gástrico de acuerdo a la clasificación de Lauren en el Hospital Nacional Cayetano Heredia. Rev Gastroenterol Peru. 1995;15(3):239-46. [ Links ]
28. Henson DE, Dittus C, Younes M, Nguyen H, Albores- Saavedra J. Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States, 1973-2000: increase in the signet ring cell type. Arch Pathol Lab Med. 2004;128(7):765-70. [ Links ]
29. Correa P, Shiao YH. Phenotypic and genotypic events in gastric carcinogenesis. Cancer Res. 1994;54(7 Suppl):1941s-1943s. [ Links ]
30. Uemura N, Okamoto S, Yamamoto S. H. pylori infection and the development of gastric cancer. Keio J Med. 2002;51Suppl 2:63-8. [ Links ]
31. Fox JG, Dangler CA, Taylor NS, King A, Koh TJ, Wang TC. Highsalt diet induces gastric epithelial hyperplasia and parietal cell loss, and enhances Helicobacter pylori colonization in C57BL/6 mice. Cancer Res. 1999;59(19):4823-8. [ Links ]
32. Loh JT, Torres VJ, Cover TL. Regulation of Helicobacter pylori cagA expression in response to salt. Cancer Res. 2007;67(10):4709-15. [ Links ]
33. Eslick GD, Lim LL, Byles JE, Xia HH, Talley NJ. Association of Helicobacter pylori infection with gastric carcinoma: a metaanalysis. Am J Gastroenterol. 1999;94(9):2373-9. [ Links ]
34. Kikuchi S, Wada O, Nakajima T, Nishi T, Kobayashi O, Konishi T, et al. Serum anti-Helicobacter pylori antibody and gastric carcinoma among young adults. Research Group on Prevention of Gastric Carcinoma among Young Adults. Cancer. 1995;75(12):2789-93. [ Links ]
35. Kokkola A, Valle J, Haapiainen R, Sipponen P, Kivilaakso E, Puolakkainen P. Helicobacter pylori infection in young patients with gastric carcinoma. Scand J Gastroenterol. 1996;31(7):643-7. [ Links ]
36. Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Helicobacter pylori infection and chronic gastritis in gastric cancer. J Clin Pathol. 1992;45(4):319-23. [ Links ]
37. Solcia E, Fiocca R, Luinetti O, Villani L, Padovan L, Calistri D, et al. Intestinal and diffuse gastric cancers arise in a different background of H. pylori gastritis through different gene involvement. Am J Surg Pathol. 1996; 20 Suppl 1:S8-22. Características endoscópicas y patológicas del cáncer gástrico Parillo Durand LB, et al 216 Rev Gastroenterol Peru. 2017;37(3):209-16 [ Links ]
38. De Vries AC, van Grieken NC, Looman CW, Casparie MK, de Vries E, Meijer GA, et al. Gastric cancer risk in patients with premalignant gastric lesions: a nationwide cohort study in the Netherlands. Gastroenterology. 2008;134(4):945-52. [ Links ]
39. González CA, Pardo ML, Liso JM, Alonso P, Bonet C, Garcia RM, et al. Gastric cancer occurrence in preneoplastic lesions: a long-term follow-up in a high-risk area in Spain. Int J Cancer. 2010;127(11):2654-60. [ Links ]
40. Cassaro M, Rugge M, Gutierrez O, Leandro G, Graham DY, Genta RM. Topographic patterns of intestinal metaplasia and gastric cancer. Am J Gastroenterol. 2000;95(6):1431-8. [ Links ]
41. Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-Pinto R, Monteiro-Soares M, OConnor A, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy 2012;44(1):74–94 [ Links ]
42. Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291(2):187-94. [ Links ]
43. Hsu PI, Lai KH, Tseng HH, Lin CK, Lo GH, Cheng JS, et al. Impact of H. pylori eradication on the development of MALT, gland atrophy and intestinal metaplasia of the antrum. Zhonghua Yi Xue Za Zhi (Taipei). 2000;63(4):279-87. [ Links ]
44. Dixon MF. Prospects for intervention in gastric carcinogenesis: reversibility of gastric atrophy and intestinal metaplasia. Gut. 2001;49(1):2-4. [ Links ]
45. Dinis-Ribeiro M, Lopes C, da Costa-Pereira A, Guilherme M, Barbosa J, Lomba-Viana H, et al. A follow up model for patients with atrophic chronic gastritis and intestinal metaplasia. J Clin Pathol. 2004;57(2):177-82. [ Links ]
46. Lin CK, Lai KH, Lo GH, Cheng JS, Hsu PI, Mok KT, et al. Cathepsin E and subtypes of intestinal metaplasia in carcinogenesis of the human stomach. Zhonghua Yi Xue Za Zhi (Taipei). 2001;64(6):331-6. [ Links ]
47. Filipe MI, Muñoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, et al. Intestinal metaplasia types and the risk of gastric cancer: a cohort study in Slovenia. Int J Cancer. 1994 May 1;57(3):324-9. [ Links ]
48. Rokkas T, Filipe MI, Sladen GE. Detection of an increased incidence of early gastric cancer in patients with intestinal metaplasia type III who are closely followed up. Gut. 1991;32(10):1110-3. [ Links ]
49. Silva S, Filipe MI, Pinho A. Variants of intestinal metaplasia in the evolution of chronic atrophic gastritis and gastric ulcer. A follow up study. Gut. 1990;31(10):1097-104. [ Links ]
50. Tosi P, Filipe MI, Luzi P, Miracco C, Santopietro R, Lio R, et al. Gastric intestinal metaplasia type III cases are classified as low-grade dysplasia on the basis of morphometry. J Pathol. 1993;169(1):73-8. [ Links ]
Correspondencia:
Lilian Parillo Durand , Carlos Arenas Loayza 130, San Miguel. Lima, Perú . E-mail: lilian.parillo@gmail.com
Recibido: 4-7-2017
Aprobado: 1-9-2017