Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.3 Lima July/Sep. 2017
ARTÍCULO DE REVISIÓN
Aspectos prácticos en métodos diagnósticos para la infección por Helicobacter pylori: una revisión narrativa
Practical issues in diagnostic tests for Helicobacter pylori infection: a narrative review
Juan Sebastián Frías Ordoñez1, William Otero Regino2
1 Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
2 Unidad de Gastroenterología, Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
RESUMEN
El diagnóstico de H. pylori es importante debido a las distintas condiciones clínicas asociadas a su presencia, teniendo en cuenta las diferentes indicaciones recomendadas para terapia de erradicación de Helicobacter pylori y el amplio espectro de métodos diagnósticos disponibles, se hace necesario lograr un diagnóstico oportuno antes y después de la terapia de erradicación. El éxito en el diagnóstico se obtiene a partir de métodos con alta precisión, aquellos cuya sensibilidad y especificidad sea mayor a 90%. Este artículo plantea presentar avances en los diversos métodos relacionados con su detección, haciendo énfasis en sus contribuciones y posibles defectos. La decisión del método diagnóstico a aplicar dependerá del contexto clínico específico.
Palabras clave: Helicobacter pylori; Diagnóstico; Prueba de laboratorio; Endoscopia (fuente: DeCS BIREME).
ABSTRACT
H. pylori diagnosis is important because of the different clinical conditions associated with its presence, taking into account the different recommended indications for Helicobacter pylori erradication therapy and the broad spectrum of available diagnostic methods, it is necessary to achieve a timely diagnosis before and after eradication therapy. The success in the diagnosis is obtained from methods with high precision, those whose sensitivity and specificity is greater than 90%. This article aims to present advances in the various methods related to its detection, emphasizing their contributions and possible defects. The decision of the diagnostic method to apply will depend on the specific clinical context.
Keywords: Helicobacter pylori; Diagnosis; Laboratory test; Endoscopy (source: MeSH NLM).
INTRODUCCIÓN
Helicobacter pylori es la única bacteria que infecta la mucosa gástrica, a pesar de ser la más dominante entre las bacterias, no se comporta como un patógeno bacteriano clásico, debido a que el desarrollo de la enfermedad depende de una relación compleja entre patógeno, huésped y factores ambientales (1). En todas las personas infectadas esta bacteria produce gastritis crónica; sin embargo, en la mayoría de casos la enfermedad cursa de modo asintomático. En menos del 20% de los casos de la infección habrá manifestaciones clínicas, dadas por enfermedad por úlcera péptica en 15%-18% de los casos y en menor proporción, cáncer gástrico y linfoma MALT gástrico, con alrededor de 2%3% y menos del 1% de los casos, respectivamente (2,3). Su presencia en mucosa gástrica es el factor de riesgo conocido más fuertemente asociado para desarrollo de cáncer gástrico. Estudios epidemiológicos han estimado que en su ausencia el 75% de los canceres gástricos no existirían (3), siendo entonces considerado el agente causante más común de cáncer atribuible a infección y responsable del 5,5% de todos los cánceres a nivel mundial (4). También se encuentra relacionada con patologías extra-gástricas, como enfermedades hematológicas, neurodegenerativas, hepáticas y coronarias (5-7). Incluso, recientemente se ha afirmado acerca de su relación con la aparición de pólipos adenomatosos y cáncer de colon (8). Por su participación en la etiología de diversos padecimientos clínicos, genera considerable morbimortalidad, causando impacto en la calidad de vida y en los sistemas de salud de la población, haciendo que su diagnóstico oportuno y tratamiento sean importantes tanto para atenuar la severidad de la enfermedad como para la prevención de cáncer gástrico (9). Se acude a los distintos métodos diagnósticos para poder realizar diagnóstico de novo o seguimiento de la enfermedad asociada a la infección.
Tradicionalmente el diagnóstico se ha realizado a partir de la combinación de pruebas, tanto invasivas como no invasivas. Considerando el amplio espectro de métodos diagnósticos, en la práctica clínica bajo ciertas circunstancias se deberían utilizar aquellas pruebas con gran precisión diagnóstica y actualmente, se tiene en cuenta que la sensibilidad y especificidad de estas mismas sean mayores al 90%. La elección del método a utilizar depende de las circunstancias clínicas del paciente a evaluar, la disponibilidad de la prueba, el cociente de probabilidad de resultados positivos y negativos y su costo-efectividad (10). Mediante la siguiente revisión se plantea exponer una visión general sobre los avances más recientes en métodos diagnósticos para evaluar la infección por H. pylori. Por tanto, se hace necesario mencionar las indicaciones precisas de cada prueba diagnóstica, describiendo sus contribuciones y posibles defectos.
VALORANDO LA PRESENCIA DE Helicobacter pylori
Existen varias pruebas diagnósticas para identificar a H. pylori ; sin embargo, no hay ninguna prueba que al ser únicamente aplicada pueda ser considerada como el estándar de oro para el diagnóstico de H. pylori, haciendo que ninguna de estas sea perfectamente confiable (10-12). La relación existente entre la prevalencia de la infección y su patología clínica al ser dispareja hace que se le niegue algún rol para el seguimiento de rutina de la infección (12,13). Sin embargo, se considera su evaluación y tratamiento en varias condiciones clínicas. En la Tabla 1, se enumeran estas condiciones de acuerdo al reporte del IV Consenso de Maastricht y las guías de manejo del Colegio Americano de Gastroenterología (ACG–American College of Gastroenterology) (14,15).
Para el diagnóstico de H. pylori se cuenta con las pruebas invasivas y no-invasivas. Las pruebas invasivas son aquellas que se realizan por vía endoscópica, permitiendo valorar la presencia de H. pylori, determinar el grado de compromiso de la mucosa gástrica y obtener muestras de ella (16), estas incluyen el estudio histopatológico, la prueba rápida de la ureasa y el cultivo (10-16). Las pruebas no-invasivas son aquellas que no implican la necesidad de realizar endoscopia, permiten estimar la ausencia o presencia de infección activa por H. pylori, realizándolo de modo directo o por la detección y respuesta de anticuerpos contra la infección que pueden ser sugestivos o no de infección activa (16), siendo estas la serología, la prueba del aliento a urea y la prueba de antígenos fecales (10-16). Por último, se encuentran los métodos moleculares, que permiten detectar al H. pylori a partir de muestras biológicas obtenidas de modo invasivo, como una muestra de tejido gástrico, o también de modo no-invasivo como muestras obtenidas de la cavidad oral o de materia fecal y por lo general estas suelen realizarse de forma no-invasiva (10).
MÉTODOS INVASIVOS
Histopatología
El examen histopatológico es una de las pruebas de mayor utilidad y es considerado por algunos como el estándar de oro para la detección de H. pylori. Los expertos coinciden en que su principal ventaja es permitir observar directamente los cambios patológicos asociados a la infección, que en caso de no poder detectarse al germen, estos cambios representarían marcadores de infección por H. pylori (17). Sus resultados dependen entonces de la calidad, el número de biopsias obtenidas en mucosa y la distribución de H. pylori. Junto a lo anterior, la necesidad de personal entrenado en endoscopia digestiva y los costos de ejecución de la prueba son sus principales limitaciones (14). La distribución de H. pylori en un mismo individuo y a nivel gástrico puede variar debido a su capacidad de migrar dentro del estómago y adaptarse a cambios bioquímicos, influenciada por numerosos factores, entre ellos el uso de medicamentos moduladores de la bioquímica gástrica, principalmente los IBP (inhibidores de bomba de protones), por lo cual se recomienda descontinuarlos dos semanas antes de realizar endoscopia y tomar biopsia tanto de antro como cuerpo gástrico (12,14). Para mayor precisión diagnóstica se recomienda la obtención de un mínimo de 3 biopsias a partir de 2 localizaciones diferentes a nivel gástrico, que incluyan al menos el antro y el cuerpo, las localizaciones específicas de estas tres serían a nivel de la incisura angularis, a nivel de la curvatura mayor del cuerpo y otra de la curvatura mayor a nivel del antro (17). En un estudio canadiense, se tomaron registros electrónicos de pacientes para evaluarlos respecto a localización de toma de biopsia gástrica y el uso de inhibidores de bomba de protones a la endoscopia, siendo 150 casos con biopsias tomadas tanto de antro como cuerpo gástrico, estos fueron seleccionados al azar para revisión patológica con tinciones especiales, se tomaron muestras de distintas regiones gástricas y se valoró la distribución de H. pylori y la influencia de factores clínicos en la interpretación patológica, confirmándose que el uso de IBP durante la realización de endoscopia contribuye a un falso diagnóstico y que, tomar biopsia gástrica de solo una región aumenta la posibilidad de pasar por alto a la infección activa en por lo menos un 15% (18). Desde el descubrimiento de H. pylori, los patólogos han utilizado distintas técnicas diagnósticas, que incluyen los métodos inmunohistoquímicos y las tinciones especiales, como Giemsa y Warthin-Starry, dependiendo de la institución o laboratorio y con sensibilidades y especificidades variables para identificar a H. pylori (10). Sin embargo, la necesidad de usar tinciones especiales o métodos inmunohistoquímicos ha sido debatida en años recientes. Wang et al. recientemente confirmaron que las tinciones especiales, específicamente las inmunohistoquímicas, no son costo-efectivas o necesarias (19). Por otro lado Smith y cols. hace unos años, en un estudio retrospectivo en el cual se tuvo en cuenta 200 muestras de mucosa gástrica tomadas de forma consecutiva, corroboraron que H. pylori es fácilmente observado en la mayoría de casos en que se utiliza hematoxilina-eosina (Sensibilidad 91% y Especificidad 100%), permaneciendo como la más conveniente y menos costosa para identificar a H. pylori en biopsias gástricas (20). Por último, hay que considerar que la coloración de Giemsa convencional es el método más ampliamente utilizado, aunque las técnicas inmunohistoquímicas aumentan tanto la especificidad como la sensibilidad en el diagnóstico de la infección (21).
Cultivo
El cultivo es considerado el método más específico y con múltiples utilidades que incluyen la clasificación genotípica del microorganismo, el diagnóstico microbiológico, la evaluación de su toxicidad y virulencia, la determinación y monitoreo de la resistencia a antibióticos y producción de antígenos, así como poder preservar la cepa para futuros estudios (22,23). Sin embargo, el cultivo a partir de biopsias gástricas se asocia a mayores costos, consumo de tiempo, requiere de personal con experiencia y de la necesidad de condiciones y requerimientos especiales para el transporte, procesamiento y cultivo de H. pylori (2024). Algunas de estas condiciones incluyen atmósferas microaerofílicas, con concentraciones de dióxido de carbono del 10%, alta humedad, temperatura de 37°C y períodos de incubación que pueden variar entre 3 a 14 días (25-27). Se debe mencionar que dada la distribución de H. pylori por parches en el estómago y el reto de tomar una muestra ideal como biopsia favorecen las dificultades en el diagnóstico por medio del cultivo, que también pueden presentarse con el uso de algunos medicamentos como los IBP, los antibióticos, el bismuto y el sucralfato, alterando los resultados (28). La prueba es conocida por su máxima especificidad, mientras que su sensibilidad puede variar de 68 a 98%, dependiendo de la pericia del laboratorio (29). Cabe resaltar que el cultivo es una prueba de gran valor diagnóstico en aquellos pacientes con falla terapéutica al manejo antibiótico inicial para H. pylori, ya que al basarse en sus resultados permite plantear ajustes terapéuticos (12,30). De lo anterior, se puede afirmar que su máxima utilidad y aplicación se ha observado en los casos de estudios de intervención en los que se evalúen resistencia pre-tratamiento, permitiendo determinar al final del estudio el impacto en la resistencia y la erradicación de H. pylori con la terapia utilizada y así establecer estrategias terapéuticas a futuro; otros escenarios incluyen la determinación del patrón de prevalencia de resistencia a los diferentes antibióticos en una población específica con el fin de establecer un esquema terapéutico más racional, y en los casos de persistencia de infección por H. pylori posterior a falla terapéutica (24,30).
En cuanto a su realización a partir de muestras de materia fecal se han encontrado ciertas dificultades, atribuibles a la composición compleja de microorganismos de la materia fecal y al desprendimiento de formas no viables de H. pylori; Sin embargo, se ha demostrado su éxito en condiciones de tránsito gastrointestinal rápido (31). Respecto al papel de la cavidad oral como posible reservorio, se afirma que la detección de H. pylori en placa dental de pacientes con dispepsia no puede pasar desapercibida y podría representar un factor de riesgo para recolonización gástrica posterior a terapia de erradicación, e incluso contribuir a su propagación intrafamiliar (32,33).
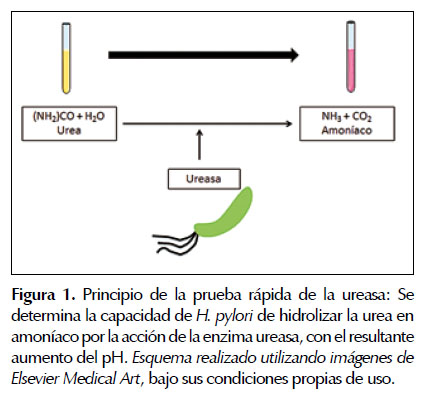
Prueba rápida de la ureasa
La prueba rápida de la ureasa se utiliza ampliamente en la práctica clínica y valora la acción de la ureasa bacteriana. La ureasa es la enzima bacteriana que permite su supervivencia en el ambiente hostil dado por la acidez gástrica, al romper la urea en dióxido de carbono y amoniaco (Figura 1), llevando a un aumento en el pH del microambiente de la bacteria a nivel gástrico (29). La prueba tiene sensibilidad del 85 a 95% y especificidad del 95 al 100% (34). Su sensibilidad hace que sea conveniente la aplicación de otras pruebas para poder completar el diagnóstico de H. pylori, y habitualmente se recomienda junto al examen histopatológico debido a su disponibilidad (35). Se debe mencionar que su sensibilidad se hace menor si la densidad bacteriana esta disminuida (inferior a 1 000 -100 000 bacterias), razón por la cual no se recomienda utilizar para evaluar la terapia de erradicación (36) . Igualmente, su sensibilidad puede disminuir según el contexto clínico del paciente, alcanzando valores del 67 al 85% en pacientes con ulcera péptica sangrante o del 79% en pacientes con gastrectomía parcial, e incluso la contaminación de los fórceps utilizados para tomar biopsias de mucosa gástrica con formalina puede contribuir a disminuir su sensibilidad (34,37-39). El valor de su especificidad favorece la conclusión de la presencia de H. pylori a partir de un resultado positivo en la prueba. En casos de densidad bacteriana elevada, la prueba se puede volver positiva en minutos, siendo evidente la necesidad de iniciar terapia de erradicación (11). A partir de varios estudios se ha establecido que la obtención de un mayor número de biopsias y de diferentes regiones del estómago permite lograr mayor sensibilidad para la prueba (40,41).
MÉTODOS NO-INVASIVOS
Pruebas moleculares
Las pruebas moleculares cada vez van ganando confiabilidad, debido a que permiten detectar la bacteria de un modo más rápido, preciso y sensible que con los métodos convencionales, e igualmente cumplir otros propósitos, como la detección de resistencia a antibióticos y determinantes de virulencia, así como la cuantificación bacteriana. En su aplicación se pueden utilizar también muestras biológicas distintas a mucosa gástrica obtenidas de forma no invasiva, como materia fecal o muestras de cavidad oral(10,14). La reacción en cadena de la polimerasa ( PCR – polymerase chain reaction) permite la detección de secuencias específicas de DNA bacteriano, logrando la secuenciación de importantes genes bacterianos responsables de la colonización y patogenicidad por H. pylori (14). Existen varias modalidades para realizar la prueba, las más importantes dentro del contexto de detección de H. pylori son la PCR convencional y la PCR en tiempo real (10). Estas técnicas pueden ser automatizadas, permitiendo obtener resultados en cualquier momento (11). Entre las dos modalidades anteriormente mencionadas, la PCR en tiempo real ha demostrado mayor sensibilidad frente a la PCR convencional. Recientemente un ensayo en el cual se realizó PCR en tiempo real basada en el gen ureC de H. pylori (gen con copia única) comparada frente a la PCR convencional, se demostró que la PCR en tiempo real era casi 10 veces más sensible que la PCR convencional para la detección de H. pylori, e incluso se corroboró que el número de copias de ureC estaba significativamente aumentado cuando había presencia asociada de gastritis crónica, metaplasia intestinal y densidad bacteriana (42). La PCR en tiempo real también puede tener gran aplicación en estudios de reservorios ambientales (43,44). La cuantificación bacteriana también puede ser de importancia en el manejo clínico de la infección, por ejemplo, para el seguimiento del tratamiento instaurado en condiciones clínicas particulares, como en la hemorragia de vías digestivas altas (45). En un estudio realizado por Lo et al, que incluyó 60 pacientes que presentaron úlcera gastroduodenal sangrante entre abril y septiembre de 2002, se comparó la sensibilidad y especificidad de la PCR convencional frente a otros métodos diagnósticos como la prueba rápida de la ureasa, estudio histopatológico, cultivo, prueba del aliento a urea y las pruebas serológicas para la detección de H. pylori, llegándose a establecer sensibilidad del 91% y especificidad del 100% para la PCR convencional, siendo de mayor precisión diagnóstica frente a las otras pruebas comparadas (46) . Las desventajas de los métodos moleculares consisten en su limitada disponibilidad, mayores costos de realización implicados y la necesidad de materiales especiales elaborados por laboratorios específicos. Se debe mencionar que no permiten determinar la viabilidad biológica de la bacteria, razón por lo cual no son utilizadas en la práctica de rutina (10,11). A medida que haya más conocimiento a nivel molecular sobre H. pylori se podrán desarrollar nuevas estrategias para tratamiento y prevención, así como mejores métodos diagnósticos moleculares para detectar infección por H. pylori (10).
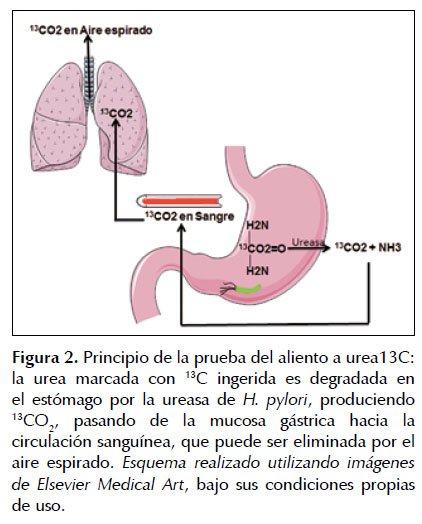
Prueba del aliento a urea
La prueba del aliento a urea con Carbono-13 es una de las pruebas más veraces para detectar infección por H. pylori. Se caracteriza porque es no-invasiva, simple y segura para proveer excelente precisión en el diagnóstico inicial de infección por H. pylori, así como valoración posterior a terapia de erradicación. Mediante la prueba se estima la habilidad de H. pylori para convertir la urea en dióxido de carbono, existente gracias a la ureasa bacteriana (47). La urea puede estar marcada con Carbono-14 o con Carbono-13. El Carbono-14 es el isotopo radioactivo, su uso es de menor costo, sin embargo implica exposición a cierta dosis de radiación, llegándose a establecer que del compuesto administrado inicialmente en la prueba alrededor del 90% es eliminado tres días después, reteniéndose entonces cierta cantidad del compuesto en el cuerpo e implicando toxicidad tras su administración (48). A su vez el Carbono-13 es el isotopo no-radiactivo, ampliamente utilizado en clínica, asociándose a mayor seguridad, por lo que puede utilizarse en mujeres gestantes y niños. Los protocolos más ampliamente utilizados incluyen bajas dosis de urea (<100 mg), siendo suficientes 50 mg o 75 mg en solución acuosa y marcada con Carbono-13 junto a 1,5 mg ácido cítrico, se formará un compuesto que va a llegar al estómago y establecerá contacto con la mucosa, difundiendo por el moco gástrico hasta llegar a H. pylori y al aporte sanguíneo de la mucosa, posterior hidrolisis y obtención de amoniaco y dióxido de carbono marcado (Figura 2) (47). Alrededor de 10 a 15 minutos después, el dióxido de carbono marcado se hará evidente en el aliento al ser exhalado, podrá ser colectado y cuantificado, con el fin de identificar y expresar de modo cuantitativo la infección activa por H. pylori (12,47). No ha sido posible basarse en algún punto de corte propuesto y a su vez único, dado que debe tenerse en cuenta diferentes factores, como la comida ingerida previo a la prueba, la dosis y el tipo de marcador utilizado, al igual que el contexto terapéutico. Actualmente, la prueba se comercializa para usar en dispositivos más pequeños y económicos, como el espectroscopio infrarrojo o el radio análisis asistido por láser, de particular interés para seguimiento en niños con síntomas para infección previo a realizar endoscopia o para valoración de la eficacia terapéutica una vez completada (49,50). En adultos, la prueba al realizarse con carbono-13 tiene sensibilidad entre el 88 al 95% y especificidad del 95 al 100%, sin embargo al evaluarse su precisión diagnóstica en población pediátrica se han encontrado resultados heterogéneos, especialmente en edades menores, con valores de sensibilidad y especificidad que van del 75 al 100%, obtenidos antes y después de dar tratamiento, y utilizando distintos protocolos (51). Se afirma que en pacientes pediátricos se requieren pruebas no-invasivas cada vez más precisas para el diagnóstico de infección por H. pylori, con el fin de evitar someter a estos pacientes a procedimientos invasivos y a su vez dolorosos y también para superar los resultados falsos negativos que pueden encontrarse con pruebas consideradas como estándar de oro (como la histopatología, el cultivo o la prueba rápida de la ureasa), casos en los cuales la colonización por H. pylori en el estómago es baja y su patrón de distribución es por parches. La variabilidad de resultados observados en niños es atribuible a la actividad ureasa de la flora bacteriana oral, las diferencias en el tiempo de toma de muestras y en los puntos de corte. También, se debe mencionar que la producción individual de dióxido de carbono está influenciada por características antropométricas como la edad y el sexo (52). Leal et al. desarrollaron una revisión sistemática informativa y meta-análisis, que incluyó 31 artículos y 135 estudios realizados entre enero de 1998 a mayo 2009, con el fin de evaluar el rendimiento de la prueba del aliento a urea con carbono-13 en el diagnóstico de infección por H. pylori en niños, los estudios incluidos comparaban la prueba frente a otra considerada como estándar de oro y los niños fueron estratificados en subgrupos de edad de menores a 6 años y mayores o iguales a 6 años, demostrándose adecuada precisión diagnóstica en todas las edades combinadas, con sensibilidad del 95,9% y especificidad del 95,7%; alta precisión diagnóstica en mayores a 6 años con sensibilidad de 96,6% y especificidad del 97,7%; y variabilidad en menores a 6 años, al obtener sensibilidad del 95% y especificidad del 93,5%. Los autores identificaron como posibles fuentes de heterogeneidad en los resultados: la dosis del marcador, la comida consumida previo a realizar la prueba y el valor del punto de corte; observando que al usar dosis de 50 mg de carbono-13 se demostraba mejor precisión diagnóstica al ser ajustada al peso corporal y superando a la de los estudios que utilizaron dosis comprendidas entre 50 y 75 mg (53).
Prueba de antígenos fecales
Esta prueba no-invasiva se recomienda usualmente cuando la prueba del aliento a urea no está disponible (54). Dentro de sus principales ventajas se encuentran no requerir de equipos costosos o personal médico para su realización y la practicidad en la toma de muestra, al poder realizarse en casa sin la necesidad de acudir al hospital (10). Su importancia para diagnóstico en niños se explica por presentar mayor seguridad y menores costos (55,56). La detección de H. pylori se hace por medio de anticuerpos monoclonales y policlonales (15). La prueba utiliza anticuerpos anti- H. pylori adsorbidos a través de los poros de una micro-placa con el fin de capturar los antígenos de H. pylori presentes en una muestra de materia fecal diluida, luego otro anticuerpo marcado con peroxidasa y un sustrato son utilizados, formándose inmunocomplejos, posteriormente estos migran por acción capilar y finalmente efectuar la lectura del resultado por espectrofotometría a 450 nm (57). Las muestras de materia fecal pueden ser sometidas a congelación a temperatura de -20°C, o también conservarse a 4°C si la prueba se va a realizar durante el día(11). Actualmente hay dos pruebas disponibles en el mercado, el Ensayo por Inmunoadsorción Ligado a Enzimas (ELISA) y el Ensayo Rápido inmunocromatográfico (ICT) (14). En una revisión sistemática realizada por Gisberty et al. se evaluó la prueba de antígenos fecales empleando anticuerpos policlonales en pacientes sin tratamiento para H. pylori, demostrando sensibilidad de 91%, especificidad del 93%, valor predictivo positivo y valor predictivo negativo 92% y 87% respectivamente; en los estudios que formaron parte de la revisión los pacientes recibieron tratamiento y les fue evaluada nuevamente la presencia de H. pylori 4 a 8 semanas después, demostrando sensibilidad de 86%, especificidad de 92%, valor predictivo positivo y valor predictivo negativo de 76% y 93% respectivamente, observándose entonces baja precisión diagnóstica pos-terapéutica (58). Más adelante Gisberty et al. realizaron una revisión sistemática y metanálisis donde evaluaron la prueba empleando anticuerpos monoclonales para diagnóstico de H. pylori antes y después del tratamiento, demostrando sensibilidad del 94% y especificidad del 97% antes de la terapia de erradicación y sensibilidad especificidad de 93% y 96% respectivamente posterior a su administración, por lo que se evidenciaron mejores resultados frente a los obtenidos con el empleo de anticuerpos policlonales. Adicionalmente, en el metanálisis se reveló que globalmente la prueba, independientemente del uso de anticuerpos policlonales o monoclonales, posee sensibilidad y especificidad de 94% (IC95%: 93-95%) y 97% (IC95%: 96-98%) respectivamente (59). Dada su fácil realización en el laboratorio y que realmente es una prueba no-invasiva, es considerada una alternativa a la prueba del aliento a urea para el seguimiento terapéutico de la infección por H. pylori durante el periodo comprendido entre la segunda semana de tratamiento y la primera semana posterior a su finalización (11,60). Otras de sus ventajas son su utilidad en áreas cuya prevalencia de infección por H. pylori es baja (14) y la posibilidad de diagnosticar la infección a partir de una muestra de materia fecal, siendo de particular interés para la aplicación en pacientes pediátricos (11). En comparación a la prueba del aliento a urea puede llegar a presentar menor especificidad, posiblemente atribuible a detección de otras Helicobacterias, como las bacterias enterohepáticas, que también son eliminadas por las heces (57). Incluso se ha demostrado la variabilidad en su rendimiento diagnóstico tras la administración de IBP (61).
Pruebas serológicas
Estas pruebas solían ser utilizadas inicialmente para el diagnóstico de infección por H. pylori (62). Algunos de los contextos a tener en cuenta para su uso incluyen el uso de IBP, tratamiento antibiótico reciente, o presencia de signos de sangrado agudo en vías digestivas altas. Siendo entonces el único método que no se ve afectado por los cambios localizados a nivel gástrico que afecten la carga bacteriana (14,63). Actualmente se recomienda su realización para el seguimiento inicial en pacientes con síntomas para infección por H. pylori, requiriendo posteriormente confirmación con histopatología y/o cultivo previo a iniciar algún tratamiento (64). Permiten valorar la presencia de anticuerpos tipo inmunoglobulina G contra H. pylori, presentes en suero hasta aproximadamente 21 días después de haber adquirido la infección y persistentes por un tiempo largo después de su erradicación, por lo cual son útiles para detectar infección activa o pasada (65). De hecho esta es una de sus limitaciones, no poder distinguir entre infección activa o pasada por H. pylori específicamente en pacientes que recibieron terapia de erradicación, ya que los anticuerpos contra la bacteria pueden persistir por largo tiempo tras su erradicación(66). Por otra parte, los niveles de anticuerpos a H. pylori son significativamente heredables, haciendo que las diferencias genéticas individuales del huésped humano contribuyan a variabilidad en niveles de anticuerpos para H. pylori (67). Los anticuerpos se valoran cuantitativamente utilizando pruebas de ELISA o aglutinación en látex, y cualitativamente utilizando un kit de fijación del complemento. Su realización es menos costosa, sus resultados son de rápida reproducibilidad, por lo que suelen ser utilizados más que las demás pruebas no-invasivas (65). Recientemente, se comparó el rendimiento de 29 kits de pruebas serológicas, demostrando sensibilidades entre el 55,6% al 100%, especificidades del 59,6% al 97,9%, valores predictivos positivos del 69,8% al 100%, y valores predictivos negativos del 68,3% al 100% (62). El kit más apropiado debe ser elegido de acuerdo a la meta propuesta, sea para seguimiento posterior a terapia de erradicación, diagnóstico inicial o confirmación con algún otro método (21). Se han sugerido modificaciones a las pruebas serológicas, tales como el ensayo de inmunoafinidad automatizado para detección de IgG a H. pylori usando el antígeno de H. pylori inmovilizado en nanopartículas magnéticas, encontrándose mayor rapidez que la prueba de ELISA y requiriendo menor volumen sérico (68). El inmunoensayo de flujo lateral, un ensayo inmunocromatográfico, mantiene el enfoque serológico con la ventaja de ser rápido, económico y de no requerir equipos adicionales o experiencia (69).
CONCLUSIONES
El diagnóstico de H. pylori no es fácil de lograr debido a las dificultades en acceder a su nicho ecológico y la fragilidad de su naturaleza. Su detección continuará siendo tema de gran interés debido a los riesgos asociados a su presencia. Poder lograrlo implica del conocimiento combinado, esfuerzos e investigación por parte de un grupo multidisciplinario que incluye personal de laboratorio, microbiólogos, patólogos, médicos generales, médicos internistas y gastroenterólogos.
A pesar de todos los avances obtenidos y las contribuciones recientes de todos los métodos diagnósticos en mejorar el enfoque clínico actual, el manejo de las enfermedades asociadas a la presencia de H. pylori y el rendimiento diagnóstico en distintos grupos de edad y condiciones clínicas, no se ha podido establecer un método perfecto para su diagnóstico y continuara siendo un tema cada vez de mayor relevancia para ser evaluado por estudios epidemiológicos.
Las contribuciones características de cada método diagnóstico para el abordaje diagnóstico y terapéutico de infección por H. pylori seguirán siendo de importancia, y corresponde al clínico tomar la decisión del método o métodos a realizar de acuerdo al contexto específico en que se vaya a evaluar la presencia de H. pylori.
Conflicto de intereses: Los autores no declaran ningún conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Dorer MS, Talarico S, Salama NR. Helicobacter pylori's unconventional role in health and disease. PLoS Pathog. 2009;5(10):e1000544. [ Links ]
2. Otero W, Gómez M, Castro D. Carcinogénesis gástrica. Rev Col Gastroenterol. 2009;24(3):314-29. [ Links ]
3. Herrera V, Parsonnet J. Helicobacter pylori and gastric adenocarcinoma. Clin Microbiol Infect. 2009;15(11):971-6. [ Links ] 4. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55(2):74-108. [ Links ]
5. Ekström P. Non-gastric effects of H. pylori infection: a literature review with respect to non-gastric diseases which might be associated with H. pylori infection. Eur J Surg. 1998;164(582):32-4. [ Links ]
6. Papagiannakis P, Michalopoulos C, Papalexi F, Dalampoura D, Diamantidis MD. The role of Helicobacter pylori infection in hematological disorders. Eur J Intern Med. 2013;24(8):685-90. [ Links ]
7. Roubaud-Baudron C, Krolak-Salmon P, Quadrio I, Mégraud F, Salles N. Impact of chronic Helicobacter pylori infection on Alzheimers disease: preliminary results. Neurobiol Aging. 2012;33(5):1009.e11-9. [ Links ]
8. Sonnenberg A, Genta RM. Helicobacter pylori is a risk for colonic neoplasms. Am J Gastroenterol. 2013;108(2):208-15. [ Links ]
9. Lu H, Xiao SD. New ideas for future studies of Helicobacter pylori. J Dig Dis. 2014;15(1):1-4. [ Links ]
10. Lopes AI, Vale FF, Oleastro M. Helicobacter pylori infection – recent developments in diagnosis. World J Gastroenterol. 2014;20(28):9299-313. [ Links ]
11. Korwin JD. Avantages et inconvénients des différentes methods diagnostiques de linfectionà H. pylori. Gastroenterol Clin Biol. 2003;27(3):380-90. [ Links ]
12. Kanna S, Maradey-Romero C, Fass R. Diagnostic tests for Helicobacter pylori. Gastroenterol Endosc News. 2013;11(Special edition):51-8. [ Links ]
13. McColl KE. Clinical Practice: Helicobacter pylori infection. N Engl J Med. 2010;362(17):1597-604. [ Links ]
14. Malfertheiner P, Megraud F, OMorain CA, Atherton J, Axon AT, Bazzoli F, et al. Management of Helicobacter pylori infection – The Maastricht IV/Florence Consensus Report. Gut. 2012;61(5):646-64. [ Links ]
15. Chey WD, Wong BC. American College of Gastroenterology guideline on the management of Helicobacter pylori infection. Am J Gastroenterol. 2007;102(8):1808-25. [ Links ]
16. Saad RJ. Helicobacter pylori infection: Who and How to test? JCOM J. 2012;19(4):158-66. [ Links ]
17. El-Zimaity HM. Accurate diagnosis of Helicobacter pylori with biopsy. Gastroenterol Clin North Am. 2000;29(4):863-9. [ Links ]
18. El-Zimaity H, Serra S, Szentgyorgyi E, Vajpeyi R, Samani A. Gastric biopsies: the gap between evidence-based medicine and daily practice in the management of gastric Helicobacter pylori infection. Can J Gastroenterol. 2013;27(10):e25-30. [ Links ]
19. Wang XI, Zhang S, Abreo F, Thomas J. The role of routine immunohistochemistry for Helicobacter pylori in gastric biopsy. Ann Diagn Pathol. 2010;14(4):256-9. [ Links ]
20. Smith SB, Snow AN, Perry RL, Qasem SA. Helicobacter pylori: to stain or not to stain? Am J Clin Pathol. 2012;137(5):733-8. [ Links ]
21. Tonkic A, Tonkic M Lehours P, Mégraud F. Epidemiology and diagnosis of Helicobacter pylori infection. Helicobacter. 2012;17(Suppl. 1):1-8. [ Links ]
22. Hutton ML, Kaparakis-Liaskos M, Ferrero RL. The use of AlbuMAX II(®) as a blood or serum alternative for the culture of Helicobacter pylori. Helicobacter. 2011;17(1):68-76.
23. Asaka M, Kato M, Takahashi S, Fukuda Y, Sugyyama T, Ota H, et al. Guidelines for the management of Helicobacter pylori infection in Japan: 2009 revised edition. Helicobacter. 2010;15(1):1-20. [ Links ] 24. Otero W. La importancia de cultivar Helicobacter pylori. Rev Col Gastroenterol. 2013;28(2):87-92. [ Links ]
25. Mohammadi M, Hashani SS, Garoosi YT, Tazehkand SJ. In vivo measurement of Helicobacter pylori. Meth Mol Biol. 2012;921:239-56. [ Links ]
26. Islam MMSU, Nahar S, Sarker MN, Salimullah ASM, Rahman MA, Ahmed DS, et al. Efficacy of different laboratory tests to diagnose Helicobacter pylori infection. Faridpur Med Coll J. 2013;8(1):11-4. [ Links ]
27. Bury-Moné S, Kaakoush NO, Asencio C, Mégraud F, Thibonnier M, De Reuse H, et al. Is Helicobacter pylori a true microaerophile? Helicobacter. 2006;11(4):296-303. [ Links ]
28. Perez-Perez GI. Accurate diagnosis of Helicobacter pylori. Culture, including transport. Gastroenterol Clin North Am. 2000;29(4):879-84. [ Links ]
29. Cutler AF. Diagnostic tests for Helicobacter pylori infection. Gastroenterologist. 1997;5(3):202-12. [ Links ]
30. Fiorini G, Vakil N, Zullo A, Saracino IM, Castelli V, Ricci C, et al. Culture-based selection therapy for patients who did not respond to previous treatment for Helicobacter pylori infection. Clin Gastroenterol Hepatol. 2013;11(5):507-10. [ Links ] 31. Parsonnet J, Shmuely H, Haggerty T. Fecal and oral shedding of Helicobacter pylori from healthy infected adults. JAMA. 1999;282(23):2240-5. [ Links ]
32. Agarwal S, Jithendra KD. Presence of Helicobacter pylori in subgingival plaque of periodontitis patients with and without dyspepsia, detected by polymerase chain reaction and culture. J Indian Soc Periodontol. 2012;16(3):398-403. [ Links ]
33. Tsami A, Petropoulou P, Kafritsa Y, Mentis YA, Roma- Giannikou E. The presence of Helicobacter pylori in dental plaque of children and their parents: is it related to their periodontal status and oral hygiene? Eur J Paediatr Dent. 2011;12(4):225-30. [ Links ]
34. Tseng CA, Wang WM, Wu DC. Comparison of the clinical feasibility of three rapid urease tests in the diagnosis of Helicobacter pylori infection. Dig Dis Sci. 2005;50(3):449-52. [ Links ]
35. Howden CW, Hunt RH. Guidelines for the management of Helicobacter pylori infection. Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology. Am J Gastroenterol. 1998;93(12):2330-8. [ Links ]
36. Conclusions et recommandations révisées du Groupe de travail. Conférence de consensus Helicobacter pylori – Révision 1999. Gastroenterol Clin Biol. 1999;23:C95-104. [ Links ]
37. Gisbert JP, Abraira V. Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol. 2006;101(4):848-63. [ Links ]
38. Choi YJ, Kim N, Lim J, Jo SY, Shin CM, Lee HS, et al. Accuracy of diagnostic tests for Helicobacter pylori in patients with peptic ulcer bleeding. Helicobacter. 2012;17(2):77-85. [ Links ]
39. Tian XY, Zhu H, Zhao J, She Q, Zhang GX. Diagnostic performance of urea breath test, rapid urea test, and histology for Helicobacter pylori infection in patients with partial gastrectomy: a meta-analysis. J Clin Gastroenterol. 2012;46(4):285-92. [ Links ]
40. Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, et al. Dual specimens increase the diagnostic accuracy and reduce the reaction duration of rapid urease test. World J Gastroenterol. 2010;16(23):2926-30. [ Links ]
41. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, et al. United Rapid Urease Test Is Superior than Separate Test in Detecting Helicobacter pylori at the Gastric Antrum and Body Specimens. Clin Endosc. 2012;45(4):392-6. [ Links ]
42. Shukla SK, Prasad KN, Tripathi A, Ghoshal UC, Krishnani N, Nuzhat H. Quantitation of Helicobacter pylori ureC gene and its comparison with different diagnostic techniques and gastric histopathology. J Microbiol Methods. 2011;86(2):231-7. [ Links ]
43. Nayak AK, Rose JB. Detection of Helicobacter pylori in sewage and water using a new quantitative PCR method with SYBR green. J Appl Microbiol. 2007;103(5):1931-41. [ Links ] 44. Voytek MA, Ashen JB, Fogarty LR, Kirshtein JD, Landa ER. Detection of Helicobacter pylori and fecal indicator bacteria in five North American rivers. J Water Health. 2005;3(4):405-22. [ Links ]
45. Saez J, Belda S, Santibáñez M, Rodríguez JC, Sola-Vera J, Galiana A, et al. Real-time PCR for diagnosing Helicobacter pylori infection in patients with upper gastrointestinal bleeding: comparison with other classical diagnostic methods. J Clin Microbiol. 2012;50(10):3233-7. [ Links ]
46. Lo CC, Lai KH, Peng NJ, Lo GH, Tseng HH, Lin CK, et al. Polymerase chain reaction: A sensitive method for detecting Helicobacter pylori infection in bleeding peptic ulcers. World J Gastroenterol. 2005;11(25):3909-14. [ Links ]
47. Gatta L, Ricci C, Tampieri A, Vaira D. Non-invasive techniques for the diagnosis of Helicobacter pylori infection. Clin Microbiol Infect. 2003;9(6):489-96. [ Links ]
48. Munster DJ, Chapman BA, Burt MJ, Dobbs BR, Allardyce RA, Bagshaw PF, et al. The fate of ingested 14C-urea in the urea breath test for Helicobacter pylori infection. Scand J Gastroenterol. 1993;28(8):661-6. [ Links ]
49. Kawakami E, Machado RS, Reber M, Patrício FR. 13 C-urea breath test with infrared spectroscopy for diagnosing helicobacter pylori infection in children and adolescents. J Pediatr Gastroenterol Nutr. 2002;35(1):39-43. [ Links ]
50. Parente F, Bianchi Porro G. The (13)C-urea breath test for non-invasive diagnosis of Helicobacter pylori infection: which procedure and which measuring equipment? Eur J Gastroenterol Hepatol. 2001;13(7):803-6. [ Links ]
51. Guarner J, Kalach N, Elitsur Y, Koletzko S. Helicobacter pylori diagnostic tests in children: review of the literature from 1999 to 2009. Eur J Pediatr. 2010;169(1):15-25. [ Links ]
52. Slater C, Preston T, Weaver LT. Is there an advantage in normalising the results of the Helicobacter pylori [13C]urea breath test for CO2 production rate in children? Isotopes Environ Health Stud. 2004;40(1):89-98. [ Links ]
53. Leal YA, Flores LL, Fuentes-Pananá EM, Cedillo-Rivera R, Torres J. 13C-urea breath test for the diagnosis of Helicobacter pylori infection in children: a systematic review and metaanalysis. Helicobacter. 2011;16(4):327-37. [ Links ]
54. Cirak MY, Akyön Y, Mégraud F. Diagnosis of Helicobacter pylori. Helicobacter. 2007;12 Suppl 1:4-9. [ Links ]
55. Choi J, Kim CH, Kim D, Chung SJ, Song JH, Kang JM, et al. Prospective evaluation of a new stool antigen test fo the detection of Helicobacter pylori, in comparison wit histology, rapid urease test, (13)C-urea breath test, and serology. J Gastroenterol Hepatol. 2011;26(6):1053-9. [ Links ]
56. Chehter EZ, Bacci MR, Fonseca FL, Gonçalves JA, Buchalla G, Shiraichi SA, et al. Diagnosis of the infection by the Helicobacter pylori through stool examination: method standardization in adults. Clin Biochem. 2013;46(15):1622-4. [ Links ]
57. Vaira D, Menegatti M, Ricci C, Gatta L, Berardi S, Miglioli M. Accurate diagnosis of Helicobacter pylori. Stool tests. Gastroenterol Clin North Am. 2000;29(4):917-23. [ Links ]
58. Gisbert JP, Pajares JM. Stool antigen test for the diagnosis of Helicobacter pylori infection: a systematic review. Helicobacter. 2004;9(4):347-68. [ Links ]
59. Gisbert JP, de la Morena F, Abraira V. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis. Am J Gastroenterol. 2006;101(8):1921-30. [ Links ]
60. Bravo LE, Realpe JL, Campo C, Mera R, Correa P. Effects of acid suppression and bismuth medications on the performance of diagnostic tests for Helicobacter pylori infection. Am J Gastroenterol. 1999;94(9):2380-3. [ Links ]
61. Manes G, Balzano A, Iaquinto G, Ricci C, Piccirillo MM, Giardullo N, et al. Accuracy of the stool antigen test in the diagnosis of Helicobacter pylori infection before treatment and in patients on omeprazole therapy. Aliment Pharmacol Ther. 2001;15(1):73-9. [ Links ]
62. Burucoa C, Delchier JC, Courillon-Mallet A, de Korwin JD, Mégraud F, Zerbib F, et al. Comparative evaluation of 29 commercial Helicobacter pylori serological kits. Helicobacter. 2013;18(3):169-79. [ Links ]
63. Kazemi S, Tavakkoli H, Habizadeh MR, Emami MH. Diagnostic values of Helicobacter pylori diagnostic tests: stool antigen test, urea breath test, rapid urease test, serology and histology. J Res Med Sci. 2011;16(9):1097-104. [ Links ]
64. Mégraud F. The most important diagnostic modalities for Helicobacter pylori, now and in the future. Eur J Gastroenterol Hepatol. 2012;9 Suppl 1:S13-5. [ Links ]
65. Loy CT, Irwig LM, Katelaris PH, Talley NJ. Do commercial serological kits for Helicobacter pylori infection differ in accuracy? A meta-analysis. Am J Gastroenterol. 1996;91(6):1138-44. [ Links ]
66. Ho GY, Windsor HM. Accurate diagnosis of Helicobacter pylori. Polymerase chain reaction tests. Gastroenterol Clin North Am. 2000;29(4):903-15. [ Links ]
67. Rubicz R, Leach CT, Kraig E, Dhurandhar NV, Duggirala R, Blangero J, et al. Genetic factors influence serological measures of common infections. Hum Hered. 2011;72(2):133-41. [ Links ]
68. Stege PW, Raba J, Messina GA. Online immunoaffinity assay- CE using magnetic nanobeads for the determination of anti- Helicobacter pylori IgG in human serum. Electrophoresis. 2010;31(20):3475-81. [ Links ]
69. Karakus C, Salih BA. Comparison of the lateral flow immunoassays (LFIA) for the diagnosis of Helicobacter pylori infection. J Immunol Methods. 2013;396(1-2):8-14. [ Links ]
Correspondencia:
Juan Sebastián Frías Ordoñez Calle 96 No. 46 - 58, Torre 1, apartamento 617, Bogotá D.C – Colombia E-mail: jsfriaso@unal.edu.co
Recibido: 14-4-2016
Aprobado: 7-7-2017