Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.4 Lima Oct./Dec. 2017
REPORTE DE CASO
Disección endoscópica submucosa en el tratamiento del cáncer precoz de esófago
Submucosal endoscopic dissection in the treatment of early esophageal cancer
Liliana Ughelli1, Carolina Miranda1, Carlos Galeano1, María del Carmen Blasco1, Guliano Boselli1, Antonio Cubilla2, Paulo Sakai3, Carmelo Blasco4
1 Médico del Servicio de Gastroenterología, Instituto Codas Thompson. Asunción, Paraguay.
2 Médico del Servicio de Anatomía Patológica, Instituto de Patología e Investigación Dr. Antonio Cubilla. Asunción, Paraguay.
3 Médico del Servicio de Gastroenterología, Hospital Osvaldo Cruz. Sao Paulo, Brasil.
4 Jefe del Servicio de Gastroenterología del Instituto Codas Thompson. Asunción, Paraguay.
RESUMEN
Reportamos el caso de un paciente masculino, 80 años, con historia de dispepsia y sin antecedente familiar de neoplasias. En la endoscopia digestiva alta, en tercio distal, se observó una lesión deprimida plana con aspecto de carcinoma precoz IIC que fue diagnosticada por biopsia como carcinoma escamoso in situ e infiltrante, no queratinizante moderadamente diferenciado grado II. Fue sometido a disección endoscópica submucosa, sin complicaciones. La histopatología concluyo: carcinoma de células escamosas, predominantemente in situ de esófago distal, midiendo 0,6 cm, con foco de 0,1 cm de infiltración en la lámina propia; ausencia de invasión neoplásica angiolinfática o perineural con márgenes de resección quirúrgica libre de neoplasia. Estadio pT1a. Tres meses después, en la endoscopia de control con toma de biopsias de la zona, no hubo evidencia de carcinoma. Presentamos el caso debido a que sigue siendo todo un reto establecer el diagnóstico de cáncer de esófago en etapa temprana, sobre todo en pacientes poco sintomáticos, resaltando la importancia de la cromoendoscopia y de una buena exploración endoscópica para llegar al diagnóstico. La disección endoscopia submucosa podría considerarse como un tratamiento alternativo seguro y eficaz a la cirugía radical.
Palabras clave: Cáncer de esófago; Disección endoscópica submucosa; Carcinoma de células escamosas (fuente: DeCS BIREME).
ABSTRACT
We report the case of a male patient, 80 years old, with a history of dyspepsia and no family history of neoplasias. In the upper digestive endoscopy in the distal esophagus, a flat depressed lesion with the appearance of early carcinoma, type IIC of Paris classification, was diagnosed by biopsy as a squamous carcinoma in situ, infiltrating, moderately differentiated non-keratinizing grade II carcinoma. He underwent submucosal endoscopic dissection without complications. Histopathology concluded: carcinoma of squamous cells, predominantly in situ of distal esophagus, measuring 0.6 cm, with focus of 0.1 cm of infiltration in the own lamina; absence of angiolymphatic or perineural invasion. The histopathology specimen had margins of surgical resection free of neoplasia. Stage pT1a. Three months later, in the endoscopy control with biopsy of the area, there was no evidence of carcinoma. We present the case because it is still a challenge to establish the diagnosis of esophageal cancer at an early stage, especially in patients without symptoms, highlighting the importance of chromoendoscopy and a good endoscopic examination to reach the diagnosis. Submucosal endoscopy dissection could be considered as a safe and effective alternative treatment to radical surgery.
Keywords: Esophageal neoplasms; Endoscopic mucosal resection; Carcinoma, squamous cell (source: MeSH NLM).
INTRODUCCIÓN
La disección endoscópica de la submucosa (DES) se desarrolló originalmente en Japón para la resección en bloque de los tumores gástricos (1).
Actualmente es aceptada como la modalidad principal para el tratamiento de los tumores superficiales del tracto gastrointestinal. Una ventaja importante es su eficacia en la resección de lesiones independientemente de su tamaño y la severidad de la fibrosis (2).
Los endoscopios de alta resolución, el uso de la cromoendoscopía, el buen entrenamiento de los endoscopistas y el conocimiento de lesiones a menudo planas han permitido detectar lesiones de esófago en sus estadios iniciales (1,3).
La cromoendoscopía es esencial para definir la lesión, el tamaño, la presencia o ausencia ulceración (4).
Según el Consenso de París, la neoplasia superficial comprende el compromiso de las capas mucosas y submucosas, sin infiltración de la muscular propia (1).
En Japón, las lesiones superficiales se denominan de tipo 0. Existen tres subtipos de lesiones superficiales: protruida (tipo 0-I), plana (tipo 0-II) y excavada (tipo 0-III). Las lesiones protruidas se subclasifican en pedunculadas (0-Ip), subpediculada (0-Isp) y sésiles (0-Is) (1,4,5).
En el esófago predominan las neoplasias superficiales planas que se subdividen en superficialmente elevadas en relación a la mucosa adyacente (IIA), planas (IIB) y deprimidas (IIC). Las neoplasias superficiales se subdividen a su vez de acuerdo al grado de penetración transmural. M1 corresponde al epitelio y la capa basal, M2 a la lámina propia o corion y M3 a la muscular de la mucosa. El compromiso de la submucosa se subdivide en SM1 (tercio superior), SM2 (promedio) y SM3 (tercio inferior) (1,4,5).
Según clasificación TNM-p ("p" de la patología), en ausencia de invasión de la lámina propia, la lesión se llama neoplasia intra-epitelial de grado bajo o alto, o carcinoma in situ (pTis). Cuando existe invasión de la lámina propia esofágica, la neoplasia es llamada carcinoma intramucoso o micro-invasivo (pT1m). Cuando hay infiltración de la submucosa, la neoplasia se considera invasiva (pT1sm) (1,4,5).
El riesgo de metástasis en ganglios linfáticos tiene estrecha relación con la profundidad de invasión tumoral vertical en la pared del órgano. Cuando el compromiso neoplásico se limita a la porción epitelial superficial (M1 y M2), el riesgo de compromiso linfonodal es cercano a cero. Cuando la invasión compromete la muscularis mucosa (M3) y la porción proximal de la submucosa a una profundidad de 200 μ (SM1) este riesgo puede llegar del 9% al 19%, respectivamente. La resección en una sola pieza, facilita una evaluación histológica precisa de toda la lesión y reduce el riesgo de recurrencia (1,4-8).
Existen estudios retrospectivos que involucran análisis histopatológicos de las muestras resecadas quirúrgicamente de carcinomas de células escamosas de esófago que demuestran que los casos de carcinoma in situ y carcinoma invasivo intramucoso limitadas a la mucosa de la lámina propia tuvieron bajo riesgo de extensión a los ganglios linfáticos y metástasis a distancia.
Basándose en estos hallazgos, las directrices japonesas indican que los candidatos para la resección endoscópica con fines curativos serian aquellos pacientes cuya lesión presenta compromiso de las capas M1 y M2 (epitelio y lámina propia). Si el resultado de la evaluación histológica revela que la lesión presenta márgenes negativos, ganglios negativos sin infiltración linfovascular, el tratamiento se juzga como una resección curativa (1,4,6).
Actualmente se acepta el tratamiento endoscópico de las lesiones mayores de 3 cm (aunque ocupen toda la circunferencia del esófago y a pesar que existe riesgo de estenosis cuando la lesión supera los dos tercios de la circunferencia luminal) y sin límite en el número de lesiones, siempre que sean intramucosos (1,6).
Se realizaron estudios que investigaron la seguridad y eficacia de DES y Resección Mucosa Endoscópica (EMR) en base a búsquedas de datos en PubMed, Web of Science, EMBASE y la Cochrane Library, los criterios de valoración incluyeron la tasa de resección en bloque y la tasa de resección curativa. Concluyeron que la DES parece ser superior a EMR en el tratamiento de lesiones superficiales del esófago, en cuanto a tasas de resección curativa y tasa de recidiva local, obviamente inferior (9).
Teniendo en cuenta que la morbilidad y la mortalidad del tratamiento quirúrgico son relativamente altas, la mayoría de edad avanzada y la calidad de vida pobre después de la cirugía, la DES con intención curativa podría considerarse como un tratamiento alternativo seguro y eficaz a la cirugía radical (4-8).
Sin embargo, la DES no está exenta de complicaciones, existe riesgo de perforación, estenosis esofágica post-DES, hemorragia y enfisema (4,6,10).
CASO CLÍNICO
Se presenta el caso de un paciente, masculino, 80 años, sin antecedentes personales ni familiares de importancia. Con historia de dispepsia de un año de evolución, examen físico sin datos de valor.
Los exámenes auxiliares informaban: Hb 15, Hto 45%, GB 4700, plaquetas 202 000, TP 81%, INR 1,15. Eritrosedimentación 5 mm. Ecografia: barro biliar. Quiste simple en riñón izquierdo.
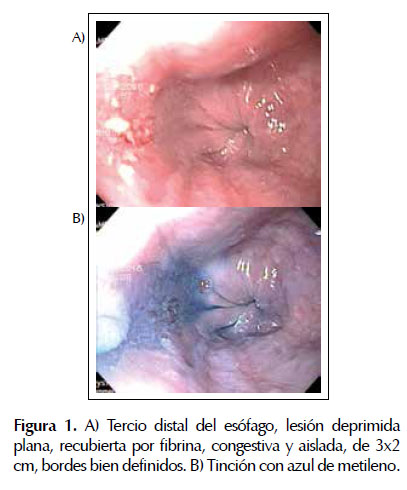
Las lesiones esofágicas fueron identificadas por primera vez utilizando endoscopía con luz blanca. Se realizó cromoendoscopía con azul de metileno pensando en Barret y se tomaron biopsias. Figura 1.
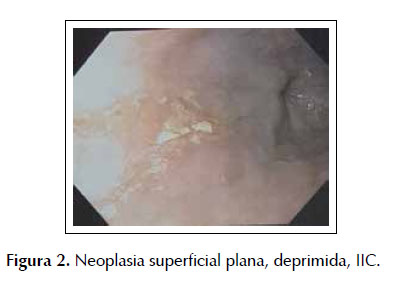
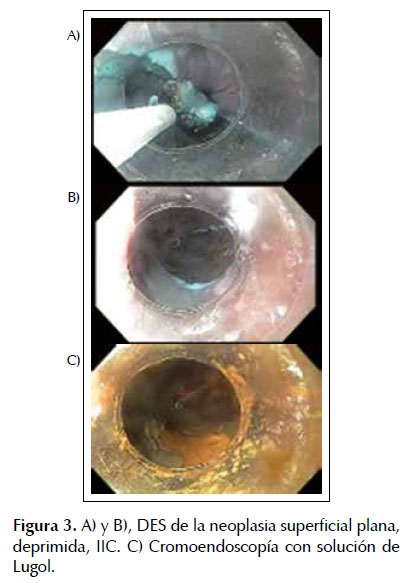
Tras el resultado histopatológico (mucosa escamosa con carcinoma escamoso in situ e infiltrante, no queratinizante moderadamente diferenciado Grado II) y tras una nueva caracterización macroscópica con cromoendoscopía con solución de Lugol y endoscopía de aumento (neoplasia superficial plana, deprimida, IIC) el paciente fue sometido a DES, sin complicaciones. Figura 2 y 3.
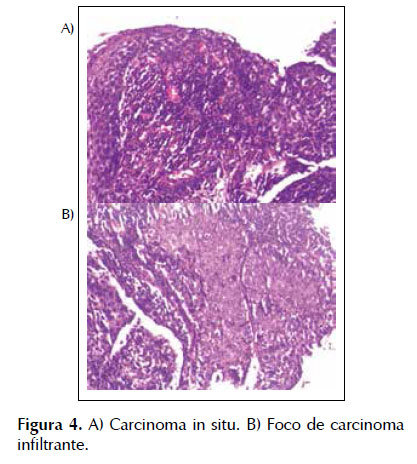
La conclusión histopatológica confirmó un carcinoma de células escamosas, predominantemente in situ de esófago distal, midiendo 0,6 cm, con foco de 0,1 cm de infiltración en la lámina propia. Ausencia de invasión neoplásica angiolinfática o perineural. Márgenes de resección quirúrgica libre de neoplasia. Estadio pT1a. Figura 4.
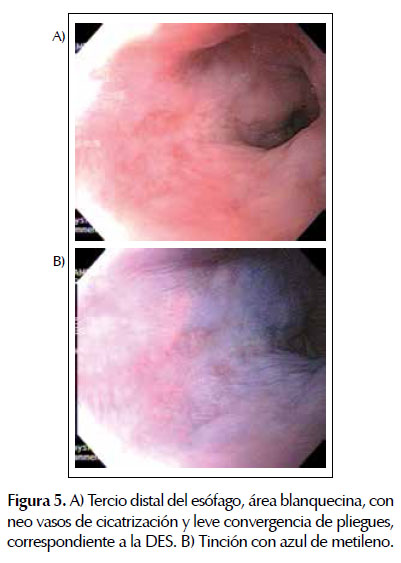
Tres meses después, se realizó una endoscopía digestiva alta de control. Se tomaron biopsias del área de la cicatriz de la DES. La histopatología retornó sin evidencia de carcinoma. Figura 5.
DISCUSIÓN
Basándonos en los hallazgos endoscópicos e histopatológicos, nuestro paciente fue sometido a DES, siguiendo las directrices japonesas que indican que los candidatos para la resección endoscópica con fines curativos serian aquellos pacientes cuya lesión presenta compromiso de las capas M1 y M2 (epitelio y lámina propia). Y teniendo en cuenta que el resultado de la histopatología reveló márgenes negativos, ganglios negativos sin infiltración linfovascular, se consideró el tratamiento como una resección curativa. El paciente será sometido a controles endoscópicos durante su seguimiento.
A continuación, se hace referencia de algunos estudios publicados que indican que el uso de DES en los tumores del esófago es una alternativa eficaz y curativa.
Ishihara et al. publicó un análisis comparativo de los resultados de la DES vs EMR en pacientes con cáncer esofágico inferior a 20 mm. Las tasas de resección en bloque y resección curativa de los casos de DES fueron superiores a los de las técnicas de EMR con cap y con strip biopsy (respectivamente 100% y 97%, 87% y 71%, 71% y 46%). No hubo diferencias en las tasas de complicación entre las tres técnicas (11).
Un estudio de cohorte retrospectivo realizado por Takahashi H et al., con el fin de demostrar la eficacia de la DES como tratamiento curativo, incluyó a 300 pacientes con carcinoma precoz que se sometieron ya sea a EMR (n = 184) o DES (n = 116) entre marzo de 1994 y julio de 2007. Estos pacientes fueron sometidos a resección endoscópica y luego fueron seguidos por endoscopia periódica de 8 a 174 meses. Se exploraron resecabilidad, tasas de curación, complicaciones, la supervivencia libre de enfermedad de los dos grupos y factores de riesgo para recidiva local. Se comprobó que la DES da una tasa de curación más alta y es más segura que la EMR cuando se aplica a principios del carcinoma precoz de esófago (12).
Toyonaga et al. reportaron 20 pacientes con carcinoma precoz de esófago que se sometieron a la DES, con resección en bloque y márgenes libres en el 100% de los casos, con un diámetro medio de la muestra de 47 mm y con un tiempo promedio de 65 minutos. En esta serie sólo hubo una complicación, enfisema mediastinal, que se manejó clínicamente.
Fujishiro et al. mostraron resultados similares en 43 pacientes, obteniéndose 100% de la resección en bloque, pero en el 22% de los casos la resección endoscópica no fue curativa, debido a compromiso de los márgenes verticales o laterales (1).
En el Instituto Alfa de Gastroenterología (Belo Horizonte, Brasil), Vitor Arantes et al., en el 2013 publicaron una serie de casos con 25 DES por cáncer de esófago en un total de 23 pacientes, promedio de edad de 68 años. El tamaño promedio de los tumores fue de 25 mm, el tiempo de resección fue en promedio de 85 minutos. La tasa de resección en bloque del tumor fue de 92% (23 procedimientos). La tasa de resección curativa fue de 80%. Todos los pacientes con resección no-curativa fueron manejados agregándose quimioterapia y radioterapia complementaria. Los informes de la histología revelaron carcinoma de células escamosas/displasia de alto grado en 23 especímenes y adenocarcinoma en el esófago de Barrett en dos casos. Hubo dos casos de recurrencia local (8%) (1).
Ching-Tai Lee et al., en el sur de Taiwan, reclutaron un total de 26 lesiones neoplásicas (incluyendo 13 tumores con alto grado de displasia, 12 tumores con carcinoma de células escamosas, y un tumor de adenocarcinoma) en 22 pacientes. Todos hombres. La edad media fue de 47,6 ± 8,6 años. El tamaño medio de los tumores fue de 33,7 ± 21,7 mm. La DES se realizó en 20 pacientes. El tamaño promedio de los ejemplares resecados fue de 43,1 ± 19,2 mm. El tiempo de operación promedio fue de 92,7 ± 69 minutos. Dos pacientes recibieron operaciones adicionales después de la DES debido a la invasión submucosa profunda por el cáncer. Dos pacientes (12,5%) desarrollaron después de la DES estenosis esofágica. No hubo mortalidad relacionada con el procedimiento. No se encontró recidiva local durante el período de seguimiento. El tratamiento post-DES (cirugía o quimiorradioterapia) se consideró para los pacientes con un margen de resección incompleta en la histología (10).
Mitsuhiro Fujishiro et al., realizaron un estudio, de cohorte longitudinal en un solo centro. Se reclutó un total de 1635 neoplasias gastrointestinales (estómago 1136; esófago 138; colon y recto 361) (13).
La DES se asoció con altas tasas de resección curativa y bajas tasas de complicaciones a corto plazo a través de ambos tractos gastrointestinales superior e inferior. No hubo complicaciones en el esófago. Sin embargo, esto puede haber sido por la experiencia previa en el estómago, el colon y recto. El pronóstico a largo plazo de la enfermedad específica y en general eran excelentes después de la resección curativa. El período de seguimiento fue de una media de 4,4 años (tasa de seguimiento por encima del 90%). Por lo que el autor concluye que la DES es un enfoque adecuado y curativo y menos radical que la cirugía (13).
En una serie prospectiva occidental, de enero 2005 a julio de 2008, Alessandro Repici et al. reclutaron 20 pacientes con neoplasia superficial de células escamosas de esófago y fueron tratados con DES. La resección en bloque con márgenes libres se logró en 18 pacientes (90%), mientras que 2 pacientes presentaron con resección incompleta o indeterminada. No hubo recurrencia post-DES local o distante en aquellos con márgenes libres de resección en una mediana de seguimiento de 18 meses. Aunque el número de pacientes es pequeño y el seguimiento limitado, el autor concluye que la DES debe ser considerado como el tratamiento de elección en todas las lesiones susceptibles de tratamiento endoscópico (14).
En la serie de trabajos citados, la DES fue considerada como el tratamiento definitivo del carcinoma superficial de células escamosas del esófago. La mayoría de ellos indicaron una endoscopía gastrointestinal superior en el seguimiento al mes y luego cada 3 meses durante el primer año. Después del primer año, cada 6 meses y anualmente a partir de entonces.
En conclusión, mediante las nuevas tecnologías de imagen con endoscopios de alta resolución, el uso de cromoendoscopía y el buen entrenamiento de los endoscopistas se pueden detectar lesiones neoplásicas en estadios iniciales.
Mediante una exploración endoscópica sistematizada, detallada y la cromoendoscopía, en este paciente se llegó al diagnóstico de una lesión IIC. Al cumplir con las Directrices de la Sociedad Japonesa de indicación absoluta de DES (Invasión de M1 y M2), se logró un tratamiento definitivo, seguro y eficaz, en relación a la cirugía radical
Conflictos de intereses: Los autores declaran no tener ningún conflicto de interés.
Fuente de financiamiento: Ninguna.
REFERENCIAS BIBLIOGRÁFICAS
1. Arantes V. Disección endoscópica de submucosa en el tratamiento del cáncer precoz de esófago. Rev Med Clin Condes. 2015;26(5):565-71. [ Links ]
2. Ono S, Fujishiro M, Koike K. Endoscopic submucosal dissection for superficial esophageal neoplasms. World J Gastrointest Endosc. 2012;4(5):162-6. [ Links ]
3. Oyama T, Tomori A, Hotta K, Morita S, Kominato K, Tanaka M, et al. Endoscopic submucosal dissection of early esophageal cancer. Clin Gastroenterol Hepatol. 2005;3(7 Suppl 1):S67-70. [ Links ]
4. Kakushima N, Fujishiro M. Endoscopic submucosal dissection for gastrointestinal neoplasms. World J Gastroenterol. 2008;14(19):2962-7. [ Links ]
5. Fujishiro M, Kodashima S. Indications, techniques, and outcomes of endoscopic submucosal dissection for esophageal squamous cell carcinoma. Esophagus. 2009;6(3):143-8. [ Links ]
6. Honda K, Akiho H. Endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms. World J Gastrointest Pathophysiol. 2012;3(2):44-50. [ Links ]
7. Fujishiro M, Yahagi N, Kakushima N, Kodashima S, Muraki Y, Ono S, et al. Endoscopic submucosal dissection of esophageal squamous cell neoplasms. Clin Gastroenterol Hepatol. 2006;4(6):688-94. [ Links ]
8. Park JS, Youn YH, Park JJ, Kim JH, Park H. Clinical outcomes of endoscopic submucosal dissection for superficial esophageal squamous neoplasms. Clin Endosc. 2016;49(2):168-75. [ Links ]
9. Guo HM, Zhang XQ, Chen M, Huang SL, Zou XP. Endoscopic submucosal dissection vs endoscopic mucosal resection for superficial esophageal cancer. World J Gastroenterol. 2014;20(18):5540-7. [ Links ]
10. Lee CT, Chang CY, Tai CM, Wang WL, Tseng CH, Hwang JC, et al. Endoscopic submucosal dissection for early esophageal neoplasia: a single center experience in South Taiwan. J Formos Med Assoc. 2012;111(3):132-9. [ Links ]
11. Ishihara R, Iishi H, Uedo N, Takeuchi Y, Yamamoto S, Yamada T, et al. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan. Gastrointest Endosc. 2008;68(6):1066-72. [ Links ]
12. Takahashi H, Arimura Y, Masao H, Okahara S, Tanuma T, Kodaira J, et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus (with video). Gastrointest Endosc. 2010;72(2):255-64. [ Links ]
13. Fujishiro M, Yahagi N, Kakushima N, Kodashima S, Muraki Y, Ono S, et al. Endoscopic submucosal dissection of esophageal squamous cell neoplasms. Clin Gastroenterol Hepatol. 2006;4(6):688-94. [ Links ]
14. Repici A, Hassan C, Carlino A, Pagano N, Zullo A, Rando G, et al. Endoscopic submucosal dissection in patients with early esophageal squamous cell carcinoma: results from a prospective Western series. Gastrointest Endosc. 2010;71(4):715-21. [ Links ]
Correspondencia:
Liliana Ughelli
E-mail: miyinuk@gmail.com
Recibido: 11-1-2017
Aprobado: 2-4-2017