Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.37 no.4 Lima oct./dic. 2017
REPORTE DE CASO
Porfiria cutánea tarda como manifestación extrahepática de hepatitis C crónica: reporte de un caso
Porphyria cutanea tarda as extrahepatic manifestation of chronic hepatitis C: a case report
Jorge Espinoza-Ríos1,2, Vanessa Valenzuela Granados1,2, Manuel Ojeda Cisneros1, Aldo Gálvez Canseco3, Cesar Ramos Aguilar3, Brunella Raymundo Villalva3, Victor Aguilar Sánchez1, José Pinto Valdivia1,2, Jorge Huerta-Mercado Tenorio2,4, Alejandro Bussalleu Rivera2
1 Servicio de Gastroenterología, Hospital Cayetano Heredia. Lima, Perú.
2 Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Servicio de Dermatología, Hospital Cayetano Heredia. Lima, Perú.
4 Servicio de Gastroenterología, Clínica Angloamericana. Lima, Perú.
RESUMEN
Se presenta el caso de un paciente varón de 56 años quien es evaluado por presentar a nivel del dorso de ambas manos cicatrices hiperpigmentadas e hipopigmentadas, asociadas a quistes de milia. Se le realizó estudios del metabolismo de las porfirinas y biopsia cutánea de las lesiones los cuales resultaron compatibles con porfiria cutánea tarda. En el laboratorio inicial se encontró elevación de los valores de transaminasas, identificándose posteriormente infección crónica por virus de hepatitis C. Con la finalidad de tratar la infección viral y resolver el compromiso dérmico, considerado como manifestación extrahepática del virus hepatitis C, se inició tratamiento con interferón pegilado y ribavirina evolucionando favorablemente con respuesta viral rápida, carga viral no detectable hasta la actualidad (36 semanas de tratamiento), disminución del nivel de transaminasas séricas y mejoría de las lesiones dérmicas.
Palabras clave: Porfiria cutánea tardía; Hepatitis C crónica; Interferón-alfa; Ribavirina (fuente: DeCS BIREME).
ABSTRACT
The present case is a 56 year old male who present hyperpigmented and hypopigmented scars in both hands, associated with the presence of milia cysts. It was studied the metabolism of porphyrins and skin biopsy of the lesions which were compatible with porphyria cutanea tarda. In the initial laboratory, elevated transaminases values were found and subsequently identified chronic infection of hepatitis C virus. In order to treat viral infection and resolve the dermal commitment; considered extrahepatic manifestation of hepatitis C virus, treatment was started with pegylated interferon and ribavirin, with favorably development and rapid viral response, with undetectable viral load until now (24 weeks of treatment), decreased level of serum transaminases and improvement of skin lesions.
Keywords: Porphyria cutanea tarda; Hepatitis C, chronic; Interferon-alpha; Ribavirin (source: MeSH NLM).
INTRODUCCIÓN
La infección crónica por virus hepatitis C (VHC) afecta alrededor de 185 millones de personas en todo el mundo y se registra globalmente 350 000 muertes cada año por dicha enfermedad (1,2). La hepatitis C crónica es una enfermedad sistémica con manifestaciones hepáticas y extrahepáticas. Entre las primeras se incluye la fibrosis hepática y cirrosis, las que eventualmente puede llevar al paciente a insuficiencia hepática o carcinoma hepatocelular por lo que incluso puede requerir trasplante hepático (2,3). En cuanto a las manifestaciones extrahepáticas están presentes en el 40 a 75% de pacientes pudiendo afectar una variedad de órganos y sistemas con una significativa morbilidad y mortalidad (4). Entre ellas se incluyen aquellas que afectan los vasos pequeños, piel, riñón, glándulas salivales, ojos y tiroides, además puede asociarse a eventos cardiacos, enfermedades inmunológicas y endocrinológicas (2-4). Entre las enfermedades más estudiadas y relacionadas a la infección crónica por VHC se encuentran la crioglobulinemia mixta y el linfoma no Hodgkin de células B. Otras entidades descritas son: porfiria cutánea tarda (PCT), liquen plano, eritema acral necrolítico, glomerulonefritis membranosa, síndrome de Sjögren, tiroiditis autoinmune, resistencia a la insulina, entre otros menos frecuentes (2,4). En esto radica la importancia de descartar la posibilidad de infección por VHC cuando se diagnostican las enfermedades previamente descritas lo cual permitirá no solo la detección oportuna de la infección por VHC sino además priorizar la terapia adecuada a este tipo de pacientes.
Se presenta el caso de un paciente con diagnóstico de porfiria cutánea tarda como manifestación extrahepática de infección crónica por VHC, siendo este el primer reporte en el Perú.
CASO CLÍNICO
Paciente varón de 56 años, natural y procedente de Lima, sin antecedentes patológicos de importancia, ni hábitos nocivos, con un tiempo de enfermedad de 15 meses caracterizado por la presencia de lesiones eritematosas violáceas y otras hipopigmentadas, no pruriginosas, localizadas en el dorso de ambas manos. Por estas lesiones acude a diversos centros de salud recibiendo múltiples diagnósticos como "reacción alérgica", "procesos inflamatorios localizados" y "celulitis". Al no encontrar mejoría de los síntomas con los tratamientos realizados, el paciente acude al Servicio de Dermatología de nuestro hospital.
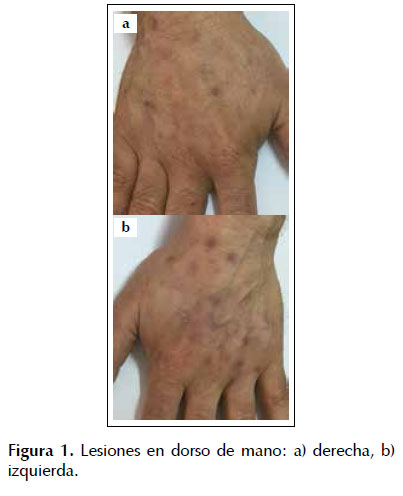
Al examen físico se observa un sujeto eutrófico, hemodinámicamente estable, que presenta erosiones cubiertas de costras, quistes de milia y cicatrices hiperpigmentadas e hipopigmentadas a nivel del dorso de ambas manos (Figura 1). No se evidenciaron lesiones cutáneas en otras localizaciones. El resto de la evaluación clínica no muestra hallazgos patológicos.
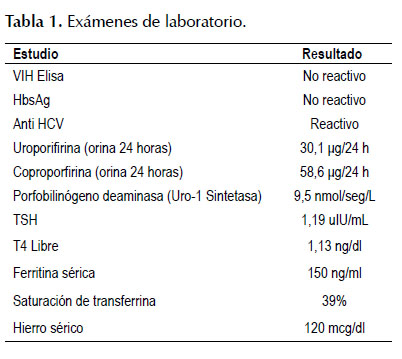
Entre los exámenes auxiliares iniciales figuran: hemoglobina: 16,2 g/dL, hematocrito: 48%, leucocitos: 5140/mm3, plaquetas: 286 000/mm3, INR: 1,07, urea: 34,3 mg/dL, creatinina: 0,7 mg/dL, bilirrubinas totales: 0,6 mg/dL, albúmina sérica: 4,3 g/dL, TGO: 78 U/L, TGP: 154 U/L, fosfatasa alcalina: 140 U/L.
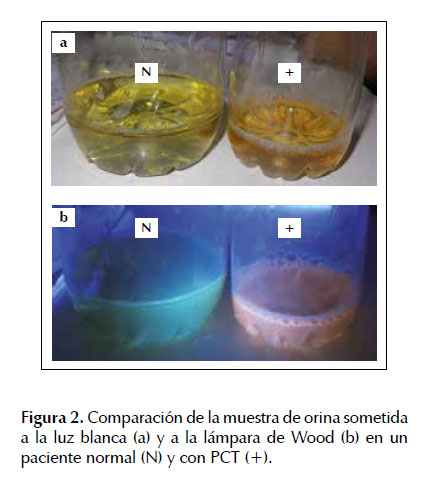
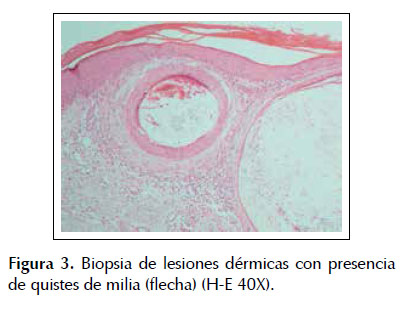
Por el hallazgo de transaminasemia y la sospecha clínica de porfiria cutánea tarda se solicitaron estudios serológicos de infección viral y estudios del metabolismo de las porfirinas (Tabla 1). Se hallaron: anticuerpo anti VHC reactivo, dosaje de uroporfirinas en orina de 24 horas en el límite superior a lo normal, y dosaje de porfobilinógeno deaminasa en el límite inferior a lo normal. Se sometió, además, la muestra de orina a la lámpara de Wood, la cual fue comparada con una muestra de orina de un paciente sin enfermedad presentándose fluorescencia naranja compatible con presencia de uroporfirinas (Figura 2). La biopsia de las lesiones dérmicas destaca la presencia de quistes de milia y de un infiltrado inflamatorio inespecífico (Figura 3). Con estos hallazgos se comprobó cuadro histológico y metabólico compatible con PCT.
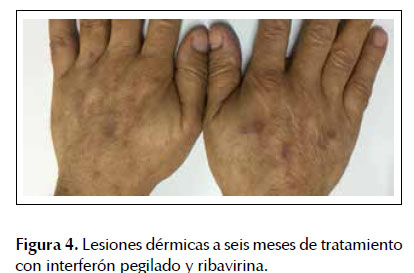
Es evaluado a su vez por la Unidad Funcional de Hígado de nuestro hospital para confirmar la infección por VHC, para lo cual se solicitó la carga viral de VHC cuantificándose en 35 263 copia/ml (6059 UI/ml), el genotipo viral identificado fue 1a y el polimorfismo IL28B fue CC. Se le realizó estudio de elastografía hepática (Fibroscan) cuyo resultado fue F0. Asimismo se solicitó estudio del metabolismo del hierro y hormonas tiroideas cuyos valores se encontraron dentro de los límites normales (Tabla 1). Sin tener contraindicación para recibir tratamiento antiviral para infección por VHC crónica y estando disponible la terapia doble en nuestra institución se inició con interferón pegilado alfa 2a (pegIFN): 180 mcg subcutáneo semanal y ribavirina (RBV): 1000 mg día. El paciente ha tenido buena adherencia al tratamiento con respuesta viral rápida y con carga viral indetectable hasta la actualidad (36 semanas de tratamiento). Durante el tratamiento se observó reducción de los valores de enzimas hepáticas (TGO: 42 U/L, TGP: 57 U/L) y mejoría de las lesiones dérmicas (Figura 4). Entre los efectos adversos relacionados a la terapia que presentó el paciente fueron: mialgias esporádicas, astenia y episodios de neutropenia que no contraindicaron continuar con la terapia.
DISCUSIÓN
El virus de la hepatitis C es un virus ARN que pertenece a la familia Flaviviridae género Hepadnavirus, este infecta los hepatocitos y establece una infección crónica en aproximadamente el 85% de los pacientes con infección aguda que puede llevar a cirrosis y hepatocarcinoma (2,4). La Organización Mundial de la Salud estima que aproximadamente el 3% de la población mundial está infectada por VHC, en el Perú la prevalencia oscila entre 1-2% en la población general (5,6).
El VHC tiene una alta diversidad genética además se caracteriza por la presencia de variaciones regionales en la prevalencia de cada genotipo, hasta ahora se conocen siete tipos de genotipos (1-7) en base a los estudios filogenéticos y al análisis de la secuencia de los genomas virales siendo el más frecuente en nuestro país el genotipo 1a (7). Este virus se caracteriza por ser hepatotrópico y linfotrópico por lo que causa una enfermedad sistémica que puede afectar otras células fuera del hígado siendo la mayoría de las manifestaciones extrahepáticas secundaria a la respuesta de la infección del huésped a los depósitos de complejos inmunes circulantes (1,4).
Las manifestaciones extrahepáticas del VHC fueron por primera vez descritas a principios de 1990 y pueden afectar una variedad de sistemas con una morbilidad y mortalidad significativa (4). Estas manifestaciones pueden estar presentes antes de la etapa de la enfermedad hepática e incluyen síntomas inespecíficos como fatiga, náuseas, dolor abdominal o dolor músculo- esquelético, pérdida de peso, depresión, irritabilidad y malestar general; pero también incluyen manifestaciones más específicas tales como crioglobulinemia mixta, trastornos linfoproliferativos como el linfoma No Hodgkin de células B, glomerulopatías, resistencia a la insulina, eventos cerebrovasculares y cardiovasculares así como porfiria cutánea tarda y liquen plano (2). De las entidades señaladas las más relacionadas a la infección por VHC se encuentran la crioglobulinemia mixta y el linfoma No Hodgkin de células B (1-4).
La asociación de la infección crónica por el VHC y las manifestaciones cutáneas tiene un amplio espectro, se considera que alrededor del 17% de los pacientes con VHC presenta al menos una manifestación en la piel, que puede ser directa o indirectamente inducida por la infección crónica por el VHC (8). En el estudio de Younossi Z et al. concluye que entre las manifestaciones cutáneas que se presentan frecuentemente en la infección por hepatitis C crónica son la crioglobulinemia mixta, porfiria cutánea tarda y el liquen plano (3). El reconocer las afecciones cutáneas asociadas a la infección por VHC es importante porque permite la identificación temprana de los casos y el inicio de tratamiento seguro y oportuno de los pacientes afectados, disminuyendo de esta manera el riesgo de progresión de la enfermedad hepática y el control de las manifestaciones extrahepáticas el cual está asociado al control de la replicación viral (9,10).
Las porfirias son un grupo de trastornos hereditarios o adquiridos de las enzimas que participan en la síntesis del grupo hemo y porfirinas (1,11). La porfiria cutánea tarda se caracteriza por la disminución o ausencia de la actividad de la enzima uroporfirinógeno descarboxilasa (UDP) con acumulación de uroporfirinógeno (1,9,12). La PCT es la porfiria más común en el mundo con una prevalencia de 1:10000 (1,13), en los pacientes con infección crónica por VHC la prevalencia varía de acuerdo a su localización geográfica encontrándose entre 8 a 91% (4,8,9,14).
La PCT se clasifica en dos tipos: Tipo I (esporádica o adquirida) es la más frecuente donde el defecto enzimático afecta predominantemente a los hepatocitos y la Tipo II (familiar o hereditaria) donde la actividad enzimática disminuye en los hepatocitos y otras células como los eritrocitos (1,8,11,12). La PCT tipo I ocurre en individuos predispuestos y se desencadena por la exposición a diferentes agentes entre los que se incluye el VHC, alcohol, estrógenos, sobrecarga de hierro (hemocromatosis), hidrocarbonos aromáticos hepatotóxicos, entre otros (1,2,8). El VHC incrementa la oxidación de uroporfirinógeno a uroporfirina asimismo aumenta las reservas de hierro que inhiben a la UDP lo cual va resultar en ambos casos en la acumulación de uroporfirina y otras porfirinas carboxiladas en varios órganos incluyendo piel y el hígado y es este incremento lo que predispone una reacción fotoquímica en la piel con la luz solar lo que hace que se presente las manifestaciones típicas a nivel cutáneo (1,11); entre las que tenemos: fotosensibilidad, fragilidad cutánea, vesículas, bulas, erosiones que cuando resuelven desarrollan cicatrices hiper o hipopigmentadas y milia, además puede presentar hipertricosis, alopecia y onicolisis, los cuales en el estudio histopatológico presentan infiltrado inflamatorio, quistes de milia o ampollas subepidérmicas en la base de las papilas que adoptan una forma ondulante llamada "base festoneada" (1,8-10,12,13).
El diagnóstico de PCT se realiza con el estudio de los niveles de las porfirinas a nivel urinario, sérico, o fecal por lo que se realiza un análisis bioquímico específico que incluye los niveles uroporfirina, coproporfirina, entre otros, se puede solicitar además el estudio de la actividad hepática de la uropoporfirinógeno descarboxilasa, el estudio histopatológico de la lesión cutánea y también se puede someter una muestra de orina a la Luz de Wood pudiendo confirmar con este último de forma indirecta la presencia de uroporfirinas con el cambio de fluorescencia (8,9,12,14-16). En general el tratamiento de la PCT se basa en el uso de fotoprotección, drogas antimaláricas (cloroquina), evitar el consumo de alcohol, estrógenos o suplementos de hierro y realizar flebotomías en caso de sobrecarga de hierro, lo cual es poco frecuente ya que la elevación de los niveles de ferritina no es marcada en la mayoría de los casos (1,8,9,13,17).
En el contexto de un paciente con infección crónica por VHC y diagnóstico de PCT el tratamiento antiviral está indicado, porque la curación de la infección viral resuelve las manifestaciones clínicas y laboratoriales de la PCT, por ello en la última guía de la Asociación Americana para el Estudio del Hígado, la PCT está incluida en el grupo de manifestaciones extrahepáticas que requieren prioridad en el tratamiento debido al alto riesgo de complicaciones (1,2,8,9,18,19). En la actualidad no existen ensayos clínicos relacionados a la respuesta virológica sostenida en estos pacientes con los nuevos antivirales de acción directa (AAD) en la mejora de la PCT (1).
En los países de Latinoamérica entre ellos el Perú, el acceso a los nuevos antivirales es limitado esto fue descrito por Botero y colaborador donde se señalan las principales barreras para el inicio de terapias libres de interferón entre las que se encuentran la reducida disponibilidad, altos costos, entre otros lo cual los hace poco elegibles (20), por ello y teniendo en cuenta los predictores para lograr una RVS en un paciente con infección por VHC genotipo 1 como subtipo1a (21), baja carga viral de base (2000 000 IU/ml) (22), polimorfismo CC de la IL28B (23-26) y con la disponibilidad de la terapia dual se inició tratamiento con Interferón pegilado alfa 2a (180 mcg subcutáneo semanal) y ribavirina (1000 mg día) (27,28). Una vez iniciado el tratamiento, el paciente tuvo una respuesta viral rápida y la carga viral se ha mantenido indetectable en los controles realizados a las 4, 12, 24 y 36 semanas, con normalización de los niveles de las enzimas hepáticas y mejora clínica a nivel de las lesiones cutáneas como se ha descrito en otros casos reportados (29,30).
La terapia con pegIFN + RBV tiene una respuesta virológica sostenida que varía entre 42-80%, sin embargo entre los efectos adversos atribuidos al pegIFN son la supresión de la médula ósea que puede llevar a una disminución de los niveles de leucocitos en especial de los neutrófilos entre 30-50% esto presente en aproximadamente el 20% de los pacientes bajo este régimen pero no se encuentra asociado a mayor riesgo de infecciones (31,32). Con respecto a la ribavirina este es un fármaco cuya principal toxicidad es la anemia hemolítica, su frecuencia se describe en aproximadamente el 13% de los pacientes que recibieron terapia dual con pegIFN + RBV siendo el tiempo de presentación entre la primera a segunda semanas de haber iniciado tratamiento y puede resolverse con la disminución de dosis de ribavirina (33).La anemia hemolítica asociada a este fármaco genera una sobrecarga de hierro sérico que a su vez inhibe la UDP y favorece la acumulación de porfirinas en la dermis con riesgo de activación de PCT, casos aislados de este evento han sido reportados (34-37). Nuestro paciente presentó episodios de neutropenia pero que no contraindicaron continuar con la terapia indicada sin aumentar el riesgo de infección, además no se manifestó exacerbación clínica de la PCT durante el uso de ribavirina.
Este es el primer caso que se presenta en el Perú de porfiria cutánea tarda como manifestación extrahepática de infección por el virus hepatitis C, siendo relevante porque el conocimiento de este tipo de asociación permitirá tener un diagnóstico y tratamiento temprano que reducirá el riesgo de progresión de la enfermedad hepática y la resolución de las lesiones cutáneas.
Conflictos de intereses: Los autores declaran no tener ningún conflicto de interés.
Fuente de financiamiento: Ninguna.
REFERENCIAS BIBLIOGRÁFICAS
1. Dedania B, Wu G. Dermatologic extrahepatic manifestations of hepatitis C. J Clin Transl Hepatol. 2015;3(2):127-33. [ Links ]
2. Tang L, Marcell L, Kottilil S. Systemic manifestations of hepatitis C infection. Infect Agent Cancer. 2016;11:29. [ Links ]
3. Younossi Z, Park H, Henry L, Adeyemi A, Stepanova M. Extrahepatic Manifestations of Hepatitis C: A meta-analysis of prevalence, quality of life, and economic burden. Gastroenterology. 2016;150(7):1599-608. [ Links ]
4. Ko HM, Hernandez-Prera JC, Zhu H, Dikman SH, Sidhu HK, Ward SC, et al. Morphologic features of extrahepatic manifestations of hepatitis C virus infection. Clin Dev Immunol. 2012;2012:740138. [ Links ]
5. Montes Teves P. Hepatitis C: retos pendientes [editorial]. Rev Gastroenterol Peru. 2014;34(3):187-8. [ Links ]
6. Farfan G, Cabezas C. Prevalencia de hepatitis C en donantes de sangre del Perú. Rev Gastroenterol Peru. 2003;23(3):171-6. [ Links ]
7. Messina JP, Humphreys I, Flaxman A, Brown A, Cooke GS, Pybus OG, et al. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology. 2015;61(1):77-87. [ Links ]
8. Garcovich S, Garcovich M, Capizzi R, Gasbarrini A, Zocco MA. Cutaneous manifestations of hepatitis C in the era of new antiviral agents. World J Hepatol. 2015;7(27):2740-8. [ Links ]
9. Akhter A, Said A. Cutaneous manifestations of viral hepatitis. Curr Infect Dis Rep. 2015;17(2):452. [ Links ]
10. Wieland C. Clinical examination: Skin. Clinical Liver Disease. 2016;7(6):119-25. [ Links ]
11. Iribas JL, Weidmann J, Reyes MA, Korol V, Coronica M, Sixto M, et al. Porfiria cutánea tardía. Reporte de 5 casos. Rev Argent Dermatol. 2008;89(1):45-52. [ Links ]
12.Rebora A. Skin diseases associated with hepatitis C virus: facts and controversies. Clin Dermatol. 2010;28(5):489-96. [ Links ]
13. Frank J, Poblete-Gutiérrez P. Porphyria cutanea tarda-when skin meets liver. Best Pract Res Clin Gastroenterol. 2010;24(5):735-45. [ Links ]
14. Gisbert JP, García-Buey L, Pajares JM, Moreno-Otero R. Prevalence of hepatitis C virus infection in porphyria cutanea tarda: systematic review and meta-analysis. J Hepatol. 2003;39(4):620-7. [ Links ]
15. Chan CC, Lin SJ. Images in clinical medicine. Porphyria cutanea tarda. N Engl J Med. 2011;365(12):1128. [ Links ]
16. Guha SK, Bandyopadhyay D, Saha A, Lal NR. Human immunodeficiency virus associated sporadic nonfamilial porphyria cutanea tarda. Indian J Dermatol. 2016;61(3):318-20. [ Links ]
17. Balwani M, Desnick RJ. The porphyrias: advances in diagnosis and treatment. Blood. 2012;120(23):4496-504. [ Links ]
18. Quansah R, Cooper CJ, Said S, Bizet J, Paez D, Hernandez GT. Hepatitis C- and HIV-induced porphyria cutanea tarda. Am J Case Rep. 2014;15:35-40. [ Links ]
19. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015;62(3):932-54. [ Links ]
20. Botero RC, Tagle M. New therapies for hepatitis C: Latin American perspectives. Clinical Liver Disease. 2015;5(1):8-10. [ Links ]
21. Pellicelli AM, Romano M, Stroffolini T, Mazzoni E, Mecenate F, Monarca R, et al. HCV genotype 1a shows a better virological response to antiviral therapy than HCV genotype 1b. BMC Gastroenterol. 2012;12:162. [ Links ]
22. Jensen DM, Morgan TR, Marcellin P, Pockros PJ, Reddy KR, Hadziyannis SJ, et al. Early identification of HCV genotype 1 patients responding to 24 weeks peginterferonα-2a (40 kd)/ ribavirin therapy. Hepatology. 2006;43(5):954-60.
23. Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, et al. Genetic variation in IL28B predicts hepatitis C treatmentinduced viral clearance. Nature. 2009;461(7262):399-401. [ Links ]
24. Chuang W-L, Yu M-L. Host factors determining the efficacy of hepatitis C treatment. J Gastroenterol. 2013;48(1):22-30. [ Links ]
25. Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, et al. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet. 2009;41(10):1100-4. [ Links ]
26. Tanaka Y, Nishida N, Sugiyama M, Kurosaki M, Matsuura K, Sakamoto N, et al. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet. 2009;41(10):1105-9. [ Links ]
27. Strader DB, Wright T, Thomas DL, Seeff LB; American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C. Hepatology. 2004;39(4):1147-71. [ Links ]
28. Obregón J, Prieto J. Guías de diagnóstico y tratamiento de hepatitis C. Rev Col Gastroenterol 2012;27(4):26-9. [ Links ]
29. Takikawa H, Yamazaki R, Shoji S, Miyake K, Yamanaka M. Normalization of urinary porphyrin level and disappearance of skin lesions after successful interferon therapy in a case of chronic hepatitis C complicated with porphyria cutanea tarda. J Hepatol. 1995;22(2):249-50. [ Links ]
30. Sheikh MY, Wright RA, Burruss JB. Dramatic resolution of skin lesions associated with porphyria cutanea tarda after interferon-alpha therapy in a case of chronic hepatitis C. Dig Dis Sci. 1998;43(3):529-33. [ Links ]
31. Roomer R, Hansen BE, Janssen HL, de Knegt RJ. Risk factors for infection during treatment with peginterferon alfa and ribavirin for chronic hepatitis C. Hepatology. 2010;52(4):1225-31. [ Links ]
32. Soza A, Everhart JE, Ghany MG, Doo E, Heller T, Promrat K, et al. Neutropenia during combination therapy of interferon alfa and ribavirin for chronic hepatitis C. Hepatology. 2002;36(5):1273-9. [ Links ]
33. Ribavirin - FDA prescribing information, side effects and uses [Internet]. North Shore, New Zealand: The Drugs.com; 2017 [cited 2016 Nov 24]. Disponible en: https://www.drugs.com/ pro/ribavirin.html [ Links ]
34. Azim J, McCurdy H, Moseley RH. Porphyria cutanea tarda as a complication of therapy for chronic hepatitis C. World J Gastroenterol. 2008;14(38):5913-5. [ Links ]
35. Jessner W, Der-Petrossian M, Christiansen L,c Maier H, Steindl-Munda P, Gangl A, et al. Porphyria cutanea tarda during interferon/ribavirin therapy for chronic hepatitis C. Hepatology. 2002;36(5):1301-2. [ Links ]
36. Thevenot T, Bachmeyer C, Hammi R, Dumouchel P, Ducamp-Posak I, Cadranel JF. Occurrence of porphyria cutaneatarda during peginterferon/ribavirin therapy for chronic viral hepatitis C. J Hepatol. 2005;42(4):607-8. [ Links ]
37. Frider B, Buonsante ME, Tiscornia J, Alessio A, Pellerano G. [Development of porphyria cutanea tarda in a chronic hepatitis C patient with indetectable viremia under treatment with peg-interferon plus ribavirin]. Acta Gastroenterol Latinoam. 2006;36(1):38-41. [ Links ]
Correspondencia:
Jorge Luis Espinoza-Ríos
Av. Del Río N° 390 - Dpto H. Pueblo Libre, Lima, Perú.
E-mail: jorge.espinoza@upch.pe
Recibido: 14-1-2017
Aprobado: 26-4-2017