Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.38 no.1 Lima Jan./Mar. 2018
ARTÍCULOS ESPECIALES
Guía de práctica clínica para la evaluación y el manejo de la hemorragia digestiva alta en el Seguro Social del Perú (EsSalud)
Clinical practice guideline for the evaluation and management of upper gastrointestinal bleeding for the Peruvian Social Security (EsSalud)
Jorge Vásquez-Quiroga1, Alvaro Taype-Rondan2, Jessica Hanae Zafra-Tanaka2, Ericson Arcana-López1, Luis Cervera-Caballero1, Javier Contreras-Turin1, Katherine Guzmán-Cáceres3, Juan Llatas-Perez1, Luis Marin-Calderón1, Alejandro Piscoya4, Daniel Vargas-Blácido5, Nelly Vásquez-Valverde6, Raúl Timaná-Ruiz2
1 Hospital Nacional Edgardo Rebagliati Martins, EsSalud. Lima, Perú.
2 Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud. Lima, Perú.
3 Hospital Nacional Alberto Sabogal Sologuren, EsSalud. Lima, Perú.
4 Hospital Guillermo Kaelin de la Fuente, EsSalud. Lima, Perú.
5 Hospital Nacional Guillermo Almenara Irigoyen, EsSalud. Lima, Perú.
6 Hospital III Suárez Angamos, EsSalud. Lima, Perú.
RESUMEN
Objetivo: Proveer recomendaciones clínicas basadas en evidencia para la evaluación y el manejo de pacientes con hemorragia digestiva alta (HDA) en el seguro social del Perú (EsSalud). Materiales y métodos: Se conformó un grupo elaborador local (GEG-Local) conformado por especialistas en gastroenterología y metodólogos. El GEG-Local formuló 11 preguntas clínicas a ser respondidas por la presente guía de práctica clínica (GPC). Se buscaron y seleccionaron GPC de HDA publicadas a partir del 2012, que respondieran a las preguntas planteadas y obtuvieran un puntaje mayor a 60% en los dominios 1 y 3 del instrumento Appraisal of Guidelines for Research and Evaluation II (AGREE-II). Durante septiembre del 2017 se realizaron búsquedas bibliográficas en Pubmed, para actualizar 9 preguntas clínicas de las GPC preseleccionadas, y para responder 2 preguntas de novo. La calidad de la evidencia fue evaluada usando la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE). En reuniones de trabajo periódicas, el GEG-Local revisó la evidencia y formuló las recomendaciones, los puntos de buenas prácticas clínicas y el flujograma de evaluación y manejo, usando la metodología GRADE Finalmente, la GPC fue aprobada con Resolución N° 80-IETSI-ESSALUD-2017. Resultados: La presente GPC abordó 11 preguntas clínicas, divididas en cuatro temas: valoración de riesgo, manejo inicial, manejo de HDA no variceal, y manejo de HDA variceal. En base a dichas preguntas se formularon 10 recomendaciones (7 recomendaciones fuertes y 3 recomendaciones débiles), 24 puntos de buena práctica clínica, y 2 flujogramas. Conclusión: Este artículo es el resumen de la GPC de EsSalud, en la cual se valoró la evidencia científica disponible sobre evaluación y manejo de HDA.
Palabras clave: Hemorragia gastrointestinal; Guía de práctica clínica; Medicina basada en la evidencia (fuente: DeCS BIREME).
ABSTRACT
Objective: To provide evidence-based clinical recommendations for the evaluation and management of patients with upper gastrointestinal bleeding (UGB) in the Peruvian Social Security (EsSalud). Materials and methods: A local guideline development group (local GDG) was established, including specialists in gastroenterology and methodologists. The local GDG formulated 11 clinical questions to be answered by this clinical practice guide (CPG). We searched and selected CPG of UGB published from 2012, which answered the posed questions and obtained a score higher than 60% in domains 1 and 3 of the Appraisal of Guidelines for Research and Evaluation II (AGREE-II) tool. During September 2017, bibliographic searches were conducted in Pubmed, to update 9 clinical questions of the preselected CPGs, and to answer 2 de novo questions. The quality of the evidence was evaluated using the Grading of Recommendations Assessment, Development, and Evaluation (GRADE) methodology. In periodic work meetings, the local GDG reviewed the evidence and formulated the recommendations, points of good clinical practice and the flowchart of evaluation and management, using the GRADE methodology Lastly, the CPG was approved with Resolución N° 80-IETSI-ESSALUD-2017. Results: This CPG addressed 11 clinical questions, divided into four themes: risk assessment, initial management, management of non-variceal UGB, and management of variceal UGB. Based on these questions, 10 recommendations (7 strong recommendations and 3 weak recommendations), 24 points of good clinical practice, and 2 flow charts were formulated. Conclusion: This article is the summary of the EsSalud’ CPG, where the available scientific evidence on evaluation and management of UGB was evaluated.
Keywords: Gastrointestinal hemorrhage; Practice guideline; Evidence-based medicine (source: MeSH NLM).
Introducción
La hemorragia digestiva alta (HDA) representa la emergencia médica gastroenterológica más frecuente (1), con una prevalencia de 150 por 100 000 adultos por año y una mortalidad entre 10 a 20% (2). Cifras similares han sido reportadas en Perú (3,4).
El seguro social del Perú (EsSalud) es el segundo sistema de salud con la mayor cantidad de asegurados en Perú, después del Ministerio de salud (MINSA). Debido a la importancia de la HDA en términos de morbilidad, complicaciones y costos; la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud elaboró una guía de práctica clínica (GPC) basada en evidencias para la evaluación y el manejo de HDA, cuyas recomendaciones se resumen en la Tabla 1.
La presente GPC tiene por objetivo orientar la evaluación y manejo de pacientes adultos con HDA en EsSalud. Las recomendaciones planteadas a continuación serán aplicadas por profesionales de la salud en todos los niveles de atención de EsSalud.
Metodología
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión "in extenso", la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_ clini.html). La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 80-IETSI-ESSALUD-2017). En resumen, se aplicó la siguiente metodología:
Conformación del GEG-Local: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del IETSI de EsSalud conformó un grupo elaborador de la guía local (GEG-Local), que incluyó médicos especialistas en gastroenterología y metodólogos.
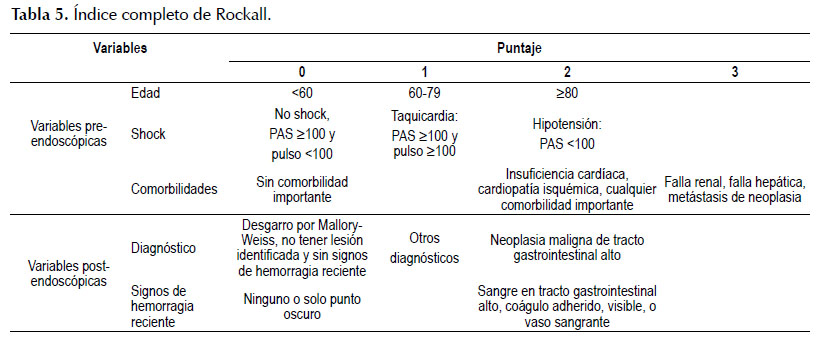
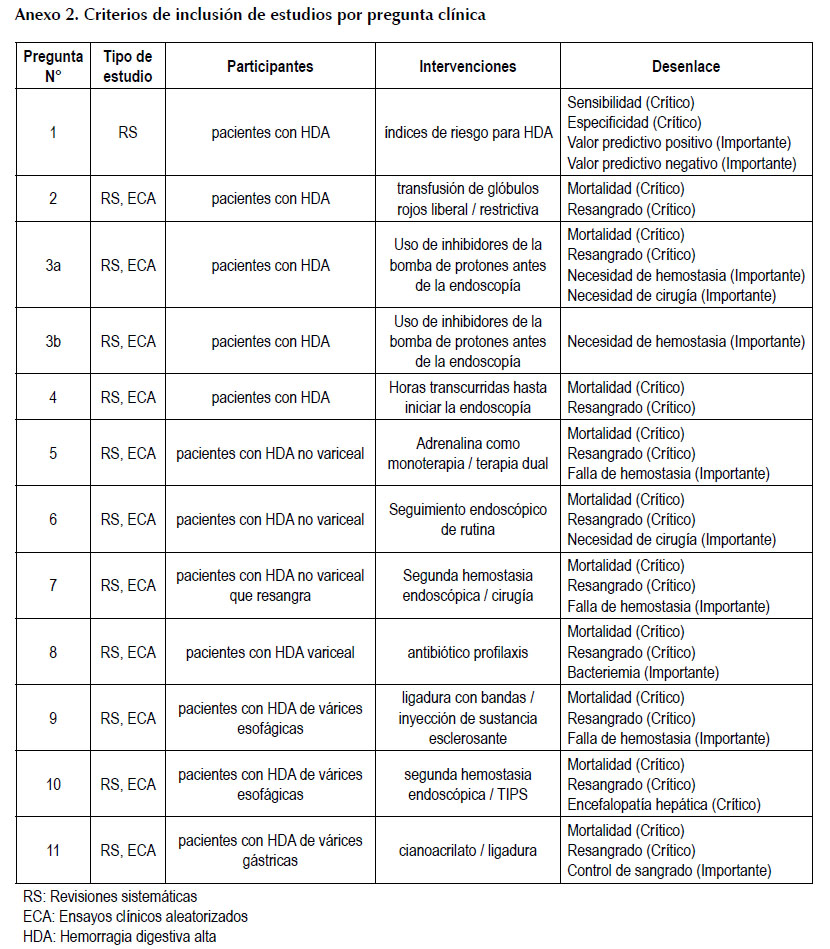
Planteamiento de preguntas clínicas y desenlaces: En concordancia con los objetivos y alcances de esta GPC, el GEG-Local formuló 11 preguntas clínicas (Tabla 2), y definió los desenlaces críticos e importantes para cada pregunta clínica.
Búsqueda y evaluación de GPC: Durante julio del 2017 se buscaron GPC de HDA publicadas a partir del 2012, que respondieran a las preguntas planteadas. Se seleccionaron las guías que tuvieron puntajes mayores al 60% en los dominios 1 y 3 del instrumento Appraisal of Guidelines for Research and Evaluation II (AGREE-II):
- "Acute upper gastrointestinal bleeding in over 16s: management" del "National Institute for Health and Clinical Excellence" (NICE). 2012, actualizada 2016 (5).
- "Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy Guideline" (ESGE) 2015 (6).
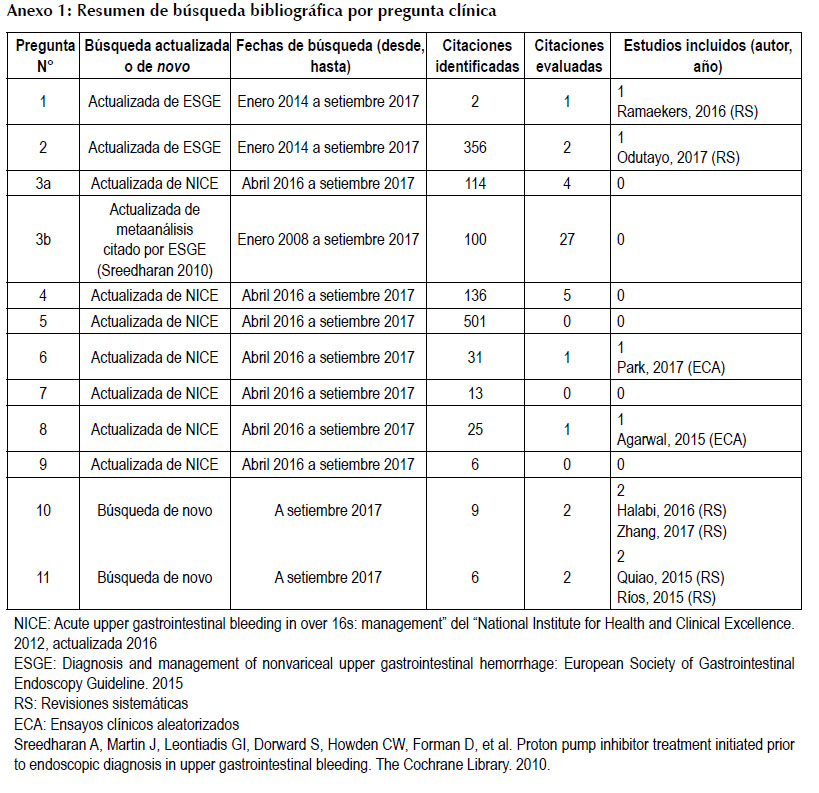
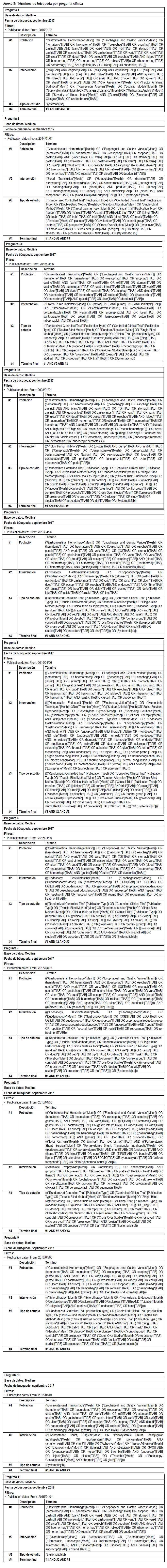
Identificación de la evidencia: De las 11 preguntas clínicas planteadas, 9 fueron contestadas por al menos una de las GPC seleccionadas, por lo cual se actualizó la evidencia para estas preguntas realizando una revisión sistemática (RS) a partir de la fecha en la que se realizó la búsqueda en la GPC seleccionada. En las 2 preguntas que no fueron contestadas por las GPC seleccionadas, se realizó una búsqueda de novo de RS que tuvieran menos de dos años de publicación. Todas las búsquedas bibliográficas fueron realizadas en el buscador Pubmed durante septiembre del 2017 (Anexo 1, disponible en la versión electrónica). Los criterios de inclusión de estudios para cada pregunta clínica se muestran en el Anexo 2, disponible en la versión electrónica, y los términos de búsqueda se muestran en el Anexo 3, disponible en la versión electrónica.
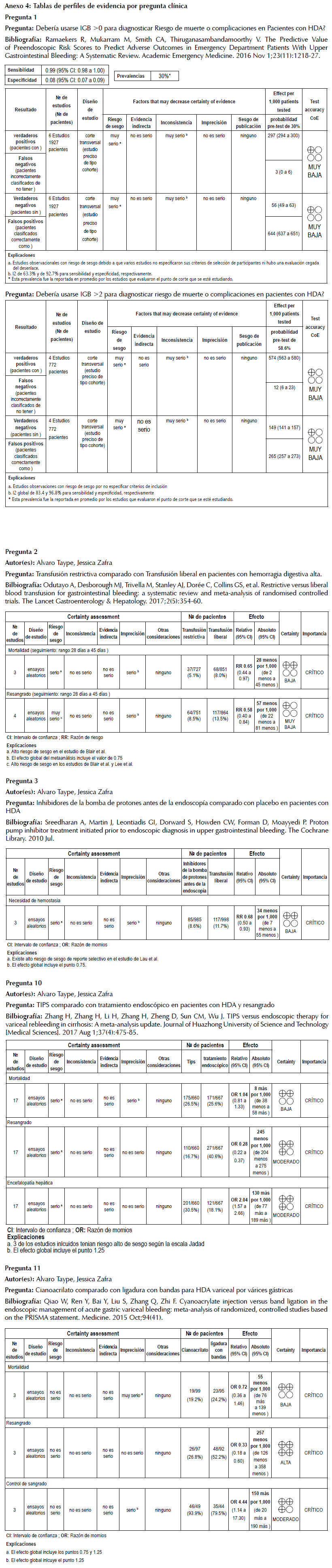
Graduación de la calidad de la evidencia: Para graduar la calidad de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE) (7). Esta graduación se realizó usando tablas de perfiles de evidencias, para las preguntas clínicas 1, 2, 3, 10 y 11 (Anexo 4, disponible en la versión electrónica). Para el resto de preguntas se utilizó la calidad de evidencia propuesta en las GPC seleccionadas, por no haberse encontrado nuevos estudios. El significado de los cuatro niveles de calidad de la evidencia se detalla en la Tabla 3.
Formulación de las recomendaciones: El GEG-Local revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, y formuló las recomendaciones, otorgándole una fuerza a cada recomendación (Tabla 3) usando la metodología GRADE (8). Se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud, 4) Factibilidad de las opciones en los establecimientos de salud de EsSalud, y 5) Uso de recursos. Para la formulación de recomendaciones, estos criterios fueron presentados y discutidos para cada pregunta, y se procuró llegar a un consenso; de no hacerlo, se tomó la decisión por mayoría simple en una votación. Asimismo, se formularon puntos de buenas prácticas clínicas (BPC), que fueron emitidos por el GEG-Local sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica u otras fuentes.
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Además, fue enviada por vía electrónica para su revisión por expertos externos que son mencionados en la sección de agradecimientos, con el objetivo de evaluar la calidad metodológica y la congruencia de las recomendaciones planteadas. El GEG-Local tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Actualización de la GPC: La presente GPC tiene una validez de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Recomendaciones
La presente GPC abordó 11 preguntas clínicas, divididas en cuatro temas: valoración de riesgo, manejo inicial, manejo de HDA no variceal, y manejo de HDA variceal. En base a dichas preguntas se formularon 10 recomendaciones (7 recomendaciones fuertes y 3 recomendaciones débiles), 24 puntos de buena práctica clínica, y 2 flujogramas.
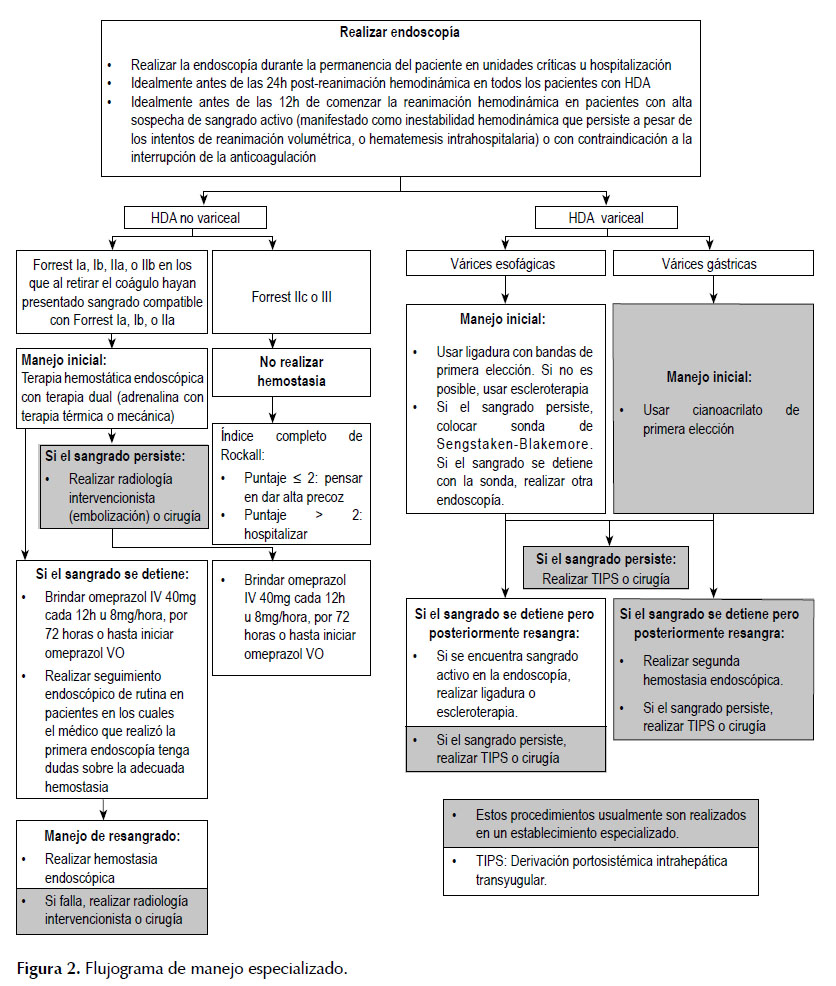
Las recomendaciones se exponen en la Tabla 1, y los flujogramas de manejo en las Figuras 1 y 2. A continuación, se expondrán las recomendaciones para cada pregunta, así como un resumen del razonamiento seguido para llegar a cada recomendación en base a la evidencia.
Valoración de riesgo
Pregunta 1: ¿Qué criterio se puede usar para decidir el alta de emergencia sin realización de endoscopía en pacientes con HDA?
Recomendaciones:
- En pacientes con sospecha de HDA y un puntaje menor a dos en el Índice de Glasgow-Blatchford, sugerimos que el médico tratante indique el alta sin necesidad de realizar una endoscopía (Recomendación débil a favor, calidad de evidencia: muy baja).
- Los pacientes dados de alta sin endoscopía, serán informados sobre la posibilidad de recurrencia del sangrado y serán orientados sobre las acciones a realizar en dichos casos (BPC).
- Los pacientes con puntaje de dos o más en el Índice de Glasgow-Blatchford serán evaluados por el especialista gastroenterólogo, o referidos a un establecimiento que cuente con un especialista gastroenterólogo (BPC).
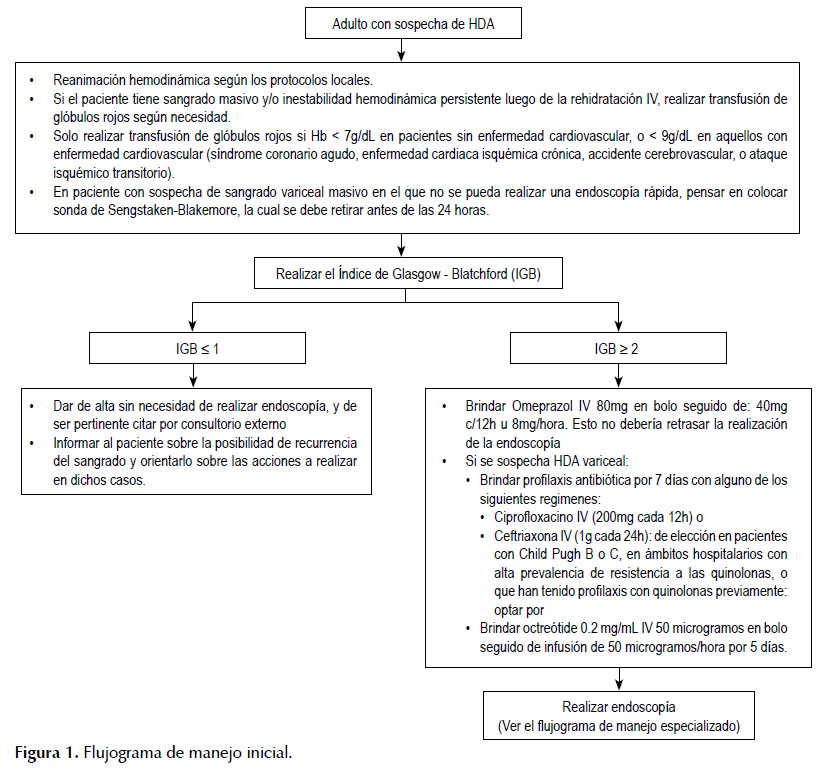
- Los pacientes con puntaje menor o igual a dos en el índice completo de Rockall pueden ser dados de alta precozmente luego de la endoscopía (BPC).
De la evidencia a la decisión:
Brindar un alta temprana a pacientes con muy bajo riesgo de complicaciones permitía ahorrar recursos y evitar exponer innecesariamente a los pacientes a una estadía prolongada en el servicio de emergencia.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía ESGE, encontrando una RS para esta pregunta clínica (9). Esta RS evaluó 13 estudios, y resumió la sensibilidad y especificidad del índice de Glasgow-Blatchford (IGB) (Tabla 4) para el desarrollo de muerte o complicaciones, encontrando que el IGB ≥ 1 tuvo sensibilidad de 99%, especificidad de 8%, y valor predictivo negativo (VPN) de 96%; en tanto que el IGB ≥ 3 tuvo sensibilidad de 98%, especificidad de 36%, y VPN de 93%. Si bien la sensibilidad fue alta para ambos puntos de corte, el GEG-Local consideró que el VPN fue bajo para IGB ≥ 3, y que la especificidad fue baja para IGB ≥ 1; por lo cual decidió recomendar el alta temprana sin la realización de la endoscopía a aquellos pacientes con un IGB ≥ 2.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
Debido a que la calidad de la evidencia era baja, y la decisión del punto de corte del IGB fue tomada por consenso entre expertos, esta recomendación tuvo una fuerza débil.
Puntos de BPC: Se consideró que aquellos con un IGB ≤ 1, debido a su bajo riesgo, podrían ser dados de alta sin que necesariamente sean evaluados por un gastroenterólogo, pero debidamente informados sobre la recurrencia de resangrado. Adicionalmente, se consideró importante determinar criterios para la realización de una alta temprana post-endoscopía, para lo cual se consideró apropiado sugerir dar de alta temprana a aquellos pacientes con un puntaje ≤ 2 en el índice completo de Rockall, tal como recomienda NICE (5) (Tabla 5).
Manejo inicial
Pregunta 2: ¿Cuál es el nivel de hemoglobina óptimo para iniciar transfusión de glóbulos rojos en pacientes con HDA?
Recomendaciones:
1. En pacientes con HDA recomendamos realizar transfusión de glóbulos rojos solo cuando la hemoglobina sea menor a 7 g/dL (Recomendación fuerte a favor, calidad de evidencia: muy baja).
2. En pacientes con enfermedad cardiovascular (síndrome coronario agudo, enfermedad cardiaca isquémica crónica, accidente cerebrovascular, ataque isquémico transitorio, o enfermedad vascular periférica): realizar transfusión de glóbulos rojos cuando la hemoglobina sea menor a 9 g/dL (BPC).
3. En pacientes con sangrado masivo y/o inestabilidad hemodinámica persistente luego de la reanimación hemodinámica, realizar transfusión de glóbulos rojos según necesidad (BPC).
De la evidencia a la decisión:
La transfusión de glóbulos rojos en pacientes con HDA podría tener efectos adversos, por lo cual se ha sugerido que la transfusión debería ser restrictiva, es decir, debería ser realizada solo cuando la hemoglobina esté debajo de puntos de corte específicos.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía ESGE, encontrando una RS para esta pregunta clínica (10). Esta RS sintetizó 5 ensayos clínicos aleatorizados (ECA) y encontró en sus metaanálisis menor mortalidad (RR: 0,65, IC95%: 0,44 – 0,97) y menor resangrado (RR: 0,58, IC95%: 0,40 – 0,84) en el grupo de transfusión restrictiva en comparación con el grupo de transfusión liberal. Considerando esto, el GEG-Local decidió recomendar la transfusión restrictiva. Sin embargo, dado que cada estudio de la RS define transfusión restrictiva de manera diferente, se optó por recomendar el punto de corte usado por el ECA con mayor número de participantes y que presentó el periodo de seguimiento más largo (11): hemoglobina < 7g/dL.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
A pesar de que la calidad de la evidencia fue baja/ muy baja, la transfusión liberal significaría un riesgo innecesario y mayor uso de recursos, por lo cual se decidió formular una recomendación fuerte.
Puntos de BPC: Esta recomendación no podría extrapolarse a pacientes con sangrado masivo y/o inestabilidad hemodinámica, que pueden requerir una transfusión pronta. Además, en pacientes con comorbilidad cardiovascular significativa la transfusión restrictiva se ha asociado con una mayor incidencia de síndrome coronario agudo en pacientes que no tenían diagnóstico de HDA (12), por lo cual se optó por consenso usar en esta población un punto de corte de hemoglobina < 9 g/dL.
Pregunta 3: ¿Se debe administrar inhibidores de bomba de protones antes de realizar la endoscopía?
Recomendaciones:
-
En pacientes con HDA, sugerimos que antes de la realización de la endoscopía digestiva alta se brinde omeprazol IV 80 mg en bolo seguido de 40 mg cada 12 horas o infusión de 8 mg/ hora (Recomendación débil a favor, calidad de evidencia: baja)
-
La falta de disponibilidad de omeprazol no debe retrasar la realización de la endoscopía (BPC).
-
En pacientes con sospecha de sangrado variceal masivo en el que no se pueda realizar una endoscopía rápida, se puede colocar sonda de Sengstaken-Blakemore (BPC).
-
En pacientes con HDA variceal sospechada o confirmada administrar octreótide 0,2 mg/mL IV en bolo de 50 microgramos seguido de infusión de 50 microgramos/hora durante 5 días (BPC).
De la evidencia a la decisión:
Si bien el uso de inhibidores de la bomba de protones (IBP) es útil después de realizar hemostasia en sangrado no variceal, aún quedan dudas sobre su utilidad antes de la endoscopía.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, pero no se encontraron RS ni ECA. NICE realiza una RS y diversos metaanálisis, encontrando que la administración de IBP antes de la endoscopía no presenta diferencias en mortalidad (RR: 1,18, IC95%: 0,79 – 1,76), resangrado (RR: 0,89, IC95%: 0,70 – 1,13), ni necesidad de cirugía (RR: 0,91, IC95%: 0,67 – 1,24). Sin embargo, la guía NICE no evalúa un desenlace de interés: la necesidad de hemostasia, el cual es abordado por una RS (13) citada en la guía ESGE.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de esta RS, pero no se encontraron más estudios, por lo cual se tomó en cuenta dicha RS. Esta RS resume 3 ECA, y encuentra que la necesidad de hemostasia fue menor en el grupo de pacientes a los que se les administró IBP antes de la endoscopía en comparación con el grupo de pacientes a los que se les administró placebo (RR: 0,68, IC95%: 0,50 – 0,93).
El GEG-Local decidió recomendar la administración de IBP antes de la endoscopía, considerando: 1) Que disminuir la necesidad de hemostasia significaría un importante ahorro de recursos, 2) Que la mayoría de ECA que han evaluado los desenlaces clínicos se han realizado en pacientes en quienes se ha realizado endoscopía en las primeras 24 horas de su ingreso, lo cual no siempre sucede en nuestro contexto; por lo cual brindar IBP en pacientes en quienes la endoscopía va a tardar podría tener beneficios clínicamente relevantes en desenlaces como mortalidad o resangrado, como se propone en otros consensos (13,15).
Con respecto al medicamento y dosis, el GEG-Local decidió recomendar la administración de omeprazol IV 80mg en bolo seguido de 40 mg cada 12 horas o infusión de 8 mg/hora. Se optó por el uso de omeprazol debido a que fue el IBP usado en la mayoría de los ECA. En cuanto a la forma de administración, continua o intermitente, un estudio en pacientes con HDA halló beneficios del uso de IBP en infusión continua para pacientes con HDA (16), mientras que un metaanálisis de ECA en pacientes con úlceras de alto riesgo no halló diferencias entre la administración continua y la intermitente en términos de mortalidad, resangrado, y necesidad de intervenciones urgentes (17). Por ello se recomendó administración de IBP antes de la endoscopía por infusión continua o de manera intermitente, de acuerdo a la disponibilidad de bombas de infusión en los establecimientos de salud.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
Debido a la baja calidad de la evidencia, se decidió formular una recomendación débil.
Puntos de BPC: Se consideró importante señalar que la falta de disponibilidad de omeprazol no debe retrasar la realización de la endoscopía; así como mencionar otras acciones que se suelen realizar antes de la endoscopía deberían ser mencionadas en la presente sección: la colocación temprana de octreótide, y la colocación de una sonda de Sengstaken-Blakemore (cuando sea necesario) en pacientes con sospecha de sangrado variceal masivo en el que no se pueda realizar una endoscopía rápida. Estos puntos de BPC fueron adoptados de otras guías, y su desarrollo puede revisarse en éstas (5,18).
Pregunta 4: ¿En qué momento se debe realizar la endoscopía digestiva alta?
Recomendaciones:
- En pacientes con HDA que tengan un puntaje de dos o más en el Índice de Glasgow-Blatchford, sugerimos realizar la endoscopia digestiva alta durante su permanencia en unidades críticas o durante su hospitalización (BPC).
- La realización de la endoscopía digestiva alta debería idealmente realizarse dentro de las 24 horas post-reanimación hemodinámica (BPC).
- En pacientes con alta sospecha de sangrado activo (manifestado por signos como inestabilidad hemodinámica que persiste a pesar de los intentos de reanimación volumétrica, o hematemesis intrahospitalaria) o con contraindicación a la interrupción de la anticoagulación: se sugiere que la endoscopía digestiva alta se realice dentro de las 12 horas después del inicio de la reanimación hemodinámica (BPC).
De la evidencia a la decisión:
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, pero no se encontraron RS ni ECA. NICE realiza una RS y diversos metaanálisis de ECA, encontrando que realizar una endoscopía temprana en pacientes con HDA no presenta diferencias con respecto a realizar una endoscopía tardía, en términos de mortalidad (RR: 0.81, IC95%: 0,13 – 5,29) y resangrado (RR: 0.89, IC95%: 0,37 – 2,18). Debido a la baja calidad y la imprecisión de la evidencia, el GEG-Local decidió no formular recomendaciones sobre este tema, sino brindar puntos de buena práctica clínica para esta pregunta.
Puntos de BPC: El GEG-Local consideró que la endoscopía debería realizarse en algún momento durante la permanencia del paciente en unidades críticas o durante su hospitalización. Asimismo, se consideró que, según los estándares internacionales (6), esto debería realizarse en las primeras 24 horas postreanimación hemodinámica. Además, se consideró realizar la endoscopía en las primeras 12 horas en pacientes con alta sospecha de sangrado activo o con contraindicación a la interrupción de la anticoagulación, basándose en la guía ESGE (6).
Manejo de HDA no variceal
Pregunta 5: ¿Es recomendable usar la inyección de adrenalina como monoterapia en HDA no variceal?
Recomendaciones:
1. En pacientes con HDA no variceal, recomendamos usar terapia dual (adrenalina con terapia térmica o adrenalina con mecánica) en vez de usar monoterapia con adrenalina (recomendación fuerte a favor, calidad de evidencia: muy baja para mortalidad y falla de hemostasia, pero moderada para resangrado).
2. En pacientes con HDA no variceal, realizar hemostasia endoscópica solo a quienes tienen estigmas de hemorragia reciente en la endoscopia (Forrest Ia, Ib, o IIa; así como Forrest IIb en los que al retirar el coágulo hayan presentado sangrado compatible con Forrest Ia, Ib, o IIa) (BPC).
3. En pacientes con HDA no variceal en los que el sangrado no puede controlarse endoscópicamente, realizar terapia por radiología intervencionista (embolización) o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
4. En pacientes con HDA no variceal que han requerido tratamiento hemostático, seguir brindando omeprazol IV 40mg cada 12 horas, por 72 horas post-endoscopía, o hasta iniciar omeprazol por vía oral (BPC).
De la evidencia a la decisión:
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, pero no se encontraron RS ni ECA. NICE realiza una RS y diversos metaanálisis de ECA, encontrando que la monoterapia con adrenalina y la terapia combinada en pacientes con HDA no variceal no tuvieron diferencias significativas con respecto a mortalidad (RR: 0,80, IC95%: 0,44 – 1,44) ni falla de hemostasia (RR: 0,69, IC95%: 0,36 – 1,30), pero sí encuentran menor resangrado en el grupo de terapia combinada (RR: 0,43, IC95%: 0,30 – 0,63). Considerando esto, el GEG-Local decidió recomendar el uso de terapia dual en vez de monoterapia con adrenalina.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible (considerando la necesaria implementación de terapia dual en todos los establecimientos de EsSalud que manejan pacientes con HDA), y significaría un adecuado uso de recursos.
Debido a que la calidad de la evidencia para resangrado fue moderada, se decidió realizar una recomendación fuerte.
Puntos de BPC: Se sugiere brindar terapia hemostática durante la endoscopía para HDA no variceal en los siguientes escenarios: Forrest Ia, Ib o IIa, así como Forrest IIb en los que al retirar el coágulo hayan presentado sangrado compatible con Forrest Ia, Ib, o IIa, como recomienda la guía ESGE (6). Asimismo, se sugiere usar omeprazol por 72 horas luego de la endoscopía en pacientes con HDA no variceal que han recibido hemostasia, como recomienda NICE (5).
En pacientes con HDA no variceal en los que el sangrado no puede controlarse endoscópicamente, debido al balance poco claro que existe entre los riesgos y beneficios de realizar terapia por radiología intervencionista (embolización) en comparación con cirugía, y a que en nuestro contexto son pocos los establecimientos que cuentan con embolización, se decidió proponer el uso de embolización o cirugía de acuerdo a disponibilidad de equipos y personal.
Pregunta 6: ¿Es necesario realizar un seguimiento endoscópico de rutina luego del primer tratamiento endoscópico en pacientes con HDA no variceal?
Recomendaciones:
- En pacientes con HDA no variceal, recomendamos no realizar seguimiento endoscópico de rutina (recomendación débil en contra, calidad de evidencia: muy baja)
- En pacientes con HDA no variceal, realizar seguimiento endoscópico en los pacientes en los cuales el médico que realizó la primera endoscopía tenga dudas sobre la adecuada hemostasia (BPC).
De la evidencia a la decisión:
El objetivo de esta pregunta fue determinar la utilidad del seguimiento endoscópico de rutina, el cual se refiere a la realización de una segunda endoscopía a todos los pacientes con HDA sometidos a una primera endoscopía.
NICE realiza una RS y diversos metaanálisis de ECA, encontrando que el seguimiento endoscópico de rutina en pacientes con HDA no variceal no presenta beneficios en términos de mortalidad (RR: 0,82, IC95%: 0,45 – 1,49), resangrado durante la hospitalización (RR: 0,74, IC95%: 0,48 – 1,13), ni necesidad de cirugía (RR: 0,58, IC95%: 0,32 – 1,03). Sin embargo, encuentra que el resangrado a los 30 días fue menor en el grupo en el que se realizó seguimiento endoscópico de rutina (RR: 0,67, IC95%: 0,48 – 0,94), aunque este resultado no es considerado clínicamente relevante.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, encontrando un ECA que incluyó 319 pacientes con HDA debido a úlcera péptica (19), que no encontró diferencias estadísticamente significativas para mortalidad, resangrado, ni necesidad de cirugía. El GEG-Local consideró que los resultados de esta ECA no modificarían los resultados presentados por los metaanálisis de NICE, por lo cual se decidió tomar las decisiones en base a estos últimos. Considerando esto, el GEG-Local decidió recomendar la no realización de seguimiento endoscópico de rutina
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
Debido a que la baja calidad de la evidencia, se decidió realizar una recomendación débil.
Puntos de BPC: Se consideró que existen pacientes con mayor riesgo de resangrado en los cuales sí se debería realizar un seguimiento endoscópico; y que esto debería depender de la opinión del médico que realizó la primera endoscopía.
Pregunta 7: ¿Cuál es el mejor manejo en pacientes con HDA no variceal que vuelven a sangrar luego del primer tratamiento endoscópico: segunda hemostasia endoscópica o cirugía?
Recomendaciones:
- En pacientes con HDA no variceal que resangra, recomendamos realizar como primera opción una segunda endoscopía con posibilidad de terapia hemostática, en vez de cirugía (Recomendación fuerte a favor, calidad de evidencia: baja).
- En pacientes con HDA no variceal que resangra, en los que el sangrado no pueda controlarse con la segunda hemostasia endoscópica, realizar terapia por radiología intervencionista (embolización) o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
De la evidencia a la decisión:
Cuando el paciente con HDA no variceal vuelve a sangrar después de un primer tratamiento endoscópico exitoso, se suele decidir entre realizar una segunda hemostasia endoscópica o una cirugía.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, pero no se encontraron RS ni ECA. NICE realiza una RS y encuentra un solo ECA, que reporta que la realización de una segunda hemostasia endoscópica en comparación con la realización de cirugía no tuvo diferencias significativas con respecto a mortalidad (RR: 0,57, IC95%: 0,20 – 1,62), falla de hemostasia (OR: 9,00, IC95%: 0,47 – 172,15), ni resangrado a 30 días (RR: 0,13, IC95%: 0,01 – 2,47). Considerando esto, junto con la mayor rapidez con la que puede estar disponible una segunda endoscopía en comparación con una cirugía, el GEG-Local decidió recomendar la realización de una segunda endoscopía.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
A pesar de que la calidad de la evidencia fue baja, el GEG-Local consideró que la hemostasia endoscópica cirugía significaría un menor riesgo de complicaciones y menor uso de recursos, por lo cual se decidió realizar una recomendación fuerte.
Puntos de BPC: Si esta hemostasia endoscópica fallara, se tienen como siguientes opciones la embolización y cirugía. Se decidió emitir un punto de BPC al respecto, para lo cual se revisó los metaanálisis de la guía de NICE (5) que comparan ambas opciones, que muestran que la realización de cirugía presenta menor resangrado pero mayor frecuencia de complicaciones en comparación a la embolización. Asimismo, se consideró que el acceso a la embolización era muy restringido en nuestro medio. Por ello, se decidió no recomendar una de estas opciones sobre la otra.
Manejo de HDA variceal
Pregunta 8: ¿Se debe administrar profilaxis antibiótica en el manejo inicial de pacientes con HDA variceal?
Recomendaciones:
1. En pacientes con HDA variceal sospechada o confirmada recomendamos administrar profilaxis antibiótica (Recomendación fuerte a favor, calidad de evidencia: muy baja).
2. Usar los siguientes regímenes de profilaxis antibiótica, por 7 días con:
a. Ciprofloxacino IV 200mg cada 12 horas, o
b. Ceftriaxona IV 1g cada 24 horas: de elección en pacientes con cirrosis avanzada (Child Pugh B o C), en ámbitos hospitalarios con alta prevalencia de infecciones bacterianas resistentes a las quinolonas, y en pacientes que han tenido profilaxis con quinolonas previamente (BPC).
De la evidencia a la decisión:
Los pacientes con várices esofágicas y cirrosis que sangran tienen factores de riesgo que los predisponen a infecciones sistémicas, por lo que podrían requerir profilaxis antibiótica.
NICE realiza una RS y diversos metaanálisis de ECA, encontrando que recibir y no recibir profilaxis antibiótica no tuvo diferencias en términos de mortalidad (RR: 0,81, IC95%: 0,63 – 1,03), pero aquellos que recibieron profilaxis antibiótica tuvieron menor resangrado (RR: 0,77, IC95%: 0,60 – 0,98) y menor bacteriemia (RR: 0,24, IC95%: 0,14 – 0,39).
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, encontrando un ECA que incluyó 56 pacientes con HDA (20). Este ECA encontró que las incidencias de infección y resangrado fueron menores en el grupo que recibió profilaxis antibiótica en comparación con el grupo que recibió antibióticos a demanda, aunque estas diferencias no fueron significativas. El GEG-Local consideró que los resultados de esta ECA no modificarían los resultados presentados por los metaanálisis de NICE, por lo cual se decidió tomar las decisiones en base a los últimos. Considerando esto, el GEG-Local decidió recomendar la aplicación de profilaxis antibiótica.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos. Sin embargo, se recalcó que no se suelen contar con perfiles de resistencia antimicrobiana local, por lo que resulta difícil elegir un antibiótico de acuerdo al perfil local.
A pesar de que la calidad de la evidencia fue muy baja, se consideró que los beneficios de la recomendación superaban grandemente los riesgos, por lo que se decidió realizar una recomendación fuerte.
Puntos de BPC: El GEG-Local consideró importante definir los antibióticos a usar. Debido a que no se cuenta con perfiles de resistencia antimicrobiana, se decidió adoptar las recomendaciones de otras guías al respecto: "American Society for Gastrointestinal Endoscopy" (2014) (18), "Prevention and Management of Gastroesophageal Varices and Variceal Hemorrhage in Cirrhosis" (2007) (21), y los consensos "Baveno V" (2010) (22) y "Baveno VI" (2015) (23).
Pregunta 9: ¿Cuál es el mejor manejo en pacientes con HDA de várices esofágicas: ligadura con bandas o escleroterapia?
Recomendaciones:
- En pacientes con HDA de várices esofágicas, recomendamos, como primera opción, usar ligadura con bandas en vez de escleroterapia (Recomendación fuerte a favor, calidad de evidencia: baja).
- En pacientes con HDA de várices esofágicas, usar escleroterapia en los casos en los que la ligadura con bandas sea técnicamente difícil o no esté disponible (BPC).
- En pacientes con HDA de várices esofágicas en los cuales no se puede controlar el sangrado durante la endoscopía, colocar una sonda de Sengstaken-Blakemore, la cual debería ser retirada antes de las 24 horas (BPC).
- Si luego de colocar la sonda el sangrado se detiene, realizar una segunda endoscopía con posibilidad de hemostasia (BPC).
- Si luego de colocar la sonda el sangrado persiste, realizar TIPS o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
De la evidencia a la decisión:
Beneficios/daños de las opciones
Dentro de las terapias endoscópicas más utilizadas para el manejo de HDA por várices esofágicas se encuentran la ligadura con bandas y la escleroterapia.
Se realizó una búsqueda en Pubmed para actualizar la evidencia de la guía NICE, pero no se encontraron RS ni ECA. NICE realiza una RS y diversos metaanálisis de ECA, encontrando que la ligadura presenta menor mortalidad (RR: 0,86, IC95%: 0,74 – 0,99), resangrado (RR: 0,54, IC95%: 0,52 – 0,76), y falla de hemostasia (RR: 0,62, IC95%: 0,43 – 0,90) en comparación a la escleroterapia. Considerando esto, el GEG-Local decidió recomendar el uso de ligadura de bandas.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
A pesar de que el nivel de la evidencia era bajo para mortalidad, resangrado y falla de hemostasia, se consideró que el balance riesgo beneficios apoyaba la recomendación. Por ello esta recomendación se consideró como fuerte.
Puntos de BPC: Se reconoció que en algunos casos la ligadura con bandas es técnicamente difícil o no disponible, por lo que se podría usar la escleroterapia. Asimismo, se resaltó la importancia del uso de la sonda de Sengstaken-Blakemore para controlar el sangrado mientras se alista una segunda endoscopía. Además, se evaluó la posibilidad de que esta segunda endoscopía fallase, teniendo como alternativas la derivación portosistémica intrahepática transyugular (TIPS) o cirugía. Sin embargo, debido a la escasa disponibilidad de TIPS en nuestro medio, se decidió no recomendar uno de estos métodos sobre el otro.
Pregunta 10: ¿Cuál es el mejor manejo en pacientes con HDA de várices esofágicas que vuelven a sangrar luego del primer tratamiento endoscópico: segunda hemostasia endoscópica o TIPS?
Recomendaciones:
1. En pacientes con HDA de várices esofágicas en los cuales se presenta resangrado luego de una terapia inicial exitosa, realizar una endoscopía. Si se encuentra sangrado, sugerimos aplicar una hemostasia endoscópica con ligadura o escleroterapia en vez de TIPS (Recomendación fuerte a favor, calidad de evidencia: baja para mortalidad, moderada para resangrado y encefalopatía hepática).
2. En pacientes con HDA de várices esofágicas que resangran, si la segunda hemostasia endoscópica falla, realizar TIPS o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
De la evidencia a la decisión:
Cuando el paciente con HDA de várices esofágicas vuelve a sangrar después de un primer tratamiento endoscópico exitoso, se suele decidir entre realizar una segunda hemostasia endoscópica o TIPS.
Para esta pregunta, se realizó una búsqueda de novo en Pubmed, encontrando dos RS para esta pregunta clínica (24,25). Se eligió una de ellas debido a ser más reciente y tener mayor puntaje en la evaluación de calidad (25). Esta RS sintetizó 17 ECA y encontró que el uso de TIPS en comparación con terapia endoscópica presentó similar mortalidad (OR: 1,04, IC95%: 0,81 – 1,33), menos resangrado (OR: 0,28, IC95%: 0,22 – 0,37) y mayor frecuencia de encefalopatía hepática (OR: 2,04, IC95%: 1,57 – 2,66). Sin embargo, debido a que la mayoría de establecimientos no cuentan con servicios de radiología intervencionista durante la mayor parte del día, el GEG-Local decidió recomendar que se intente detener el sangrado realizando una segunda endoscopía.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos.
A pesar de que al evaluar si los beneficios superan los riesgos existe incertidumbre, se consideró que el uso de TIPS trae complicaciones relevantes, y no suele estar disponible en nuestro medio, por lo que se decidió realizar una recomendación fuerte,
Puntos de BPC: Si la hemostasia endoscópica en resangrado fallase, se debería realizar TIPS o cirugía. Sin embargo, debido a la escasa disponibilidad de TIPS en nuestro medio, se decidió no recomendar uno de estos métodos sobre el otro.
Pregunta 11: ¿Cuál es el mejor manejo en pacientes con HDA de várices gástricas: aplicación de cianoacrilato o ligadura?
Recomendaciones:
1. En pacientes con HDA por várices gástricas, recomendamos el uso de cianoacrilato en vez de ligadura (Recomendación fuerte a favor, calidad de evidencia: alta para resangrado, moderada para control de sangrado y baja para mortalidad).
2. En pacientes con HDA por várices gástricas, si el sangrado no se controla con el uso de cianoacrilato, realizar TIPS o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
3. En pacientes con HDA por várices gástricas en los que se presenta resangrado luego de una terapia inicial exitosa, intentar una segunda hemostasia endoscópica. Si esta falla, realizar TIPS o cirugía, de acuerdo a disponibilidad de equipos y personal (BPC).
De la evidencia a la decisión:
Beneficios/daños de las opciones
Para esta pregunta, se realizó una búsqueda de novo en Pubmed, encontrando dos RS para esta pregunta clínica (26,27). Se eligió una de ellas debido a ser más reciente y tener mayor puntaje en la evaluación de calidad (26). Esta RS sintetizó 3 ECA y encontró que el uso de cianoacrilato en comparación con ligadura de bandas presentó menor resangrado (OR: 0,33, IC95%: 0,18 – 0,60), y mayor frecuencia de control de sangrado (OR: 4,44, IC95%: 1,14 – 17,30), pero no se hallaron diferencias en mortalidad (OR: 0,72, IC95%: 0,36 – 1,46). Considerando esto, el GEG-Local decidió recomendar el uso de cianoacrilato en vez de ligadura.
El GEG-Local consideró que esta recomendación no iría en contra de los valores y preferencias de los pacientes, sería aceptable, factible, y significaría un adecuado uso de recursos. Además, se consideró necesario asegurar el abastecimiento de cianoacrilato en los establecimientos de salud con capacidad para realizar endoscopías.
Debido a que existe evidencia de calidad moderada/ alta de que los beneficios superan los riesgos, se decidió formular una recomendación fuerte.
Puntos de BPC: Se consideró que, en caso de falla terapéutica, se debería realizar TIPS o cirugía. Debido a la escasa accesibilidad de TIPS en nuestro contexto, se decidió no recomendar una de estas terapias sobre la otra. En el caso de resangrado, se consideró que sería mejor realizar primero una terapia endoscópica por ser más accesible, y de fallar esta recurrir a TIPS o cirugía.
AGRADECIMIENTOS
Agradecemos a las siguientes personas por la revisión que realizaron a la presente guía: Dra. Milagros Dávalos Moscol, Gastroenteróloga, Jefa del Departamento del Aparato Digestivo del Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Perú. Dr. Augusto Vera Calderón, Gastroenterólogo, Jefe del Servicio de Endoscopia del Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Perú. Dr. Charles Huamaní Saldaña, Epidemiólogo, Hospital Nacional Adolfo Guevara Velasco, EsSalud Cusco, Perú. Dr. Carlos Alberto Contardo Zambrano, Gastroenterólogo. Sres. Christoper Alarcón-Ruiz de la Universidad Ricardo Palma, y Walter A Tellez de la Universidad Nacional Federico Villarreal.
Conflictos de interés: Los responsables de la elaboración del presente documento declaran no tener ningún conflicto de interés financiero y no financiero, con relación a los temas descritos en el presente documento.
Financiamiento: Este documento técnico ha sido financiado por el Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), EsSalud, de Perú.
Citar como: Vásquez-Quiroga J, Taype-Rondan A, Zafra-Tanaka JH, Arcana-López E, Cervera-Caballero L, Contreras-Turin J, et al. Guía de práctica clínica para la evaluación y el manejo de la hemorragia digestiva alta en el seguro social del Perú (EsSalud). Rev Gastroenterol Peru. 2018;38(1):89-102
REFERENCIAS BIBLIOGRÁFICAS
1. Rotondano G. Epidemiology and diagnosis of acute nonvariceal upper gastrointestinal bleeding. Gastroenterol Clin North Am. 2014;43(4):643-63. [ Links ]
2. Cremers I, Ribeiro S. Management of variceal and nonvariceal upper gastrointestinal bleeding in patients with cirrhosis. Therap Adv Gastroenterol. 2014;7(5):206-16. [ Links ]
3. Cassana A, Scialom S, Segura ER, Chacaltana A. Validation of the Glasgow-Blatchford Scoring System to predict mortality in patients with upper gastrointestinal bleeding in a hospital of Lima, Peru (June 2012-December 2013). Rev Esp Enferm Dig. 2015;107(8):476-82. [ Links ]
4. Espinoza-Rios J, Aguilar Sanchez V, Bravo Paredes EA, Pinto Valdivia J, Huerta-Mercado Tenorio J. Comparación de los scores Glasgow-Biatchford, Rockall y AIMS65 en pacientes con hemorragia digestiva alta en un hospital de Lima, Peru. Rev Gastroenterol Peru. 2016;36(2):143-52. [ Links ]
5. National Institute for Health and Clinical Excellence (NICE). Acute upper gastrointestinal bleeding in over 16s: management. London: NICE; 2012. [ Links ]
6. Gralnek IM, Dumonceau J-M, Kuipers EJ, Lanas A, Sanders DS, Kurien M, et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2015;47(10):a1-a46. [ Links ]
7. Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011;64(4):401-6. [ Links ]
8. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation's direction and strength. J Clin Epidemiol. 2013;66(7):726-35. [ Links ]
9. Ramaekers R, Mukarram M, Smith CA, Thiruganasambandamoorthy V. The predictive value of preendoscopic risk scores to predict adverse outcomes in emergency department patients with upper gastrointestinal bleeding: a systematic review. Acad Emerg Med. 2016;23(11):1218-27. [ Links ]
10. Odutayo A, Desborough MJ, Trivella M, Stanley AJ, Dorée C, Collins GS, et al. Restrictive versus liberal blood transfusion for gastrointestinal bleeding: a systematic review and metaanalysis of randomised controlled trials. Lancet Gastroenterol Hepatol. 2017;2(5):354-60. [ Links ]
11. Villanueva C, Colomo A, Bosch A, Concepción M, Hernandez- Gea V, Aracil C, et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013;368(1):11-21. [ Links ]
12. Docherty AB, O’Donnell R, Brunskill S, Trivella M, Doree C, Holst LB, et al. Effect of restrictive versus liberal transfusion strategies on outcomes in patients with cardiovascular disease in a non-cardiac surgery setting: systematic review and metaanalysis. BMJ. 2016;352:i1351. [ Links ]
13. Sreedharan A, Martin J, Leontiadis GI, Dorward S, Howden CW, Forman D, et al. Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in upper gastrointestinal bleeding. Cochrane Database Syst Rev. 2010;(7):CD005415. [ Links ]
14. Laine L, Jensen DM. Management of patients with ulcer bleeding. Am J Gastroenterol. 2012;107(3):345. [ Links ]
15. Sung JJ, Chan FK, Chen M, Ching JY, Ho K, Kachintorn U, et al. Asia-Pacific Working Group consensus on non-variceal upper gastrointestinal bleeding. Gut. 2011;60(9):1170-7. [ Links ]
16. Lau JY, Leung WK, Wu JC, Chan FK, Wong VW, Chiu PW, et al. Omeprazole before endoscopy in patients with gastrointestinal bleeding. N Engl J Med. 2007;356(16):1631-40. [ Links ]
17. Sachar H, Vaidya K, Laine L. Intermittent vs continuous proton pump inhibitor therapy for high-risk bleeding ulcers: a systematic review and meta-analysis. JAMA Intern Med. 2014;174(11):1755-62. [ Links ]
18. Hwang JH, Shergill AK, Acosta RD, Chandrasekhara V, Chathadi KV, Decker GA, et al. The role of endoscopy in the management of variceal hemorrhage. Gastrointest Endosc. 2014;80(2):221-7. [ Links ]
19. Park SJ, Park H, Lee YC, Choi CH, Jeon TJ, Park JC, et al. Effect of scheduled second-look endoscopy on peptic ulcer bleeding: a prospective randomized multicenter trial. Gastrointest Endosc. 2018;87(2):457-65. [ Links ]
20. Agarwal A, Kumar SS, Sadasivan J, Kate V. Antibiotic prophylaxis in the prevention of rebleeding in acute variceal hemorrhage: A randomized trial. Pharmacol Pharmacother. 2015;6(1):24-9. [ Links ]
21. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007;46(3):922-38. [ Links ]
22. de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2010;53(4):762-8. [ Links ]
23. De Franchis R. Expanding consensus in portal hypertension. J Hepatol. 2015;63(3):743-52. [ Links ]
24. Halabi SA, Sawas T, Sadat B, Jandali A, Halabi HA, Halabi FA, et al. Early TIPS versus endoscopic therapy for secondary prophylaxis after management of acute esophageal variceal bleeding in cirrhotic patients: a meta-analysis of randomized controlled trials. J Gastroenterol Hepatol. 2016;31(9):1519-26. [ Links ]
25. Zhang H, Zhang H, Li H, Zhang H, Zheng D, Sun CM, et al. TIPS versus endoscopic therapy for variceal rebleeding in cirrhosis: A meta-analysis update. J Huazhong Univ Sci Technolog Med Sci. 2017;37(4):475-85. [ Links ]
26. Qiao W, Ren Y, Bai Y, Liu S, Zhang Q, Zhi F. cyanoacrylate injection versus band ligation in the endoscopic management of acute gastric variceal bleeding: meta-analysis of randomized, controlled studies based on the PRISMA statement. Medicine. 2015;94(41):e1725. [ Links ]
27. Ríos Castellanos E, Seron P, Gisbert JP, Bonfill Cosp X. Endoscopic injection of cyanoacrylate glue versus other endoscopic procedures for acute bleeding gastric varices in patients with portal hypertension Cochrane Database Syst Rev. 2015;(5):CD010180. [ Links ]
Correspondencia
Raúl Timaná-Ruiz Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud, Lima, Perú Jirón Domingo Cueto 109, Jesús María, Lima, Perú
E-mail: raul.timana@essalud.gob.pe, rtimanar@gmail.com
Recibido: 16-2-2018
Aprobado: 19-3-2018
ANEXOS