Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.38 no.2 Lima Apr./Jun. 2018
ARTÍCULOS ORIGINALES
Validación de una prueba de amonio en aliento para el diagnóstico de la infección por Helicobacter pylori en pacientes del Hospital Cayetano Heredia
Validation of an ammonia breath test for the diagnosis of Helicobacter pylori infection in patients with dyspepsia at Hospital Cayetano Heredia
María Teresa Peralta Espejo1,a, Alejandro Bussalleu Rivera1,2,b, Vladimir Espinoza Ildefonso1,a, Claudia Meza Borja2,c, José Luis Rojas-Vilca1,d
1 Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Servicio de Gastroenterología, Hospital Cayetano Heredia. Lima, Perú.
a Médico cirujano, b Médico gastroenterólogo, c Licenciada en enfermería, d Médico epidemiólogo
RESUMEN
Objetivo: Determinar la validez diagnóstica de una prueba de amonio en aire espirado para la infección por Helicobacter pylori en pacientes a los que se le realiza una endoscopía digestiva alta en el Hospital Cayetano Heredia. Material y métodos: De abril a diciembre del 2014 se evaluó a 155 pacientes con una prueba de amonio en aliento y la evaluación histopatológica de las biopsias de estómago (considerada como el patrón de oro) tomadas durante la endoscopía. Los datos fueron analizados en Microsoft Excel y STATA 14 para construir una curva ROC. Resultados: Los pacientes fueron predominantemente mujeres (71%), con una edad media de 53 años (18-84) y una prevalencia de Helicobacter pylori de 51,6%. Al comparar la prueba de amonio en aire espirado con la prueba histológica se obtiene una sensibilidad de 70%, especificidad de 36%, valor predictivo positivo de 53,8%, valor predictivo negativo de 36%, índice de probabilidad positivo de 1,15 e índice de probabilidad negativo de 0,75. De acuerdo a la curva ROC, no se encontró un punto de corte óptimo con adecuados valores de sensibilidad y especificidad y el área bajo la curva es de 0,5517. Conclusiones: Esta prueba de amonio en aliento (aire espirado) no presenta poder diagnóstico y no se recomienda como una herramienta para el diagnóstico de la infección por Helicobacter pylori.
Palabras clave: Helicobacter pylori; Compuestos de amonio; Pruebas respiratorias (fuente: DeCS BIREME).
ABSTRACT
Objetive: To determine the diagnostic validity of an ammonia breath test for Helicobacter pylori infection in patients who undergo an upper gastrointestinal endoscopy at Hospital Cayetano Heredia. Material and methods: From April to December 2014, 155 patients were evaluated with the ammonia breath test and compared with a histological evaluation of the gastric biopsies as the gold standard. Data were evaluated using Microsoft Excel and STATA 14 to build a ROC curve. Results: The patients were predominantly female (71%), with a median age of 53 years (18-84) and a Helicobacter pylori prevalence of 51.6%. The ammonia breath test, when compared to the gastric biopsy has a 70% sensitivity, 36% specificity, 53.8% positive predictive value, 36% negative predictive value, 1.15 positive likelihood ratio and 0.75 negative likelihood ratio. According to the ROC curve, there is not an optimal cut off value and the area under the curve was 0.5517. Conclusions: The ammonia breath test evaluated on this study does not have diagnostic accuracy and is not recommended as a diagnostic tool for Helicobacter pylori infection.
Keywords: Helicobacter pylori; Ammonium compounds; Breath tests (source: MeSH NLM).
INTRODUCCIÓN
Helicobacter pylori (HP) es una bacteria espiralada, flagelada, Gram negativa, microaerofílica, y productora de catalasa, ureasa y oxidasa, que coloniza la mucosa del estómago (1-3). La ureasa hidroliza la urea luminal en amonio y permite neutralizar el ácido gástrico alrededor de ella y su entorno, favoreciendo su supervivencia (4). Múltiples pruebas diagnósticas aprovechan esta particular excesiva actividad de la ureasa de la bacteria para detectarla.
El HP es calificado por la Organización Mundial de la Salud como carcinógeno tipo I (1,5,6), es decir que existe suficiente evidencia de carcinogenicidad en humanos para el desarrollo de cáncer gástrico (5). Actualmente se reconoce que la infección es el mayor factor de riesgo para el desarrollo del cáncer de estómago y en ausencia de ella, 60-85% de los casos de adenocarcinoma gástrico distal no existirían (1,6). Sin embargo, posterior a la erradicación de la bacteria, aún puede ocurrir cáncer gástrico por lesiones premalignas como atrofia gástrica y metaplasia intestinal desarrolladas durante la infección, que pueden derivar en displasia y cáncer (7). En el Perú, es la neoplasia maligna más frecuente en hombres, la tercera en mujeres y la primera causa de muerte por cáncer en ambos sexos. La bacteria también es un factor de riesgo para el desarrollo de gastritis, dispepsia, úlcera péptica y maltoma gástrico (1,3,8-10). Entre el 10-15% de los infectados desarrolla una úlcera péptica en el largo plazo y el riesgo de desarrollarla es de 2 a 10 veces mayor en los infectados que en los no infectados (3).
En el Perú, en 1985, la prevalencia de la infección por HP era similar en los diferentes niveles socioeconómicos. Actualmente, en el nivel socioeconómico medio y alto ésta ha disminuido de 80 a 45%, así como de las enfermedades asociadas (1,11). En cambio, en el nivel socioeconómico bajo se mantiene una prevalencia de 80% (1,3). De acuerdo a los datos que maneja el Servicio de Gastroenterología del Hospital Cayetano Heredia (HCH), la prevalencia de infección en pacientes por HP es alrededor del 59% (12).
La estrategia prueba-y-trata, recomendada en el 4to Consenso Florencia/Maastrich del 2010, consiste en diagnosticar por métodos no invasivos la infección por HP en pacientes jóvenes con dispepsia y sin síntomas de alarma (13). Esto permite evitar los costos y la inconveniencia de una endoscopía en zonas con prevalencias de la infección mayores al 20% (10,11,13).
La prueba de aliento con urea marcada con C13 o C14, UBT por sus siglas en inglés, se basa en la actividad de la ureasa producida por la bacteria, teniendo alta sensibilidad y especificidad para identificarla (14). Ambos métodos son costosos y en el caso de C14, requiere administrar 1-μCi en forma de radiación beta (10,15). La dosis biológica efectiva es 0,3 rad/mCi, mucho menor a la radiación natural y al rango teratogénico para el feto. Sin embargo, se recomienda evaluar la relación riesgo-beneficio en gestantes y niños pequeños para evitar la prueba con C14 (11). Las pruebas de amonio en aire espirado (Ammonia Breath Test, ABT) son pruebas nuevas y relativamente poco estudiadas, sin embargo, algunos estudios concluyen que podrían utilizarse para diagnosticar la infección por HP. Se basan en la medición de amonio en lugar de carbono marcado para evaluar la actividad de la ureasa presente en HP (16,17).
La prueba del amonio espirado o también llamada prueba del amonio en aliento estudiada en esta investigación es una nueva prueba diagnóstica proveniente de Rusia, sin material radioactivo, mucho menos costosa que las UBT, fácil de usar y disponible para su uso masivo entre los gastroenterólogos del Perú (18,19). Si se comprueba la validez diagnóstica de esta nueva prueba, su uso permitiría reducir el costo de las pruebas de aliento, así como aumentar la rapidez y seguridad de las mismas.
Pocos pacientes se evalúan posteriormente a la finalización de un tratamiento anti HP. Un estudio realizado entre el 2003 y 2011 en la Clínica Médica Cayetano Heredia (CMCH), reporta que lo hace menos del 13% (20). Ello podría estar condicionado al alto costo de las pruebas diagnósticas para confirmar la erradicación, al pobre acceso a pruebas no invasivas en algunos centros, al falso temor que para evaluar la erradicación es necesaria una endoscopia, la falta de información adecuada por el personal médico, entre otros.
El objetivo general del presente estudio es determinar la validez diagnóstica de la prueba ABT a través de objetivos específicos que incluyen, determinar la sensibilidad, especificidad, VPP y VPN de la misma en la población estudiada. Además de explorar si puntos de corte alternativos al ya establecido resultan en un mejor perfil de sensibilidad y especificidad, mediante el uso de la curva ROC.
MATERIALES Y MÉTODOS
Entre abril y diciembre del 2014, se realizó este estudio analítico transversal con el objetivo de evaluar una nueva prueba ABT para la infección por HP. Se incluyó en el estudio a pacientes programados para una Endoscopía Gastrointestinal alta (EGD) ambulatoria en el Servicio de Gastroenterología del HCH en Lima, elegidos mediante un muestreo no probabilístico por conveniencia. La muestra calculada fue de 150 pacientes, basado en la estadística brindada por el Servicio de Gastroenterología con una prevalencia de infección por HP de 58,9% (12).
La muestra incluyó a pacientes con dispepsia, mayores de 18 años, en ayunas por más de 10 horas, sin tratamiento previo para HP, sin consumo durante las dos últimas semanas de antibióticos, bismuto, antiácidos e IBP. Se excluyó a pacientes con hemorragia digestiva alta activa, insuficiencia renal, cirrosis hepática, diagnóstico histológico o sospecha endoscópica de cáncer gástrico y negativa del paciente a participar en el estudio o de firmar el consentimiento informado.
La investigación se basó en los resultados de dos herramientas, la prueba diagnóstica ABT y la evaluación histológica de las biopsias tomadas durante la EGD. Esta prueba ABT, se basa en la actividad de la ureasa de HP, evaluada por el cambio de color en un tubo indicador sensible a amonio, y tiene dos partes: la primera, previo cepillado de dientes, mide el amonio basal en aire espirado durante 7 minutos y, la segunda, mide el amonio en aire espirado durante 7 minutos inmediatamente luego de la ingesta de 0,5 g de urea. Según las indicaciones de la casa productora de la prueba, esta es positiva si hay un incremento de la longitud del cambio de color del tubo indicador mayor o igual a tres milímetros (Figura 1) (11).
Durante la EGD se tomó al menos 3 biopsias de mucosa gástrica (antro, cuerpo y curvatura mayor) como parte del manejo de rutina. Las biopsias fueron obtenidas por fórceps y depositadas en un frasco con formaldehido para ser enviadas al Servicio de Patología del HCH. Posteriormente se incluyeron en parafina, se realizaron cortes de 5 micras de espesor teñidos con hematoxilina-eosina y tinciones de plata para evaluarlas con un microscopio óptico por patólogos del HCH. La positividad de la prueba histológica se define por la visualización de HP en el corte y se reporta como positivo o negativo. La prueba histológica se utilizó como estándar de oro.
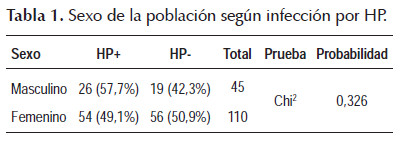
Inicialmente se analizó las variables que definen las características poblacionales, la edad, el sexo y el resultado de la prueba histológica en Microsoft Excel. Posteriormente, los resultados de la prueba histológica y ABT (utilizando el punto de corte recomendado de 3mm) fueron colocados en una tabla de contingencia
o de doble entrada. Se calculó la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), índice de probabilidad positivo y negativo (LHR+ y LHR-) de la prueba ABT comparándola con el estándar de oro.
Finalmente, basados en los valores de la diferencia obtenida entre las mediciones basales y posterior a la ingesta de urea de la prueba ABT, se graficó la curva ROC con STATA 14 y se calculó el área bajo la curva (AUC) para poder determinar el poder diagnóstico de la prueba (14).
RESULTADOS
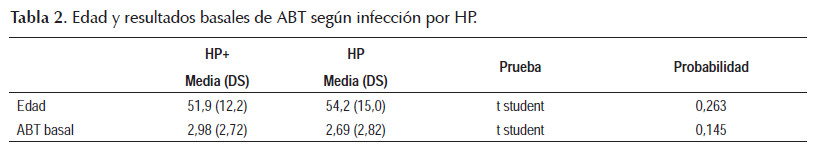
Durante el periodo de estudio se incluyó a 164 pacientes, de los cuales se excluyeron a nueve, 6 de ellos por falta de resultado histológico, 2 por diagnóstico histológico de cáncer de estómago y a uno por imposibilidad para evaluar el resultado de la prueba ABT debido a una medición basal muy grande. De los 155 pacientes restantes, 110 fueron mujeres (71%) y 45 hombres (29%). La edad promedio en mujeres y hombres es 53,1 años y 52,9 años, respectivamente, y tienen un promedio de edad global de 53 años (rango de 18 a 84 años). Según el resultado histológico, 80 pacientes son HP positivo (51,6%) y 75 son HP negativo (48,4%). Los pacientes HP positivo tienen una media de edad de 51,9 años y los pacientes HP negativo tienen una media de edad de 54,2 años, sin diferencia significativa (prueba t student, p>0,01). Al evaluar las mediciones de amonio basal con la prueba ABT se obtiene un promedio de 2,98 para pacientes HP+ y un promedio de 2,69 para pacientes HP-, sin diferencia significativa (prueba t student, p>0,01) (Tabla 1 y 2).
De acuerdo a los resultados de la prueba ABT, los valores de la diferencia entre medición de amonio basal-posterior a ingesta de urea tienen una distribución no normal (Shapiro- Wilk, p<0,001). Esta diferencia basal-posterior no tuvo una diferencia estadísticamente significativa entre los pacientes HP+ y HP- (U Mann-Whitney, p=0,151).
Considerando el punto de corte de 3mm en la diferencia basal-posterior para determinar un resultado positivo (según recomendaciones del fabricante), 104 (67,1%) pacientes son positivos y 51 (32,9%) negativos. Por lo tanto, la prueba ABT tiene una sensibilidad de 70% (IC 95%: 62,8-77,2%), especificidad de 36% (IC 95%: 28,4-43,6%), valor predictivo positivo (VPP) de 53,8%, valor predictivo negativo (VPN) de 36%, LHR+ 1,15 (IC 95%: 0,92-1,45) y LHR- 0,75 (IC 95% 0,471,19) (Tabla 3).
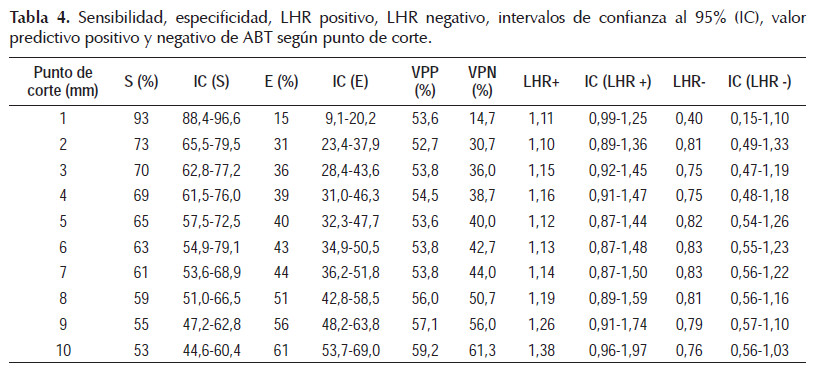
Adicionalmente, se calculó 9 puntos de corte desde 1 mm a 10 mm para la prueba ABT. Con una sensibilidad máxima del 93% (IC 95%: 88,4-96,6%), pero especificidad de 15% (IC 95%: 9,1-20,2%) para el punto de corte de 1 mm. La especificidad máxima fue de 61% (IC 95%: 53,7-69%) y la sensibilidad bajó a 53% (IC 95%: 44,6-60,4%) para el punto de corte de 10 mm (Tabla 4).
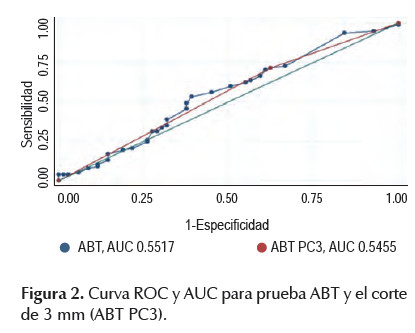
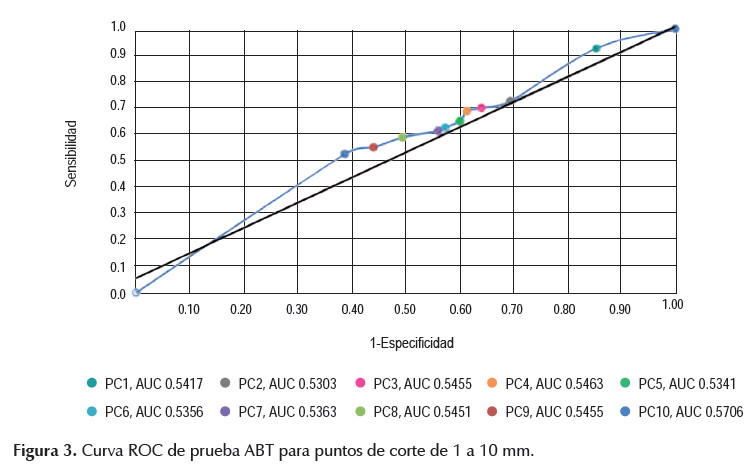
Para evaluar el poder diagnóstico de la prueba, se graficó la curva ROC. La curva muestra valores bajos de sensibilidad y especificidad, se encuentra muy cerca a la diagonal de la gráfica y el área bajo esta (AUC) es de 0,5517 (Figura 2). El área bajo la curva del punto de corte de 3 mm, es inferior al de la curva total, con 0,5455. (Figura 2). Se realizó una segunda curva ROC con los puntos de corte de 1 a 10 mm que muestran áreas bajo la curva pequeñas. El punto de corte de 10 mm muestra la mejor área bajo la curva de 0,5706, aunque de bajo poder diagnóstico (Figura 3).
DISCUSIÓN
Los resultados de la prueba del amonio en aliento o en el aire espirado (ABT) no permiten diferenciar adecuadamente entre los pacientes con HP+ de los HP- según la prueba histológica o estándar de oro. Esto se evidencia por la diferencia estadísticamente no significativa en los resultados de la diferencia basal-posterior entre ambos grupos de pacientes. Los valores de la diferencia basal-posterior nos permiten definir si la prueba ABT es positiva (ABT+). Por lo tanto, los pacientes HP+ están distribuidos de manera similar y aleatoria en los grupos de pacientes ABT+ y ABT-(21).
El gráfico de la curva ROC muestra una curva cercana a la diagonal del gráfico y con un AUC bajo de 0,5517. Incluso, al cambiar el punto de corte a 10 mm con los valores más altos de VPP y VPN, el AUC permanece bajo con 0,5706. Esto demuestra que la prueba ABT no tiene una adecuada capacidad discriminativa. La diagonal con un área de 0,5, similar a la gráfica y AUC obtenida, corresponde a una prueba que indica resultados aleatorios y sin valor diagnóstico (22).
Debido a la prevalencia elevada de HP en la muestra estudiada, se espera que el VPN disminuya y que el VPP aumente (22). Sin embargo, ambos valores son bajos y la prevalencia no debería afectar la sensibilidad y especificidad. A pesar de ello la sensibilidad, especificidad y todos los parámetros estudiados evidencian una prueba diagnóstica deficiente.
Daino et al., en el 2015 en Argentina, evaluaron una prueba ABT basada en un sensor electroquímico para medir el amonio; encontraron una especificidad de 88,89% y sensibilidad de 71,43% al compararla con la prueba histológica y ureasa como pruebas de oro (23). Kearney et al, en el 2002 en EEUU, evaluaron otra prueba ABT basada en el cambio de color asociado al pH medido con un sensor de fibra óptica, y obtuvieron una sensibilidad y especificidad del 100% al compararla con la prueba UBT C14 como estándar de oro (17). Si bien, ambos resultados sugieren la utilidad de las pruebas ABT, evaluaron muestras muy pequeñas de 23 y 13 pacientes respectivamente. Nuestro estudio, basado en la observación directa del cambio de color de una barra sensible a amonio, usó una muestra adecuada y no ha mostrado utilidad para el diagnóstico.
Un estudio, realizado en Rusia el 2011, compara la prueba Xelic que mide amonio espirado con histología y PCR, pero no encontró correlación con la actividad de gastritis evaluada histológicamente, la prueba histológica y el PCR para HP, por lo que no recomiendan su uso para el diagnóstico de esta infección bacteriana(24). Esta prueba es producida por la misma empresa que la prueba ABT evaluada en el presente trabajo. De acuerdo a los resultados de este estudio, la prueba ABT evaluada no es recomendable para el diagnóstico de la infección por Helicobacter pylori. Es deseable continuar estudios con pruebas no invasivas, económicas y rápidas para el diagnóstico de HP y evaluar pruebas ABT que midan cuantitativamente el amonio en aire espirado en la población peruana. Asimismo, se sugiere que se realicen estudios en población peruana con las pruebas diagnósticas que se ofrecen al personal médico para uso en pacientes peruanos.
Conflictos de intereses: No existe un potencial conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Ramirez A, Sanchez R. Helicobacter pylori y cáncer gástrico. Rev Gastroenterol Peru. 2008;28(3):258-66. [ Links ]
2. Goodwin CS, Worsley BW. Microbiology of Helicobacter pylori. Gastroenterol Clin North Am. 1993;22(1):5-19. [ Links ]
3. Prochazka R, Salazar FA, Barriga E, Salazar F. Prevalencia de Helicobacter pylori en una clínica privada de Lima. Sensibilidad de las biopsias del antro y el cuerpo, y la prueba rápida de la ureasa. Rev Gastroenterol Peru. 2010;30(1):33-9. [ Links ]
4. Mobley HL. The role of Helicobacter pylori urease in the pathogenesis of gastritis and peptic ulceration. Aliment Pharmacol Ther. 1996;10 Suppl 1:57-64. [ Links ]
5. Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [ Links ]
6. Wroblewski L, Peek R. Helicobacter pylori in gastric carcinogenesis: mechanisms. Gastroenterol Clin N Am. 2013;42(2):285-98. [ Links ]
7. Crowe SE. Helicobacter infection, chronic inflammation, and the development of malignancy. Curr Opin Gastroenterol. 2005;21(1):32-8. [ Links ]
8. Eck M, Schmausser B, Haas R, Greiner A, Czub S, Müller- Hermelink HK. MALT-type lymphoma of the stomach is associated with Helicobacter pylori strains expressing the CagA protein. Gastroenterology. 1997;112(5):1482-4. [ Links ]
9. Nomura A, Stemmermann GN, Chyou PH, Perez-Perez GI, Blaser MJ. Helicobacter pylori infection and the risk for duodenal and gastric ulceration. Ann Intern Med. 1994;120(12):977-81. [ Links ]
10. Bentur Y, Matsui D, Koren G. Safety of 14C-UBT for diagnosis of Helicobacter pylori infection in pregnancy. Can Fam Physician. 2009;55(5):479-80. [ Links ]
11. Ramirez A, Sánchez R. Contribución de Latinoamérica al estudio del Helicobacter pylori. Acta Gastroenterol Latinoam. 2009;39(3):197-218. [ Links ]
12. Valdivieso M, Bussalleu A, Sexton R, Boehnke K, Osorio S, Novoa I, et al. Clinical, Epidemiologic, and Genomic Studies (SWOG S1119) of Helicobacter pylori in Lima, Peru: Role of Contaminated Water. J Cancerol. 2016;3(2):52-63. [ Links ]
13. Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, et al. Management of Helicobacter pylori infection- The Maastrich IV/Florence Consensus Report. Gut. 2012;61(5):646-64. [ Links ]
14. Howden CW, Hunt RH. Guidelines for the management of Helicobacter pylori infection. Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology. Am J Gastroenterol. 1998;93(12):2330-8. [ Links ]
15. Leide-Svegborn S, Stenström K, Olofsson M, Mattsson S, Nilsson LE, Nosslin B, et al. Biokinetics and radiation doses for carbon-14 urea in adults and children undergoing the Helicobacter pylori breath test. Eur J Nucl Med. 1999;26(6):573-80. [ Links ]
16. Dun CDR, Blac M, Cowell DC, Penaul C, Ratcliffe NM, Spence R, et al. Ammonia vapour in the mouth as a diagnostic marker for Helicobacter pylori infection: preliminary 'proof of principle' pharmacological investigations. Br J Biomed Sci. 2001;58(2):66-75. [ Links ]
17. Kearney D, Hubbard T, Putnam D. Breath ammonia measurement in Helicobacter pylori infection. Dig Dis Sci. 2002;47(11):2523-30. [ Links ]
18. Association of Medicine and Analytics. HELIC Ammonia Breath Test (HELIC ABT). Disponible en URL: http://www. amamed.ru/en/index.php?i=8 [ Links ]
19. Laboratorio Clínico ROE. Análisis: PY-test, Helicobacter pylori. Disponible en URL: https://www.labroe.com/roe/roe_ analisis_detalle_home.aspx?ca=I4B0t0KYh/Q= [ Links ]
20. Bernuy P, Salinas C, Benites H, Bussalleu A, Ojeda M, Montes P, et al. Eficacia de los tratamientos para la infección por Helicobacter pylori en una clínica particular. Rev Soc Peru Med Interna. 2013;26(3):115-20. [ Links ]
21. Rivas R, Moreno J, Talavera J. Investigación clínica XVI. Diferencias de medianas con la U de Mann-Whitney. Rev Med Inst Mex Seguro Soc. 2013;51(4):414-9. [ Links ]
22. Hajian-Tilaki K. Receiver Operating Characteristic (ROC) Curve Analysis for Medical Diagnostic Test Evaluation. Caspian J Intern Med. 2013;4(2):627-35. [ Links ]
23. Daino D, Soifer L, Pedestá J, Rome J. Prueba piloto para la detección de Helicobacter pylori con test de amoníaco en aire espirado. Acta Gastroenterol Latinoam. 2015;45(1):12-7. [ Links ]
24. Sukhanov AV, Pikerski IE, Sa futdinov RG, Makarov AA, Frolov SV. [Comparison of various diagnostic methods of Helicobacter infection]. Eksp Klin Gastroenterol. 2011;(5):8- 15. [Article in Russian] [ Links ]
Correspondencia:
María Teresa Peralta Espejo
Av. Del Sur 208, dpto. 502, Chacarilla, Surco. Lima, Perú.
E-mail maria.peralta.e@upch.pe, mtperaltae@gmail.com
Recibido: 07-09-2017
Aprobado: 19-02-2018