Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.38 no.3 Lima jul./set. 2018
ARTÍCULOS ORIGINALES
Valor pronóstico de la razón de ganglios metastásicos en pacientes con cáncer gástrico operados
Prognostic value of lymph node ratio (LNR) in patients who underwent radical gastrectomy
Andrés Guevara Jabiles1, Eloy Ruiz Figueroa1, Francisco Berrospi Espinoza1, Iván Chávez Passiuri1, Frank Young Tabusso1, Carlos Luque Vásquez1, Ebert Poquioma Rojas2, Raul Mantilla3, Eduardo Payet Meza1
1 Departamento de Cirugía Oncológica Abdominal, Instituto Nacional de Enfermedades Neoplásicas. Lima, Perú.
2 Departamento de Epidemiología y Estadística, Instituto Nacional de Enfermedades Neoplásicas. Lima, Perú.
3 Departamento de Investigación, Instituto Nacional de Enfermedades Neoplásicas. Lima, Perú.
RESUMEN
Objetivo: El objetivo del estudio fue evaluar el valor pronóstico de la razón de ganglios metastásicos (LNR) en los pacientes con cáncer gástrico operados de gastrectomía radical D2. Materiales y métodos: Se revisaron retrospectivamente las historias clínicas de 498 pacientes del Instituto Nacional de Enfermedades Neoplásicas (INEN) entre los años 2008 y 2011 que cumplían los criterios de inclusión y exclusión. Se dividieron en 4 grupos de acuerdo a su LNR; LNR0: 0, LNR1: 0-0,13, LNR2: 0,14-0,4 y LNR3: ≥ 0,4. Resultados: La mediana de ganglios resecados fue de 42 [rango 8-153] y 494 (99,2%) pacientes tuvieron más de 15 ganglios resecados. 340 (68,5%) pacientes presentaron compromiso ganglionar y 175 (35,1%) fueron clasificados como pN3, 94 (18,5%) pN2 y 72 (14,5%) como pN1. 285 (57,2%) pacientes tuvieron estadío III. Hubo diferencias significativas entre los grupos del LNR en las curvas de sobrevida global (SV) y de sobrevida libre de enfermedad (SVLE) (p <0,05). Según los grupos del LNR existen diferencias según la edad, el tamaño de la lesión, el nivel de compromiso ganglionar (pN), la clasificación Lauren, la invasión vascular y la invasión linfática (p <0,05). El LNR es un factor pronóstico importante para explicar el tiempo de muerte (LNR3: HR: 6,77, 95%CI: 3,346-13,706, p <0,05) y de recurrencia (LNR3: HR: 5,3, 95%CI: 2,104-13,439, p <0,05). Conclusión: El LNR es un factor pronóstico independiente importante en los pacientes operados de gastrectomía radical con linfadenectomia D2 por cáncer gástrico.
Palabras clave: Cáncer gástrico; Linfadenectomía; Ganglios linfáticos (fuente: DeCS BIREME).
ABSTRACT
Objective: The study objective was to evaluate the prognostic value of lymph node ratio (LNR) in patients with gastric cancer who underwent radical gastrectomy D2. Materials and methods: We reviewed retrospectively 498 medical records of patients with gastric cancer who were attended at the National Institute of Neoplastic Diseases (INEN) between 2008 and 2011and met the inclusion and exclusion criteria. They were distributed into 4 groups according to their LNR, LNR0: 0, LNR1: 0-0.13, LNR2: 0.14-0.4 and LNR3: ≥ 0.4. Results: The median of resected lymph nodes was 42 [range; 8.153] and 494 (99.2%) patients had more than 15 lymph nodes retrieved. 340 (68.5%) patients had lymph node involvement and 175 (35.1%) cases (35.1%) were classified as pN3, 94 (18.5%) pN2 and 72 (14.5%) were pN1. 285 (57.2%) patients had stage III disease. There was a significant difference between groups of LNR in overall survival (OS) and disease-free survival (DFS) curves (p <0.05). According to the LNR groups there was significant differences according to age, lesion size, lymph node involvement (pN), Lauren classification, vascular invasion and lymphatic invasion (p <0.05). LNR is an important prognostic factor to explain the time of death (LNR3: HR: 6.77, 95% CI: 3.346-13.706, p <0.05) and recurrence time (LNR3: 95% CI: 2.104-13.439, p <0.05). Conclusion: LNR remains as an important independent prognostic factor in patients undergoing radical gastrectomy and D2 lymphadenectomy for gastric cancer.
Keywords: Gastric cancer; Lymphadenectomy; Lymph nodes (source: MeSH NLM).
INTRODUCCIÓN
El cáncer gástrico es una de las neoplasias malignas más frecuentes y la segunda con mayor mortalidad a nivel mundial, con incidencias más altas en Asia y Latinoamérica a diferencia de América del Norte y Europa (1). En el Perú, el cáncer gástrico ocupa los primeros lugares con una tasa de incidencia de 17,1 casos por 100 000 habitantes y representa la primera causa de muerte relacionada al cáncer en Lima Metropolitana (2,3) por lo que su diagnóstico oportuno y su valoración pronóstica son de suma importancia. El sistema de estadiaje propuesto por la International Union for Cancer Control (UICC) basado en el compromiso de la profundidad de la pared gástrica del tumor primario (T), el número los ganglios linfáticos regionales comprometidos (N) y la presencia o no de metástasis a distancia (M) es la mejor herramienta pronóstica a la actualidad y es utilizado por la American Joint Commitee on Cancer (AJCC) y por la Japanese Gastric Cancer Association (JGCA) para proveer precisión predictiva de la sobrevida global (SVG) y sobrevida libre de enfermedad (SVLE) según su estadio clínico-patológico. Sin embargo, existen otros factores asociados que podrían mejorar la precisión predictiva de sobrevida entre 75,4% hasta un 87% (4,5), entre ellos; factores pronósticos propios del tumor como la localización, el tipo y el grado histológico, la invasión linfovascular, el tamaño tumoral, entre otros(6,7) y propios de la cirugía como los márgenes quirúrgicos, el número de ganglios resecados y el tipo de la disección ganglionar a pesar de que la gastrectomía radical con linfadenectomía D2 es actualmente el procedimiento estándar para el tratamiento de cáncer gástrico a pesar de la morbimortalidad registrada en algunos países occidentales (8-11).
El compromiso ganglionar es uno de los factores predictivos más importantes en cáncer gástrico (11) por lo que luego de múltiples revisiones, la UICC sugiere la evaluación de al menos 15 ganglios para evitar la migración de estadios clínicos por subestimación y así mejorar la predicción pronóstica de los pacientes operados (4). La controversia sobre el valor del sistema de estadiaje TNM surge al valorar piezas operatorias con menos de 15 ganglios resecados por lo que se plantean nuevos métodos de predicción pronóstica como el LNR, considerado por algunos autores como un mejor indicador pronóstico en comparación con su clasificación numérica pN (12-20). El valor pronótico del LNR ha sido evaluado por diversos trabajos de origen predominante asiático y ha sido propuesto como un sistema de clasificación alternativa al pN, sobretodo en los pacientes con menos de 15 ganglios resecados, con la finalidad de evitar el fenómeno de migración de estadio al realizar una disección ganglionar limitada(13-19). Su utilidad en los pacientes con linfadenectomía D2 con más de 15 ganglios resecados es controversial por lo que se plantea como objetivo analizar el valor pronóstico de la razón de ganglios metastásicos en los pacientes operados de gastrectomía radical D2 por cáncer gástrico.
MATERIALES Y MÉTODOS
La recolección de datos se realizó de forma retrospectiva de las historias clínicas los pacientes del INEN que tuvieron gastrectomía radical con linfadenectomía D2 entre enero del 2008 y diciembre del 2011. Los criterios de inclusión fueron; pacientes con cáncer gástrico con confirmación histopatológica previa a la cirugía, operados de gastrectomía radical con infadenectomía D2 con intención curativa (R0 definida como resección microscópica libre de enfermedad) de acuerdo a lo descrito por la JGCA (5) por cirujanos oncólogos de experiencia. Los criterios de exclusión fueron; historia clínica y datos incompletos del paciente, márgenes quirúrgicos comprometidos, gastrectomías paliativas por enfermedad metastásica identificada en el preoperatorio o intraoperatorio, gastrectomías modificadas por cáncer gástrico precoz, tratamiento neoadyuvante, mortalidad peri operatoria y sobrevida menor de 6 meses. Se recolectaron un total de 679 casos de los cuales 181 fueron excluidos del estudio por lo criterios mencionados. Se realizó el análisis estadístico final con los 498 pacientes.
Las características clinicopatológicas estudiadas fueron; edad y género; de acuerdo a la JCGC y la AJCC (4,5); ubicación del tumor, el tamaño tumoral, el tipo histológico, el grado histológico, el aspecto macroscópico según el Bormann, la profundidad de invasión tumoral (pT), el compromiso linfovascular, el número de ganglios resecados, el número de ganglios comprometidos, el compromiso ganglionar (pN), el tipo de gastrectomía radical (total o subtotal distal), tratamiento adyuvante, sobrevida libre de enfermedad y sobrevida global. El TNM según la UICC/AJCC de la 7ma edición (4).
El seguimiento de los pacientes fue a través de examen físico cada 3 meses, ecografía abdominal completa o tomografía computarizada abdominopélvica (TAC AP) y radiografía de tórax cada 6 meses durante los primeros 2 años, luego anual hasta las 5 años y estudio endoscópico al año y a los 3 años de la cirugía. Se realizó un análisis descriptivo a través de frecuencias, porcentajes y medidas de tendencia central. Se tomó como punto de corte (2/15) y (6/15) para la reclasificación de compromiso ganglionar utilizando el LNR 0, 0,13 y 0,40 y se dividieron en 4 grupos; LNR0, conformado por lo que tienen una razón de cero; LNR1, con una razón mayor de cero y menor o igual a 0,13; LNR2, con razón mayor de 0,13 y menor o igual a 0,40 y finalmente LNR3, con una razón mayor de 0,40 debido a su mayor capacidad discriminatoria según los mismos puntos de cortes utilizados en el estudio de Chen S (13). Asociaciones entre características cualitativas y los grupos definidos se evaluaron con la prueba Chi-cuadrado o la prueba exacta de Fisher, según correspondía; diferencias entre los cuatro grupos respecto a una característica cuantitativa se probaron con el ANOVA o su correspondiente prueba no paramétrica (previa evaluación de la normalidad a través de la prueba de Kolmogorov-Smirnov). El tiempo de seguimiento para la sobrevida global comprendió desde la fecha de cirugía hasta la fecha de muerte (evento de interés) o la búsqueda en el sistema de RENIEC hasta marzo 2017, y para la sobrevida libre de enfermedad comprendió desde la fecha de cirugía hasta la fecha de último control, muerte sin recurrencia o recurrencia (evento de interés); pacientes que no cumplieron los eventos de interés fueron considerados como censuras. Curvas de sobrevida se estimaron con el método de Kaplan-Meier y diferencias en la sobrevida según características se evaluaron con el logrank test. El valor pronóstico de la razón de ganglios linfáticos se evaluó con la regresión de Cox. Un valor p<0,05 se consideró para una asociación o diferencia significativa. En el análisis de los datos se usó el programa R (R CoreTeam (2017). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria.URL https:// www.R-project.org/). La base de datos creada no incluyó la identidad de los pacientes y la información obtenida se mantuvo en completa confidencialidad sin infringir la declaración de Helsinki.
RESULTADOS
Se estudiaron 498 casos con cáncer gástrico que fueron operados de gastrectomía radical estandarizada D2 con intención curativa y se analizó el valor pronóstico del LNR.
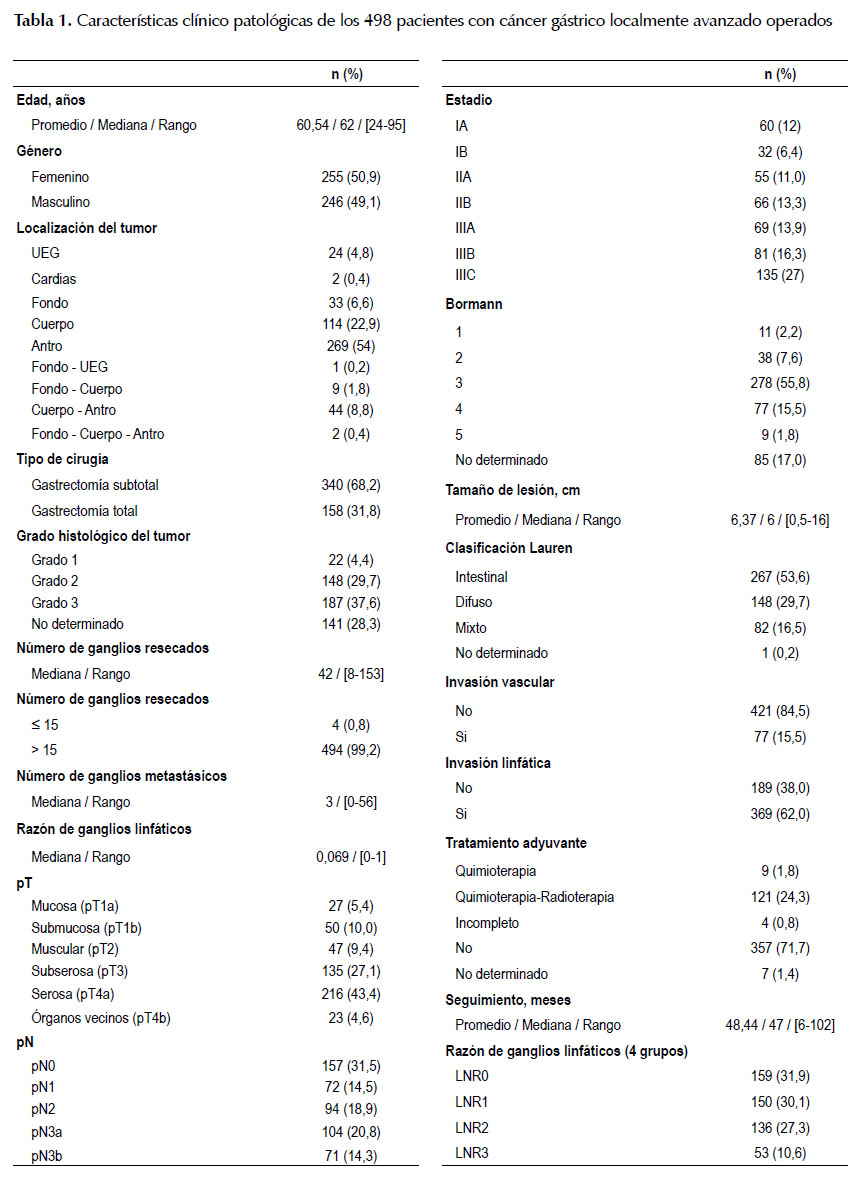
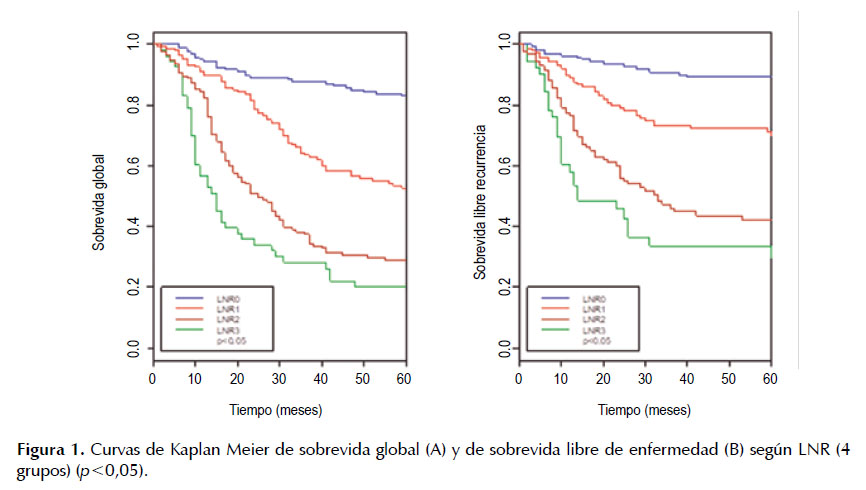
La Tabla 1 describe las características clínico patológicas de estos pacientes. La mediana de ganglios resecados fue de 42 [rango, 8 - 153], y 494 (99,2%) pacientes tuvieron más de 15 ganglios resecados. El 50% de pacientes presentó más de 3 ganglios comprometidos [rango, 0 - 56 ganglios comprometidos]. Hubo 175 casos (35,1%) con pN3 (20,8% con pN3a y 14,3% con pN3b), 94 (18,9%) pacientes presentaron pN2, 72 (14,5%) tuvieron pN1 y 157 casos (31,5%) con pN0. En la reclasificación por LNR; 159 (31,9%), 150 (30,1%), 136 (27,3%) y 53 (10,6%) tuvieron LNR0, 1, 2 y 3 respectivamente. El promedio de seguimiento del total de pacientes fue de 48,4 meses (rango de 6 a 102 meses), una sobrevida global de 51,6% y una sobrevida libre de enfermedad de 66% a los 5 años. Las curvas de SV y SVLE para los cuatro grupos definidos para la reclasificación ganglionar según el LNR evidenció una diferencia significativa entre los grupos tanto en la SV como en la SVLE (Figura 1).
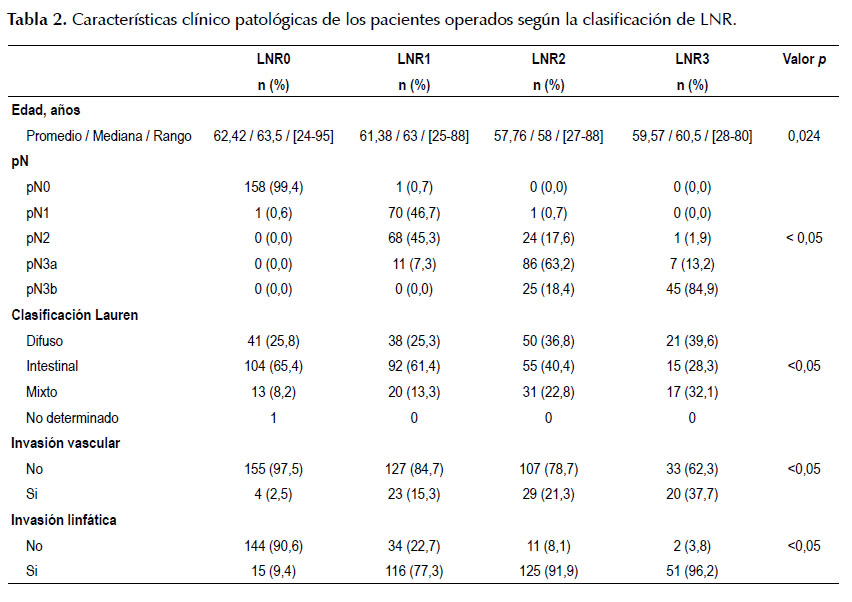
Se evidenció una diferencia significativa entre los pacientes de los cuatro grupos definidos respecto a la edad y el tamaño de la lesión; pacientes del grupo LNR0 tuvieron un promedio de edad mayor y un tamaño de lesión promedio menor. Se encontró una asociación significativa (p<0,05) del nivel de compromiso ganglionar (pN), la clasificación Lauren, la invasión vascular y la invasión linfática con los cuatro grupos definidos. Hubo una mayor proporción de pacientes con nivel de compromiso ganglionar N3a o N3b en los grupos LNR2 y LNR3 que en los grupos LNR0 y LNR1 (81,6% y 98,1% vs 0,0% y 7,3%, respectivamente).
Una mayor proporción de pacientes con tipo difuso o mixto en los grupos LNR2 y LNR3 que en los grupos LNR0 y LNR1 (59,6% y 71,7% vs 34% y 38,6%, respectivamente). Una mayor proporción de tumores con invasión vascular en el grupo LNR3 que en los otros grupos (37,7% vs 2,5%, 15,3% y 21,3%, respectivamente) y una mayor proporción de tumores con invasión linfática en el grupo LNR3 que en los otros grupos (96,2% vs 9,4%, 77,3% y 91,9%, respectivamente) (Tabla 2).
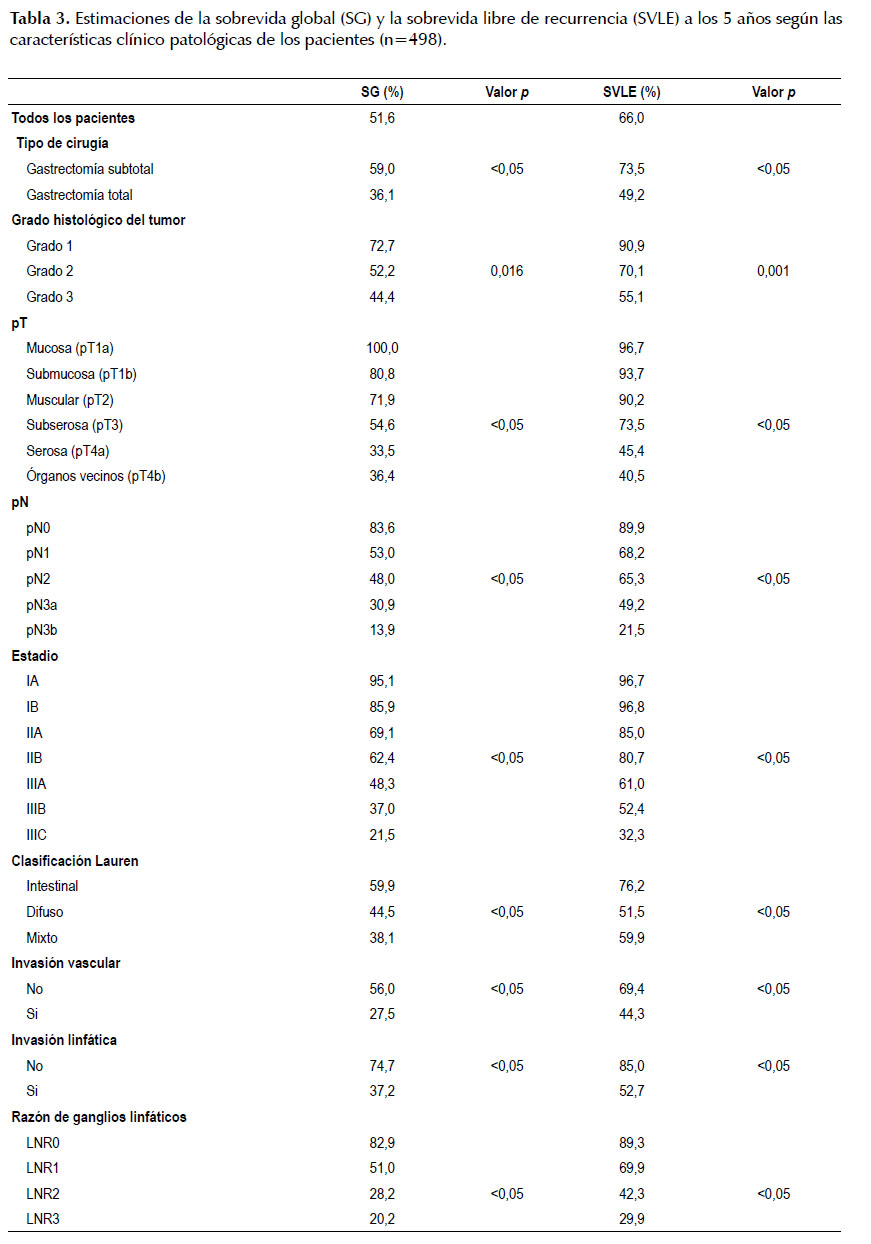
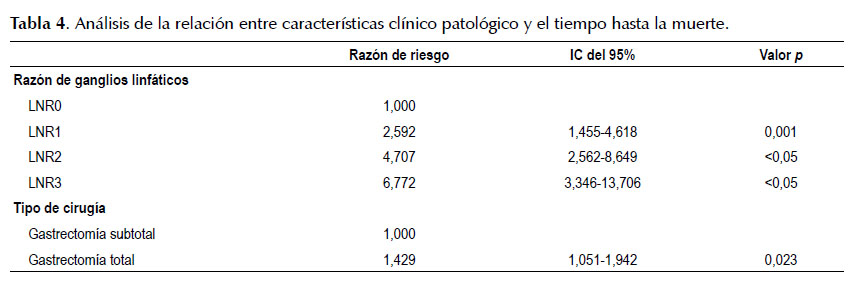
Existen además diferencias significativas (p <0,05) en la SV y en la SVLE según el tipo de cirugía realizada, el grado histológico del tumor, la profundidad de invasión de la pared gástrica (pT), el nivel de compromiso ganglionar (pN), LNR, el estadio clínico, la clasificación de Lauren, la invasión vascular y la invasión linfática. La SV a los 5 años fue de 82,9%, 51%, 28,2% y 20,2% y la SVLE a los 5 años fue de 89,3%, 69,9%, 42,3% y 29,9% según LNR 0, 1, 2 y 3 respectivamente (Tabla 3).
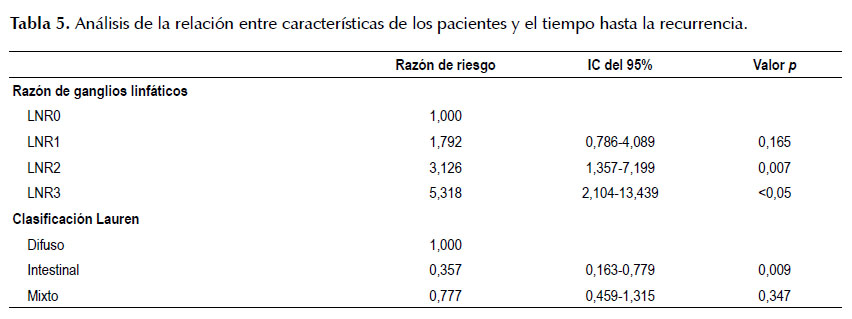
El LNR según los cuatro grupos definidos es un factor pronóstico importante ya que aumenta hasta en 2.5 veces el riesgo de muerte si el paciente es del grupo LNR1 respecto al grupo LNR0, en 4,7 veces el riesgo si es del grupo LNR2 y en 6,7 veces si es del grupo LNR3 (HR: 6,77, 95%CI: 3,346-13,706, p <0,05) (Tabla 4). De igual manera sucede para explicar el tiempo libre de enfermedad aumentando hasta en 3 veces el riesgo de recurrencia si el paciente es del grupo LNR2 respecto al grupo LNR0 y en 5,3 veces si es del grupo LNR3 (HR: 5,3, 95%CI: 2,104-13,439, p <0,05 (Tabla 5).
DISCUSIÓN
El LNR es considerado como un método de estadificación al igual que el método cuantitativo de pN de la AJCC como concluyó Bilici et al. en el año 2010 al igual que otros autores incluyendo un porcentaje importante de casos con linfadenectomias D0/D1 o con menos de 15 ganglios resecados; sin embargo, Bilici no demostró superioridad de un método sobre otro (20).
Por otro lado, Zhang B-Y et al. comprobó que el LNR era mejor factor pronóstico que el pN en los casos con menos de 15 ganglios resecados más no en los casos con más de 15 ganglios probablemente por el escaso número de pacientes incluidos con linfadenectomias adecuadas (60% de su serie) (12). Las linfadenectomias D2 aumentan el número de ganglios resecados en la pieza operatoria y por lo tanto disminuye el riesgo de fenómeno de migración de estadio clínico mejorando la precisión en la clasificación pN como lo señala Marchet A et al.(14) como se observa en nuestro estudio ya que el 99% de los pacientes estudiados con linfadenectomía D2 presentaron más de 15 ganglios examinados. Esta reducción del riesgo de subestadiaje debido a una adecuada linfadenectomia optimiza el valor pronóstico del LNR ya que se analiza sobre una población homogénea como la de nuestro estudio y corrobora que el LNR es un método de estadifiación ganglionar aplicable en pacientes con más de 15 ganglios examinados con diferencias significativas ya que se observa que la SV y SVLE es menor a medida que aumenta la proporción de ganglios metastásicos (HR 2,59: LNR1 vs. HR: 6,77: LNR3).
Es importante demostrar el valor pronóstico del LNR no solo para mejorar su estadificación sino también porque demarca un valor biológico propio de acuerdo a la reacción inmunológica de cada paciente como lo describe Yamashita et al. (21) en su estudio en donde menciona que el LNR se correlaciona con la expresión del EGFR, siendo esta una molécula que afecta la reacción inmunológica para el desarrollo del cáncer en el paciente (22). De igual manera el LNR determina que pacientes presentan mejor predisposición a una respuesta adyuvante, ya sea con quimioterapia o quimio radioterapia (23). Kim demostró en sus estudios realizados en pacientes tratados con gastrectomía radical con linfadenctomía D2, que el tratamiento adyuvante para los pacientes con un alto LNR (≥ 0,25) presentaban mayor beneficio con mejor sobrevida libre de enfermedad frente a los que no recibieron o frente a los que presentaban un valor de LNR menor a 0,25(24,25).
La heterogeneidad de los valores para la clasificación del LNR en pacientes con cáncer gástrico es aún controversial. Sin embargo, a pesar de los diversos puntos de corte utilizados en múltiples estudios, el LNR persiste como factor pronóstico (26,27). Los estudios con mayor número de casos reportados fueron el estudio de Chen S et al. en el 2012 (13) quien utilizó los valores de 0%, 13% (2/15) y 40% (6/15) y el estudio de Zhao L-Y et al. (19) en el 2016 quien utilizó los valores de 0%, 15% y 40% según el sistema X-tile plot. En este último además se comparó con otros valores; ambos estudios concluyeron que el LNR representa un importante valor pronóstico que podría mejorar el actual método de pTNM de la AJCC. En nuestro estudio se utilizaron los puntos de corte 0%, 13% y 40% por la similitud en las características clinicopatológicas que presentaron los pacientes de los estudios asiáticos y se observa que existen diferencias significativas en la sobrevida de los 4 grupos sin embargo, el estudio no compara ambas clasificaciones por lo que no se puede concluir la superioridad de un método sobre otro. La principal limitación es el resultado propio de un estudio restrospectivo no randomizado. En conclusión, la razón de los ganglios metastásicos sobre los ganglios resecados es un factor pronóstico independiente importante en los pacientes operados de gastrectomía radical con linfadenectomía D2 con más de 15 ganglios resecados por cáncer gástrico. Estos resultados demuestran que el fenómeno de migración de estadio no es el único motivo para emplear el LNR en el sistema de estadificación.
Declaración de conflicto de interés: Los autores declaramos no presentar conflictos de intereses.
Financiamiento: Autofinanciado.
REFERENCIAS BIBLIOGRÁFICAS
1. Feig BW, Ching CD, Abad JD, Abdalla EK, Amos KD, Badgwell B, et al. The MD Anderson Oncology Surgical Handbook. 5th ed. Philadelphia: Wolters Kluwer Lippincott Williams & Wilkins; 2012. [ Links ]
2. World Health Organization. Peru [Internet]. Ginebra: WHO; 2014 [citado el 11 de april de 2015]. Disponible en: http:// www.who.int/cancer/country-profiles/per_en.pdf [ Links ]
3. Payet MezaE, Perez Mejia P, Poquioma Rojas E, Diaz Nava E (ed.). Registro de Cáncer de Lima Metropolitana. Incidencia y Mortalidad 2010-2012. Lima: INEN; 2016. [ Links ]
4. Edge SB (ed.). AJCC Cancer Staging Manual. 7th ed. New York: Springer Dordrecht Heide; 2010. [ Links ]
5. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer. 2017;20(1):1-19. [ Links ]
6. Lu J, Huang CM, Zheng CH, Li P, Xie JW, Wang JB, et al. Consideration of tumor size improves the accuracy of TNM predictions in patients with gastric cancer after curative gastrectomy. Surg Oncol. 2013;22(3):167-71. [ Links ]
7. Jiang N, Deng JY, Ding XW, Liu Y, Liang H. Tumor volume as a prognostic factor was superior to the seventh edition of the pT classification in resectable gastric cancer. Eur J Sur Oncol. 2014;41(3):315-22. [ Links ]
8. Songun I, Putter H, Kranenbarg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol. 2010;11(5):439-49. [ Links ]
9. Cuschieri A, Hanna GB. Meta-analysis of D1 versus D2 gastrectomy for gastric adenocarcinoma: let us move on to another era. Ann Surg. 2014;259(6):e90. [ Links ]
10. Memon MA, Subramanya MS, Khan S, Hossain MB, Osland E, Memon B. Meta-analysis of D1 versus D2 gastrectomy for gastric adenocarcinoma. Ann Surg. 2011;253(5):900-11. [ Links ]
11. Kodera Y. The current state of stomach cancer surgery in the world. Jpn J Clin Oncol. 2016 Aug 30. [Epub ahead of print] [ Links ].
12. Zhang BY, Yuan J, Cui ZS, Li ZW, Li XH, Lu YY. Evaluation of the pronostic value of the metastatic lymph node ratio for gastric cancer. Am J Surg. 2014;207(4):555-65. [ Links ]
13. Chen S, Zhao BW, Li YF, Feng XY Sun XW, Li W, et al. The prognostic value of harvested lymph nodes and the metastatic lymph node ratio for gastric cancer patients: results of study of 1,101 patients. PLoS One. 2012;7(11):e49424. [ Links ]
14. Marchet A, Mocellin S, Ambrosi A, de Manzoni G, di Leo A, Marrelli D, et al. The prognostic value of N-ratio in patients with gastric cancer: validation in a large, multicenter series. Eur J Surg Oncol. 2008;34(2):159-65. [ Links ]
15. Kutlu OC, Watchell M, Dissanaike S. Metastatic lymph node ratio successfully predicts prognosis in western gastric cancer patients. Surg Oncol. 2015;24(2):84-8. [ Links ]
16. Kulig J, Sierzega M, Kolodziejczyk P, Popiela T; Polish Gastric Cancer Study Group. Ratio of metastatic to resected lymph nodes for prediction of survival in patients with inadequately staged gastric cancer. Br J Surg. 2009;96(8):910-8. [ Links ]
17. Liu H, Deng J, Zhang R, Hao X, Jiao X, Liang H. The RML of lymph node metastasis was superior to the LODDS for evaluating the prognosis of gastric cancer. Int J Surg. 2013;11(5):419-24. [ Links ]
18. Bando E, Yonemura Y, Taniguchi K, Fuchida S, Fujimura T, Miwa K. Outcome of ratio of lymph node metástasis in gastric carcinoma. Ann Surg Oncol. 2002;9(8):775-84. [ Links ]
19. Zhao LY, Li CC, Jia LY, Chen XL, Zhang WH, Chen XZ, et al. Superiority of lymph node ratio-based staging system for prognostic prediction in 2575 patients with gastric cancer: validation analysis in a large single center. Oncotarget. 2016;7(32):51069-81. [ Links ]
20. Bilici A, Ustaalioglu BB, Gumus M, Seker M, Yilmaz B, Kefeli U, et al. Is metastatic lymph node ratio superior to the number of metastatic lymph nodes to assess outcome and survival of gastric cancer? Onkologie. 2010;33(3):101-5. [ Links ]
21. Yamashita K, Hosoda K, Ema A, Watabane M. Lymph node ratio as a novel and simple prognostic factor in advanced gastric cancer. Eur J Surg Oncol. 2016;42(9):1253-60. [ Links ]
22. Ema A, Waraya M, Yamashita K, Kokubo K, Kobayashi H, Hoshi K, et al. Identification of EGFR expression status association with metastatic lymph node density (ND) by expression microarray analysis of advanced gastric cancer. Cancer Med. 2015;4(1):90-100. [ Links ]
23. Park SH, Sohn TS, Lee J, Lim DH, Hong ME, Kim KM, et al. Phase III trial to compare adjuvant chemotherapy with capecitabine and cisplatin versus concurrent chemoradiotherapy in gastric cancer: final report of the Adjuvant Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset Analyses. J Clin Oncol. 2015;33(28):3130-6. [ Links ]
24. Kim Y, Park SH, Kim KM, Choi MG, Lee JH, Sohn TS, et al. The influence of metastatic lymph node ratio on the treatment outcomes in the Adjuvant Chemoradiotherapy in Stomach Tumors (ARTIST) Trial: a phase III trial. J Gastric Cancer. 2016;16(2):105-10. [ Links ]
25. Kim Y, Squires MH, Poultsides GA, Fields RC, Weber SM, Votanopoulos KI, et al. Impact of lymph node ratio in selecting patients with resected gastric cancer for adjuvant therapy. Surgery. 2017;162(2):285-94. [ Links ]
26. Saito H, Fukumoto Y, Osaki T, Yamada Y, Fukuda K, Tatebe S, et al. Prognostic significance of the ratio between metastatic and dissected lymph nodes (n ratio) in patients with advanced gastric cancer. J Surg Oncol. 2008;97(2):132-5. [ Links ]
27. Kodera Y, Yamamura Y, Shimizu Y, Torii A, Hirai T, Yasui K, et al. Lymph node status assessment for gastric carcinoma: is the number of metastatic lymph nodes really practical as a parameter for N categories in the TNM Classification? Tumor Node Metastasis. J Surg Oncol. 1998;69(1):15-20. [ Links ]
Correspondencia:
Andrés Guevara Jabiles Dirección: Av. Angamos Este 2520, Surquillo 15038. Lima, Perú.
Teléfono: 987971990 / 201-6500 /201-6160
E-mail: guevarajabiles@gmail.com
Recibido: 25/02/2018
Aprobado: 24/09/2018