Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.1 Lima Jan./Mar. 2019
ARTÍCULOS ORIGINALES
Eosinofilia duodenal en pacientes Colombianos con dispepsia funcional: un estudio de casos y controles
Duodenal eosinophilia in functional dyspepsia in a Colombian sample: a case-control study
Adán Lúquez Mindiola1, William Otero Regino2, Martín Gómez Zuleta3
1 Internista, Fellow de Gastroenterología, Universidad Nacional de Colombia, Bogotá, Colombia.
2 Profesor de Medicina, Coordinador de Gastroenterología, Universidad Nacional de Colombia, Hospital Universitario Nacional, Bogotá, Colombia.
3 Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia, Hospital Universitario Nacional, Bogotá, Colombia.
RESUMEN
Introducción: La dispepsia funcional (DPF) es una entidad compleja cuya fisiopatología no está claramente definida. Existen alteraciones motoras gastroduodenales y recientemente se ha dado importancia a la eosinofilia duodenal. Objetivo: El objetivo de este estudio fuedeterminar si existe asociación entre eosinofilia duodenal y DPF. Materiales y métodos: Estudio de casos y controles. Pacientes mayores de 18 años con dispepsia según ROMA IV, a quienes se descartó DP orgánica con endoscopia alta (EVDA). Los controles fueron pacientes con anemia ferropénica y diarrea crónica a quienes de rutina se toman biopsias tanto del estómago como del duodeno. Se calcularon 70 pacientes en cada grupo. La información se recolectó en un formulario específico. Resultados: Hubo 243 pacientes elegibles. Se incluyeron 84 pacientes en grupo. El 80% eran mujeres. Edad promedio 53,6 años. Se encontró eosinofilia duodenal con diferencia significativa en los pacientes con saciedad precoz (p=0,01). No hubo diferencia significativa en los pacientes con llenura posprandial (p=0,63), dolor o ardor epigástrico (p=0,26), síntomas de reflujo gastroesofágico (p=0,13), alergia e intolerancia a alimentos (p=0,42) y tabaquismo (p=0,28). Asimismo, no se encontró relación entre mastocitosis duodenal y saciedad precoz (p=0,98), llenura posprandial (p=0,78) y dolor o ardor epigástrico (p=0,82). Conclusiones: La eosinofilia duodenal fue más frecuente en pacientes con DPF que tenían saciedad precoz.
Palabras clave: Dispepsia; Eosinofilia; Duodeno (fuente: DeCS BIREME).
ABSTRACT
Introduction: Functional dyspepsia (FD) is a complex symptom. Currently there are multiple therapeutic options that are used for the management of these patients; however, FD therapies are based on symptomatic control and do not address the pathophysiological pathways involved in its development. The duodenum has been proposed as a key site to understand the complex pathophysiology involved in FD. Objective: The aim of the study is to determine duodenal eosinophilia in patients with FD and establish the clinical-pathological correlation with the cardinal symptoms of dyspepsia. Material and methods: Case-control study. Patients older than 18 years with dyspepsia according to the Rome IV criteria, and upper gastrointestinal endoscopy normal (FD group).Patients with iron deficiency anemia and chronic diarrhea (control group). Biopsies were taken in the stomach, duodenal bulb and second portion of duodenum. A sample size of 140 patients (70 patients in the FD group and 70 patients in the control group) was calculated. The collected information was described and analyzed by conventional statistical techniques. Results: 243 patients were recruited. 84 patients were included in the FD group and 84 patients in the control group. 135 patients were women (80.3%). The mean age was 53.6 years (SD 14.9). Duodenal eosinophilia was found with significant difference in patients with early satiety (p=0.01). There was no difference in patients with postprandial fullness (p=0.63), epigastric pain or burning (p=0.26), gastroesophageal reflux symptoms (p=0.13), allergy and food intolerance (p=0.42) and smoking (p=0.28). There was no relationship between duodenal mastocytosis and early satiety (p=0.98), postprandial fullness (p=0.78), and epigastric pain or burning (p=0.82). Conclusions: Duodenal eosinophilia was similar in FD and controls. In subgroup analysis, duodenal eosinophilia occurs in patients with early satiety.
Keywords: Dyspepsia; Eosinophilia; Duodenum (source: MeSH NLM)
INTRODUCCIÓN
La dispepsia (DP) es un dolor o malestar recurrente, localizado en la parte central del abdomen superior o región gastroduodenal (1,2). Cuando la DP no ha sido estudiada se denomina DP no investigada (DNI) (2). Cuando existen alteraciones sistémicas, metabólicas o estructurales que explican los síntomas, se denomina DP secundaria (DPS) y cuando esas no existen, es DP funcional (DPF) (2). Las causas de la DPS son diversas e incluyen tumores malignos, ulceras pépticas, enfermedades pancreato- biliares, enfermedades endocrinas y Helicobacter pylori (H. pylori) (3) Se considera que la DP es secundaria a H. pylori cuando la mejoría de los síntomas persiste después de seis meses de erradicar la infección (2,3). La patogénesis de los síntomas no se ha determinado de manera definitiva, pero puede ser multifactorial, con participación de múltiples actores como genéticos, infecciones, dieta, alteraciones de motilidad gastroduodenal, eje cerebro-intestino, alteraciones sicológicas, mediadores inflamatorios y eosinofilia duodenal (2,4,5). En la mayoría de los casos, la causa se puede establecer con endoscopia digestiva alta (EVDA) (6). Con la EVDA se ha encontrado que menos del 10% de los pacientes tienen ulcera péptica, menos de 1% cáncer gastroesofágico y más del 70% tienen DPF (6). La DPF se subdivide en dos categorías (2): síndrome de dolor epigástrico (SDE) y síndrome de malestar (distrés posprandial (SDP), aunque se pueden sobreponer (2,6). En el SDE, los síntomas deben estar presentes por lo menos un día a la semana y en el SDP por lo menos 3 días por semana, en los últimos tres meses, con inicio de síntomas por lo menos seis meses antes del diagnóstico (2). La prevalencia mundial de DPF es 5-11% (7). Se desconocen los mecanismos fisiopatológicos responsables de la DPF, aunque tradicionalmente se han propuesto diferentes alteraciones que alteran el estómago, tales como vaciamiento gástrico lento y falta de relajación del fundus (5,8). También se ha considerado que puede relación con la intolerancia a alimentos (9), el tabaquismo (5,8) y más recientemente alteraciones en la microbiota del intestino delgado (10). Otras alteraciones adicionales involucran específicamente al duodeno e incluyen, aumento de la exposición al ácido, anormalidades en la motilidad antro-duodenal, hipersensibilidad a la infusión de lípidos, activación inmune, alteraciones en la integridad de la barrera intestinal y aumento del paso paracelular y de manera importante, aumento de los eosinófilos y de granulación de los mastocitos (11-16). Después del primer trabajo sobre DPF y eosinofilia duodenal, publicado por Talley et al. (15), el interés ha sido generalizado y el hallazgo consistente a nivel mundial (13,17-19). Con respecto al conteo de eosinófilos en el duodeno, geográficamente hay amplia, variación, pero se ha considerado que el valor anormal es más de 22 esosinófilos en 5 campos de alto poder (15). No obstante la importancia que se ha dado a la eosinofilia duodenal, a nivel mundial existen pocos trabajos en la literatura, en adultos que hayan evaluado esta asociación (11,13,15,16). Hasta donde tenemos conocimiento, hay pocos trabajos Latinoamericanos publicados sobre este tema. Teniendo en cuenta lo anterior, decidimos realizar el presente estudio con el objetivo de determinar si existe asociación entre la esosinofilia y lamastocitosis duodenal y los diferentes síndromes de DPF.
MATERIALES Y MÉTODOS
Diseño del estudio
Estudio de casos y controles.
Población
Se incluyeron en el estudio, de manera prospectiva, casos incidentes de DPF de acuerdo a los criterios diagnósticos del consenso de Roma IV (2). Los pacientes del presente estudio, son adultos mayores de 18 años, a quienes se les realizó EVDA entre mayo de 2016 a enero 2017, en la Unidad de Gastroenterología y Endoscopia Digestiva de la Clínica Fundadores de Bogotá, Institución adscrita al posgrado de Gastroenterología de la Universidad Nacional de Colombia.
Casos: pacientes remitidos por primera vez a EVDA por DNI sin signos o síntomas de alarma de alarma y no tenían alteraciones estructurales evidentes a nivel del esófago, estómago y duodeno, detectables con el procedimiento.
Controles: pacientes con indicación de EVDA por anemia ferropénica o diarrea crónica, sin síntomas de DP. Estos fueron elegidos, porque en ellos en nuestro servicio de rutina se les toman biopsias del bulbo y segunda porción del duodeno (véase más adelante)
Criterios de exclusión
Menores de 18 años de edad, pacientes con DP secundaria (úlcera péptica, reflujo gastroesofágico erosivo,duodenitiserosiva,cáncergástricooenfermedad pancreático-biliar), pacientes con comorbilidades severas (hipertensión arterial, insuficiencia cardíaca descompensada, diabetes mellitus), pacientes con cáncer intestinal o extra intestinal, consumidores de AINES o aspirina, macrólidos), síndrome de intestino irritable, síntomas de enfermedad por reflujo gastroesofágico.
Los pacientes firmaron consentimiento informado y aceptaron participar en el estudio.Todos los datos se manejaron con estándares de confidencialidad para lo cual se utilizó un sistema de codificación de los pacientes para que no fueran identificados.
Consideraciones éticas
El consentimiento informado y el protocolo fueron aprobados por el Comité de Ética de las instituciones participantes.
Procedimientos y recolección de la información
Previo al ingreso a la sala de procedimientos, los pacientes fueron invitados a participar, se les explicó el propósito del estudio, se les diligenció un formulario, específico, el cual fue aplicado por una enfermera entrenada para recolectar esa información, miembro de la unidad de gastroenterología y endoscopia digestiva, que no hacía parte del grupo de investigación. En ese documento de recolección de datos, estaban incluidos datos demográficos, los síntomas cardinales de DPF, la historia médica de medicamentos, tabaquismo, alergia e intolerancia a alimentos, enfermedades concomitantes. Posterior al diligenciamiento del cuestionario, los pacientes elegibles, firmaron el consentimiento informado para la investigación y se les realizó la EVDA. La EVDA fue realizada por endoscopistas expertos, profesores universitarios. Si no existían alteraciones estructurales (DPF), con una pinza fórceps Olympus reusable, se tomaron biopsias para el estudio histológico de gastritis crónica según las recomendaciones del protocolo OLGA (18) así: dos biopsias del cuerpo, dos biopsias del antro, una biopsia de la incisura, cada grupo de biopsias se enviaron en frascos separados. Para el estudio de la eosinofilia duodenal, se tomaron dos biopsias del bulbo duodenal y dos biopsias de la segunda porción del duodeno, las cuales se enviaron en frascos separados. Todas las biopsias fueron fijadas en formol y embebidos en parafina. En todas las biopsias se hicieron cortes de tres micras. Las biopsias gástricas fueron evaluadas con coloración Hematoxilina & Eosina y coloración Giemsa para determinar la presencia de H. pylori. En las biopsias de duodeno se evaluó la arquitectura y los eosinófilos se cuantificaron contando 5 Campos de Alto Poder (CAP) no superpuestos, con objetivo X40. En el tejido duodenal se identificaron los mastocitos con coloración azul de toluidina. A los controles seles realizó el mismo set de biopsias (dos biopsias del cuerpo, dos biopsias del antro, una biopsia de incisura, dos biopsias de bulbo duodenal y dos biopsias de la segunda porción del duodeno).
Tamaño de muestra
Teniendo en cuenta un nivel de significancia de 0,05, un poder de 0,8, además de una razón 1:1 entre las personas con y sin el desenlace, teniendo en cuenta un OR a detectar de 2 y una proporción de pacientes sin eosinofilia con dolor epigástrico o distrés posprandial de 53% se calculó un tamaño de muestra de 140 pacientes (70 pacientes en el grupo DPF y 70 pacientes en el grupo control).
Análisis estadístico
Las variables cualitativas se presentaron en forma de proporciones y números absolutos, mientras que las variables cuantitativas se presentaron en forma de promedios y desviación estándar si estas tienen un comportamiento normal, en caso contrario se presentaron en forma de medianas y rangos intercuartilicos. Se realizó una prueba de Chi-cuadrado y un OR con intervalo de confianza del 95% para buscar la relación entre la presencia de eosinofilia y síntomas en los pacientes. Adicionalmente se utilizaron estas mismas medidas para relacionar los síntomas de dispepsia funcional, tabaquismo y alergia e intolerancia a alimentos con eosinofilia duodenal, estas medidas se ajustaron por posibles variables de confusión. Finalmente se relacionaron los síntomasde dispepsia y mastocitosis duodenal. Se tuvo en cuenta un valor de p menor a 0,05 como estadísticamente significativo.
RESULTADOS
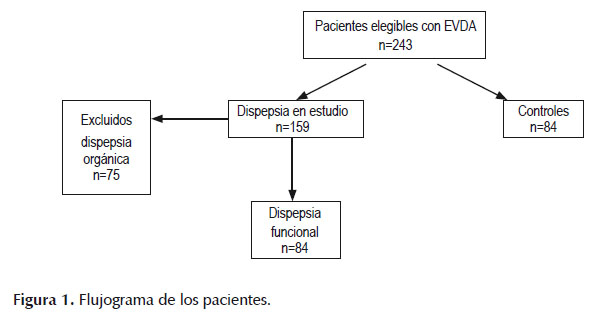
Se reclutaron consecutivamente 243 pacientes con indicación de EVDA por DNI, anemia por deficiencia de hierro y/o diarrea crónica. Se incluyeron 84 pacientes en el grupo DPF y 84 pacientes en el grupo control, se excluyeron 75 pacientes por dispepsia orgánica, Figura 1 (tabla CONSORT).
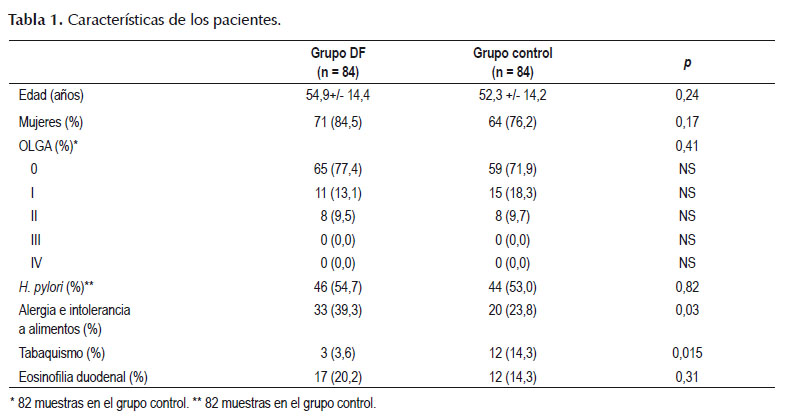
El 80,3% eran mujeres (135). La edad promedio fue 53,6 años (DE 14,9). En el grupo DPF, el 39,3% de los pacientes refirió alergia e intolerancia a alimentos. En el grupo control, el 14,3% de los pacientes refirió tabaquismo. Las características de los pacientes incluidos se muestran en la Tabla 1.
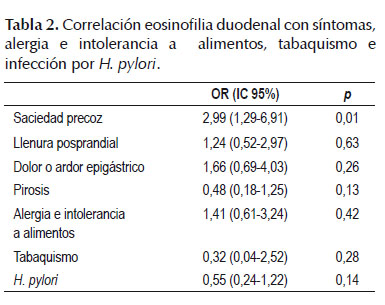
Eosinofilia duodenal se encontró en 29 pacientes, 17 pacientes en el grupo DPF y 12 pacientes en el grupo control. No hubo diferencia significativa en eosinofilia duodenal entre estos dos grupos (p=0,31). En el análisis por subgrupos, se encontró eosinofilia duodenal con diferencia significativa en los pacientes con saciedad precoz (p=0,01). No hubo diferencia significativa en los pacientes con llenura posprandial (p=0,63), dolor o ardor epigástrico (p=0,26) (Tabla 2).
La prevalencia de infección por H. pylori fue de 53,8% (90/167 muestras) y fue similar en ambos grupos, 54,7% en DPF y 53% en el grupo control. No se encontraron diferencias entre los síntomas de reflujo gastroesofágico y eosinofilia duodenal (p=0,13). 20,7% (11/53) de los pacientes con alergia e intolerancia a alimentos presentaron eosinofilia duodenal; sin embargo, no hubo asociación (p=0,42). Se realizó el ajuste por variable de confusión dado mayor número de pacientes con alergia e intolerancia a alimentos en el grupo DPF y no hubo asociación (OR ajustado 1,39 IC 95% 0,6-3,21 p=0,44). No se evidenció asociación entre tabaquismo y eosinofilia duodenal (p=0,28), se realizó el ajuste por variable de confusión dado mayor número de pacientes con tabaquismo en el grupo control y no se encontró asociación (OR ajustado 0,32 IC 95% 0,04-2,57 p=0,28). Asimismo, no se encontró relación entre mastocitosis duodenal y saciedad precoz (p=0,98), llenura posprandial (p=0,78) y dolor o ardor epigástrico (p=0,82). El tabaquismo fue más frecuente en el grupo control que en DPF (14,3 vs 3%, p=0,015).
DISCUSIÓN
En el presente estudio de casos y controles se realizó una correlación entre los síntomas clínicos de DPF y los hallazgos histopatológicos en duodeno. No se encontró diferencia significativa con respecto a eosinofilia duodenal entre casos y controles, pero, al realizar el análisis por subgrupos, se encontró asociación entre saciedad precoz y eosinofilia duodenal. Este hallazgo es similar a lo encontrado en otros trabajos de otras latitudes (15,18). En el estudio de Talley et al. (15), la asociación de este síntoma con eosinofilia en el bulbo duodenal tuvo un OR 11,7 (p=0,01) y en la segunda porción del duodeno un OR 7,3 (p=0,02) (15). Walker et al., también encontraron asociación con eosinofilia en la segunda porción (p=0,01), pero no así en el bulbo duodenal (18).
En el presente estudio, no se encontró asociación con llenura posprandial, ardor y dolor epigástrico, en contraste con el estudio de Walker et al. (18), en el cual la llenura posprandialse correlacionó con eosinofilia en la segunda porción duodenal (p=0,001) y el dolor epigástrico con eosinofilia en la primera y segunda porción duodenal, con p=0,02 y p=0,005, respectivamente (18). Estos últimos síntomas, a diferencia de la saciedad precoz, podrían estar explicados por mecanismos fisiopatológicos diferentes; sin embargo, el sustento para esta observación permanece desconocido y requiere investigaciones futuras. Los mecanismos responsables de estas asociaciones, se desconocen. Sin embargo, recientemente Vanheel et al. (19) realizaron un estudio en 560 pacientes en el cual determinaron las alteraciones fisiológicas gástricas en tres subgrupos: SDE, SDP y un grupo con sobreposición que cumplía criterios para SDE y SDP, encontrando pobre correlación con los síntomas, siendo estas alteraciones fisiológicas gástricas similares si los pacientes presentaban SDE, SDP o ambos (19). Esto apoya la hipótesis que se puede estar buscando la explicación fisiopatológica erróneamente en el estómago ya que en la mayoría de pacientes con DF el estómago no es la causa de los síntomas (20). Los hallazgos consistentes de asociación entre eosinofilia duodenal y saciedad precoz, sugiere algún papel de los mediadores inflamatorios a nivel duodenal en la alteración de la motilidad gástrica (13,14,21,22). Con la degranulación de los eosinófilos se liberan moléculas que actúan sobre el músculo liso gastrointestinal y podrían producir alteraciones en la motilidad gástrica (23). De esta manera, las alteraciones del duodeno serían las responsables de los síntomas gástricos. Si se confirma que definitivamente la saciedad precoz se correlaciona con eosinofilia duodenal, esta alteración podría ser un blanco terapéutico para el manejo de este subgrupo de pacientes y se cambiaría el paradigma de utilizar procinéticos que aumenten el vaciamiento gástrico (2,3,24), los cuales serían medicamentos sintomáticos, ya que el origen del síntoma estaría en el duodeno (23-25). La eficacia de los IBP en un subgrupo de pacientes con DPF (26), podría relacionarse con los efectos sistémicos de estos medicamentos para disminuir la eosinofilia, como sucede con la esofagitis eosinofílica (27). Recientemente se ha encontrado que elmontelukast, un antagonista del receptor leucotrieno, tiene beneficio en pacientes pediátricos con dispepsia y eosinofilia duodenal por encima del placebo (84% vs. 42% p<0,01) (28), aunque la respuesta clínica a corto plazo no produce cambios en la densidad tisular de eosinófilos (28). Así mismo, se han encontrado resultados positivos con la combinación de los antagonistas H1/ H2 (hidroxicina/ranitidina) con tasa de respuesta del 50% (29).
En el presente estudio no se encontró asociación entre síntomas dispépticos y mastocitosis duodenal y al respecto, los resultados de los pocos estudios realizados han sido contradictorios (29,30). Este aumento en el recuento de mastocitos ha sido documentado en estudios moleculares que demuestran que esas células, pueden reclutar eosinófilos a través de la liberación de serotonina (14,31). Los eosinófilos a su vez, promueven la supervivencia, proliferación, maduración y degranulación de mastocitos por secreción de varias sustancias, principalmente proteína básica mayor (14,31).
Sin embargo, el cromoglicato sódico, un estabilizador de mastocitos, demostró eficacia en el 89% de los niños con DPF que no respondieron la combinación de los antagonistas H1/H2 (hidroxicina/ranitidina) (16). Otro medicamento potencial para los mastocitos, es el ketotifeno, el cual ha demostrado beneficio en algunos pacientes con síndrome de intestino irritable (18). En este estudio no se encontró asociación entre eosinofilia duodenal y tabaquismo. En el año 2014 Walker et al. reportaron por primera vez la asociación entre tabaquismo y eosinofilia en la segunda porción duodenal y saciedad precoz (32), sin embargo, estos hallazgos requieren investigaciones futuras.
En nuestro estudio no se encontró asociación entre alergia a medicamentos, factores ambientales o comida con eosinofilia duodenal, los cuales han sido propuestos en un estudio previo como mediadores en la DPF (12), aunque la alergia y la intolerancia a alimentos en DPF no se ha estudiado ampliamente (9). H. pylori ha sido relacionado con el reclutamiento de esoinófilos (33), sin embargo en este estudio la prevalencia del mismo fue similar en ambos grupos y más baja que le informada en estudios previos de Colombia que encontraron prevalencias de 69,1% y 83,1% (34-36).
Por el diseño del estudio no podemos determinar cuántos pacientes diagnosticados con DPF, pudieran tener DP por H. pylori, cuyo diagnóstico sólo se puede establecer con la ausencia de los síntomas seis meses después de erradicar la infección (2,3).
En conclusión, en el presente estudio, que es el primero realizado en Colombia y uno de los pocos en Latinoamérica, se ha encontrado asociación entre saciedad precoz y eosinofilia duodenal, similar a algunos de otros continentes.
Conflictos de interés: ninguno.
REFERENCIAS BIBLIOGRÁFICAS
1. Talley NJ, Stanghellini V, Heading RC, Koch KL, Malagelada JR, Tytgat GN. Functional gastroduodenal disorders. Gut. 1999;45(Suppl II):II37-42. [ Links ]
2. Stanghellini V, Chan FK, Hasler WL, Malagelada JR, Suzuki H, Tack J, et al. Gastroduodenal disorders. Gastroenterology. 2016;150(6):1380-92. [ Links ]
3. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Soichiro Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-67. [ Links ]
4. Tack J, Talley NJ. Functional dyspepsia – symptoms, definitions and validity of the Rome III criteria. Nat Rev Gastroenterol Hepatol. 2013;10(3):134-41. [ Links ]
5. Carbone F, Tack J. Gastroduodenal mechanisms underlying functional gastric disorders. Dig Dis. 2014;32(3):222-9. [ Links ]
6. Ford AC, Marwaha A, Lim A, Moayyedi P. What is the prevalence of clinically significant endoscopic findings in subjects with dyspepsia? Systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2010;8(10):830-7. [ Links ]
7. Ford AC, Marwaha A, Sood R, Moayyedi P. Global prevalence of, and risk factors for, uninvestigated dyspepsia: a meta-analysis. Gut. 2015;64(7):1049-57. [ Links ]
8. Lee KJ, Tack J. Duodenal implications in the pathophysiology of functional dyspepsia. J Neurogastroenterol Motil. 2010;16(3):251-7. [ Links ]
9. Zuo XL, Li YQ, Li WJ, Guo YT, Lu XF, Li JM, et al. Alterations of food antigen-specific serum immunoglobulins G and E antibodies in patients with irritable bowel syndrome and functional dyspepsia. Clin Exp Allergy. 2007;37(6):823-30. [ Links ]
10. Zhong L, Shanahan ER, Raj A, Koloski NA, Fletcher L, Morrison M, et al. Dyspepsia and the microbiome: time to focus on the small intestine. Gut. 2016; 66(6):1168-1169. [ Links ]
11. Futagami S, Shindo T, Kawagoe T, Horie A, Shimpuku M, Gudis K, et al. Migration of eosinophils and CCR2-/CD68-double positive cells into the duodenal mucosa of patients with postinfectious functional dyspepsia. Am J Gastroenterol. 2010;105(8):1835-42. [ Links ]
12. Walker MM, Salehian SS, Murray CE, Rajendran A, Hoare JM, Negus R, et al. Implications of eosinophilia in the normal duodenal biopsy – an association with allergy and functional dyspepsia. Aliment Pharmacol Ther. 2010;31(11):1229-36. [ Links ]
13. Friesen CA, Schurman JV, Colombo JM, Abdel-Rahman SM. Eosinophils and mast cells as therapeutic targets in pediatric functional dyspepsia. World J Gastrointest Pharmacol Ther. 2013;4(4):86-96. [ Links ]
14. Vanheel H, Vicario M, Vanuytsel T, Van Oudenhove L, Martinez C, Keita ÅV, et al. Impaired duodenal mucosa integrity and low-grade inflammation in functional dyspepsia. Gut. 2014;63(2):262-72. [ Links ]
15. Talley NJ, Walker MM, Aro P, Ronkainen J, Storskrubb T, Hindley LA, et al. Non-ulcer dyspepsia and duodenal eosinophilia: an adult endoscopic population-based case-control study. Clin Gastroenterol Hepatol. 2007;5(10):1175-83. [ Links ]
16. Friesen CA, Sandridge L, Andre L, Roberts CC, Abdel-Rahman SM. Mucosal eosinophilia and response to H1/H2 antagonist and cromolyn therapy in pediatric dyspepsia. Clin Pediatr (Phila). 2006;45(2):143-7. [ Links ]
17. Rugge M, Correa P, Di Mario F, El-Omar E, Fiocca R, Geboes K, et al. OLGA stagingfor gastritis: a tutorial. Dig Liver Dis. 2008;40(8):650-8. [ Links ]
18. Walker MM, Aggarwal KR, Shim LS, Bassan M, Kalantar JS, Weltman MD, et al. Duodenal eosinophilia and early satiety in functional dyspepsia: confirmation of a positive association in an Australian cohort. J Gastroenterol Hepatol. 2014;29(3):474-9. [ Links ]
19. Vanheel H, Carbone F, Valvekens L, Simren M, Tornblom H, Vanuytsel T, et al. Pathophysiological abnormalities in functional dyspepsia subgroups according to the Rome III criteria. Am J Gastroenterol. 2017;112(1):132-40. [ Links ]
20. Talley NJ. Moving away from focussing on gastric pathophysiology in functional dyspepsia: new insights and therapeutic implications. Am J Gastroenterol. 2017;112(1):141-4. [ Links ]
21. Cirillo C, Bessissow T, Desmet AS, Vanheel H, Tack J, Vanden Berghe P. Evidence for neuronal and structural changes in submucous ganglia of patients with functional dysepsia. Am J Gastroenterol. 2015;110(8):1205-15. [ Links ]
22. Liebregts T, Adam B, Bredack C, Gururatsakul M, Pilkington KR, Brierley SM, et al. Small bowel homing T cells are associated with symptoms and delayed gastric emptying in fuctional dyspepsia. Am J Gastroenterol. 2011;106(6):1089-98. [ Links ]
23. Powell N, Walker MM, Talley NJ. Gastrointestinal eosinophils in health, disease and functional disorders. Nat Rev Gastroenterol Hepatol. 2010;7(3):146-56. [ Links ]
24. Talley NJ. Functional dispepsia: new insights into pathogenesis and therapy. Korean J Intern Med. 2016;31(3):444-56. [ Links ]
25. Walker MM, Talley NJ. The role of duodenal inflammation in functional dyspepsia. J Clin Gastroenterol. 2017;51(1):12-8. [ Links ]
26. Pinto-Sanchez M, Yuan Y, Bercik P, Moayyedi P. Proton pump inhibitors for functional dyspepsia. Cochrane Database Syst Rev. 2017;11:CD011194. [ Links ]
27. Irano I. 2015 David Y. Graham Lecture: The First Two Decades Of Eosinophilic Esophagitis—From Acid Reflux To Food Allergy. Am J Gastroenterol. 2016;111(6):770-6. [ Links ]
28. Friesen CA, Kearns GL, Andre L, Neustrom M, Roberts CC, Abdel-Rahman SM. Clinical efficacy and pharmacokinetics of montelukast in dyspeptic children with duodenal eosinophilia. J Pediatr Gastroenterol Nutr. 2004;38(3):343-51. [ Links ]
29. Walker MM, Talley NJ, Prabhakar M, Pennaneac’h CJ, Aro P, Ronkainen J, et al. Duodenal mastocytosis, eosinophilia and intraepithelial lymphocytosis as posible disease markers in the irritable bowel syndrome and functional dyspepsia. Aliment Pharmacol Ther. 2009;29(7):765-73.
30. Wang X, Li X, Ge W, Huang J, Li G, Cong Y, et al. Quantitative evaluation of duodenal eosinophils and mast cells in adult patients with functional dyspepsia. Ann Diagn Pathol. 2015;19(2):50-6. [ Links ]
31. Piliponsky AM, Pickholtz D, Gleich GJ, Levi-Schaffer F. Human eosinophils induce histamine release from antigen-activated rat peritoneal mast cells: a possible role for mast cells in late-phase allergic reactions. J Allergy ClinImmunol. 2001;107(6):993-1000. [ Links ]
32. Klooker TK, Braak B, Koopman KE, Welting O, Wouters MM, van der Heide S, et al. The mast cell stabiliserketotifen decreases visceral hypersensitivity and improves intestinal symptoms in patients with irritable bowel syndrome. Gut. 2010;59(9):1213-21. [ Links ]
33. Kikuchi T, Kato K, Ohara S, Sekine H, Arikawa T, Suzuki T, et al. The relationship between persistent secretion of RANTES and residual infiltration of eosinophils and memory T lymphocytes after Helicobacter pylori eradication. J Pathol. 2000;192(2):243-50. [ Links ]
34. Bravo LE, Cortés A, Carrascal E, Jaramillo R, Stella García L, Bravo PE, et al. Helicobacter pylori: patología y prevalencia en biopsias gástricas en Colombia. Col Med. 2003;34(3):124-31. [ Links ]
35. Campuzano-Maya G, Hoyos-Castaño D, Calvo-Betancur VD, Suárez-Ramírez OA, Lizcano-Cardona D, Rojas-Arbeláez CA. Prevalencia de la infección por Helicobacter pylori en médicos de Medellín, Colombia. Acta Gastroenterol Latinoam. 2007;37(2):99-103. [ Links ]
36. Porras C, Nodora J, Sexton R, Ferreccio C, Jimenez S, Dominguez RL, et al. Epidemiology of Helicobacter pylori infection in six Latin American countries (SWOG Trial S0701). Cancer Causes Control. 2013;24(2):209-15. [ Links ]
Correspondencia:
William Otero
E-mail: waoteror@gmail.com
Recibido: 16.10.18
Aprobado:18.03.19