Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.1 Lima Jan./Mar. 2019
ARTÍCULOS ORIGINALES
Utilidad de la elastografía guiada por ultrasonografía endoscópica en la evaluación de lesiones sólidas pancreáticas
Usefulness of endoscopic ultrasound guided elastography in the assessment of solid pancreatic lesions
Alfonso Chacaltana Mendoza1,2, Vivian Fabiola Jerez Lanza3, Juan Llatas Perez1, Bruno Li Salvatierra1, Augusto Vera Calderon1
1 Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
2 Clínica Internacional San Borja. Lima, Perú.
3 Instituto Gastroenterológico Boliviano Japonés. Cochabamba, Bolivia.
RESUMEN
Introducción: La elastografía guiada por ultrasonografía endoscópica es considerada una herramienta útil en la evaluación de las lesiones solidas pancreáticas (LSP). Objetivo: El objetivo del estudio fue evaluar el rendimiento diagnóstico de la elastografia en pacientes con LSP. Material y métodos: Se realizó un estudio transversal prospectivo en el hospital Rebagliati durante julio 2017 a junio 2018. Se incluyeron pacientes con diagnóstico de LSP y estudio ecoendoscópico, elastografía y toma de PAAF. Se realizó elastografia cualitativa y elastografia cuantitativa (SR e histograma) y se analizó con resultados histopatológicos para determinar la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y exactitud diagnostica en la detección de malignidad. Resultados: De 846 ecoendoscopías, se estudiaron 46 pacientes con LSP con una edad promedio de 64,6 años, 29 (63%) sexo femenino. El adenocarcinoma pancreático fue diagnosticado en 36 casos (78,3%). En elastografía cualitativa predominó el score 3 (n=39, 84,8%) con una sensibilidad, especificidad y exactitud de 88.9%, 30% y 76,1% respectivamente para predecir adenocarcinoma. Elastografía cuantitativa de SR≥ 15 (sensibilidad 100%, especificidad 66,7% y exactitud 97,8%) y un valor de histograma menor de 49 (sensibilidad 66,7%, especificidad 97,6% y exactitud 95,6%) predice malignidad en una LSP con área bajo de la curva ROC de 0,941 (IC 95%, 0,82 – 1,0). Conclusiones: La elastografía brinda información para predecir la naturaleza maligna de la lesión. En nuestro estudio la detección elastográfica de un score 3, SR≥ 15 o un histograma < 49 predice la presencia de malignidad en la LSP estudiada.
Palabras clave: Ultrasonografía endoscópica; Elastografía; Páncreas (fuente: DeCS BIREME).
ABSTRACT
Introduction: endoscopic ultrasonography (EUS) elastography is considered a useful tool for the evaluation of solid pancreatic lesions (SPL). Objective: The aim of our study was to evaluate the diagnostic performance of elastography in patients with SPL. Material and methods: A prospective, cross-sectional study was performed at the Rebagliati Hospital between July 2017 and June 2018. Patients with a diagnosis of SPL and echoendoscopic study, elastography and FNA were included. Qualitative and quantitative elastography: strain ratio (SR) and strain histogram, were performed and analyzed with histopathological results. The diagnostic accuracy of EUS elastography in detecting malignancy was calculated using receiver operating curve analysis. Sensitivity, specificity, positive predictive value (PPV), negative predictive value (NPV), and accuracy for the detection of malignancy were calculated. Results: Out of 832 EUS examinations performed, 46 patients with SPL (mean age, 64.6 years; 29 women) were included in the study. Pancreatic adenocarcinoma was diagnosed in 36 cases. In qualitative elastography, score 3 was most frequent (n = 39, 84.8%) with sensitivity, specificity and accuracy of 88.9%, 30% and 76.1%, respectively, for predict adenocarcinoma. A strain ratio of 15 or higher (100% sensitivity, 66.7% specificity and 97.8% accuracy) and a histogram of less than 49 (66.7% sensitivity, 97.6% specificity and 95.6% accuracy) predicts malignancy in SPL, with area under a ROC curve of 0.941 (95% CI, 0.82 - 1.0). Conclusions: EUS elastography provides information to predict the malignant nature of the pancreatic lesion. In our study, the elastographic detection of a score 3, SR≥15 or a histogram <49 predicts the presence of malignancy in LSP.
Keywords: Endoscopic ultrasonography; Elastography; Pancreas (source: MeSH NLM).
INTRODUCCIÓN
La introducción de la ultrasonografía endoscópica (USE) en la práctica clínica ha representado un avance importante en el diagnóstico y tratamiento de una amplia variedad de enfermedades gastrointestinales, con mayor impacto en la evaluación de enfermedades pancreáticas siendo considerado como una herramienta de diagnóstico altamente confiable (1,2). Sin embargo, la diferenciación entre distintos tipos de lesiones sólidas pancreáticas (LSP) sigue siendo un desafío. La punción aspiración con aguja fina guiada por USE (USE-PAAF) es un método para optimizar el rendimiento diagnóstico de USE en LSP con una sensibilidad de 85% y especificidad de 98% (3,4). No obstante la USE-PAAF puede ser técnicamente difícil, y los resultados falsos negativos pueden ser un problema (5). La USE-PAAF también se asocia con un bajo pero no despreciable riesgo de complicaciones (6).
Durante los últimos años, han surgido métodos complementarios no invasivos con el objetivo de incrementar el rendimiento diagnóstico de la USE, entre ellos la elastografía que investiga la rigidez del tejido mediante la detección de pequeñas deformaciones estructurales dentro de la imagen en modo B causadas por la compresión (7). La deformación difiere entre los diferentes tejidos y el grado de deformación se utiliza como indicador de la dureza o rigidez del tejido. Los diferentes valores de elasticidad se traducen a una escala de color de azul oscuro a cian, verde, amarillo y rojo, donde el azul oscuro es el más duro y el rojo el más suave. Se ha utilizado un sistema de calificación subjetiva (elastografía cualitativa) basado en diferentes patrones de color de las imágenes para diferenciar las LSP donde la sensibilidad, la especificidad, VPP, VPN y la precisión global de USE-elastografía para malignidad fueron del 100%, 85,5%, 90,7%, 100% y 94,0%, respectivamente (8). Para la elastografía cuantitativa existen dos métodos alternativos para la cuantificación de la rigidez tisular basados en los datos cualitativos de la USE: histograma de deformación y relación de deformación.
El histograma de deformación es un valor medio de elasticidad en una región de interés seleccionada y la relación de deformación o SR (por sus siglas en inglés "strain ratio") se define como la relación de la deformación media en una región de interés sobre la deformación media en un área de referencia que generalmente se selecciona la pared del tracto digestivo (7).
Los hallazgos de la elastografía se han relacionado con características histopatológicas, sin embargo, estas tecnologías de software no pueden reemplazar a la USE-PAAF porque no son herramientas de diagnóstico patológico, pero pueden ayudar en muchos escenarios clínicos, como en lesiones con un rendimiento de diagnóstico de USE- PAAF notablemente bajo, incluida la pancreatitis crónica (9).
Esta nueva técnica se ha utilizado inicialmente para el análisis de lesiones superficiales de órganos como mama y próstata (10,11). A la fecha, varios estudios publicados han analizado la precisión diagnóstica de la USE en la diferenciación de LSP malignas y benignas (12), y recientemente, un estudio prospectivo reportó una sensibilidad del 100% para la detección de tumores malignos por elastografía guiada por USE (13).
En nuestro Hospital la realización de esta nueva técnica fue implementada en el Departamento de
Aparato Digestivo desde el año 2015, sin embargo no existe un estudio reportado hasta la fecha para evaluar el rendimiento diagnóstico de la elastografía guiada por USE en lesiones sólidas pancreáticas en nuestro medio.
El objetivo general fue evaluar el rendimiento diagnóstico de la elastografía guiada por ultrasonografía endoscópica en pacientes con lesiones sólidas pancreáticas en el Hospital Edgardo Rebagliati Martins.
Los objetivos específicos fueron determinar la utilidad de la elastografía cualitativa en el diagnóstico de lesiones sólidas pancreáticas en relación a un sistema de calificación basada en un color predominante y patrón de imagen, y la utilidad de la elastografía cuantitativa en el diagnóstico de lesiones sólidas pancreáticas en base al histograma de deformación y relación de deformación.
MATERIAL Y MÉTODO
Diseño de estudio
Se realizó un estudio de corte transversal prospectivo en el servicio de endoscopía del Hospital Nacional Edgardo Rebagliati Martins durante los meses de julio del 2017 a junio del 2018.
Se incluyeron a todos los pacientes con diagnóstico de LSP a quienes se les realizó estudio ecoendoscópico.
Para el estudio, se consideró LSP a aquellos con diagnóstico o sospecha de neoplasia maligna de páncreas, pancreatitis crónica focal, tumor neuroendocrino y metástasis pancreática.
Selección de pacientes
Criterios de inclusión:
-
Pacientes mayores de 18 años de edad con diagnóstico de LSP y estudio ecoendoscópico con realización de elastografia cualitativa-cuantitativa y toma de PAAF.
-
Pacientes con resultado de histopatología de muestras de PAAF o pieza quirúrgica en aquellos sometidos a cirugía.
Criterios de exclusión fueron:
-
Pacientes con diagnóstico de lesiones quísticas y solido-quísticas.
-
Pacientes con diagnostico histopatológico no concluyente.
-
Pacientes con datos incompletos.
Ultrasonido endoscópico y elastografía
El servicio de endoscopia del HNERM cuenta con un sistema de videoendoscopio PENTAX EPK-i, con un ecoendoscopio lineal (PENTAX 3.8 EG-3870 UTK) y un procesador ecográfico HITACHI HI VISION Avius.
Los estudios ecoendoscópicos fueron realizados por 3 médicos con experiencia en ultrasonografía endoscópica. A todos los pacientes se les administró sedación con midazolam, clorhidrato de petidina y propofol por indicación del médico endoscopista y administrado por el personal de enfermería. Se realizó estudio ecoendoscópico convencional utilizando una frecuencia de 7,5 MHz y elastografia complementaria.
Elastografía cualitativa:
La región de interés para la evaluación elastográfica se seleccionó manualmente, incluyendo toda la lesión objetivo y tejido circundante teniendo una imagen estable durante al menos 5 segundos para la definición final del patrón de color y en base a la visualización del gráfico de deformación para tener uniformidad de la compresión para seleccionar la mejor imagen eliminando el sesgo. Se utilizó un sistema de calificación basada en 4 patrones de color diferentes propuesta en un estudio previo 13:
-
Score 1; Patrón homogéneo verde (páncreas normal).
-
Score 2; Patrón heterogéneo, verde predominante (pancreatitis crónica).
-
Score 3; Patrón heterogéneo, azul predominante (adenocarcinoma pancreático).
-
Score 4; Patrón homogéneo azul (tumor pancreático neuroendocrino).
La elastografía cualitativa fue interpretada por el médico operador, posteriormente se realizó un análisis interobservador entre los ecoendoscopistas del servicio.
Elastografía cuantitativa:
El cálculo del SR se basó en la imagen elastográfica cualitativa obtenida durante el procedimiento estándar. Se seleccionaron dos áreas diferentes, áreas A y B. El área más grande posible de la lesión investigada se seleccionó como área A y el área B (rojo) fuera del tumor, siendo comparado con la pared del tracto digestivo. El SR se calculó automáticamente como el cociente B/A.
El cálculo de histograma de deformación se basó en la imagen elastográfica cualitativa obtenida durante el procedimiento estándar, la lesión a estudiar para el histograma se seleccionó manualmente. El valor medio del histograma correspondió a la dureza o elasticidad global de la lesión.
PAAF guiado por EUS
A todos los pacientes incluidos en el estudio, al completar la evaluación elastográfica se realizó PAAF guiado por EUS con aguja EchoTip Ultra (Cook Medical) N°22-G con técnica combinada de capilaridad y fanning (abanico) realizándose 2 pases de aguja. La muestra se envió para estudio histopatológico en frasco de formol.
Registro de datos
Se elaboró una ficha de recolección de datos en el que se registró las principales variables de estudio y los valores obtenidos en la evaluación de la elastografia, así como el resultado histopatológico final de las muestras de PAAF o en aquellas con pieza quirúrgica.
Evaluación del diagnóstico final
Los casos se clasificaron como benignos o malignos según resultados de PAAF o muestra quirúrgica en los casos operados:
-
Maligno: PAAF o muestra quirúrgica en casos operados con resultado de adenocarcinoma, neuroendocrino maligno o metástasis.
-
Benigno: PAAF con resultado de pancreatitis crónica, neuroendocrino benigno.
En los casos benignos se realizó seguimiento clínico durante un mínimo de 3 meses siendo compatibles con un diagnóstico benigno.
Análisis de Datos
Las variables continuas se presentan como medias con desviación estándar (SD) o medianas con rango intercuartílico (RI) según tipo de distribución, y las variables categóricas como frecuencias con porcentajes. Se determinó la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y exactitud diagnostica para la elastografía cualitativa (score de patrón de color) y elastografía cuantitativa (SR e histograma de deformación) para la detección de malignidad, los cuales fueron calculados con intervalos de confianza al 95%. Los valores de corte óptimo para la detección de malignidad fueron identificados por el análisis de curva ROC. Además se calculó el valor kappa de la variabilidad interobservador. Para el análisis se empleó el paquete estadístico Stata versión 10.
RESULTADOS
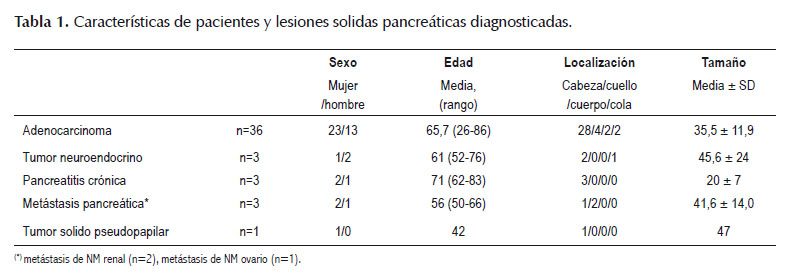
En el periodo de estudio se realizaron 846 ecoendoscopias, de las cuales 95 (11,2%) fueron por lesión solida pancreática (LSP). De éstos fueron excluidos 49 (17 examen sin elastografia, 14 lesiones solido-quísticas, 7 examen frustro/suspendido, 6 tumoración retroperitoneal, 2 colangiocarcinoma, 2 ampuloma, 1 PAAF frustro), incluyéndose al final 46 pacientes con estudio ecoendoscopico, elastografia y punción aspiración con aguja fina (PAAF). La edad promedio fue de 64,6 ± 13,9 años, siendo 29 (63%) de sexo femenino. Los tumores fueron localizados con mayor frecuencia en cabeza (n=35, 76,1%), seguido de cuello (n=6, 13%), cola (n=3, 6,5%) y cuerpo (n=2, 4,3%). El tamaño promedio fue de 35,8 mm (rango 11- 72 mm). El diagnostico final fue realizado con PAAF en 38 pacientes y por histología de la pieza quirúrgica en 8 pacientes. Los diagnósticos anatomopatológicos finales se muestran en la Tabla 1.
En cuanto a la elastografía cualitativa, el patrón de color predominante fue el score 3 (n=39, 84,8%), seguido del score 4 (n=5, 10,9%) y el score 2 (n=2, 4,4%). Las características diagnosticas de la elastografia cualitativa expresada en los score 2, 3 y 4 para la predicción de pancreatitis crónica, adenocarcinoma y tumor neuroendocrino respectivamente se detallan en la Tabla 2. Al evaluar la variabilidad interobservador se obtuvo una concordancia considerable entre los tres médicos endosonografistas del servicio (kappa= 0,67, p=0,005).
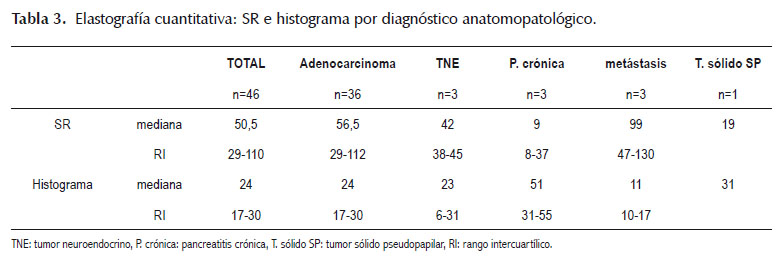
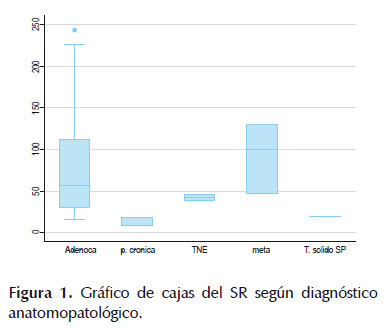
En cuanto a la elastografía cuantitativa, los resultados del SR e histograma se muestran en la Tabla 3. La mediana del SR del total de casos fue de 50,5 (rango 29-110), siendo mayor en los pacientes con metástasis pancreática (mediana = 99, rango 47-130) que en los pacientes con pancreatitis crónica que tuvieron el menor SR (mediana= 9, rango 8-37), Figura 1. En cuanto al histograma, la mediana del total de casos fue de 24 (rango 17-30), siendo menor en los pacientes con metástasis pancreática (mediana= 11, rango 10-17) que en aquellos con pancreatitis crónica (mediana= 51, rango 31-55).
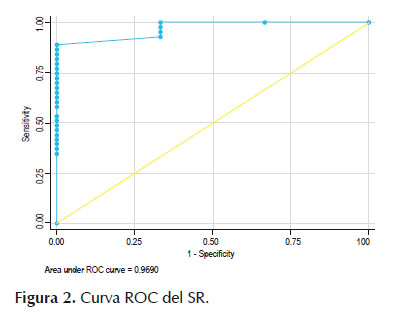
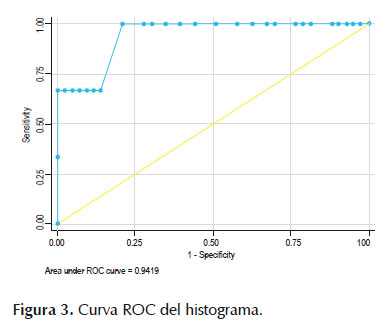
El análisis de la curva ROC mostró un área bajo de la curva ROC (Figura 2) de 0,969 (IC 95%, 0,90 – 1,0) con un valor de corte óptimo del SR para detectar malignidad de 15 con un LR+ de 3, sensibilidad de 100%, especificidad 66,67% y exactitud de 97,8%. En cuanto al histograma, el área bajo de la curva ROC (Figura 3) de 0,941 (IC 95%, 0,82 – 1,0) mientras que el mejor punto de corte para detectar malignidad fue de 49 con un LR+ de 28,6, sensibilidad de 66,67%, especificidad 97,6% y exactitud de 95,6%.
Medición de elastografía cuantitativa en relación con el diagnóstico final
El SR ≥ 15 detectó el 100% (36/36) de los todos los casos malignos mientras que el histograma de deformación < 49 detectó el 97,2% (35/36) de los casos malignos. En cuanto a la pancreatitis crónica (n=3) el SR<15 detectó al 100% (3/3) de los casos mientras que el histograma ≥ 49 detectó al 66,7% (2/3). Hubo un caso de LSP que fue clasificado como maligno por tener un histograma < 49 pero posteriormente el estudio anatomopatológico indicó pancreatitis crónica.
DISCUSIÓN
Los resultados de nuestro estudio muestran el primer reporte del rendimiento diagnóstico de la elastografia guiada por USE como herramienta diagnóstica en las lesiones solidas pancreáticas en nuestro medio.
De las LSP estudiadas con elastografia guiada por USE (n=46) el mayor porcentaje correspondió a adenocarcinoma pancreático (36/46, 78,3%) con una marcada predominancia de las lesiones malignas (adenocarcinoma, tumor neuroendocrino, metástasis y tumor solido pseudopapilar) con un total de 93,5% de los casos, mientras que solo 3 pacientes (6,5%) tuvieron diagnostico final de pancreatitis crónica, los que constituyeron los únicos casos de no malignidad en nuestro estudio. Estas características de la muestra estudiada inciden en los resultados obtenidos.
La elastografía cualitativa guiada por USE se basa en un sistema de calificación de patrón de color predominante que permite clasificarlo en un patrón de imagen o score (8) que sirve a su vez para predecir un diagnostico anatomopatológico definitivo en una lesión solida pancreática. Sin embargo, a pesar de que una limitación intrínseca de la elastografia cualitativa es que es una herramienta subjetiva, múltiples estudios remarcan su utilidad y reproducibilidad de la técnica (13-16). Así, en el estudio de Giovannini et al. (15) (en base a 5 patrones o scores) se obtuvo una sensibilidad, especificidad y precisión global de 92,3%, 80% y 89,2% respectivamente en el diagnóstico de malignidad en las LSP. Posteriormente, Iglesias et al. (8) en base a 4 patrones o scores elastográficos obtuvo un buen rendimiento diagnostico con una sensibilidad, especificidad y precisión global de 100%, 85,5% y 94%, respectivamente en el diagnóstico de LSP malignas. El sistema de calificación basada en color predominante y score propuesto en el estudio de Iglesias fue el mismo que se empleó en nuestro trabajo, aunque con resultados diferentes. Así, el rendimiento diagnóstico del score 3 para predecir adenocarcinoma tuvo una sensibilidad, especificidad y precisión global de 88,9%, 30% y 76,1% respectivamente. La explicación de tener una sensibilidad elevada con una especificidad muy baja se debe al elevado número de pacientes verdaderos positivos (adenocarcinoma pancreático) y al reducido número de verdaderos negativos (pacientes con pancreatitis crónica) en los casos estudiados. De igual forma, el rendimiento diagnóstico de los scores 2 y 4 para predecir pancreatitis crónica y tumor neuroendocrino respectivamente, se ven afectados por el reducido número de casos confirmados de pancreatitis crónica y tumor neuroendocrino (3 casos de cada entidad) lo que además limita la comparación con estudios similares (1,16).
En cuanto a la elastografía cuantitativa, se determinó en nuestro estudio en base al análisis de la curva ROC determinándose que el mejor punto de corte del strain ratio (SR) o relación de deformación para predecir malignidad fue de 15, de tal forma que un SR ≥ 15 en un paciente con LSP predice malignidad con una sensibilidad, especificidad y exactitud de 100%, 66,7% y 97,8% respectivamente, con una área bajo la curva de 0,969 (IC95% 0,90-1,0). En 2010, Iglesias et al. (17) publicaron un estudio de 86 pacientes con LSP en el que determinó un punto de corte para SR de 15,41 o más con una especificidad de 100% para determinar malignidad. Y más recientemente en el 2017, nuevamente Iglesias et al. (13) en un estudio de 62 pacientes con LSP determinó que un punto de corte de SR >10 fue el valor óptimo para predecir una LSP como maligna con una sensibilidad de 100% y un especificidad de 92,3%.
De igual forma, el análisis de la curva ROC del histograma de deformación en nuestro estudio mostró que el mejor punto de corte para predecir malignidad en un paciente con LSP en nuestro estudio fue de 49, con una sensibilidad, especificidad y exactitud diagnostica de 66,7%, 97,7% y 95,7% respectivamente, con una área bajo la curva de 0,942 (0,82 - 1,0). El punto de corte del histograma obtenido en nuestro estudio es similar al reportado por Iglesias y col en el que se identificó un punto de corte de 50 (13).
Es necesario remarcar que nuestro estudio tiene algunas limitaciones. Por un lado el reducido número de casos no malignos (pancreatitis crónica) puede limitar la interpretación de nuestros resultados determinando valores bajos de especificidad, mientras que por otro lado el elevado número de lesiones malignas puede afectar la interpretación de los valores predictivos positivos y negativos de todos los tests. Sin embargo, es preciso mencionar que las características de nuestra muestra, la cual fue obtenida por inclusión consecutiva de todos los pacientes con indicación de ecoendoscopia para estudio de LSP (con lo que se redujo el sesgo de selección), determina la proporción real de pacientes con LSP en nuestro medio con mayor predominancia de adenocarcinoma de páncreas y reducida frecuencia de LSP no malignas (pancreatitis crónica formadora de masas). Además, este es el primer reporte en nuestro medio del rendimiento diagnóstico de la elastografia en pacientes con lesiones solidas pancreáticas, por lo que nuestros resultados pueden servir como punto de comparación para posteriores estudios similares.
En resumen, y a pesar de las limitaciones del estudio, nuestros resultados avalan la utilidad clínica de la elastografía en el diagnóstico de las LSP, como complemento del resultado del PAAF. Si bien la punción aspiración con aguja fina (PAAF) continúa siendo el patrón de oro para el diagnóstico diferencial de los tumores pancreáticos, la elastografía guiada por USE puede mejorar de forma significativa el manejo de este tipo de casos y brindar información adicional para la predicción de la naturaleza de malignidad o benignidad de la lesión. La presencia de características como un patrón heterogéneo de predominio verde (score 2) o un SR <15 o histograma ≥49 (características que sugieren no malignidad) apoyan de forma significativa el resultado benigno de una punción y pueden permitir excluir un diagnóstico de malignidad, con lo cual no se insistiría en una segunda toma de PAAF. Por el contrario, la presencia de características elastográficas de malignidad (patrón heterogéneo de predominio azul = score 3 o un SR ≥ 15 o un histograma < 49) en aquellos casos de LSP con un resultado de PAAF negativo para malignidad obligarían a insistir en una segunda toma de PAAF para alcanzar un diagnóstico histopatológico definitivo.
En conclusión, la elastografía guiada por USE se muestra como una herramienta útil para la caracterización de las LSP al dar información importante del nivel de dureza de la lesión de forma cualitativa y cuantitativa, con lo cual puede predecir la naturaleza maligna o benigna de la lesión.
Durante la realización de un estudio ecoendoscópico la definición de un patrón elastográfico especifico (score 3) muestra una alta sensibilidad y baja especificidad para el diagnóstico de adenocarcinoma de páncreas.
En nuestro estudio la detección de un SR≥ 15 o un histograma < 49 predice con elevada sensibilidad y especificidad la presencia de malignidad en la LSP estudiada.
Conflicto de intereses: los autores expresamos no tener ningún conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Iglesias-Garcia J, Lindkvist B, Larino-Noia J, Domínguez-Muñoz JE. The role of EUS in relation to other imaging modalities in the differential diagnosis between mass forming chronic pancreatitis, autoimmune pancreatitis and ductal pancreatic adenocarcinoma. Rev Esp Enferm Dig. 2012;104(6):315-21. [ Links ]
2. Li X, Xu W, Shi J, Lin Y, Zeng X. Endoscopic ultrasound elastography for differentiating between pancreatic adenocarcinoma and inflammatory masses: a meta-analysis. World J Gastroenterol. 2013;19(37):6284-91. [ Links ]
3. Puli SR, Bechtold ML, Buxbaum JL, Eloubeidi MA. How good is endoscopic ultrasound-guided fine-needle aspiration in diagnosing the correct etiology for a solid pancreatic mass? A meta-analysis and systematic review. Pancreas. 2013;42(1):20-6. [ Links ]
4. Ge N, Zhang S, Jin Z, Sun S, Yang A, Wang B, et al. Clinical use of endoscopic ultrasound-guided fine-needle aspiration: Guidelines and recommendations from Chinese Society of Digestive Endoscopy. Endosc Ultrasound. 2017;6(2):75-82. [ Links ]
5. Giovannini M, Seitz JF, Monges G, Perrier H, Rabbia I. Fine-needle aspiration cytology guided by endoscopic ultrasonography: results in 141 patients. Endoscopy. 1995;27(2):171-7. [ Links ]
6. Eloubeidi MA, Tamhane A, Varadarajulu S, Wilcox CM. Frequency of major complications after EUS-guided FNA of solid pancreatic masses: a prospective evaluation. Gastrointest Endosc. 2006;63(4):622-9. [ Links ]
7. Iglesias-Garcia J, Lindkvist B, Larino-Noia J, Domínguez-Muñoz JE. Endoscopic ultrasound elastography. Endosc Ultrasound. 2012;1(1):8-16. [ Links ]
8. Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez-Munoz JE. Endoscopic ultrasound elastography for the characterization of solid pancreatic masses. Gastrointest Endosc. 2009;70(6):1101-8. [ Links ]
9. Chantarojanasiri T, Kongkam P. Endoscopic ultrasound elastography for solid pancreatic lesions. World J Gastrointest Endosc. 2017;9(10):506-3. [ Links ]
10. Cochlin DL, Ganatra RH, Griffiths DF. Elastography in the detection of prostatic cancer. Clin Radiol. 2002;57(11):1014-20. [ Links ]
11. Itoh A, Ueno E, Tohno E, Kamma H, Takahashi H, Shiina T, et al. Breast disease: clinical application of us elastography for diagnosis. Radiology. 2006;239(2):341-50. [ Links ]
12. Mei M, Ni J, Liu D, Jin P, Sun L. EUS elastography for diagnosis of solid pancreatic masses: a meta-analysis. Gastrointest Endosc. 2013;77(4):578-89. [ Links ]
13. Iglesias-Garcia J, Lindkvist B, Larino-Noia J, Abdulkader-Nallib I, Dominguez-Muñoz JE. Differential diagnosis of solid pancreatic masses: contrast-enhanced harmonic (CEH-EUS), quantitative-elastography (QE-EUS), or both? United European Gastroenterol J. 2017;5(2):236-46. [ Links ]
14. Giovannini M, Hookey LC, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: the first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38(4):344-8. [ Links ]
15. Giovannini M. Contrast-enhanced endoscopic ultrasound and elastosonoendoscopy. Best Prac Res Clin Gastroenterol. 2009;23(5):767-79. [ Links ]
16. Giovannini M. Endoscopic ultrasound elastography. Pancreatology. 2011;11 Suppl 2:34-9. [ Links ]
17. Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez-Munoz JE. Quantitative endoscopic ultrasound elastography: an accurate method for the differentiation of solid pancreatic masses. Gastroenterology. 2010;139(4):1172-80. [ Links ]
Correspondencia:
Alfonso Chacaltana Mendoza
Dirección: Jr. Sanchez Cerro 1868 Dpto 701 Jesus María 15702, Lima, Perú.
Teléfono: (+51) 976348028
E-mail: dralfonso_al@yahoo.com
Recibido: 11.02.19
Aprobado:18.03.19