Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.2 Lima abr./jun. 2019
ARTÍCULO DE REVISIÓN
Enfoque diagnóstico y terapéutico de dispepsia y dispepsia funcional: ¿qué hay nuevo en el 2019?
Diagnostic and therapeutic approach to dyspepsia and functional dyspepsia: what’s new in 2019?
Adán Lúquez Mindiola1,2, William Otero Regino3,4, Max Schmulson5,6,7
1 Universidad Nacional de Colombia. Bogotá, Colombia.
2 Centro de Enfermedades Digestivas, GutMédica. Bogotá, Colombia.
3 Hospital Universitario Nacional de Colombia, Universidad Nacional de Colombia. Bogotá, Colombia.
4 Centro de Gastroenterología y Endoscopia Digestiva, Bogotá - Colombia.
5 Facultad de Medicina, Universidad Nacional Autónoma de México. México DF, México.
6 Laboratorio de Hígado, Páncreas y Motilidad, Unidad de Investigación en Medicina Experimental, Hospital General de México "Dr. Eduardo Liceaga". Universidad Nacional Autónoma de México. México DF, México.
7 Gastroenterología y Endoscopía en Práctica Médica - Centro Médico ABC, México DF, México.
RESUMEN
La dispepsia abarca un conjunto de síntomas que se originan en la región gastroduodenal. Se caracteriza por dolor o ardor epigástrico, saciedad precoz y llenura pos-prandial. Según la relación de los síntomas con las comidas se divide en síndrome de dolor epigástrico y síndrome de malestar pos-prandial. Sin embargo, en la práctica clínica, frecuentemente se sobreponen. En los últimos años se ha cambiado el paradigma de las alteraciones fisiológicas gástricas y han aumentado las evidencias que apoya a la eosinofilia duodenal, como una alteración primaria que altera la fisiología gástrica y puede inducir la sintomatología. Así mismo, cada día hay mayor interés en la alteración de la microbiota. El tratamiento se basa en la supresión de ácido, procinéticos, neuromoduladores, psicoterapia, terapias alternativas y complementarias. Ningún tratamiento es universalmente eficaz en todos los pacientes.
Palabras clave: Dispepsia; Duodeno; Microbioma gastrointestinal; Tratamiento (fuente: DeCS BIREME).
ABSTRACT
Dyspepsia encompasses a set of symptoms that originate in the gastroduodenal region. It is characterized by pain or epigastric burning, early satiety and post-prandial fullness. According to the relationship of symptoms with meals, it is divided into epigastric pain syndrome and postprandial distress syndrome. However, in clinical practice, they frequently overlap. In recent years the paradigm of gastric physiological alterations has been changed and evidence supporting duodenal eosinophilia has increased, as a primary alteration that alters gastric physiology and can induce symptomatology. Every day there is more interest in the alteration of the microbiota. The treatment is based on the suppression of acid, neuromodulators, prokinetics, psychotherapy, alternative and complementary therapies. No treatment is effective in all patients.
Keywords: Dyspepsia; Duodenum; Gastrointestinal microbiome, Treatment (source: MeSH NLM).
INTRODUCCIÓN
Dispepsia (DP) etimológicamente significa "mala digestión" o "indigestión (1). Las descripciones iniciales de esta entidad se remontan a los escritos de Hipócrates y Galeno (1). La DP describe diversas molestias gastrointestinales superiores, de posible origen gastroduodenal, que incluyen dolor o ardor epigástrico, saciedad precoz y llenura pos-prandial (2,3). De manera frecuente e incorrecta, se le denomina "gastritis crónica" o "enfermedad ácido-péptica" (4). La DP afecta al 20% de la población mundial (5), aunque sólo el 40% consulta al médico de nivel primario (5). No afecta la sobrevida (6), sin embargo, impacta negativamente a la calidad de vida (7,8), la asistencia al trabajo y la productividad (9-11). Con frecuencia hay presentismo (asistencia al trabajo, pero sin desempeñar el trabajo correctamente) (10). Tiene un alto costo económico y en Estados Unidos (USA), genera gastos anuales superiores a 18 billones de dólares (12). Es más frecuente en mujeres, en fumadores y en sujetos que utilizan antinflamatorios no esteroideos (AINES) (5).
Cuando el origen de la sintomatología no se ha estudiado, se considera que se trata de "dispepsia no investigada" (DNI). Si en los exámenes diagnósticos se encuentra una lesión orgánica aparente que explique los síntomas, se denomina "dispepsia secundaria" (DS) y si no se encuentra una etiología, el diagnóstico es "dispepsia funcional (DF)" (13,14). Esta última se diagnostica con los criterios de Roma, de los cuales la versión de Roma IV (Ver más adelante) es la más reciente (13). De todos los pacientes con DNI, menos del 25% tendrán DS (5), cuyas causas más frecuentes son esofagitis erosiva (13%), ulcera péptica (10%), cáncer gastrointestinal (menos del 1%), medicamentos, enfermedades pancreáticas (incluyendo cáncer de páncreas), parásitos (Giardia lamblia, Strongyloides), enfermedades endocrinas (paratiroides, diabetes mellitus), gastroparesia y Helicobacter pylori (H. pylori) (menos del 5% de los infectados) (2,3). Es de anotar, que la gastroparesia si bien puede ser causa de dispepsia orgánica en pacientes con diabetes mellitus, por ejemplo, también es un mecanismo subyacente que puede estar presente en un subgrupo de pacientes con DF. En el consenso de Kioto, en el cual se clasificó la gastritis crónica y duodenitis, se realizó una distinción clínica de la DP causada por H. pylori y DF (15), y su diagnóstico se establece cuando los síntomas desaparecen 6 a 12 meses, después de erradicar la infección (15). Se desconocen los mecanismos involucrados en la mejoría de los síntomas cuando se erradica el H. pylori. Si bien la inflamación gástrica producida por este microorganismo, puede producir múltiples alteraciones en la fisiología y motilidad gástrica (16-18), también es plausible que la mejoría se relacione con cambios en la microbiota y no solo por la erradicación per se del H. pylori. En un meta-análisis reciente, se encontró que la mejoría de la DF fue más frecuente cuando en los esquemas se utilizaba metronidazol y tenían una duración mínima de 10 días (19). Además, se ha encontrado que la respuesta es mayor cuando se erradica H. pylori, y los pacientes tienen duodenitis microscópica (20). Estas observaciones destacan fundamentalmente la importancia de la microbiota y la disbiosis asociada a H. pylori. Mas aún, estudios recientes han demostrado que el H. pylori "no vive solo" en el estómago y su presencia modifica notablemente la microbiota gástrica no solo por las modificaciones en la secreción de ácido, sino también, porque sus productos metabólicos, pueden favorecer el crecimiento o la eliminación de otros microrganismos (21). Adicionalmente, la hiposecreción o hipersecreción de ácido, secundaria a gastritis antro-corporal o antral respectivamente, determinaría la aparición de diferentes micro-organismos en el duodeno y en el resto del intestino delgado (22). En la actualidad, la "disbiosis" se considera un factor importante en la fisiopatología de la DF, y puede estar asociada o no a H. pylori (23,24).
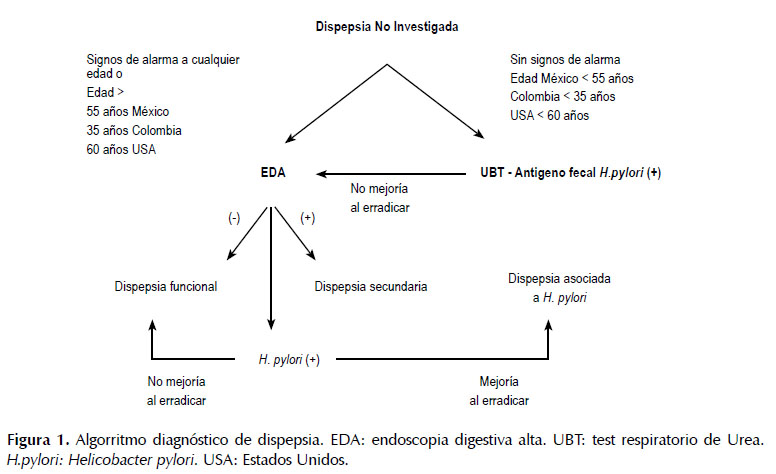
Más del 75% de los pacientes con DNI tienen DF (5). En USA, Canadá y el Reino Unido, el 10% de la población adulta tiene DF con base en los criterios de Roma IV (25). La decisión y elección de exámenes para descartar etiologías primarias en pacientes con DNI es diferente según los países y regiones, dependiendo fundamentalmente de la prevalencia de infección por H. pylori y la incidencia de cáncer gástrico (CG) (1). En la reciente guía conjunta de USA y Canadá, sobre el manejo de DP, se recomienda endoscopia digestiva alta (EDA) en pacientes mayores de 60 años (14). En México se recomienda a los 55 años o más (26), en Colombia (27) y en Asia (28) a los 35 años por mayor tasa de incidencia de CG. En contraste, en todas las guías, se recomienda la realización de EDA a menor edad si hay signos o síntomas de alarma independientemente de la región geográfica, Tabla 1. Si bien, se ha considerado que las "banderas rojas" son indicación absoluta de EDA, diferentes estudios han encontrado que esa sintomatología, tienen un bajo valor predictivo positivo para tumores gastro-intestinales superiores, ulcera péptica y esofagitis (14,29). Por lo anterior, la decisión para EDA basada en la edad, debe ser individualizada, teniendo en cuenta además, que si no hay mejoría con los tratamientos empíricos, también está indicada realizarla (14,26-28).
Clasificación de la dispepsia funcional
Roma IV (13), clasifica ahora a la DF en dos síndromes: síndrome de malestar pos-prandial (SDPP) y síndrome de dolor epigástrico (SDE), Tabla 2. El SDPP se caracteriza por saciedad precoz y llenura pos-prandial, las cuales deben estar presentes al menos tres veces por semana. Estos síntomas deben ser crónicos y molestos, deben estar presentes durante los tres meses previos con inicio de síntomas al menos seis meses antes del diagnóstico (13). La saciedad precoz, se identifica cuando el paciente siente llenura al consumir una porción pequeña de alimento, y en el interrogatorio se identifica que siente llenura, con menos alimentos de "lo usual". La llenura pos-prandial, denota que el paciente se "siente lleno" incluso muchas horas después de haber comido. Pueden existir otros síntomas inespecíficos como náuseas, sensación subjetiva de distensión abdominal (bloating), eructos y pirosis. En el 80% de los pacientes los síntomas empeoran con los alimentos (13).
El SDE se caracteriza por dolor o ardor epigástrico, cuya frecuencia debe ser por lo menos una vez por semana (13). El dolor puede ser inducido o aliviado por los alimentos y también puede ocurrir en ayuno. Las siguientes situaciones deben tenerse en cuenta al hacer el diagnóstico: (13): a) Puede coexistir la sensación subjetiva de distensión abdominal (bloating), eructos y náuseas, b) El vómito, no hace parte del SDE y su presencia sugiere otro trastorno, c) La pirosis puede coexistir, aunque no es un síntoma dispéptico, sino de enfermedad por reflujo gastroesofágico (ERGE), d) El dolor no debe cumplir las características de cólico biliar (dolor súbito, irradiado a la espalda, de intensidad creciente y sin oscilaciones en su intensidad) y no se alivia con las deposiciones o con la expulsión de gases. Esta última característica, lo diferencia del síndrome de intestino irritable (SII). Es importante considerar que en pacientes con SDE, pueden coexistir el SII y la ERGE (30).
La utilización de pictogramas que representan los diferentes síntomas, ha facilitado la identificación de los mismos, mejorando las descripciones verbales aisladas (31). Estas ayudas visuales, mejoran la comprensión del paciente sobre el significado de las preguntas y logran una mejor evaluación y concordancia entre pacientes y médicos sobre los síntomas de la DF (31). En la mitad de los pacientes, estos dos síndromes se pueden sobreponer (13). La división de DF por Roma IV es muy útil para identificar y estandarizar los pacientes en las investigaciones y poder excluir los que tienen ERGE (14). Sin embargo, en la reciente guía de USA y Canadá, se define DF como un cuadro clínico, caracterizado fundamentalmente por dolor epigástrico con duración mínima de un mes, asociado o no a saciedad precoz, llenura pos-prandial, náuseas, pirosis o vómito, en un paciente en quien la EDA y otras pruebas son negativas para otras causas de DP (14). Aunque, esta última definición, es clínicamente clara y facilita la identificación de los pacientes, hasta el momento no ha sido validada en trabajos de investigación (2,14).
Fisiopatología
La denominación "funcional", de los trastornos funcionales gastrointestinales (TFGI) ahora llamados trastornos de la interacción intestino-cerebro (TIIC), significa básicamente una "alteración de la función". No significa "enfermedad producida por el estrés" o "ausencia de enfermedad orgánica" (13). Esta consideración es fundamental ya que en la DF, existen claras anormalidades orgánicas como alteración de la motilidad, hipersensibilidad y activación del sistema inmune innato y adaptativo (1,13,32-34), con participación variable de los mismos, en cada paciente, lo cual hace que en la actualidad, la fisiopatología de esta entidad, sea muy compleja. Sin embargo, el término "funcional" puede tener una connotación psiquiátrica por lo cual Roma IV ha eliminado el término en la medida de lo posible, aunque no ha sido el caso en DF. Esto no excluye el hecho de que en pacientes con DF son frecuentes los trastornos como ansiedad y depresión (35) y la influencia en el eje intestino-cerebro es bidireccional (36). Las infecciones gastrointestinales agudas, pueden inducir la denominada "DF-Pos infección (DF-PI)", la cual puede aparecer en 10-20% de los pacientes, como ha sido ratificado en un meta-análisis (37). Las principales anormalidades gastroduodenales encontradas son alteración del vaciamiento gástrico, de la acomodación del fundus, hipersensibilidad duodenal a la distensión y otros estímulos intraluminales (1-3). El vaciamiento gástrico retardado se encuentra en el 35% de los pacientes, y aunque hay pocos estudios, algunos han mostrado también vaciamiento gástrico acelerado (13).
La división de DF en SDPP y SDE se basó en la concepción de que diferentes mecanismos fisiopatológicos podrían explicar cada uno de estos subtipos, así como también, orientar el tratamiento inicial de los pacientes. A este respecto, diversos estudios han encontrado, que además de las alteraciones motoras gástricas (retardo del vaciamiento, alteración de la relajación del fundus, hipersensibilidad gástrica), los pacientes con SDPP también tienen un aumento de eosinófilos intraepiteliales en la segunda porción del duodeno (38), (véase más adelante). En contraste, los pacientes con SDE presentan menos alteraciones motoras, pero tienen hipersensibilidad duodenal al ácido gástrico, a nutrientes, y a la distensión gástrica en ayuno y pos-prandial (3,39,40). No obstante, en un estudio reciente, no se encontró correlación entre las alteraciones motoras gástricas con ninguno de los dos subtipos de DF, como tampoco con la sobreposición de ambos (41). Estos hallazgos plantean la posibilidad de que la disfunción gástrica primaria no es el origen de los síntomas de la DF (42) y que la división de la DF, no permitiría orientar el tratamiento, como inicialmente se había pensado. Hallazgos similares, han motivado la búsqueda de alteraciones en sitios diferentes al estómago, que pudieran explicar el origen y alteraciones fisiopatológicas en la DF y el sitio más estudiado al respecto es el duodeno (43-53).
En el año 2007 Talley et al. demostraron que los pacientes adultos con eosinofilia duodenal, tenían más riesgo de DF (54) y hallazgos similares fueron encontrados en los niños (55). En otro estudio, ese grupo encontró que la infiltración de eosinófilos en la segunda porción del duodeno, fue más frecuente en los pacientes con SDPP y el compromiso simultáneo del bulbo y la segunda porción fue más frecuente en los pacientes con SDE (56). En un estudio reciente hemos encontrado eosinofilia duodenal con diferencia significativa en pacientes con saciedad precoz (57). El aumento de los eosinófilos en el duodeno, podría ser secundaria a la exposición al ácido gástrico y también a diferentes alérgenos presentes en los alimentos (50). La inflamación y los productos secretados por los eosinófilos pueden inducir alteraciones locales al estimular estructuras neuronales y contraer el músculo liso, además actuar sobre diferentes receptores (43,53). Los eosinófilos promueven la proliferación, maduración, supervivencia y degranulación de los mastocitos (58). Un estudio reciente que comparó hallazgos ultraestructurales en biopsias duodenales de pacientes con DF y controles sanos, evidenció mayor grado de degranulación en eosinófilos (p<0,0001) y disminución de la densidad granular en eosinófilos (p<0,0001) (59). Con respecto al recuento y tasa de degranulación de mastocitos los resultados son contradictorios. Algunos han encontrado aumento de estas dos alteraciones en pacientes con DF comparados con los controles sanos (60,61), aunque otros no encontraron diferencias en la degranulación de mastocitos en pacientes con DF (62) y los pacientes con DF tenían un contenido granular más heterogéneo (p<0,0001) (59). En una revisión sistemática y meta-análisis que hemos llevado a cabo sobre los mastocitos en intestino delgado de pacientes con SII que incluyó 3 estudios en duodeno, 6 en yeyuno y 5 en el íleon, encontramos que no hubo diferencias en el conteo de mastocitos en el duodeno, ni en el yeyuno; sin embargo, se encontraron incrementados en el íleon (63). Lo anterior sugiere que el sitio de infiltración de mastocitos, puede determinar el TIIC que se manifiesta, ya sea SII en caso de infiltración del intestino delgado distal y por supuesto colon, pero DF en caso de infiltración del intestino delgado proximal. Por otra parte, es posible que los mastocitos en el futuro sirvan como biomarcadores diagnósticos de SII y DF.
La inflamación secundaria a la infiltración de eosinófilos, podría producir también alteraciones de la motilidad antro-duodenal, aumento de la permeabilidad de la mucosa e inducir hipersensibilidad a diferentes sustancias (ácido, lípidos, y otros componentes de los alimentos) (39,43,53). Además, se han descrito alteraciones en la función neuronal, cambios estructurales en las neuronas entéricas y células gliales en los ganglios de la submucosa duodenal, aumento de la expresión de factor neurotrópico derivado de las células gliales que sirve para mantener la función de barrera epitelial, migración de células inflamatorias principalmente macrófagos CCR2-/CD68 positivos, disminución en la resistencia eléctrica trans-epitelial y alteraciones en la integridad mucosa intestinal, con expresión anormal de proteínas de adhesión celular a nivel de las uniones estrechas, uniones adherentes y desmosomas (47-49,52). Esta disminución en la resistencia eléctrica trans-epitelial puede permitir el paso de antígenos microbianos a la submucosa que puede desencadenar una activación inflamatoria de bajo grado cuyos mediadores pueden estimular las terminales entéricas y así desencadenar los síntomas de la DF (52).
Microbiota
La microbiota intestinal es un "órgano dinámico" con variedad de funciones bioquímicas, metabólicas e inmunológicas que repercuten en la salud y enfermedad, así como también en el eje intestino-cerebro (64). En pacientes con DF, se han encontrado alteraciones en la microbiota del fluído gástrico con respecto a la de los controles sanos, siendo más abundantes los Bacteroidetes con menor cantidad de Proteobacteria y ausencia de Acidobacteria (65). Se desconocen las causas de estas diferencias, aunque podría estar involucrado el reflujo del contenido del intestino delgado hacia el estómago, incluyendo ácidos biliares y bacterias intestinales (66). Además, en pacientes con DF se ha encontrado en el duodeno, aumento relativo de Streptococcus y disminución de los géneros anaeróbicos Prevotella, Veillonella y Actinomyces con respecto a los controles (66). Por otra parte, en diversos estudios, los pacientes con DF tienen con más frecuencia sobrecrecimiento bacteriano en el intestino delgado (SIBO), determinado mediante prueba de aliento espirado con lactulosa (23). Se considera que en algunos pacientes el SIBO, podría generar los síntomas después de episodios de gastroenteritis infecciosa. Las consecuencias metabólicas e inmunológicas del SIBO son múltiples e incluyen entre otras las siguientes: fermentación anormal de carbohidratos por la proliferación aumentada de bacterias coliformes, produciendo distensión luminal, aumento de la permeabilidad intestinal, perpetuación de la respuesta inmune en hospederos predispuestos (67), e incluso induciendo la aparición de enfermedades autoinmunes y empeorando las ya existentes (68). En cuanto a la DFPI, esta se presenta por lo menos 6 meses después de un episodio de gastroenteritis aguda y los patógenos más frecuentemente implicados son Salmonella spp., Escherichia coli O157, Campylobacter jejuni, Yersinia enterocolitica, Giardia lamblia, Rotavirus y Norovirus (69). Mearin et al., encontraron que después de gastroenteritis aguda por Salmonella enteritidis, el riesgo de padecer DF-PI es 5,2 veces mayor que en los sujetos no expuestos (70). Tack et al. encontraron que el 17% de los pacientes con síntomas dispépticos, tiene antecedentes de gastroenteritis aguda y en ellos es alta la prevalencia de alteraciones de la acomodación gástrica atribuible a disfunción a nivel de las neuronas nitrérgicas (71).
Diagnóstico y tratamiento
En pacientes con DNI, el abordaje diagnóstico debe comenzar con una detallada y completa historia clínica (3,13,14), para identificar las características de la sintomatología (dolor, ubicación, saciedad precoz, llenura pos-prandial, empeoramiento con los alimentos). Así mismo, determinar la presencia de "banderas rojas" o signos y síntomas de alarma. También se debe indagar sobre el uso de medicamentos que producen DP tales como aspirina, AINES y otros, precisando si al suspenderlos, se mejora la sintomatología. Aunque sean prominentes los síntomas pos-prandiales, no están indicados los estudios de motilidad (vaciamiento gástrico, acomodación, etc), ya que no hay evidencia definitiva de la asociación de esas molestias con trastornos de la motilidad (2,14,72,73). Si los síntomas predominantes son náuseas y vómito, si se debe considerar la posibilidad de gastroparesia, e iniciar el abordaje diagnóstico y terapéutico de la misma (74).
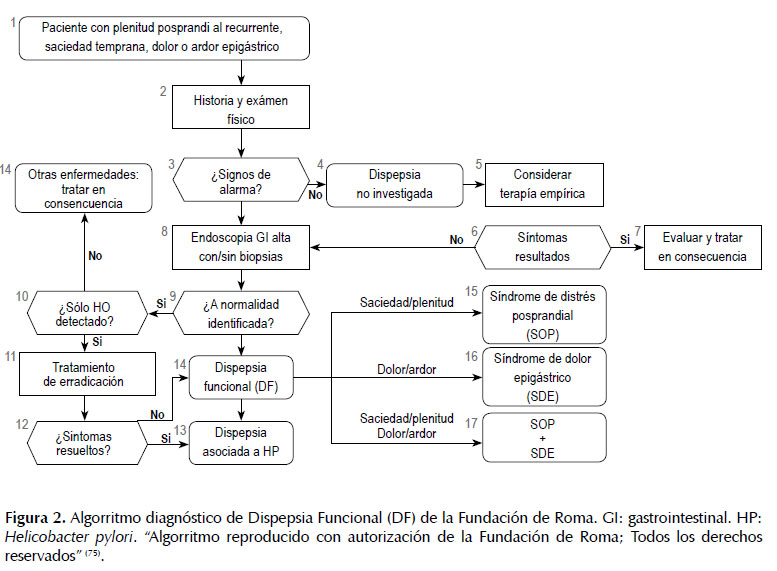
El enfoque diagnóstico está determinado por la recomendación local o regional para realizar EDA para descartar neoplasias del tubo digestivo superior, con base en la prevalencia de las mismas (14,26-28). Cuando los síntomas aparecen por debajo de la edad en la cual se recomienda la EDA, las opciones son investigar H. pylori por métodos no invasivos, tales como la prueba de aliento espirado con urea o UBT (Urea Breath Test) o con antígenos fecales, Figura 1. Si el H. pylori es positivo, se debe dar terapia de erradicación. En los pacientes infectados por H. pylori, la eficacia pos-erradicación, se obtiene en 24-84%, con un número necesario a tratar (NNT) de 12,5 (14). Aunque los síntomas de DF no mejoren, la erradicación del H. pylori trae beneficios a largo plazo ya que disminuye el riesgo de úlceras y CG (15,16). En quienes los síntomas no mejoren después de erradicar el H. pylori, se recomienda EDA y si es necesario, otros exámenes como ecografía hepatobiliar o tomografía de abdomen. En la Figura 2 se presenta el algorritmo diagnóstico de Roma IV. Dicho algorritmo en pacientes con DP, inicia descartando signos de alarma. Si hay alguno presente, se debe realizar EDA y ante la presencia de alguna anormalidad identificada, se debe tratar al paciente en consecuencia. En caso de encontrar H. pylori, se debe erradicar y si resuelven los síntomas, se concluye que se trataba de DP Asociada al H. pylori. Si no hay ninguna anormalidad en la EDA se trata de una DF y se debe clasificar el subtipo de DF. Así mismo, si al inicio no hay signos de alarma, se sigue la vía de la DNI en la cual se puede dar tratamiento empírico y si los síntomas no resuelven se debe realizar EDA y ante la ausencia de anormalidades se diagnostica DF y se clasifica según el subtipo de DF (75).
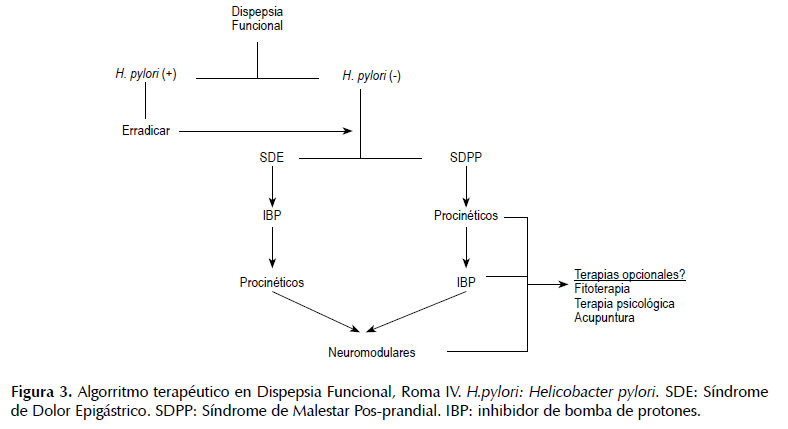
Luego de realizar el diagnóstico definitivo de DF, la conducta es iniciar un inhibidor de bomba de protones (IBP) (14). Si hay mejoría, se continúa con este medicamento y en caso contrario, iniciar antidepresivos tricíclicos (ATC) a dosis bajas como analgésicos viscerales (2,14). Si la respuesta es positiva, la conducta sería continuarlos y si no hay mejoría, se recomendaría iniciar procinéticos (PCN). Este enfoque terapéutico es recomendado por la guía conjunta de USA y Canadá (14). El enfoque terapéutico de Roma IV, en términos generales es similar al anterior. Sin embargo, tiene en cuenta la clasificación de SDE y SDPP, para decidir el tratamiento inicial con IBP en el primer subtipo o PCN en el segundo, respectivamente. Es importante anotar, que en el manejo de la DF es fundamental, mantener una excelente relación médico-paciente. La evidencia sobre la utilización de las diferentes terapias, se muestra a continuación.
Supresión ácida
Los IBP se consideran medicamentos de primera línea cuando los pacientes persisten con síntomas a pesar de la erradicación de H. pylori o son negativos para esta infección (14). En dos meta-análisis se confirmó que su eficacia es superior a placebo, con un NNT de 10 (14,76). No hay evidencia sobre la utilidad de los antagonistas de receptores de Histamina-2 (H2) (2,14). Los estudios con IBP han utilizado una dosis al día, por lo cual no son necesarias dosis más altas (14). Si en ocho semanas no hay mejoría, se deben suspender (2,14,77). Como la DF es recurrente, el tratamiento con IBP puede ser a demanda (78). El vonoprazan, un inhibidor competitivo de los canales de potasio, solo disponible en Japón, ha demostrado superioridad con respecto a los IBP convencionales en la ERGE y en erradicación de H. pylori (79,80), sin embargo, ha sido menos estudiado en pacientes con DF. El mecanismo por el cual los IBP mejoran los pacientes, no se conoce con exactitud, pero puede estar relacionado, con la disminución de los eosinófilos en el duodeno, y las diferentes alteraciones fisiopatológicas producidas por esas células (81). Ese efecto sistémico de los IBP es similar al encontrado en la esofagitis eosinofílica (82). También se considera que, al suprimir el ácido, ayudaría a mejorar la hipersensibilidad duodenal al ácido encontrada en esos pacientes (1,39,43). La utilización de IBP ha generado preocupación y confusión en los pacientes y en los médicos, por los potenciales efectos adversos de esos medicamentos en diferentes órganos y sistemas, sin embargo, hasta el momento, solo se ha encontrado asociación y no causalidad (83,84). Las investigaciones realizadas que les imputan efectos adversos serios, son estudios observacionales con múltiples sesgos, que impiden controlar muchas variables de confusión (84) y no satisfacen los más importantes criterios de causalidad de Bradford Hill (85). Efectos adversos reales incluyen mayor riesgo de encefalopatía en pacientes con cirrosis y ascitis (83,84) y nefritis intersticial por mecanismos idiosincráticos (84), SIBO sobre todo a largo plazo, diarrea, distensión abdominal y posible infección por Clostridium difficile (86). Expertos (83,84,87) y diferentes asociaciones internacionales (88,89), han publicado sus posiciones oficiales destacando fundamentalmente lo anotado y enfatizando que, como cualquier otro medicamento, su prescripción debe estar totalmente indicada y siempre utilizando la mínima dosis necesaria para alcanzar los objetivos terapéuticos. Los antiácidos y sucralfato no han demostrado eficacia en el control de los síntomas de DF y se consideran iguales al placebo (2).
Procinéticos
La calidad de la evidencia sobre la eficacia de los PCN en DF es baja, además no están disponibles en muchos países y tienen efectos adversos cuando se utilizan por períodos prolongados (2). En un meta-análisis reciente se documentó eficacia de los PCN en DF (90) con un NNT de 7, el cual aumenta a 12, cuando se excluye cisapride, un procinético retirado del mercado hace muchos años por efectos adversos serios (91). Los autores reconocen que la calidad de la evidencia es baja y que se necesitan ensayos clínicos de alta calidad con adecuado tamaño de la muestra (90). Expertos que han analizado esa publicación (92) concluyen que existe notable heterogeneidad entre los estudios incluidos y alto riesgo de sesgos. Los PCN que demostraron eficacia significativa por encima de placebo fueron cisapride, tegaserod y acotiamida. Sin embargo, los dos primeros fueron retirados del mercado de USA, aunque está disponible en algunos países de Latinoamérica como México, y acotiamida solo está disponible en India y Japón (92). Este último es un novedoso gastroprocinético que aumenta la liberación de acetilcolina en el sistema nervioso entérico vía antagonismo de receptor muscarínico e inhibición de acetilcolinesterasa, mejorando la acomodación y el vaciamiento gástrico (93). En un meta-análisis que incluyó 7 ensayos clínicos controlados, la acotiamida mostró mejoría global de los síntomas dispépticos con respecto a placebo, y al comparar los resultados según los subtipos de DF, la mejoría se observó en los pacientes con SDPP, sin mejoría en aquellos con SDE (94). Los eventos adversos no fueron significativamente diferentes con placebo (94). En un estudio reciente, Tack et al. reportaron en pacientes con SDPP, cuya mayoría fueron tratados con acotiamida por más de 50 semanas, que este tratamiento a largo plazo es seguro y al parecer mejora la calidad de vida y la productividad laboral (95). Una reciente revisión Cochrane concluyó que, por la baja y muy baja calidad de las evidencias, no se pudo establecer si los PCN son eficaces en DF (96). La guía conjunta USA y Canadá recomienda estos medicamentos como tercera línea, si no hay respuesta a IBP y ATC, en ese orden (14).
Neuromoduladores
Su interés en DF está relacionado con el impacto del eje cerebro-intestino en los TFGI (97). Los pacientes con DF más frecuentemente tienen depresión y ansiedad (98,99), las cuales pueden preceder hasta tres años los síntomas y el diagnóstico del trastorno funcional (100). La más reciente compilación de trabajos, en un meta-análisis concluyó que los psicótropos eran eficaces en DF, con un NNT de 6 (101). La eficacia fue encontrada para ATC como amitriptilina e imipramina, y antipsicóticos como sulpiride y levosupiride, sin embargo, produjeron más efectos adversos que el placebo (101). La guía conjunta USA y Canadá recomienda los ATC si el paciente no responde a IBP, con la recomendación de utilizarlos antes que los PCN (14).
Fitoterapia
Las preparaciones herbales o fitoterapia, han sido utilizadas desde hace muchos años para tratar molestias gastrointestinales. El rikkunshito (TJ-43) es una medicina herbal japonesa que produce relajación del fondo gástrico y mejora el vaciamiento gástrico (102). Su efecto farmacológico, probablemente se relaciona con los niveles plasmáticos de des-acil ghrelina (103). En un estudio reciente, los pacientes quienes recibieron rikkunshito tuvieron mejoría de los síntomas gastrointestinales, especialmente saciedad precoz, llenura pos-prandial y distensión subjetiva, y también mejoría de los síntomas psicológicos (104). El iberogast (STW 5), es otro producto herbal, que ha suscitado interés para el manejo de la DF (105). A nivel gastrointestinal tiene los siguientes efectos: reducción de la hipersensibilidad visceral, inhibición de la secreción ácida gástrica, relajación del fondo y cuerpo gástrico, y aumento de la contractilidad (105). En un estudio fue superior a placebo (106), pero se requiere más estudios para determinar su efectividad y seguridad (107). En una revisión sistemática, la medicina herbal china, fue superior a PCN en el alivio de los síntomas globales de DP (108). Otro producto investigado, es la mezcla aceite de menta con aceite de alcaravea y en un estudio fue más eficaz que el placebo en pacientes con SDE y SDPP, adicionalmente mejoró la calidad de vida (109). Su principal efecto adverso, fue la aparición de eructos transitorios (109).
Rifaximina
La rifaximina es un antibiótico intraluminal con efectos antibacterianos exclusivamente en el intestino delgado, con efectos antiinflamatorios y citoprotectores, en el colon, que además fomenta el aumento de bacterias benéficas (Bifidobacterium, Lactobacillus y Faecalibacterium prausnitzii) y experimentalmente disminuye la hipersensibilidad visceral (110). Por su excelente actividad en el intestino delgado y mínima absorción (0,4%), es un antibiótico ideal para el SIBO. En un estudio reciente en el cual se incluyeron 86 pacientes con DF comparado con placebo, se encontró que este antibiótico fue más eficaz en aliviar síntomas globales, llenura pos-prandial/distensión abdominal subjetiva y eructos (111). La respuesta fue mejor en las mujeres (111).
Terapia psicológica
Por la importancia del eje intestino - cerebro en DF, se ha planteado la utilidad de estas terapias. Existe controversia sobre la eficacia de las intervenciones psicológicas (psicoterapia, psicodrama, terapia cognitiva-conductual, relajación e hipnoterapia) en DF (2,107). Una revisión Cochrane concluyó que eran ineficaces (112). Sin embargo, en el meta-análisis de la guía USA y Canadá se encontró que eran eficaces en reducir los síntomas en DF, con un NNT de 3 (14), aunque los autores reconocieron que la calidad de la evidencia es baja y se requieren estudios mejor diseñados (14). Un inconveniente adicional para las investigaciones con esta intervención, es que no es fácil evitar los sesgos, por la dificultad en el cegamiento para la asignación del tratamiento (2).
Acupuntura
La acupuntura que comprende la acupuntura manual, electroacupuntura y acuestimulación eléctrica, se ha encontrado que puede mejorar los desórdenes de motilidad gastrointestinal (113). En una revisión Cochrane, se encontró que esta intervención no fue superior a cisapride, domperidona o itoprida, en la reducción de los síntomas en DF (114), aunque los trabajos incluidos eran de mala calidad. La electroacupuntura, fue superior al procedimiento fingido (sham), en un ensayo clínico con 200 pacientes con DF refractaria (115). Sin embargo, se necesitan más estudios y a largo plazo para poder evaluar la eficacia de esta terapia (116).
Conclusiones
La DF es una entidad frecuente en la cual los mecanismos patogénicos no están bien dilucidados. Según estudios recientes, la división que hace Roma IV en SDE y SDPP con base en los mecanismos fisiopatológicos, no se correlaciona con las alteraciones en la sensibilidad y función motora gástrica respectivamente y tampoco con la respuesta terapéutica. Recientemente, se ha encontrado que el duodeno un sitio clave dentro de la fisiopatología y el tratamiento de la DF, especialmente en el subtipo SDPP, por lo cual los expertos recomiendan tomar biopsias de duodeno en los pacientes con DNI. Por la pobre correlación entre los síntomas y alteraciones fisiopatológicas, en la actualidad el tratamiento de estos pacientes es un reto. Ningún tratamiento es universalmente eficaz probablemente por la gran heterogeneidad de los pacientes (117). Los diferentes tratamientos actualmente disponibles, han sido críticamente revisados por expertos y la más reciente recomendación, ha sido la guía conjunta USA y Canadá la cual propone iniciar el tratamiento con IBP y según respuesta, ATC y PCN. Las terapias complementarias, alternativas y emergentes, se utilizan en pacientes quienes persisten sintomáticos, sin embargo, los estudios con estos tratamientos son de baja calidad. En la Figura 3, se presenta un algorritmo de tratamiento para los pacientes con SDE y SDPP (117).
Conflicto de interés: los autores declaran no tener conflictos de interés.
Financiamiento: Ninguno.
REFERENCIAS BIBLIOGRÁFICAS
1. Koduru P, Irani M, Quigley EMM. Definition, pathogenesis and management of that cursed dyspepsia. Clin Gastroenterol Hepatol. 2018;16(4):467-79. [ Links ]
2. Black CJ, Houghton LA, Ford AC. Insights into the evaluation and management of dyspepsia: recent developments and new guidelines. Therap Adv Gastroenterol. 2018;11:1756284818805597. [ Links ]
3. Tack J, Talley NJ. Functional dyspepsia--symptoms, definitions and validity of the Rome III criteria. Nat Rev Gastroenterol Hepatol. 2013;10(3):134-41. [ Links ]
4. Otero W, Gómez M, Otero L. Enfoque del paciente con dispepsia y dispepsia funcional: actualización. Rev Col Gastroenterol. 2014;29(2):132-8. [ Links ]
5. Ford AC, Marwaha A, Sood R, Moayyedi P. Global prevalence of, and risk factors for, uninvestigated dyspepsia: a metaanalysis. Gut. 2015;64(7):1049-57. [ Links ]
6. Ford AC, Forman D, Bailey AG, Axon AT, Moayyedi P. Effect of dyspepsia on survival: a longitudinal 10-year follow-up study. Am J Gastroenterol. 2012;107(6):912-21. [ Links ]
7. Halder SL, Locke GR, Talley NJ, Fett SL, Zinsmeister AR, Melton LJ 3rd. Impact of functional gastrointestinal disorders on health-related quality of life: a population-based case control study. Aliment Pharmacol Ther. 2004;19(2):233-42. [ Links ]
8. Aro P, Talley NJ, Agréus L, Johansson SE, Bolling-Sternevald E, Storskrubb T, et al. Functional dyspepsia impairs quality of life in the adult population. Aliment Pharmacol Ther. 2011;33(11):1215-24. [ Links ]
9. Lacy BE, Weiser KT, Kennedy AT, Crowell MD, Talley NJ. Functional dyspepsia: the economic impact to patients. Aliment Pharmacol Ther. 2013;38(2):170-7. [ Links ]
10. Sander GB, Mazzoleni LE, Francesconi CF, Balbinotto G, Mazzoleni F, Wortmann AC, et al. Influence of organic and functional dyspepsia on work productivity: the HEROES-DIP study. Value Health. 2011;14(5 Suppl 1):S126-9. [ Links ]
11. Talley NJ, Vakil NB, Moayyedi P. American gastroenterological association technical review on the evaluation of dyspepsia. Gastroenterology. 2005;129(5):1756-80. [ Links ]
12. Lacy BE, Weiser KT, Kennedy AT, Crowell MD, Talley NJ. Functional dyspepsia: the economic impact to patients. Aliment Pharmacol Ther. 2013;38(2):170-7. [ Links ]
13. Stanghellini V, Chan FK, Hasler WL, Malagelada JR, Suzuki H, Tack J, et al. Gastroduodenal disorders. Gastroenterology. 2016;150(6):1380-92. [ Links ]
14. Moayyedi PM, Lacy BE, Andrews CN, Enns RA, Howden CW, Vakil N. ACG and CAG Clinical guideline: Management of Dyspepsia. Am J Gastroenterol. 2017;112(7):988-1013. [ Links ]
15. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-67. [ Links ]
16. Malfertheiner P, Megraud F, O`Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30. [ Links ]
17. Suzuki H, Moayyedi P. Helicobacter pylori infection in functional dyspepsia. Nat Rev Gastroenterol Hepatol. 2013;10(3):168-74. [ Links ]
18. Hurlimann S, Dür S, Schwab P, Varga L, Mazzucchelli L, Brand R, et al. Effects of Helicobacter pylori on gastritis, pentagastrin-stimulated gastric acid secretion, and mealstimulated plasma gastrin release in the absence of peptic ulcer disease. Am J Gastroenterol. 1998;93(8):1277-85. [ Links ]
19. Kim YJ, Chung WC, Kim BW, Kim SS, Kim JI, Kim NJ, et al. Is Helicobacter pylori associated functional dyspepsia correlated with dysbiosis? J Neurogastroenterol Motil. 2017;23(4):504- 16. [ Links ]
20. Mirbagheri SS, Mirbagheri SA, Nabavizadeh B, Ostovaneh MR, Hosseini SME, Rakhshani N, et al. Impact of microscopic duodenitis on symptomatic response to Helicobacter pylori eradication in functional dyspepsia. Dig Dis Sci. 2015;60(1):163-7. [ Links ]
21. Wroblewski LE, Peek RM Jr, Coburn LA. The role of the microbiome in gastrointestinal cancer. Gastroenterol Clin North Am. 2016;45(3):543-56. [ Links ]
22. Holtmann G, Talley NJ. Functional dyspepsia. Curr Opin Gastroenterol. 2015;31(6):492-8. [ Links ]
23. Costa MB, Azeredo Jr IL, Marciano RD, Caldeira LM, Bafutto M. Evaluation of small intestine bacterial overgrowth in patients with functional dyspepsia through H2 breath test. Arq Gastroenterol. 2012;49(4):279-83. [ Links ]
24. Grace E, Shaw C, Whelan K, Andreyev HJ. Review article: small intestinal bacterial overgrowth--prevalence, clinical features, current and developing diagnostic tests, and treatment. Aliment Pharmacol Ther. 2013;38(7):674-88. [ Links ]
25. Aziz I, Palsson OS, Törnblom H, Sperber AD, Whitehead WE, Simrén M. Epidemiology, clinical characteristics, and associations for symptom-based Rome IV functional dyspepsia in adults in the USA, Canada, and the UK: a cross-sectional population-based study. Lancet Gastroenterol Hepatol. 2018;3(4):252-62. [ Links ]
26. Bosques-Padilla F, Remes-Troche JM, González-Hueso MS, Pérez-Pérez G, Torres-López J, Abdo-Francis JM, et al. IV Consenso Mexicano sobre Helicobacter pylori. Rev Gastroenterol Mex. 2018;83(3):325-41. [ Links ]
27. Pineda LF, Rosas MC, Amaya M, Rodriguez A, Luque A, Agudelo F, et al. Guía de Práctica Clínica para el diagnóstico y tratamiento de la dispepsia en adultos. Rev Col Gastroenterol. 2015;30(Suppl. 1):9-16. [ Links ]
28. Chen SL, Gwee KA, Lee JS, Miwa H, Suzuki H, Guo P, et al. Systematic review with meta-analysis: prompt endoscopy as the initial management strategy for uninvestigated dyspepsia in Asia. Aliment Pharmacol Ther. 2015;41(3):239-52. [ Links ]
29. Vakil N, Moayyedi P, Fennerty MB, Talley N. Limited value of alarm features in the diagnosis of upper gastrointestinal malignancy: systematic review and meta-analysis. Gastroenterology. 2006;131(2):390-401. [ Links ]
30. de Bortoli N, Tolone S, Frazzoni M, Martinucci I, Sgherri G, Albano E, et al. Gastroesophageal reflux disease, functional dyspepsia ans irritable bowel syndrome: common overlapping gastrointestinal disorders. Ann Gastroenterol. 2018;31(6):639-48. [ Links ]
31. Tack J, Carbone F, Holvoet L, Vanheel H, Vanuytsel T, Vandenberghe A. The use of pictograms improves symptom evaluation by patients with functional dyspepsia. Aliment Pharmacol Ther. 2014;40(5):523-30. [ Links ]
32. Powell N, Walker MM, Talley NJ. The mucosal immune system: master regulator of bidirectional gut-brain communications. Nat Rev Gastroenterol Hepatol. 2017;14(3):143-59. [ Links ]
33. Talley NJ, Ford AC. Functional dyspepsia. N Engl J Med. 2015;373(19):1853-63. [ Links ]
34. Burns G, Carroll G, Mathe A, Horvat J, Foster P, Malker M, et al. Evidence for local and systemic immune activation in functional dyspepsia and the irritable bowel syndrome: A systematic review. Am J Gastroenterol. 2019;114(3):429-36. [ Links ]
35. Henningsen P, Zimmermann T, Sattel H. Medically unexplained physical symptoms, anxiety, and depression: a meta-analytic review. Psychosom Med. 2003;65(4):528-33. [ Links ]
36. Koloski NA, Jones M, Talley NJ. Investigating the directionality of the brain-gut mechanism in functional gastrointestinal disorders. Gut. 2012;61(12):1776-7. [ Links ]
37. Pike BL, Porter CK, Sorrell TJ, Riddle MS. Acute gastroenteritis and the risk of functional dyspepsia: a systematic review and meta-analysis. Am J Gastroenterol. 2013;108(10):1558-63. [ Links ]
38. Corsetti M, Fox M. The management of functional dyspepsia in clinical practice: what lessons can be learnt from recent literature? F1000Res. 2017;6:1778. [ Links ]
39. Carbone F, Tack J. Gastroduodenal mechanisms underlying functional gastric disorders. Dig Dis. 2014;32(3):222-9. [ Links ]
40. Di Stefano M, Miceli E, Tana P, Mengoli C, Bergonzi M, Pagani M, et al. Fasting and postprandial gastric sensorimotor activity in functional dyspepsia: postprandial distress vs. epigastric pain syndrome. Am J Gastroenterol. 2014;109(10):1631-9. [ Links ]
41. Vanheel H, Carbone F, Valvekens L, Simren M, Tornblom H, Vanuytsel T, et al. Pathophysiological abnormalities in functional dyspepsia subgroups according to the Rome III criteria. Am J Gastroenterol. 2017;112(1):132-40. [ Links ]
42. Talley NJ. Moving away from focussing on gastric pathophysiology in functional dyspepsia: new insights and therapeutic implications. Am J Gastroenterol. 2018;112(1):141-4. [ Links ]
43. Lee KJ, Tack J. Duodenal implications in the pathophysiology of functional dyspepsia. J Neurogastroenterol Motil. 2010;16(3):251-7. [ Links ]
44. van Boxel OS, ter Linde JJ, Oors J, Otto B, Weusten BL, Feinle-Bisset C, et al. Functional dyspepsia patients have lower mucosal cholecystokinin concentrations in response to duodenal lipid. Eur J Gastroenterol Hepatol. 2014;26(2):205-12. [ Links ]
45. van Boxel OS, ter Linde JJ, Siersema PD, Smout AJ. Role of chemical stimulation of the duodenum in dyspeptic symptom generation. Am J Gastroenterol. 2010;105(4):803-11. [ Links ]
46. Liebregts T, Adam B, Bredack C, Gururatsakul M, Pilkington KR, Brierley SM, et al. Small bowel homing T cells are associated with symptoms and delayed gastric emptying in fuctional dyspepsia. Am J Gastroenterol. 2011;106(6):1089- 98. [ Links ]
47. Cirillo C, Bessissow T, Desmet AS, Vanheel H, Tack J, Vanden Berghe P. Evidence for neuronal and structural changes in submucous ganglia of patients with functional dyspepsia. Am J Gastroenterol. 2015;110(8):1205-15. [ Links ]
48. Tanaka F, Tominaga K, Fujikawa Y, Nagami Y, Kamata N, Yamagami H, et al. Concentration of glial cell line-derived neurotrophic factor positively correlates with symptoms in functional dyspepsia. Dig Dis Sci. 2016;61(12):3478-85. [ Links ]
49. Futagami S, Shindo T, Kawagoe T, Horie A, Shimpuku M, Gudis K, et al. Migration of eosinophils and CCR2-/CD68- double positive cells into the duodenal mucosa of patients with postinfectious functional dyspepsia. Am J Gastroenterol. 2010;105(8):1835-42. [ Links ]
50. Walker MM, Salehian SS, Murray CE, Rajendran A, Hoare JM, Negus R, et al. Implications of eosinophilia in the normal duodenal biopsy – an association with allergy and functional dyspepsia. Aliment Pharmacol Ther. 2010;31(11):1229-36. [ Links ]
51. Friesen CA, Schurman JV, Colombo JM, Abdel-Rahman SM. Eosinophils and mast cells as therapeutic targets in pediatric functional dyspepsia. World J Gastrointest Pharmacol Ther. 2013;4(4):86-96. [ Links ]
52. Vanheel H, Vicario M, Vanuytsel T, Van Oudenhove L, Martinez C, Keita AV, et al. Impaired duodenal mucosa integrity and low-grade inflammation in functional dyspepsia. Gut. 2014;63(2):262-72. [ Links ]
53. Walker MM, Talley NJ. The role of duodenal inflammation in functional dyspepsia. J Clin Gastroenterol. 2017;51(1):12-8. [ Links ]
54. Talley NJ, Walker MM, Aro P, Ronkainen J, Storskrubb T, Hindley LA, et al. Non-ulcer dyspepsia and duodenal eosinophilia:an adult endoscopic population-based case-control study. Clin Gastroenterol Hepatol. 2007;5(10):1175-83. [ Links ]
55. Wauters L, Nightingale S, Talley NJ, Sulaiman B, Walker MM. Functional dyspepsia is associated with duodenal eosinophilia in an Australian paediatric cohort. Aliment Pharmacol Ther. 2017;45(10):1358-64. [ Links ]
56. Walker MM; Aggarwal KR, Shim LS, Bassan M, Kalantar JS, Weltman MD, et al. Duodenal eosinophilia and early satiety in functional dyspepsia: confirmation of a positive association in an Australian cohort. J Gastroenterol Hepatol. 2014;29(3):474-9. [ Links ]
57. Lúquez A, Otero W, Gómez M. Eosinofilia duodenal en pacientes Colombianos con dispepsia funcional: un estudio de casos y controles. Rev Gastroenterol Peru. 2019;39(1):21-6. [ Links ]
58. Piliponsky AM, Pickholtz D, Gleich GJ, Lvi-Schaffer F. Human eosinophils induce histamine release from antigenactivated rat peritoneal mast cells: a possible role for mast cells in late-phase allergic reactions. J Allergy Clin Immunol. 2001;107(6):993-1000. [ Links ]
59. Vanheel H, Vicario M, Boesmans W, Vanuytsel T, Salvo- Romero E, Tack J, et al. Activation of eosinophils and mast cells in functional dyspepsia: an ultrastructural evaluation. Sci Rep. 2018;8:5383. [ Links ]
60. Yuan HP, Li Z, Zhang Y, Li XP, Li FK, Li YQ. Anxiety and depression are associated with increased counts and degranulation of duodenal mast cells in functional dyspepsia. Int J Clin Exp Med. 2015;8(5):8010-4. [ Links ]
61. Wang X, Li X, Ge W, Huang J, Li G, Cong Y, et al. Quantitative evaluation of duodenal eosinophils and mast cells in adult patients with functional dyspepsia. Ann Diagn Pathol. 2015;19(2):50-6. [ Links ]
62. Du L, Shen J, Kim JJ, Yu Y, Ma L, Dai N. Increased duodenal eosinophil degranulation in patients with functional dyspepsia: a prospective study. Sci Rep. 2016;6:34305. [ Links ]
63. Robles A, Perez Ingles D, Myneedu K, Deoker A, Zuckerman MJ, Schmulson M, et al. Mast cells are increased in the small intestinal mucosa of patients with irritable bowel syndrome: a systematic review and meta-analysis. [en revisión] [ Links ].
64. Shin A, Preidis GA, Shulman R, Kashyap PC. The gut microbiome in adult and pediatric functional gastrointestinal disorders. Clin Gastroenterol Hepatol. 2019;17(2):256-74. [ Links ]
65. Igarashi M, Nakae H, Matsuoka T, Takahashi S, Hisada T, Tomita J, et al. Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia. BMJ Open Gastroenterol. 2017;4(1):e000144. [ Links ]
66. Zhong L, Shanahan ER, Raj A, Koloski NA, Fletcher L, Morrison M, et al. Dyspepsia and the microbiome: time to focus on the small intestine. Gut. 2017;66(6):1168-9. [ Links ]
67. Tziatzios G, Giamarellos-Bourboulis EJ, Papanikolaou IS, Pimentel M, Dimitriadis GD, Triantafyllou K. Is small intestinal bacterial overgrowth involved in the pathogenesis of functional dyspepsia? Med Hypotheses. 2017;106:26-32. [ Links ]
68. Pimentel M. Small intestinal bacterial overgrowth: Etiology and pathogenesis [Internet]. UpToDate. Febrero 2019 [citado el 11 de abril de 2019]. Disponible en: https://www.uptodate. com/contents/small-intestinal-bacterial-overgrowth-etiologyand- pathogenesis [ Links ]
69. Futagami S, Itoh T, Sakamoto C. Systematic review with meta-analysis: post-infectious functional dyspepsia. Aliment Pharmacol Ther. 2015;41(2):177-88. [ Links ]
70. Mearin F, Perez-Oliveras M, Perello A, Vinyet J, Ibañez A, Coderch J, et al. Dyspepsia and irritable bowel syndrome after a Salmonella gastroenteritis outbreak: one-year followup cohort study. Gastroenterology. 2005;129(1):98-104. [ Links ]
71. Tack J, Demedts I, Dehondt G, Caenepeel P, Fischler B, Zandecki M, et al. Clinical and pathophysiological characteristics of acute-onset functional dyspepsia. Gastroenterology. 2002;122(7):1738-47. [ Links ]
72. Asano H, Tomita T, Nakamura K, Yamasaki T, Okugawa T, Kondo T, et al. Prevalence of gastric motility disorders in patients with functional dyspepsia. J Neurogastroenterol Motil. 2017;23(3):392-9. [ Links ]
73. Van Den Houte K, Carbone F, Tack J. Postprandial distress syndrome: stratification and management. Expert Rev Gastroenterol Hepatol. 2019;13(1):37-46. [ Links ]
74. Tack J, Camilleri M. New developments in the treatment of gastroparesis and functional dyspepsia. Curr Opin Pharmacol. 2018;43:111-7. [ Links ]
75. Talley NJ. Trastornos gastroduodenales. En: Kellow J, Ed Invit. y Roma IV, Drossman DA, Chang L, Kellow J, Chey WD, Tack J, Whitehead WE, Eds. Rome IV: Algoritmos diagnósticos para síntomas GI comunes. 1ra ed. México: Permanyer México SA de CV; 2017. p. 25-35. [ Links ]
76. Pinto-Sánchez MI, Yuan Y, Bercik P, Moayyedi P. Proton Pump inhibitor for functional dyspepsia. Cochrane Database Syst Rev. 2017;3:CD011194. [ Links ]
77. Lacy BE, Talley NJ, Locke GR 3rd, Bouras EP, DiBaise JK, El- Serag HB, et al. Review article: current treatment options and management of functional dyspepsia. Aliment Pharmacol Ther. 2012;36(1):3-15. [ Links ]
78. NICE. Gastro-oesophageal reflux disease and dyspepsia in adults: investigation and management. Clinical Guideline CG184. London: NICE; 2014. [ Links ]
79. Suzuki H. New pharmacological treatments for gastroesophageal reflux: Potassium-competitive acid blockers and bile acid sequestrants. Neuro Gastro Latam Rev. 2018;2:18-27. [ Links ]
80. Mori H, Suzuki H. Role of acid supression in acid-related diseases: proton pump inhibitor and potassium-competitive acid blocker. J Neurogastroenterol Motil. 2019;25(1):6-14. [ Links ]
81. Potter MDE, Wood NK, Walker MM, Jones MP, Talley NJ. Proton pump inhibitors and supression of duodenal eosinophilia in functional dyspepsia. Gut. 2019;68(7):1339-40. [ Links ]
82. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, et al. Updated international consensus diagnostic criteria for eosinophilic esophagitis: proceedings of the AGREE conference. Gastroenterology. 2018;155(4):1022-33. [ Links ]
83. Vaezi MF, Yang YX, Howden CW. Complications of proton pump inhibitor therapy. Gastroenterology. 2017;153(1):35-48. [ Links ]
84. Targoownik L. Discontinuing long-term PPI therapy: why, with, whom, and how?. Am J Gastroenterol. 2018;113(4):519-28. [ Links ]
85. Hill AB. The environment and disease: association or causation? Proc R Soc Med. 1965;58(5):295-300. [ Links ]
86. Schmulson MJ, Frati-Munari AC. Bowel symptoms in patients that receive proton pump inhibitors. Results of a multicenter survey in Mexico. Rev Gastroenterol Mex. 2019;84(1):44-51. [ Links ]
87. Savarino V, Marabotto E, Zentilin P, Furnari M, Bodini G, De Maria C. Proton pump inhibitors: use and misuse in the clinical setting. Expert Rev Clin Pharmacol. 2018;11(11):1123-34. [ Links ]
88. Freedberg DE, Kim LS, Yan YX. The risks and benefits of long-term use of proton pump inhibitors: expert review and best practice advice from the American Gastroenterological Association. Gastroenterology. 2017;152(5):706-15. [ Links ]
89. de la Coba C, Argüelles-Arias F, Martín de Argila C, Júdez J, Linares A, Ortega-Alonso A, et al. Efectos adversos de los inhibidores de la bomba de protones: revisión de evidencias y posicionamiento de la Sociedad Española de Patología Digestiva. Rev Esp Enferm Dig. 2016;108(4):207-24. [ Links ]
90. Pittayanoun R, Yuan Y, Bollegala NP, Khanna R, Lacy BE, Andrews CN, et al. Prokinetics for functional dyspepsia: A systematic review and meta-analysis of randomized control trials. Am J Gastroenterol. 2019;114(2):233-43. [ Links ]
91. Tack J, Camilleri M, Chang L, Chey WD, Galligan JJ, Lacy BE, et al. Systemic review: cardiovascular safety profile of 5HT4 agonists developed for gastrointestinal disorders. Aliment Pharmacol Ther. 2012;35(7):745-67. [ Links ]
92. Tack J, Van Der Houte K, Carbone F. The unfulfilled promise of prokinetics for functional dyspepsia/postprandial distress syndrome. Am J Gastroenterol. 2019;114(2):204-6. [ Links ]
93. Tack J, Janssen P. Acotiamide (Z-388, YM443), a new drug for the treatment of functional dyspepsia. Expert Opin Investig Drugs. 2011;20(5):701-12. [ Links ]
94. Xiao G, Xie X, Fan J, Deng J, Tan S, Zhu Y, et al. Efficacy and safety of acotiamide for the treatment of functional dyspepsia: systematic review and meta-analysis. Scientific World Journal. 2014;2014:541950. [ Links ]
95. Tack J, Pokrotnieks J, Urbonas G, Banciu C, Yakusevich V, Bunganic I, et al. Long-term safety and efficacy of acotiamide in functional dyspepsia (postprandial distress syndrome)- results from the European phase 3 open-label safety trial. Neurogastroenterol Motil. 2018;30(6):e13284. [ Links ]
96. Pittayanon R, Yuan Y, Bollegala NP, Khanna R, Leontiadis GI, Moayyedi P. Prokinetics for functional dyspepsia. Cochrane Database Syst Rev. 2018;10:CD00943. [ Links ]
97. Drossman DA, Tack J, Ford AC, Szigethy E, Törnblom H, Van Oudenhove L. Neuromodulators for functional gastrointestinal disorders (Disorders of gut-brain interaction): A Rome Foundation Working Team Report. Gastroenterology. 2018;154(4):1140-71. [ Links ]
98. Jamil O, Sarwar S, Hussain Z, Fiaz RO, Chaudary RD. Association between functional dyspepsia and severity of depression. J Coll Physicians Surg Park. 2016;26(6):513-6. [ Links ]
99. Ly HG, Weltens N, Tack J, Van Oudenhove L. Acute anxiety and anxiety disorders are associated with impaired gastric accomodation in patients with functional dyspepsia. Clin Gastroenterol Hepatol. 2016;13(9):1584-91. [ Links ]
100. Jones MP, Tack J, Van Oudenhove L, Walker MM, Holtmann G, Koloski NA, et al. Mood and anxiety disorders precede development of functional gastrointestinal disorders in patients but not in the population. Clin Gastroenterol Hepatol. 2017;15(7):1014-20. [ Links ]
101. Ford AC, Luthra P, Tack J, Boeckxstaens GE, Moayyedi P, Talley NJ. Efficacy of psychotropic drugs in functional dyspepsia: systematic review and meta-analysis. Gut. 2017;66(3):411-20. [ Links ]
102. Suzuki H, Inadomi JM, Hibi T. Japanese herbal medicine in functional gastrointestinal disorders. Neurogastroenterol Motil. 2009;21(7):688-96. [ Links ]
103. Togawa K, Matsuzaki J, Kobayakawa M, Fukushima Y, Suzaki F, Kasugai K, et al. Association of baseline plasma des-acyl ghrelin level with the response to rikkunshito in patients with functional dyspepsia. J Gastroenterol Hepatol. 2016;31(2):334-41. [ Links ]
104. Tominaga K, Sakata Y, Kusonoki H, Odaka T, Sakurai K, Kawamura O, et al. Rikkunshito simultaneously improves dyspepsia correlated with anxiety in patients with functional dyspepsia: a randomized clinical trial (the DREAM study). Neurogastroenterol Motil. 2018;30(7):e13319. [ Links ]
105. Allescher HD, Abdel-Aziz H. Mechanism of action of STW 5 in functional dyspepsia and IBS: the origin of multi-target. Dig Dis. 2017;35 suppl 1:18-24. [ Links ]
106. von Arnim U, Peitz U, Vinson B, Gungermann KJ, Malfertheiner P. STW 5, a phytopharmacon for patients with functional dyspepsia: results of a multicenter, placebocontrolled double-blind study. Am J Gastroenterol. 2007;102(6):1268-75. [ Links ]
107. Schmulson MJ. How safe and effective is the herbal drug STW 5 for patients with functional dyspepsia? Nat Clin Pract Gastroenterol Hepatol. 2008;5(3):136-7. [ Links ]
108. Chu MHK, Wu IXY, Ho RST, Wong CHL, Zhang AL, Zhang Y, et al. Chinese herbal medicine for functional dyspepsia: systematic review of systematic reviews. Therap Adv Gastroenterol. 2018;11:1756284818785573. [ Links ]
109. Rich G, Shah A, Koloski N, Funk P, Stracke B, Köhler S, et al. A randomized placebo-controlled trial on the effects of Menthacarin, a proprietary peppermint- and caraway-oilpreparation, on symptoms and quality of life in patients with funtional dyspepsia. Neurogastroenterol Motil. 2017;29(11):doi:10.1111/nmo.13132. [ Links ]
110. Otero W, Otero L. Enfermedades digestivas tratables con antibióticos intraluminales. México: McGrawHill; 2016. [ Links ]
111. Tan VP, Liu KS, Lam FY, Hung IF, Yuen MF, Leung WK. Randomised clinical trial: rifaximin versus placebo for the treatment of functional dyspepsia. Aliment Pharmacol Ther. 2017;45(6):767-76. [ Links ]
112. Soo S, Moayyedi P, Deeks J, Delaney B, Lewis M, Forman D. Psychological interventions for non-ulcer dyspepsia. Cochrane Database Syst Rev. 2005;2:CD002301. [ Links ]
113. Chen JDZ, Ni M, Yin J. Electroacupuncture treatments for gut motility disorders. Neurogastroenterol Motil. 2018;30(7):e13393. [ Links ]
114. Lan L, Zeng F, Liu GJ, Ying L, Wu X, Liu M, et al. Acupuncture for functional dyspepsia. Cochrane Database Syst Rev. 2014;10:CD008487. [ Links ]
115. Zheng H, Xu J, Sun X, Zeng F, Li Y, Wu X, et al. Electroacupuncture for patients with refractory functional dyspesia: a randomized controlled trial. Neurogastroenterol Motil. 2018 Jul;30(7):e13316. [ Links ]
116. Kim KN, Chung SY, Cho SH. Efficacy of acupuncture treatment for functional dyspepsia: a systematic review and meta-analysis. Complement Ther Med. 2015;23(6):759-66. [ Links ]
117. Masuy I, Van Oudenhove L, Tack J. Review article: treatment options for functional dyspepsia. Aliment Pharmacol Ther. 2019;49:1134-72. [ Links ]
Correspondencia:
William Otero Regino
E-mail: waoteror@gmail.com
Recibido: 14.05.19
Aprobado: 10.06.19