Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.3 Lima jul./set. 2019
ARTÍCULOS ORIGINALES
Trombosis venosa portal en pacientes sometidos a trasplante de hígado
Portal vein thrombosis in patients undergoing to liver transplantation
José Rivera Romaní1a, Bertha Cárdenas Ramírez1b, Omar Mantilla Cruzatti1a,Wilmer Bacilio Calderon1a, P. Martin Padilla-Machaca1b, Carlos Rondón Leyva1a, José-Carlos Chaman Ortiz1a
1 Departamento de Trasplantes, Hospital Nacional Guillermo Almenara. Lima, Perú.
a Cirujano, b Gastroenterólogo
RESUMEN
Introducción: La trombosis venosa portal (TVP) es frecuente en los pacientes con cirrosis hepática, sometidos a trasplante hepático (TH); en nuestro medio, esta es la primera publicación con énfasis en resultados y estrategias quirúrgicas. Objetivo: Revisar la casuística del Hospital Nacional Guillermo Almenara Irigoyen, determinar características, tipos de TVP y el manejo quirúrgico. Materiales y métodos: Se analizaron las historias clínicas de los pacientes cirróticos sometidos a TH, que presentaron TVP, entre marzo 2000 a junio 2018. En dicho lapso se realizaron 255 trasplantes hepáticos en 239 pacientes, 229 adultos y 26 pediátricos; éstos últimos fueron excluidos. Resultados: Encontramos 27 pacientes con TVP (12,2%), diagnosticados en pre y durante el TH, ninguno de etiología maligna; las etiologías más frecuentes de la cirrosis fueron esteatohepatitis no alcohólica (37,4%), esteatohepatitis alcohólica (22%), hepatitis autoinmune (HAI) (11%), virus de hepatitis B (VHB) (7,4%) y otros (11,5%). Según la clasificación de Yerdel, encontramos: Grado I: 10 (37%), Grado II: 10 (37%), Grado III: 4 (15%) y Grado IV: 3 (11%). Las estrategias quirúrgicas empleadas fueron: trombectomía en 23 (85,2%); hemitransposición cavoportal en 2 (7,4%), anastomosis reno-portal con interposición de injerto venoso en 1 (3,7%) y la trombo-venectomía mas interposición de injerto venoso 1 (3,7%). En 2 casos se presentaron re-TVP (7,5%). Observamos que la TVP disminuyó la supervivencia del paciente posterior al TH: Al año (81,2%), 3 años (78,4%) y 5 años (78,4%) comparado con pacientes sin TVP 1 año (84,6%) 3 años (82,3%) y 5 años (82,3%). Conclusiones: Los pacientes cirróticos con TVP estuvieron clínicamente más descompensados, la supervivencia disminuyo a mayor grado de TVP. La conducta quirúrgica fue similar a otros centros trasplantadores; el diagnóstico temprano fue esencial para tomar una conducta quirúrgica anticipada y disminuir la morbimortalidad posterior al trasplante hepático.
Palabras clave: Trombosis venosa; Trasplante hepático; Cirrosis hepática (fuente: DeCS BIREME).
ABSTRACT
Introduction: Portal venous thrombosis (PVT) is common in patients with liver cirrhosis, undergoing liver transplantation (LT); in our setting, this is the first publication with an emphasis on results and surgical strategies. Objective: Was to review the case history of the Guillermo Almenara Irigoyen National Hospital, determine characteristics, types of PVT and surgical management. Materials and methods: We analyzed patients undergoing LT who presented PVT between March 2000 and Jun 2018. Of 255 liver transplants in 239 patients, 229 adults and 26 pediatric, these last were excluded. Results: We found 27 patients had PVT (12.2%) diagnosed in pre and during LT, none with malignant PVT, the most frequent etiologies of cirrhosis were non-alcoholic steatohepatitis (37.4%), alcoholic steatohepatitis (22%), autoimmune hepatitis (AIH) (11%), virus B hepatitis (VBH) (7.4%) and others (11.5%). According to PVT grade: Yerdel I in ten patients (37%), Yerdel II in te patients (37%), Yerdel III in four patients (15%) and Yerdel IV in three patients (11%). Surgical strategy used: thrombectomy in 23 cases (85.2%), hemitransposition cavoportal in 2 cases (7.4%), reno-porto anastomosis with interposition of venous graft in 1 case (3.7%) and thrombectomy with interposition of venous graft in 1 case (3.7%). The re - PVT was present in two cases (7.5%). The PVT decreased patient survival after LT 1 year (81.2%), 3 years (78.4%) and 5 years (78.4%) compared with patients without PVT 1 year (84.6%) 3 years (82.3%) and 5 years (82.3%) respectively. Conclusions: Cirrhosis with PVT was clinically more unbalanced, survival decreased to a higher degree of PVT. Surgical behavior similar to other transplant centers. Early diagnosis is essential to take early surgical action and decrease morbidity and mortality after LT.
Keywords: Venous thrombosis; Liver transplantation; Liver cirrhosis (source: MeSH NLM).
INTRODUCCIÓN
La trombosis venosa portal (TVP) es una complicación relativamente frecuente en los pacientes con cirrosis hepática sometidos a trasplante hepático (TH), con una incidencia que puede variar desde 0,6% hasta 25% (1-5).
La aparición de la TVP es compleja y multifactorial, sin embargo existen dos factores, uno local y otro sistémico que juegan un rol muy importante en la fisiopatología de la TVP en pacientes con cirrosis hepática (6). El primer factor es la disminución del flujo en la vena porta, lo cual es favorecido por la vasodilatación esplácnica y se agrava con la progresión de la alteración de la arquitectura hepática que conlleva al aumento de la resistencia vascular intrahepática y reducción del flujo portal. En ese sentido, Zocco et al., en un estudio prospectivo con una cohorte de 73 pacientes con cirrosis, determinó que la reducción de la velocidad de flujo portal fue la única variable predictiva para el desarrollo de la TVP (6).
El segundo factor es el disbalance hemostático, que presentan los pacientes con cirrosis hepática, sobre todo en los estados avanzados (estadios 3-6), donde por lo general la hipertensión portal es más severa (7). En estos pacientes puede existir status de hipercoagulabilidad o de tendencia al sangrado, debido a bajos niveles de proteína C y la antitrombina, además de la elevada concentración del dimero D (8,9).
Se ha reportado un genotipo trombofílico hasta en un 69,5% de pacientes con cirrosis que cursan con TVP, siendo el polimorfismo del gen de la protrombina el más frecuente de estos (10).
En el pasado, la TVP fue considerada una contraindicación absoluta para el TH, debido a la falta de estrategias quirúrgicas para poder realizar un óptimo restablecimiento del flujo portal hacia el injerto hepático.
En la actualidad, la TVP ya no se considera una contraindicación absoluta para el TH. La experiencia nos ha permitido aplicar diversas opciones quirúrgicas reportadas en el mundo (11) con el objetivo de mantener flujo venoso portal descomprimiendo el lecho esplácnico. Gracias a estas estrategias, este grupo de pacientes de nuestra serie, se beneficiaron con el TH, con resultados aceptables. Sin embargo, algunos estudios han demostrado un aumento de la mortalidad posterior al TH en pacientes con TVP completa (10,12).
En un análisis retrospectivo de 21 673 receptores de trasplante de hígado, basado en el registro de la red unificada para la distribución del órganos (UNOS, USA), la presencia de TVP fue identificada como un factor independiente de riesgo de mortalidad posterior al TH (11).
El objetivo fue revisar la casuística del Hospital Nacional Guillermo Almenara Irigoyen, determinar características, tipos de TVP y el manejo.
MATERIALES Y MÉTODOS
Se confeccionó una base de datos en el Departamento de Trasplantes del Hospital Nacional Guillermo Almenara Irigoyen, revisando las historias clínicas y reportes operatorios de forma retrospectiva, de 255 trasplantes hepáticos con donante cadavérico y donante vivo, realizados en 239 pacientes. Dicha revisión comprendió el periodo marzo 2000 a junio 2018, de los cuales 229 fueron adultos y 26 fueron pediátricos (la mayoría de estos con donante vivo relacionado). Para el presente estudio se consideró solo la población adulta.
De la población seleccionada, 27 pacientes tuvieron TVP, los cuales fueron diagnosticados antes y durante el TH lo cual representa el 12,2 % del total de trasplantados adultos, ninguno de ellos de etiología maligna o tumoral.
El presente estudio fue aprobado por la jefatura del Servicio de Trasplante de Hígado del Departamento de Trasplantes del Hospital Nacional Guillermo Almenara Irigoyen.
Los pacientes calificados para trasplantes, tuvieron de forma rutinaria ecografía de abdomen completo, doppler de hígado y TEM abdomino pélvico con contraste. En caso de sospecha de TVP se realiza TEM trifásica de hígado con reconstrucción vascular o RMN de hígado. Con estos estudios se confirmaron los casos de TVP y se excluyeron los pacientes con TVP de etiología neoplásica (HCC) y los casos de TVP Yerdel 3 y 4 sin shunt esplenorenal espontáneo o con historia previa de HDA por hipertensión portal.
Además durante el seguimiento en LE se realizaron imágenes de acuerdo al siguiente esquema: ultrasonografía doppler cada 3 meses, TEM trifásica contrastada cada 6 meses o antes si el flujo venoso portal medido por ecografía doppler fue menor de 15 cm/seg.
Por otro lado, los pacientes en LE con diagnóstico de TVP fueron anticoagulados con warfarina, manteniendo el INR entre 2 a 3 (12). La anticoagulación fue suspendida al momento del llamado para el TH.
Las técnicas operatorias disponibles para el manejo de la TVP, en pacientes con indicación de trasplante son:
a) Fisiológicas: 1. Trombectomía. 2. Trombovenectomía, con o sin interposición de injerto venoso. 3. Anastomosis mesentérico-portal, con interposición de injerto venoso. 4. Trasplante multivisceral (hígado e intestino).
b) No Fisiológicas: 1. Derivación reno-portal. 2. Hemitransposición cavo-portal.
La mayoría de los trasplantes de hígado en nuestra institución fueron realizados mediante técnica de Piggy Back sin derivación veno – venosa; la técnica clásica (con by pass V-V) sólo se utilizó en los primeros casos. El flujo venoso del injerto hepático fue restaurado por anastomosis término - terminal de la vena cava inferior del injerto al cuff de la venas hepáticas del receptor o mediante la técnica de anastomosis cava latero – lateral. Luego se realizó la anastomosis portal y reperfusión del injerto.
Finalmente la arteria hepática se confeccionó, en la mayoría de los casos, usando parche de Carrel a nivel de la arteria hepática propia y la arteria gastroduodenal o Carrel a nivel de arteria hepática común y esplénica, tanto en el receptor como en el injerto.
Además se utilizaron Injertos vasculares provenientes de la vena iliaca del donante para la reconstrucción del flujo venoso portal en los casos que tuvieron indicación.
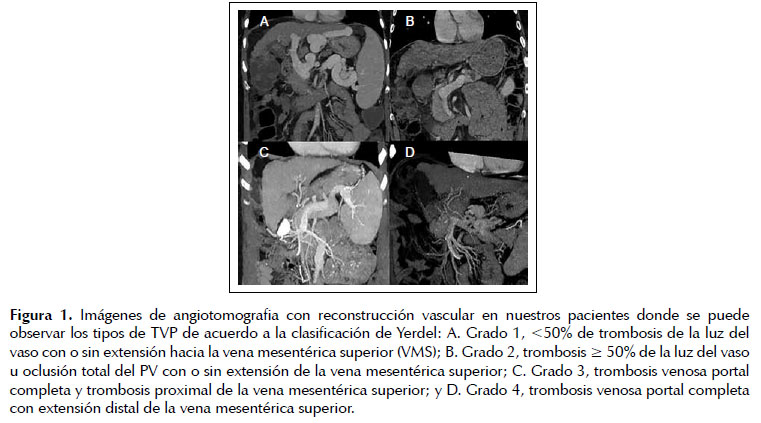
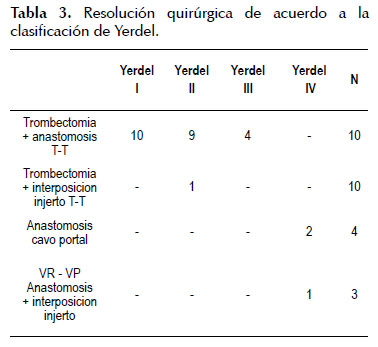
El grado y la extensión de la TVP fue evaluado y clasificado en el pre y/ o intra – operatorio, de acuerdo al sistema propuesto por Yerdel et al, como sigue: Grado 1, <50% de trombosis de la luz del vaso con o sin extensión hacia la vena mesentérica superior (VMS); Grado 2, trombosis ≥ 50% de la luz del vaso u oclusión total del PV con o sin extensión de la vena mesentérica superior; Grado 3, trombosis venosa portal completa y trombosis proximal de la vena mesentérica superior; y Grado 4, trombosis venosa portal completa con extensión distal de la vena mesentérica superior (13) (Figura 1).
El seguimiento post-trasplante se realizó mediante ultrasonografía doppler de forma rutinaria, diariamente durante la primera semana posterior al trasplante y luego cada semana hasta el primer mes; posteriormente cada 3 meses hasta el 6to. mes. A partir de esta fecha, cada 6 meses o cuando tenían sospecha de re-TVP. La TEM trifásica lo mantuvimos opcional a la información doppler.
Los exámenes de laboratorio, que incluyeron perfil hepático y hemograma completo y perfil de coagulación, fueron realizados diariamente durante la hospitalización y cada mes a partir de entonces.
Todos los pacientes trasplantados con TVP recibieron profilaxis antitrombótica cuando los valores del INR fueran menores de 1,5 y el recuento plaquetario mayor de 100 000.
Análisis estadístico
Todos los datos fueron analizados utilizando el software SPSS 13.0, aplicamos ![]() 2 o las pruebas exactas de Fisher para analizar los datos, y se realizó la regresión logística, para el análisis multivariante.
2 o las pruebas exactas de Fisher para analizar los datos, y se realizó la regresión logística, para el análisis multivariante.
Se midió la supervivencia desde el momento del trasplante hasta la muerte o el último seguimiento, y todas las causas de muerte fueron incluidas en el análisis de la supervivencia global.
Las curvas de supervivencia se construyeron utilizando el método de Kaplan-Meier y se comparó con la prueba log-rank. Un valor p de menos de 0,05 se consideró estadísticamente significativa.
RESULTADOS
El número de pacientes que fueron sometidos a trasplante de hígado con donante cadavérico y que cursaron con TVP fue de 27 (22 hombres y 5 mujeres), con edades de los receptores que van desde 20 hasta los 69 años (media ± SD, 52,8 ± 10,0) (Tabla 1).
Al momento del trasplante el promedio del score Child Pugh fue: para los que presentaron TVP Yerdel I 9,3 (7-11), para TVP Yerdel II 8,4 (7-11), para TVP Yerdel III 9,5 (7-13), para TVP Yerdel IV 11,3 (11-12).
Además al momento del trasplante el puntaje MELD fue: para los que presentaron TVP Yerdel I 19,2 (1429), para TVP Yerdel II 20,1 (13-33), para TVP Yerdel III 20,5 (12-37), para TVP IV 23,6 (22-26) (Tabla 2).
El momento del diagnóstico de TVP fue: En calificación en 6 pacientes (22,2%), en lista de espera en 12 (44,4%) y durante el trasplante en 9 pacientes (33,3%).
De los 27 pacientes que presentaron TVP, 10 pacientes (37%) tuvieron TVP grado I, 10 pacientes (37%) tuvieron TVP grado II, 4 pacientes (15%) tuvieron TVP grado III y 3 pacientes (11%) tuvieron TVP grado IV.
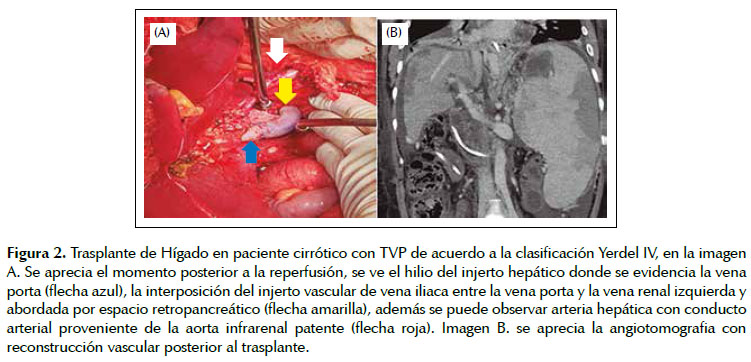
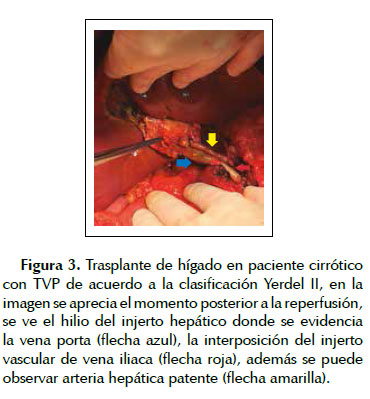
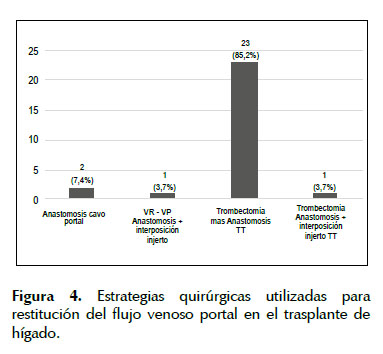
El manejo quirúrgico de la TVP durante el TH incluyó: 1) trombectomía seguida de anastomosis de las venas porta del receptor y el injerto en forma termino terminal en 23 pacientes (85,2%), 2) hemitransposicion cavo portal en 2 pacientes (7,4%), 3) interposición de injerto venoso entre la vena renal izquierda seccionada y la vena porta (Figura 2), en 1 paciente (anastomosis reno-portal) (3,7%), y trombo-venectomía de la vena porta seguido por la interposición del injerto venoso entre la vena porta del receptor y la vena porta del injerto, (Figura 3), en 1 paciente (3,7%). (Figura 4) (Tabla 3).
En nuestra casuística, 2 pacientes (7,5%) desarrollaron re – TVP.
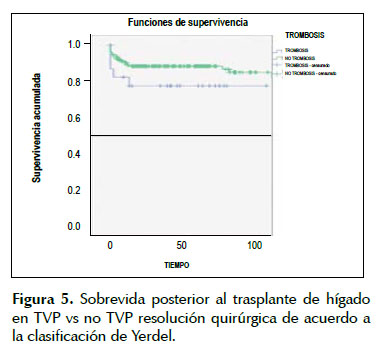
La supervivencia post trasplante con TVP al 1, 3 y 5 años fue: 81,2%, 78,4%% y 78,4% y sin TVP fue: 84,6%, 82,3% y 82,3% (Figura 5).
El período medio de seguimiento de los pacientes fue de 31,6 meses (rango, 3,4 - 105,1 meses).
DISCUSIÓN
Hasta principios de los años 80s, la TVP fue considerada una contraindicación absoluta para el TH. Con el tiempo y la experiencia acumulada, ha pasado a ser una dificultad técnica superable, en la mayor parte de los casos. Algunos grupos reportaron resultados favorables en pacientes con TVP y además se describieron estrategias efectivas para el manejo de la TVP durante TH (13-17). Por lo tanto, actualmente la TVP ya no es considerada una contraindicación absoluta para el TH.
Sin embargo, los reportes acerca de esta patología en trasplante de hígado siguen siendo relativamente limitados y, en nuestro país no existen. Por lo tanto, el presente estudio intenta contribuir al manejo de esta complicación de los pacientes cirróticos con indicación de trasplante hepático.
La fisiopatología de TVP es compleja, pero parece estar relacionada con la cirrosis hepática, por lo que un incremento de la presión de la vena porta está asociada a la lesión endotelial y formación de trombos (18,19). La incidencia de TVP, en los candidatos a TH varía del 2,1% al 26% (13,20). No obstante, otros autores estiman que la tasa de TVP en pacientes cirróticos puede llegar hasta el 64%, dependiendo del método de diagnóstico y de la definición (18,19). En ese sentido, se espera que en el futuro, los cirujanos de trasplante de hígado, encontrarán aún más pacientes con TVP.
En el presente estudio la tasa de TVP en los pacientes sometidos a TH fue de 12% y se presentaron casos de TVP hasta grado 4 de acuerdo a la clasificación de Yerdel. Esto puede deberse al estadio avanzado de la cirrosis hepática con el que entran los pacientes a lista de espera y posteriormente son sometidos a TH, ya que como se evidencia en el presente estudio cuanto mayor fue el grado de TVP mayor fue el MELD y en CHILD.
Los pacientes con TVP tipo 4 de Yerdel generalmente, presentan complicaciones asociadas, las cuales pueden incluir ascitis masiva, sangrado por varices esofágicas y la circulación colateral (12,17). Aunque varios centros de trasplante en el mundo han propuesto métodos quirúrgicos eficaces para el tratamiento de TVP extensa (grado 4 de Yerdel) (11,13,20). Potencialmente son más difíciles desde el punto de vista técnico e incrementan la morbilidad y la mortalidad. Además, la extensión de TVP parece influir en los resultados de los pacientes que fueron sometidos a trasplante de hígado (12,16,19).
Por lo expuesto anteriormente, aunque el TH en pacientes con TVP de grado 4 es factible, la decisión de realizar el procedimiento sólo debe realizarse después de una cuidadosa evaluación y discusión del estado clínico del paciente por parte del equipo del centro de trasplante. Además, la mortalidad de los pacientes cirróticos con TVP que no reciben TH ha sido reportado como 2,6 veces mayor que en los pacientes sin TVP (20).
Por lo tanto, el tiempo en lista de espera para TH debería ser más corto en pacientes con TVP ya que la sobrevida al año posterior al TH es de 81,2 %, en el presente estudio. Estos resultados son comparables con el estudio de Englesbe et al. en el cual se mostraron tasas de supervivencia a un año que van del 57% al 87% en pacientes con TVP sometidos a TH (21). Donde además se indicó que los receptores con TVP tenían un mayor riesgo de mortalidad versus receptores sin TVP. Esto sugiere que el TH en pacientes con TVP sigue siendo un procedimiento de alto riesgo.
Se debe tener en cuenta en el presente estudio que la causa de la mortalidad de algunos pacientes con y sin trombosis venosa portal se debieron además por la intercurrencia de multiples factores (sepsis, sangrado, trombosis de arteria hepática) que incrementaron la tasa de mortalidad hospitalaria. Sin embargo la diferencia observada podría atribuirse al pequeño tamaño de muestra de pacientes con TVP.
Un mayor número de pacientes o un análisis más detallado de la fisiopatología de los pacientes con TVP podría ser necesario para aclarar estos resultados, esto garantiza tener un mayor número de investigaciones al respecto.
La retrombosis portal (re - TVP) posterior al trasplante de hígado es una de las principales preocupaciones para el equipo trasplantador. En algunos estudios se reportaron desde 6,2% hasta 28,6% de re - TVP posterior al TH (22-25). En el presente estudio, se identificaron re-trombosis en 2 pacientes (7,5%).
En el presente estudio se sugiere que pueden utilizarse injertos venosos criopreservados de forma segura y sin afectar negativamente la supervivencia del injerto hepático y del paciente. La anticoagulación profiláctica para prevenir re - TVP posterior al TH sigue siendo controvertida; sin embargo, podría considerarse en pacientes con alto riesgo de re - TVP (26).
Durante el TH se pueden utilizar diversas técnicas quirúrgicas de reconstrucción de la vena porta, esto va a depender del grado de extensión de la TVP según la clasificación de Yerdel y además de la experiencia del cirujano.
En conclusión, la TVP es común en los pacientes con cirrosis hepática sometidos a TH y más aún cuando la cirrosis se encuentra en estadío avanzado, además afecta a la supervivencia cuanto mayor es el grado de TVP, al menos en el corto plazo posterior al trasplante.
Por lo tanto, la detección temprana de la TVP es esencial, además del inicio del tratamiento para intentar la repermeabilización de la vena porta y prevenir la extensión de la trombosis.
Aunque en el pasado la TVP fue considerada una contraindicación absoluta, actualmente se considera una contraindicación relativa y esto va a depender del grado y extensión de la TVP al momento del trasplante.
Se debería realizar una evaluación minuciosa del paciente en lista de espera para TH y así poder diagnosticar de forma anticipada y tener un plan estratégico al momento del TH.
En los pacientes sometidos a TH, sobre todo en pacientes con TVP, se debe tener una evaluación cercana mediante ultrasonografía doppler seriada para poder prevenir la retrombosis de la vena porta y asi disminuir la morbimortalidad posterior al TH.
Conflicto de interés: No existen conflictos de interés de ninguno de los autores en el estudio.
Citar como: Rivera Romaní J, Cárdenas Ramírez B, Mantilla Cruzatti O, Bacilio Calderon W, Padilla-Machaca PM, Rondón Leyva C, et al. Trombosis venosa portal en pacientes sometidos a trasplante de hígado. Rev Gastroenterol Peru. 2019;39(3):258-264
REFERENCIAS BIBLIOGRÁFICAS
1. Nonami T, Yokoyama I, Iwatsuki S, Starzl TE. The incidence of portal vein thrombosis at liver transplantation. Hepatology. 1992;16(5):1195-8. [ Links ]
2. Amitrano L, Guardascione MA, Brancaccio V, Margaglione M, Manguso F, Iannaccone L, et al. Risk factors and clinical presentation of portal vein thrombosis in patients with liver cirrhosis. J Hepatol. 2004;40(5):736-41. [ Links ]
3. Janssen HL, Wijnhoud A, Haagsma EB, van Uum SH, van Nieuwkerk CM, Adang RP, et al. Extrahepatic portal vein thrombosis: aetiology and determinants of survival. Gut. 2001;49(5):720-4. [ Links ]
4. Manzanet G, Sanjuan F, Orbis P, Lopez R, Moya A, Juan M, et al. Liver transplantation in patients with portal vein thrombosis. Liver Transpl. 2001;7(2):125-31. [ Links ]
5. Okuda K, Ohnishi K, Kimura K, Matsutani S, Sumida M, Goto N, et al. Incidence of portal vein thrombosis in liver cirrhosis. An angiographic study in 708 patients. Gastroenterology. 1985;89(2):279-86. [ Links ]
6. Zocco MA, Di Stasio E, De Cristofaro R, Novi M, Ainora ME, Ponziani F, et al. Thrombotic risk factors in patients with liver cirrhosis: correlation with MELD scoring system and portal vein thrombosis development. J Hepatol. 2009;51(4):682-9. [ Links ]
7. D’Amico G, Morabito A, D’Amico M, Pasta L, Malizia G, Rebora P, et al. Clinical states of cirrhosis and competing risks. J Hepatol. 2018;68(3):563-76.
8. Senzolo M, Burra P, Cholongitas E, Burroughs AK. New insights into the coagulopathy of liver disease and liver transplantation. World J Gastroenterol. 2006;12(48):7725-36. [ Links ]
9. Tripodi A, Primignani M, Chantarangkul V, Dell’Era A, Clerici M, de Franchis R, et al. An imbalance of pro- vs anticoagulation factors in plasma from patients with cirrhosis. Gastroenterology. 2009;137(6):2105-11.
10. Amitrano L, Brancaccio V, Guardascione MA, Margaglione M, Iannaccone L, D’Andrea G, et al. Inherited coagulation disorders in cirrhotic patients with portal vein thrombosis. Hepatology. 2000;31(2):345-8.
11. Paskonis M, Jurgaitis J, Mehrabi A, Kashfi A, Fonouni H, Strupas K, et al. Surgical strategies for liver transplantation in the case of portal vein thrombosis current role of cavoportal hemitransposition and renoportal anastomosis. Clin Transplant. 2006;20(5):551-62. [ Links ]
12. Rana A, Hardy MA, Halazun KJ, Woodland DC, Ratner LE, Samstein B, et al. Survival outcomes following liver transplantation (SOFT) score: a novel method to predict patient survival following liver transplantation. Am J Transplant. 2008;8(12):2537-46. [ Links ]
13. Yerdel MA, Gunson B, Mirza D, Karayalcin K, Olliff S, Buckels J, et al. Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome. Transplantation. 2000;69(9):1873-81. [ Links ]
14. De Pietri L, Montalti R, Nicolini D, Troisi RI, Moccheggiani F, Vivarelli M. Perioperative thromboprophylaxis in liver transplant patients. World J Gastroenterol. 2018;24(27):2937-43. [ Links ]
15. Egawa H, Tanaka K, Kasahara M, Takada Y, Oike F, Ogawa K, et al. Single center experience of 39 patients with preoperative portal vein thrombosis among 404 adult living donor liver transplantations. Liver Transpl. 2006;12(10):1512-8. [ Links ]
16. Molmenti EP, Roodhouse TW, Molmenti H, Jaiswal K, Jung G, Marubashi S, et al. Thrombendvenectomy for organized portal vein thrombosis at the time of liver transplantation. Ann Surg. 2002;235(2):292-6. [ Links ]
17. Tao YF, Teng F, Wang ZX, Guo WY, Shi XM, Wang GH, et al. Liver transplant recipients with portal vein thrombosis: a single center retrospective study. Hepatobiliary Pancreat Dis Int. 2009;8(1):34-9. [ Links ]
18. Stieber AC, Zetti G, Todo S, Tzakis AG, Fung JJ, Marino I, et al. The spectrum of portal vein thrombosis in liver transplantation. Ann Surg. 1991;213(3):199-206. [ Links ]
19. Belli L, Romani F, Sansalone CV, Aseni P, Rondinara G. Portal thrombosis in cirrhotics. A retrospective analysis. Ann Surg. 1986;203(3):286-91. [ Links ]
20. Sarfeh IJ. Portal vein thrombosis associated with cirrhosis: clinical importance. Arch Surg. 1979;114(8):902-5. [ Links ]
21. Davidson BR, Gibson M, Dick R, Burroughs A, Rolles K. Incidence, risk factors, management, and outcome of portal vein abnormalities at orthotopic liver transplantation. Transplantation. 1994;57(8):1174-7. [ Links ]
22. Englesbe MJ, Kubus J, Muhammad W, Sonnenday CJ, Welling T, Punch JD, et al. Portal vein thrombosis and survival in patients with cirrhosis. Liver Transpl. 2010;16(1):83-90. [ Links ]
23. Charco R, Fuster J, Fondevila C, Ferrer J, Mans E, Garcia- Valdecasas JC. Portal vein thrombosis in liver transplantation. Transplant Proc. 2005;37(9):3904-5. [ Links ]
24. Seu P, Shackleton CR, Shaked A, Imagawa DK, Olthoff KM, Rudich SR, et al. Improved results of liver transplantation in patients with portal vein thrombosis. Arch Surg. 1996;131(8):840-4. [ Links ]
25. Orlando G, De LL, Toti L, Zazza S, Angelico M, Casciani CU, et al. Liver transplantation in the presence of portal vein thrombosis: report from a single center. Transplant Proc. 2004;36(1):199-202. [ Links ]
26. Nikitin D, Jennings LW, Khan T, Vasani S, Ruiz R, Sanchez EQ, et al. Twenty years’ follow-up of portal vein conduits in liver transplantation. Liver Transpl. 2009;15(4):400-6.
27. Jia YP, Lu Q, Gong S, Ma BY, Wen XR, Peng YL, et al. Postoperative complications in patients with portal vein thrombosis after liver transplantation: evaluation with Doppler ultrasonography. World J Gastroenterol. 2007;13(34):4636-40. [ Links ]
Correspondencia:
José Rivera Romaní Av. Grau 800. La Victoria. Lima 13, Perú.
E-mail: joseriveraprom37@gmail.com