Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.3 Lima jul./set. 2019
ARTÍCULO DE REVISIÓN
Esófago de Barrett con displasia de alto grado o adenocarcinoma intramucoso: ¿EMR o ESD?
Barrett's esophagus with high grade dysplasia or intramucosal adenocarcinoma: EMR or ESD?
Josué Jesus Aliaga Ramos1,2, Vitor Arantes3,4,5
1 Servicio de Gastroenterología, Hospital Cayetano Heredia. Lima, Perú.
2 Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Unidad de Endoscopia, Instituto Alfa de Gastroenterología,Belo Horizonte, Minas Gerais, Brasil.
4 Facultad de Medicina, Universidad Federal de Minas Gerais. Belo Horizonte, Minas Gerais, Brasil.
5 Unidad de Endoscopia, Hospital Mater Dei Contorno. Belo Horizonte, Minas Gerais, Brasil.
RESUMEN
El esófago de Barrett (EB) es una entidad clínica relativamente frecuente con un importante impacto en la calidad de vida de estos pacientes. La incidencia de esta patología se ha incrementado en los últimos años debido al aumento de los diversos factores de riesgo que la condicionan, entre ellos principalmente la enfermedad por reflujo gastroesofágico. Se sabe del potencial oncogénico a la cual predispone esta condición clínica (displasia/adenocarcinoma) existiendo por tal motivo una recomendación de vigilancia endoscópica con la finalidad de detectar lesiones neoplásicas tempranas y ofrecer opciones terapéuticas menos invasivas siendo la resección endoscópica la de primera línea para estos casos. Sin embargo, uno de los puntos más controversiales en el manejo del esófago de Barrett complicado con alguna lesión pre-neoplásica o neoplásica temprana es el tipo de abordaje endoscópico resectivo: resección endoscópica de mucosa (EMR) o disección endoscópica de submucosa (ESD). Siendo esto sumamente importante debido a que una resección endoscópica completa (R0) independientemente de la técnica utilizada reduce significativamente la tasa de recurrencia local mejorando la sobrevida a mediano y largo plazo. El objetivo del presente artículo es revisar los principales estudios que nos ayuden a tener una visión más clara y a elegir el procedimiento endoscópico terapéutico resectivo de los mencionados (EMR/ESD) con mejor evidencia científica para este tipo de lesiones en pacientes con esófago de Barrett.
Palabras clave: Esófago de Barrett; Adenocarcinoma; Resección endoscópica de la mucosa (fuente: DeCS BIREME).
ABSTRACT
Barrett’s esophagus (BE) is a relatively common clinical entity with an important impact on the quality of life of these patients. The incidence of this pathology has been increasing in recent years due to an increase in the occurrence of predisposing factors such as gastroesophageal reflux disease. BE carries an oncogenic potential with the development of dysplasia or esophageal adenocarcinoma. Thus, endoscopic surveillance is recommended to BE patients, aiming to detect neoplastic transformation in an early stage, enabling less invasive therapeutic options like endoscopic resection as the first line of therapy. One of the most controversial issues in the recent management of Barrett’s esophagus complicated by a pre-neoplastic or early neoplastic lesion is the technique of endoscopic approach: endoscopic mucosal resection (EMR) or endoscopic submucosal dissection (ESD). This question is extremely important because a complete endoscopic resection (R0) regardless of the technique utilized significantly reduces local recurrence rate, improving survival in the medium and long term. The objective of this article is to review the most important studies published about this topic, in order to better understand which endoscopic therapeutic procedure of the aforementioned (EMR or ESD) may lead to better clinical outcome for this type of lesions in patients with Barrett’s esophagus.
Keywords: Barrett esophagus; Adenocarcinoma; Endoscopic mucosal resection (source: MeSH NLM).
INTRODUCCIÓN
La prevalencia e incidencia del esófago de Barrett (EB) se han ido incrementando en los últimos años según estudios actuales (1-3). Shiota et al. (3) en un reciente meta-análisis, encontró en 51 estudios, principalmente asiáticos, con un total de 453 147 pacientes una prevalencia agrupada de EB alrededor del 1,3%, con una asociación de lesiones pre-malignas y neoplásicas tales como displasia de bajo grado, displasia de alto grado y adenocarcinoma esofágico del 6,9%, 3% y 2% respectivamente. La progresión neoplásica del EB es uno de los parámetros clínicos más importantes que definen pronostico y morbimortalidad en este grupo de pacientes presentando según las últimas revisiones sistemáticas una incidencia anual agrupada del 0,33% (1 de cada 300 pacientes por año) siendo menor (0,19%) en el esófago de Barrett de segmento corto (1 de cada 500 pacientes por año), lo cual demuestra la baja tasa de incidencia acumulada de esta complicación neoplásica (2,3). Sin embargo, la alta mortalidad del cáncer de esófago en estadios avanzados, nos impulsa a encontrar formas de detectar tempranamente este tipo de lesiones en los pacientes con EB, para ofrecer un tratamiento curativo con procedimientos mínimamente invasivos mejorando asi la calidad de vida y la supervivencia a mediano y largo plazo.
Las nuevas técnicas de endoscopia avanzada tales como la endoscopia de alta definición, la cromoendoscopia digital o con ácido acético asociadas a la magnificación endoscópica, las cuales permiten una toma de biopsias dirigidas, han incrementado exponencialmente la sensibilidad y especificidad en la detección de este tipo de lesiones neoplásicas tempranas en pacientes con EB, logrando un tratamiento efectivo y oportuno en la mayoría de los casos generando tasas de supervivencia a los 5 años de hasta un 95% (4). La resección endoscópica completa de lesiones neoplásicas tempranas en pacientes con EB ha demostrado ser igual de eficaz que las técnicas resectivas quirúrgicas convencionales (esofagectomía) generando menores tasas de mortalidad y complicaciones asociadas al procedimiento (4,5).
Las 2 principales técnicas utilizadas para la erradicación endoscópica de este tipo de lesiones neoplásicas tempranas en el EB, son la mucosectomia o resección endoscópica de la mucosa (EMR) y la disección endoscópica de submucosa (ESD). Si bien ambas técnicas son empleadas en distintas partes del mundo las diferentes investigaciones aun no logran un consenso estandarizado que defina cuál de estas dos es la técnica óptima para el manejo de lesiones displasicas o neoplásicas malignas precoces en pacientes con esófago de Barrett, y que genere las mejores tasas de supervivencia a largo plazo con menores tasas de recurrencia local. La EMR fue la primera terapia endoscópica desarrollada y ha sido utilizada como tratamiento de las neoplasias superficiales de esófago por ser menos invasiva que la esofagectomía con similares tasas de efectividad. Sin embargo diferentes estudios han demostrado que la EMR usualmente solo es capaz de retirar en bloque lesiones pequeñas (< 10 o 15 mm) empleando resecciones tipo piecemeal para lesiones más grandes, lo cual predispone a una mayor tasa de recurrencia local y a una inadecuada evaluación histopatológica de los bordes de la lesión (lateral y vertical) (6-8) Es por este motivo que se comenzó a utilizar la ESD para el tratamiento de las neoplasias superficiales, la cual tiene la capacidad de resecar en bloque lesiones incluso mayores de 20 mm posibilitando una adecuada evaluación histológica de los bordes de la lesión y menores tasas de recidiva local (9-12).
El presente artículo tiene como objetivo principal reforzar los conocimientos en los nuevos avances endoscópicos en el tratamiento de lesiones displasicas y neoplásicas tempranas de pacientes con esófago de Barrett asimismo realizar una revisión detallada de los estudios más representativos sobre la técnica de ESD en el manejo de este tipo de lesiones, difundiendo aún más esta técnica para su mayor uso a nivel occidental especialmente en países latinoamericanos.
AVANCES EN EL DIAGNÓSTICO
El esófago de Barrett es una condición clínica usualmente asintomática incluso cuando está asociado a lesiones pre-malignas y neoplásicas tempranas. Algunos pacientes suelen presentar síntomas crónicos y refractarios de reflujo gastroesofágico por lo que se sugiere realizar en estos pacientes un examen endoscópico que nos permita detectar este cambio metaplasico intestinal, sobretodo si son mayores de 40 años, de raza caucásica, obesos, fumadores o presentan historia familiar de cáncer de esófago (1,3,4).
Las nuevas técnicas en endoscopia digestiva avanzada tales como la endoscopia de alta definición con luz blanca, la cromoendoscopia digital, el uso de soluciones como el ácido acético, la técnica de magnificación endoscópica, la endomicroscopia con focal han incrementado significativamente la sensibilidad diagnostica de lesiones displasicas y neoplásicas precoces en este grupo de pacientes con ayuda de la toma de biopsias dirigidas (4).
La cromoendoscopia digital con NBI (narrow band imaging) asociado a otras técnicas como la magnificación endoscópica ha sido utilizada ampliamente para la detección de lesiones neoplásicas tempranas en pacientes con esófago de Barrett con muy buenos resultados y con una sensibilidad diagnóstica cercana al 94% según los últimos estudios, sin embargo con la aparición de otros métodos diagnósticos como la endomicroscopia con focal laser se ha visto una mejora significativa en el hallazgo de lesiones neoplásicas precoces en estos pacientes (4,5) . Recientemente Xiong et al. (5) publicaron un meta-análisis en el cual se incluyeron 5 estudios con 251 pacientes comparando la capacidad diagnostica para la detección de lesiones neoplásicas tempranas en esófago de Barrett (displasia de alto grado y adenocarcinoma intramucoso) entre la cromoendoscopica digital con NBI y la endomicroscopia con focal laser encontrando una sensibilidad y especificidad agrupadas para la cromoendoscopia con NBI del 62,8% y 85,3% respectivamente mientras que para la endomicroscopia con focal laser se observó una sensibilidad y especificidad agrupadas del 72,3% y 83,8% respectivamente, lo cual demuestra la excelente rentabilidad diagnostica de esta técnica endoscópica para la detección de este tipo de lesiones. Además, investigaciones recientes han demostrado la utilidad de esta nueva herramienta de imagen endoscópica para la detección de metaplasia intestinal sub-escamosa en pacientes con mucosa esofágica reepitelizada posterior al tratamiento ablativo. Son pocos los estudios elaborados en relación a esta complicación uno de los más representativos fue el realizado por Swager et al. (6) los cuales emplearon la endomicroscopia con focal laser en 17 pacientes con mucosa esofágica escamosa aparentemente normal los cuales habían sido sometidos a ablación por radiofrecuencia por esófago de Barrett encontrando anormalidades en 13 de ellos de los cuales solo 1 presento confirmación histológica para metaplasia intestinal sub-escamosa presentando una frecuencia del 7,7% (1/13) lo cual nos muestra que esta novedosa técnica de imagen endoscópica es una buena alternativa para optimizar la detección de glándulas de Barrett enterradas, sin embargo se necesitan estudios a mayor escala y con una mayor cohorte de pacientes para consolidar su rol diagnóstico. Además, la gran limitación de la endomicroscopia con focal sigue siendo la bajísima disponibilidad en la práctica clínica diaria, sobretodo en Latinoamérica.
ESTADIFICACIÓN ENDOSCÓPICA DE LA NEOPLASIA TEMPRANA
El adenocarcinoma esofágico en pacientes con esófago de Barrett es una complicación infrecuente, pero con una alta tasa de mortalidad en estadios avanzados, el pronóstico de esta neoplasia maligna está directamente asociada al nivel de invasión tumoral en profundidad y esta a su vez con el riesgo de metástasis tanto locoregional como a distancia. Por este motivo es fundamental determinar con un alto grado de exactitud el nivel de extensión tumoral para de esta forma seleccionar adecuadamente a los pacientes que son candidatos para una resección endoscópica curativa (4,8,13).
Se define adenocarcinoma esofágico temprano cuando la extensión neoplásica afecta únicamente la mucosa y submucosa sin infiltración de la capa muscular, es así que las neoplasias esofágicas superficiales se clasifican en base a la penetración transmural de la siguiente manera: a) Cuando existe únicamente compromiso de la mucosa (adenocarcinoma intramucoso): m1: con afectación del epitelio y capa basal (carcinoma in situ o neoplasia intra-epitelial con displasia de alto grado), m2: lamina propia y m3: muscular de la mucosa b) Cuando existe infiltración tumoral en la submucosa sub-dividiendose en función de la extensión en profundidad en: Sm1: tercio superior, Sm2: tercio medio y Sm3: tercio inferior (8,13). El impacto clínico de conocer el grado de extensión neoplásica en sentido vertical es identificar el riesgo de metástasis linfovascular existente, debido a que presenta una relación directamente proporcional con esta forma de invasión tumoral. Según los estándares oncológicos actuales y la última guía sobre ESD propuesta por la Sociedad Europea de Endoscopia Gastrointestinal (ESGE) es necesario clasificar el riesgo de linfoadenopatias metastásicas de los adenocarcinomas intramucosos en pacientes con EB que van a ser sometidos a resección endoscópica con el fin de conocer si son candidatos a una resección curativa. Por este motivo se desarrollaron criterios para la identificación de adenocarcinomas de bajo riesgo tales como presencia de una invasión a la submucosa superficial (Sm1, ≤ 500 µm), grado de diferenciación celular G1 o G2, ausencia de invasión linfovascular y tamaño tumoral < 3 cm, los cuales confieren un riesgo de metástasis a ganglios linfáticos de solo 1,4% generando tasas de resección endoscópica curativa con una escisión completa en bloque por encima del 95%. Por otro lado los adenocarcinomas de alto riesgo de metástasis linfática en EB que no cumplen los criterios antes mencionados en los cuales la probabilidad de una resección curativa es baja deberían ser sometidos a una terapia quirúrgica (esofagectomía) para erradicar completamente la enfermedad mejorando la sobrevida a mediano y largo plazo (13,14).
Se sabe que la tomografía computarizada es el primer examen de imagen a realizar para el estadiaje de neoplasias esofágicas buscando metástasis a distancia sin embargo su sensibilidad para la detección de lesiones pequeñas es baja, es por esto que en pacientes con esófago de Barrett y lesión focal neoplásica se deben emplear técnicas de estadiaje más sofisticadas con el fin de determinar con exactitud el grado de extensión tumoral en profundidad. La ultrasonografía endoscópica es una de las herramientas que más se ha utilizado para evaluar el estadiaje locoregional en este grupo de pacientes con una sensibilidad cercana al 80% (8,13). Sin embargo algunos estudios recientes han demostrado que su uso en pacientes con esófago de Barrett y displasia de alto grado o adenocarcinoma superficial no debe ser considerado como único método de detección de invasión neoplásica a capas más profundas sino siempre complementarse con otras técnicas endoscópicas que sugieran infiltración a nivel submucoso tales como un inadecuado lifting, lesión Paris 0-IIa+IIc y extensión horizontal mayor de 15 mm (15,16). Por lo tanto en centros en donde no se cuente con un eco-endoscopio se podría únicamente realizar una evaluación endoscópica minuciosa de la lesión neoplásica sin necesidad de retrasar el procedimiento resectivo por falta de este equipo (17,18,19).
INDICACIONES DEL TRATAMIENTO ENDOSCÓPICO EN EL ESÓFAGO DE BARRETT NEOPLÁSICO
Debido al potencial oncogénico que presenta el esófago de Barrett este debe ser periódicamente vigilado endoscópicamente. En los pacientes que no presenten cambios displásicos está indicado, según las guías actuales de manejo, mantener solo vigilancia endoscópica entre 3 a 5 años, no siendo necesaria la terapia ablativa endoscópica o cualquier otro tipo de terapia en estos casos (4,20). En pacientes que presentan EB y displasia de bajo grado sin lesión focal visible, existen estudios recientes que demuestran que la terapia endoscópica ablativa reduce significativamente la progresión a displasia de alto grado y/o adenocarcinoma intramucoso en comparación con la sola vigilancia endoscópica cercana sugerida por las guias de manejo (cada 6 a 12 meses) (4,13,21). Quimseya et al. (20) elaboro un meta-análisis incluyendo 19 estudios con un total de 2746 pacientes en el cual se comparó la tasa de incidencia acumulada de displasia de alto grado y adenocarcinoma intramucoso en pacientes con esófago de Barrett con displasia de bajo grado entre aquellos que fueron sometidos a ablación endoscópica por radiofrecuencia y los que solamente tuvieron seguimiento endoscópico. Los autores encontraron una tasa de progresión a displasia de alto grado y adenocarcinoma intramucoso en pacientes sometidos a terapia ablativa de 1% y 1,2% respectivamente mientras que en el grupo control de seguimiento endoscópico fue de 7,9% y 5,9% respectivamente, lo cual nos muestra el rol profiláctico para lesiones neoplásicas de la ablación endoscópica en estos pacientes, idealmente realizada con radiofrecuencia (RFA) que es el método con mayor evidencia científica según la mayoría de estudios. Sin embargo, un punto crítico sobre este tipo de terapia es el riesgo de aparición durante el seguimiento, de glándulas enterradas de Barrett debajo del epitelio neo escamoso, por lo que se sugiere mantener una vigilancia endoscópica a pesar de la erradicación completa de la metaplasia intestinal con una evaluación endoscópica e histológica detallada de las áreas re-epitelizadas post terapia ablativa (6,7). Diferentes grupos de investigación han demostrado que la terapia combinada de resección endoscópica completa de la lesión focal visible más la erradicación del esófago de Barrett restante ya sea por ablación endoscópica o mucosectomia es el tratamiento de elección en este grupo de pacientes, con el fin de reducir la incidencia de lesiones neoplásicas metacrónicas a mediano y largo plazo (12,13,21).
Otro de los puntos fundamentales en el abordaje diagnostico-terapéutico de este tipo de lesiones neoplásicas en pacientes con esófago de Barrett es la adecuada estadificación tumoral, la cual se ve parcialmente afectada por la frecuente discordancia existente entre el resultado histopatológico de la biopsia previa al tratamiento endoscópico y el reporte histológico final del espécimen resecado la cual fluctúa según los últimos estudios entre el 20% al 40%. Recientemente Werbrouck et al. (22) corroboro estos resultados en una gran cohorte de pacientes encontrando una precisión diagnostica de la biopsia pre-resección endoscópica del 61% en 142 procedimientos, con un grado de discordancia entre la biopsia y el espécimen resecado del 39% (55/142) de los cuales 23 casos (16%) redujeron la estadificación inicial y 32 casos (23%) la incrementaron. La exactitud en la estadificación de las lesiones focales en esófago de Barrett que son candidatas a resección endoscópica es fundamental debido a que en la mayoría de casos el reporte histopatológico final incrementa el grado de avance oncológico generando cambios importantes en el pronóstico y tratamiento. Lo cual a la vez reafirma la importancia de la resección completa en bloque para una adecuada evaluación histopatológica del espécimenresecado.
Los pacientes con EB que presentan una lesión displásica de alto grado o neoplásica temprana focal visible actualmente presentan una controversia en la elección de la técnica endoscópica resectiva más eficaz. Los dos procedimientos resectivos más utilizados para la erradicación de este tipo de lesiones son la EMR y la ESD. Diferentes trabajos de investigación han encontrado ventajas y desventajas de cada una de estas dos técnicas en el abordaje de estas lesiones. A continuación haremos una revisión detallada de los estudios más representativos en relación a estas dos técnicas de resección endoscópica.
EMR EN EL ESÓFAGO DE BARRETT NEOPLÁSICO
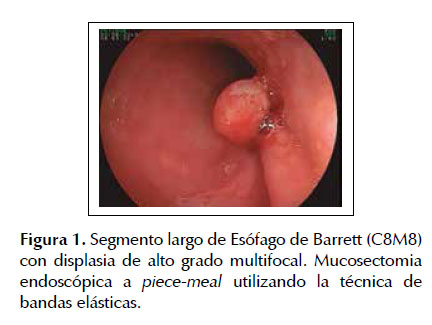
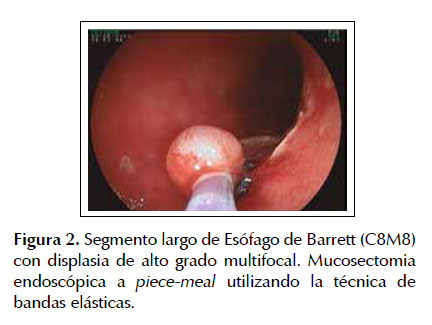
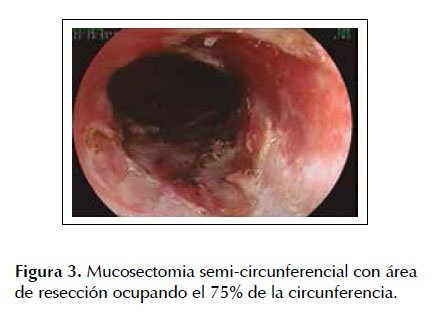
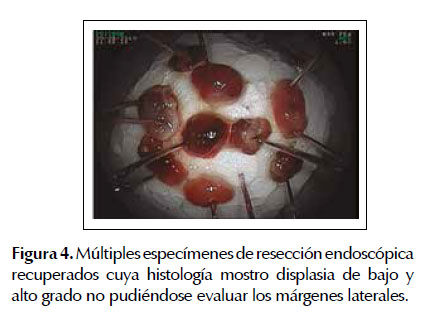
La EMR fue la primera técnica de resección endoscópicadesarrolladaparalaerradicacióndelesiones neoplásicas tempranas en el tracto gastrointestinal como alternativa al tratamiento quirúrgico convencional la cual conlleva mayores tasas de morbi-mortalidad (23,24). Diferentes estudios han demostrado la eficacia y seguridad de este procedimiento terapéutico en pacientes con esófago de Barrett asociado a neoplasias superficiales. Uno de los estudios más representativos fue el realizado por Pech et al. (17) en el cual se incluyeron 1000 pacientes con EB con displasia o asociado a adenocarcinoma intramucoso los cuales fueron sometidos a mucosectomia endoscópica con una media de seguimiento de 56,6 meses. Estos autores observaron remisión completa de la lesión neoplásica en 963 pacientes (96,3%) con una tasa de recurrencia local del 14,5% (140 pacientes) de los cuales el re- tratamiento endoscópico fue exitoso en 115 con una tasa de remisión completa a largo plazo del 93,8% y con una sobrevida calculada a 10 años del 75% (17). Lo cual nos muestra la alta tasa de efectividad de la EMR para lesiones neoplásicas intramucosas en pacientes con esófago de Barrett. De la misma manera Pouw et al. (25) corroboro estos resultados elaborando un registro prospectivo en 14 centros de referencia a nivel mundial (Europa: 10, Estado Unidos: 3 y Canadá: 1). Estos autores reclutaron 291 pacientes con esófago de Barrett neoplásico con indicación de resección endoscópica (332 lesiones) conformados de la siguiente manera 64% con displasia de alto grado, 19% con adenocarcinoma temprano, 11% con displasia de bajo grado y 6% sin una definición histológica precisa, determinando una tasa de éxito (resección endoscópica completa) para la EMR del 97% (322/332 lesiones) con un bajo índice de complicaciones 48/332 procedimientos (14%). En este estudio también se pudo observar que el 67% (221 lesiones) fueron resecadas en partes (piecemeal) y solo el 33% (111 casos) pudieron ser erradicadas en bloque lo cual representa la principal limitación de la EMR debido a que este tipo de resección está fuertemente asociada a elevadas tasas de recurrencia local. Las Figuras 1 a 4 ilustran la técnica de EMR para esófago de Barrett con displasia (ver Figuras 1, 2, 3 y 4).
Uno de los principales estudios comparativos entre la EMR y ESD en el EB fue el publicado por Terheggen et al. (26) Los autores incluyeron de forma aleatoria 20 pacientes para cada grupo (EMR/ESD) todos ellos con esófago de Barrett neoplásico (displasia de alto grado/ adenocarcinoma temprano), hallándose una frecuencia de resección en bloque mayor en los pacientes sometidos a ESD 20/20 en comparación a los de EMR 3/20. Cabe aún resaltar que las lesiones erradicadas por ESD fueron de mayor tamaño que las sometidas a EMR. Otro de los resultados importantes obtenidos en este estudio fue el índice de resección completa definido histológicamente por presencia de márgenes libres de enfermedad hallándose 10/17 para la ESD y 2/17 para la EMR (3 casos fueron excluidos) finalmente se encontró que la frecuencia de eventos adversos fue mayor para la ESD 8/20 en comparación con la EMR 2/20. Este estudio nos muestra un primer panorama comparativo del impacto clínico de ambos procedimientos terapéuticos sin embargo la mayoría de investigaciones concuerda que la EMR es una buena alternativa para el tratamiento de lesiones neoplásicas pequeñas (<10 mm) sin componente fibrótico (sin manipulación previa) y limitadas únicamente a la mucosa (15,26).
ESD EN EL ESÓFAGO DE BARRETT NEOPLÁSICO
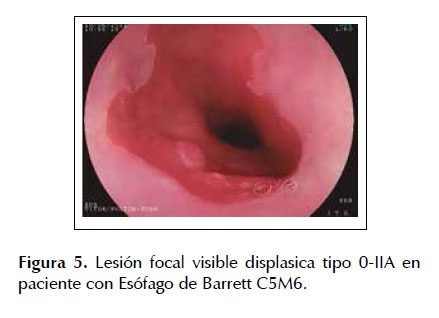
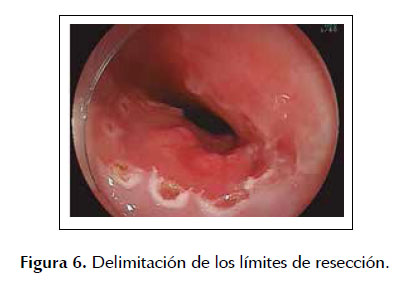
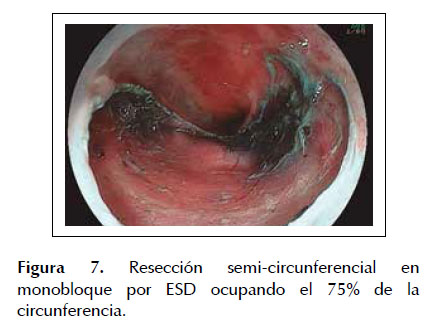
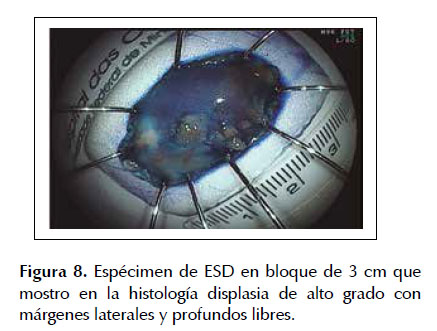
La ESD es una técnica de resección endoscópica diseñada en Japón y ha presentado desde sus inicios resultados prometedores en el tratamiento de lesiones neoplásicas en estadios tempranos. En los últimos años se comenzó a utilizar la ESD para el manejo de lesiones tempranas en pacientes con EB buscandose obtener mejores resultados tanto en la tasa de resección en bloque como en la incidencia de recidiva local (27,28). Sin embargo, muchos países en especial occidentales, aun usan la ESD rutinariamente debido a la larga curva de aprendizaje que se necesita para realizar la ESD con el menor número de complicaciones (16,29) .Recientemente Yang et al.(18) elaboro un meta-análisis sobre ESD en EB asociado a una neoplasia temprana, en el cual incluyo 11 estudios con un total de 501 pacientes, determinándose una tasa total de resección en bloque del 92,9%, una tasa de resección completa y resección curativa del 74,5% y 66,3% respectivamente con una incidencia de recurrencias locales en 22,9 meses del 0,17%. Asimismo, se observó que el índice de complicaciones fue bastante bajo (estenosis esofágica: 11,6%, sangrado digestivo: 1,7% y perforación: 1,5%), lo cual nos muestra los grandes beneficios de la ESD para el tratamiento de este tipo de lesiones neoplásicas. Son pocos los estudios realizados en América Latina sobre la ESD en el manejo de neoplasias precoces de esófago uno de los más importantes fue el realizado por Arantes et al. (30) en 25 pacientes con neoplasias esofágicas tempranas en el cual se detectó una tasa de resección en bloque del 92% (23/25) con una tasa de resección completa y curativa del 84% y 80% respectivamente. De la misma forma se observó una tasa de incidencia de recidivas locales de solo el 8% (2/25) en una media de seguimiento endoscópico de 21,4 meses con un total de 12% de complicaciones (3/25), todas manejadas conservadoramente. Estos resultados confirman que en manos expertas aun en una población distinta los resultados son similares a los obtenidos por diferentes grupos de investigación. Las Figuras 5 a 8 son ilustrativas de la técnica de ESD en pacientes con EB y displasia de alto grado (ver Figuras 5, 6, 7 y 8).
Uno de los estudios comparativos en los que se muestra los beneficios de la ESD sobre la EMR para el tratamiento de este tipo de lesiones fue el realizado por Deprez et al.(31) en el cual se confrontaron los resultados obtenidos entre pacientes con displasia de alto grado y/o adenocarcinoma intramucoso en EB sometidos a ESD (25 pacientes) y a EMR con CAP (25 pacientes) encontrando una tasa de resección en bloque para la ESD del 96% y ningún caso para la EMR con CAP presentando además una superficie de extensión mayor las lesiones resecadas por la ESD. Asimismo se observó que la tasa de resección completa (R0) fue del 64% para la ESD y del 24% para la EMR con CAP con resultados estadísticamente significativos, sin embargo la incidencia de recurrencias locales fueron las mismas para ambos procedimientos resectivos lo cual probablemente se atribuya al poco tiempo de seguimiento.
Es por este motivo que se fueron desarrollando estudios comparativos con una mayor cohorte de pacientes y un tiempo de seguimiento más prolongado con la finalidad de corroborar estos resultados. Chedgy et al. (32) elaboró el estudio comparativo prospectivo más grande entre ESD y EMR en el manejo de neoplasias tempranas en esófago de Barrett en el cual se realizaron 81 ESD esofágicos en 70 pacientes y 180 EMR esofágicas en 112 pacientes encontrando una vez más que la tasa de resección en bloque para este tipo de neoplasias precoces por ESD fue del 89% en comparación con el 30% para la EMR resaltando que la mayoría de lesiones tratadas por ESD presentaron un tamaño mayor que en el grupo de la EMR. La tasa de resección completa fue del 82% para ESD y 73% para EMR observándose además que la tasa de incidencia de recurrencias locales fue mayor en la EMR con un 12% en comparación con un 4% para ESD. Uno de los resultados más llamativos en este estudio fue encontrar un mayor número de complicaciones para la EMR (8%) en comparación con la ESD (4%) a diferencia de otros estudios, lo cual nos muestra que ambos procedimientos resectivos están expuestos a complicaciones sin presentar una diferencia estadísticamente significativa en la tasa acumulada de eventos adversos entre ellos según la mayoría de trabajos de investigación, sobretodo cuando son realizados por operadores experimentados (19,33,34). Sin embargo, uno de los pilares en la realización de cualquiera de estos dos procedimientos terapéuticos es la prevención de las potenciales complicaciones más aun en resecciones difíciles y circunferenciales (que comprometan más del 75% o > ¾ de la circunferencia esofágica) siendo una de las más frecuentes la estenosis esofágica. Barret et al. (35) elaboro recientemente una de las más grandes revisiones sistemáticas respecto a la incidencia de estenosis esofágica posterior a una resección endoscópica circunferencial y su forma de prevención, encontrando en 62 estudios como resultado primario una tasa agrupada de estenosis esofágica para la EMR entre el 37%-88% y para la ESD de 90%. Asimismo, en este estudio se plantean diversas medidas profilácticas para esta complicación endoscópica siendo la que presenta mayor evidencia científica el uso de corticoesteroides tanto sistémicos como locales. Es así que tanto el uso de Acetonida de Triamcinolona intralesional mediante el protocolo de Hanaoka (35) como la utilización de Prednisolona vía oral siguiendo el protocolo de Yamaguchi (35) han demostrado una reducción estadísticamente significativa de la estenosis esofágica post resección endoscópica circunferencial, con tasas sumamente bajas de eventos adversos tales como perforaciones o sangrado digestivo para la terapia esteroidal local o infecciones sistémicas para el uso vía oral. Por lo que se sugiere que en pacientes con esófago de Barrett y neoplasia temprana asociada en donde es fundamental la resección completa con extensión superior a 75% de la circunferencia iniciar un tratamiento profiláctico con esteroides para evitar este tipo de estenosis cicatricial (31,35).
CONCLUSIONES
Los procedimientos endoscópicos resectivos para lesiones displásicas o neoplásicas tempranas en pacientes con EB han demostrado una alta tasa de efectividad y seguridad. Según los diferentes estudios revisados se puede concluir que la ESD es la técnica óptima para el tratamiento de este tipo de lesiones con excelentes resultados a mediano y largo plazo (tasa de resección en bloque, tasa de resección completa, tasa de resección curativa, tasa de recurrencias locales) y con un índice de complicaciones en manos experimentadas similar al de la EMR. Sin embargo, la EMR es una buena alterativa para el tratamiento del EB con lesiones neoplásicas tempranas pequeñas sin compenente de fibrosis ni signos de invasión a submucosa. Asimismo es importante resaltar que la asociación de la erradicación del esófago de Barrett restante ya sea por medio de terapia ablativa o mismo por mucosectomia endoscópica es considerada actualmente como el tratamiento de elección para este grupo de pacientes, debido a que la erradicación del epitelio metaplásico restante elimina los posibles focos de displasia o neoplasia superficial sincrónica no diagnosticados reduciendo de esta forma la incidencia de lesiones neoplasias o displásicas metacrónicas. Es por esta razón que es fundamental difundir los nuevos conceptos en el tratamiento del esófago de Barrett asociado a displasia de alto grado o adenocarcinoma intramucoso con especial énfasis en la técnica de ESD en base a evidencia científica actualizada de alto nivel, así como también es necesario crear centros de entrenamiento para procedimientos de alta complejidad en países en donde el uso de la ESD es aún limitado principalmente América Latina con la única finalidad de lograr efectos beneficiosos en nuestros pacientes.
Conflicto de Intereses: Los autores declaran no tener ningún conflicto de intereses.
Fuente de financiación: La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades privadas, sin ánimos de lucro.
Citar como: Aliaga Ramos JJ, Arantes V. Esófago de Barrett con displasia de alto grado o adenocarcinoma intramucoso: ¿EMR o ESD? Rev Gastroenterol Peru. 2019;39(3):265-72
REFERENCIAS BIBLIOGRÁFICAS
1. Desai TK, Krishnan K, Samala N, Singh J, Cluley J, Perla S, et al. The incidence of oesophageal adenocarcinoma in non-dysplastic Barrett’s oesophagus: A meta-analysis. Gut. 2012;61(7):970-6.
2. Lee SW, Lien HC, Peng YC, Lin MX, Ko CW, Chang CS. The incidence of esophageal cancer and dysplasia in a Chinese population with nondysplastic Barrett’s esophagus. JGH Open. 2018;2(5):214-6.
3. Shiota S, Singh S, Anshasi A, El-Serag HB. Prevalence of Barrett’s Esophagus in Asian countries: A systematic review and Meta-analysis. Clin Gastroenterol Hepatol. 2015;13(11):1907-18.
4. Standards of Practice Committee, Wani S, Qumseya B, Sultan S, Agrawal D, Chandrasekhara V, et al. Endoscopic eradication therapy for patients with Barrett’s esophagus- associated dysplasia and intramucosal cancer. Gastrointest Endosc. 2018;87(4):907-931.e9.
5. Xiong YQ, Ma SJ, Hu HY, Ge J, Zhou LZ, Huo ST, et al. Comparison of narrow-band imaging and confocal laser endomicroscopy for the detection of neoplasia in Barrett’s esophagus: A meta-analysis. Clin Res Hepatol Gastroenterol. 2017;42(1):31-9.
6. Swager AF, Boerwinkel DF, de Bruin DM, Faber DJ, van Leeuwen TG, Weusten BL, et al. Detection of buried Barrett’s glands after radiofrequency ablation with volumetric laser endomicroscopy. Gastrointest Endosc. 2016;83(1):80-8.
7. Chennat J, Ross AS, Konda VJ, Lin S, Noffsinger A, Hart J, et al. Advanced pathology under squamous epithelium on initial EMR specimens in patients with Barrett’s esophagus and high-grade dysplasia or intramucosal carcinoma: implications for surveillance and endotherapy management. Gastrointest Endosc. 2009;70(3):417-21.
8. Lightdale CJ, Larghi A, Rotterdam H, Okpava N. Endoscopic ultrasonography and endoscopic mucosal resection for staging and treatment of high-grade dysplasia and early adenocarcinoma in Barrett’s esophagus. Gastrointest Endosc. 2004;59(5):90.
9. Chadwick G, Groene O, Taylor A, Riley S, Hardwick RH, Crosby T, et al. Management of Barrett’s high-grade dysplasia: initial results from a population- based national audit. Gastrointest Endosc. 2015;83(4):736-42.
10. Singh T, Sanaka MR1, Thota PN. Endoscopic therapy for Barrett’s esophagus and early esophageal cancer: Where do we go from here? World J Gastrointest Endosc. 2018;10(9):165-74.
11. Bahin FF, Jayanna M, Hourigan LF, Lord RV, Whiteman D, Williams SJ, et al. Long term outcomes of a primary complete endoscopic resection strategy for short segment Barrett´s esophagus with high-grade dysplasia and/or early esophageal adenocarcinoma. Gastrointest Endosc. 2015;83(1):68-77. [ Links ]
12. Desai M, Saligram S, Gupta N, Vennalaganti P, Bansal A, Choudhary A, et al. Efficacy and safety outcomes of multimodal endoscopic eradication therapy in Barrett’s esophagus-related neoplasia: a systematic review and pooled-analysis. Gastrointest Endosc. 2017;85(3):482-95.
13. Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, Repici A, Vieth M, De Ceglie A, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2015;47(9):829-54. [ Links ]
14. Manner H, May A, Pech O, Gossner L, Rabenstein T, Günter E, et al. Early Barrett’s carcinoma with "low risk" submucosal invasion: long-term results of endoscopic resection with a curative intent. Am J Gastroenterol. 2008;103(10):2589-97.
15. Deprez PH, Aouattah T, Piessevaux H, Grodos J, Fiasse R, Horsmans Y, et al. Can piecemeal mucosectomy completely remove Barrett’s Esophagus with high-grade dysplasia or adenocarcinoma? Gastrointest Endosc. 2005;61(5):AB129.
16. Tomizawa Y, Friedland S, Hwang J. Endoscopic submucosal dissection as a salvage therapy for patients with recurrece or progression of Barrett’s esophagus related early neoplasia after standar endoscopic management is feasible and safe: A us multi-center study. Gastrointest Endosc. 2018;87(6):AB281-2.
17. Pech O, May A, Manner H, Behrens A, Pohl J, Weferling M, et al. Long-term efficacy and safety of endoscopic resection for patients with mucosal adenocarcinoma of the esophagus. Gastroenterology. 2014;146(3):652-60. [ Links ]
18. Yang D, Zou F, Xiong S, Forde JJ, Wang Y, Draganov PV. Endoscopic submucosal dissection for early Barrett’s neoplasia: A meta-analysis. Gastrointest Endosc. 2017;87(6):1383-93.
19. Koike T, Nakagawa K, Iijima K, Shimosegawa T. Endoscopic resection (endoscopic submucosal dissection/endoscopic mucosal resection) for superficial Barrett’s esophageal cancer. Dig Endosc. 2013;25 Suppl 1:20-8.
20. Qumseya BJ, Wani S, Gendy S, Harnke B, Bergman JJ, Wolfsen H. Disease progression in Barrett’s low-grade dysplasia with radiofrequency ablation compared with surveillance: systematic review and meta-analysis. Am J Gastroenterol. 2017;112(6):849-65.
21. Phoa KN, Pouw RE, Bisschops R, Pech O, Ragunath K, Weusten BL, et al. Multimodality endoscopic eradication for neoplastic Barrett oesophagus: results of an European multicentre study (EURO-II). Gut. 2016;65(4):555-62. [ Links ]
22. Werbrouck E, De Hertogh G, Sagaert X, Coremans G, Willekens H, Demedts I, et al. Oesophageal biopsies are insufficient to predict final histology after endoscopic resection in early Barrett’s neoplasia. United European Gastroenterol J. 2016;4(5):663-8.
23. Ross A, Larghi A, Stearms L, Wagh M, Dye C, Noffsinger A, et al. Endoscopic Mucosal resection as a surveillance strategy for Barrett’s esophagus with dysplasia: The new standard of care? Gastrointest Endosc. 2006;63(5):AB129.
24. Fukami N, Dekovich A, Sericati M, Maru D, Wang H, Hofstetter WL, et al. Multifocal high-grade dysplasia (MFHGD) in Barrett’s esophagus is associated with adenocarcinoma in patients undergoing endoscopic mucosal resection (EMR) for Barrett’s esophagus. Gastrointest Endosc. 2008;67(5):AB180.
25. Pouw RE, Beyna T, Belghazi K, Koch A, Schoon E, Haldry R, et al. A prospective multicenter study using a new multiband mucosectomy device for endoscopic resection of early neoplasia in Barrett’s esophagus. Gastrointest Endosc. 2018;88(4):647-54.
26. Terheggen G, Horn EM, Vieth M, Gabbert H, Enderle M, Neugebauer A, et al. A randomised trial of endoscopic submucosal dissection versus endoscopic mucosal resection for early Barrett’s neoplasia. Gut. 2016;66(5):783-93.
27. Siddiqui J, Gerke H. Efficacy and safe of band ligator assisted mucosal resection to completely remove Barrett’s esophagus with high-grade dysplasia or early cancer. Gastrointest Endosc. 2008;67(5):AB177.
28. Konda VJ, Gonzales-Haba M, Frazao M, Koons A, Ferguson M, Posner MC, et al. Su1462 A Single Center Report of 100 patients enrolled in complete Barrett’s eradication with endoscopic mucosal resection (CBE-EMR) of Barrett’s esophagus (BE) with high grade dysplasia (HGD) or early cancer. Gastrointest Endosc. 2013;77(5):AB332-3.
29. Subramaniam S, Chedgy F, Longcroft G, Kandiah K, Maselli R, Seewald S, et al. Complex early Barrett’s neoplasia at 3 Western centers: European Barrett’s Endoscopic Submucosal Dissection Trial (E-BEST). Gastrointest Endosc. 2017;86(4):608-18.
30. Arantes V, Albuquerque W, Freitas C, Demas M, Yamamoto H. Standardized endoscopic submucosal tunnel dissection for management of early esophageal tumors (with video). Gastrointest Endosc. 2013;78(6):946-52. [ Links ]
31. Deprez PH, Piessevaux H, Aouattah T, Yeung R, Sempoux C, Jouret-Mourin A. 587c: ESD in Barrett’s esophagus high grade dysplasia and mucosal cancer: prospective comparison with CAP mucosectomy. Gastrointest Endosc. 2010;71(5):AB126.
32. Chedgy F, Subramaniam S, Kandiah K, Thayalasekaran S, Bhandari P. EMR Vs ESD for Barrett’s neoplasia: Time to shift the paradigm? Gut. 2016;65(1):1-310.
33. Yang D, Coman RM, Kahaleh M, Waxman I, Wang A, Sethi A, et al. Endoscopic submucosal dissection for Barrett’s early neoplasia: a multicenter study in the United States. Gastrointestl Endosc. 2016;86(4):600-7.
34. Chedgy F, Bhattacharyya R, Kandiah K, Basford P, Alkandari A, Bhandari P. Tu1568 EMR vs ESD for early Barrett’s cancer: is it a case of horses for courses? Gastrointest Endosc. 2015;81(5):AB512-3.
35. Barret M, Beye B, Leblanc S, Beuvon F, Chaussade S, Batteux F, et al. Systematic review: the prevention of oesophageal stricture after endoscopic resection. Aliment Pharmacol Ther. 2015;42(1):20-39. [ Links ]
Correspondencia:
Vitor Arantes
Unidad de Endoscopia. Instituto Alfa de Gastroenterología. Facultad de Medicina,Universidad Federal de Minas Gerais. Belo Horizonte. Brasil
E-mail: arantesvitor@hotmail.com