Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.3 Lima jul./set. 2019
REPORTE DE CASO
Linfoma folicular tipo duodenal: reporte de caso y revisión de la literatura
Duodenal type folicular lymphoma: case report and literature review
Denisse Castro1, Brady Beltrán1,2, Maria del Pilar Quiñones3, Eugenio Palomino3, Esther Cotrina4, Edgar Alva5, John Bryan Medina 5, Alejandro Yábar3
1 Departamento de Oncología y Radioterapia, Hospital Rebagliat Martins. Lima, Perú.
2 Centro de Investigación de Medicina de Precisión, Universidad de San Martín de Porres. Lima, Perú.
3 Departamento de Patología, Hospital Rebagliati Martins. Lima, Perú.
4 Departamento de Enfermería, Hospital Rebagliati Martins. Lima, Perú.
5 Departamento de Aparato Digestivo, Hospital Rebagliati Martins. Lima, Perú.
RESUMEN
El linfoma folicular de tipo duodenal es una neoplasia maligna rara que representa menos del 4% de los casos primarios de linfoma no Hodgkin del tracto gastrointestinal y es una entidad nueva que se describió recientemente en la nueva actualización de la OMS 2016. Actualmente faltan datos sobre los resultados a largo plazo, y por esa razón, no se ha establecido un consenso sobre el manejo de esta enfermedad y su tratamiento. Presentamos un caso de una paciente de 57 años diagnosticada con linfoma folicular de tipo duodenal grado 3a que fue tratado con R-CHOP. El objetivo de este estudio es agregar más datos para una mayor caracterización de la entidad y así seleccionar el mejor manejo para cada caso.
Palabras clave: Linfoma folicular; Linfoma no Hodgkin; Tracto gastrointestinal (fuente: DeCS BIREME).
ABSTRACT
Duodenal type follicular lymphoma is a rare malignancy accounting for less than 4% of primary non-Hodgkin lymphomas of the gastrointestinal tract and it is a new entity that was recently described in the new update WHO 2016. Data regarding long-term outcome are currently lacking, and for that reason, a consensus on the management of this disease has not been established and treatment. We report a case of a 57-year-old female patient diagnosed with duodenal- type follicular lymphoma grade 3a who was treated with R-CHOP. The aim of this study is to add more data for a greater characterization of the entity and thus select the best management for each case.
Keywords: Lymphoma, follicular; Lymphoma, non-Hodgkin; Gastrointestinal tract (source: MeSH NLM).
INTRODUCCIÓN
El linfoma folicular (LF) es el segundo más frecuente en los países occidentales y en los Estados Unidos, constituyendo el 35% de los linfomas no Hodgkin (LNH) (1,2). Además, es el subtipo más frecuente de linfoma indolente (3). En el Perú según el estudio de Diumenjo et al., el linfoma folicular constituye el segundo en frecuencia luego de los linfomas de alto grado de células B (4). El linfoma folicular es una enfermedad heterogénea, siendo su clasificación de acuerdo al número de centroblastos por 40 campos de alta potencia, Grado 1: 5 o menos centroblasos por HPF, Grado 2: 6-15 centroblastos por HPF y Grado 3: más de 15 centroblastos por HPF. El grado 3, se subdivide en 3A: centrocitos aún presentes y 3B: en sábanas de centroblastos (1). Los linfomas No Hodgkin gastrointestinales (LNH-GI) son el subtipo más común de linfoma extranodal, constituyendo aproximadamente el 40% de todos los LNH (5,6). Menos del 4% de linfomas gastrointestinales, lo constituye el linfoma folicular, siendo su localización más frecuente el duodeno (7).
CASO CLÍNICO
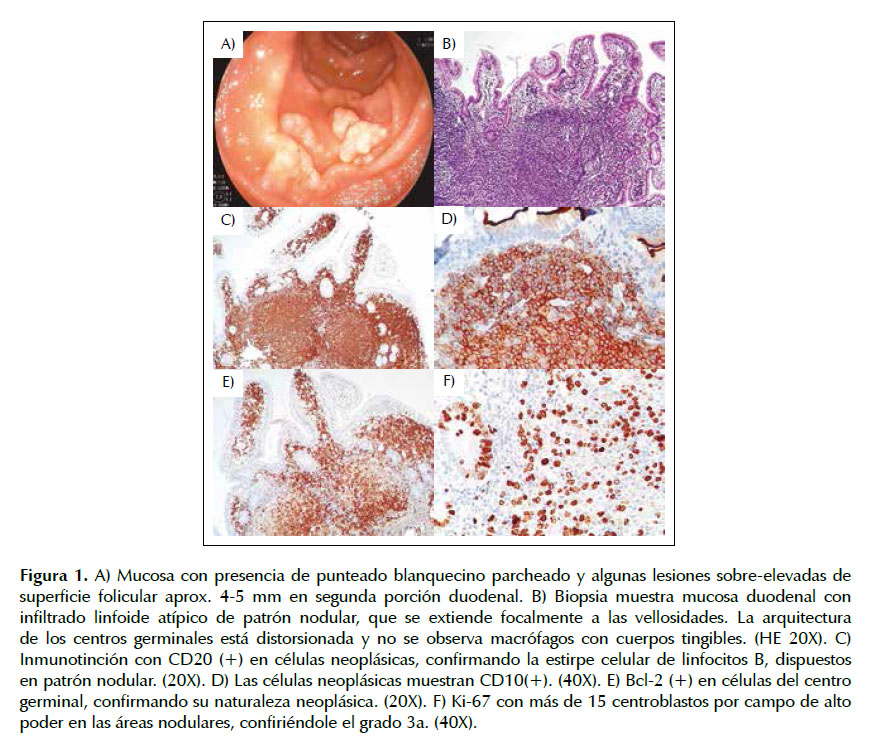
Paciente mujer de 57 años natural y procedente de Lima, con antecedente de gastritis crónica y colecistectomía hace 10 años. Cursa con un tiempo de enfermedad 6 meses caracterizado por dispepsia, por lo que se le realiza endoscopía digestiva alta , encontrándose en la segunda porción del duodeno una mucosa elevada tipo granular de 3 a 5 mm y concluyendo como diagnóstico endoscópico en una duodenitis crónica con hiperplasia folicular severa. La patología concluye en duodenitis crónica con hiperplasia folicular severa. Se le realiza inmunohistoquímica, mostrando positividad para CD20, CD10, BCL-6 y BCL-2, negatividad de CD3, CD5 y CD43, además con conteo de 5 a 18 centroblastos/campo de gran aumento, concluyendo en linfoma folicular grado 3A. Los síntomas se exacerban en el último mes con baja de peso, fiebre y sudoración nocturna, por lo que es admitida en emergencia. Se le realizaron exámenes de analítica hemática como hemograma, perfil bioquímico, hepático, LDH y B2 –microglobulina; estando todos dentro de los límites normales. Además, todos los estudios virales para hepatitis B, C, HTLV-1 y HIV resultaron no reactivos. Las imágenes de extensión evaluadas con tomografías fueron negativas. Se le realiza nueva endoscopía en emergencia, encontrando dentro de los hallazgos endoscópicos, el bulbo y segunda porción del duodeno con presencia de punteado blanquecino parcheado en mucosa y algunas lesiones sobrelevadas en la superficie folicular de 4 a 5 mm, siendo de mayor proporción en la segunda porción duodenal y de distribución parcheada. El diagnóstico anatomo-patológico nuevamente concluye en Linfoma folicular grado 3a, expresando positividad para CD20, BCL-2, CD10 y CD43, negatividad de CD3, Ki67 del 40% con conteo de centroblastos: más de 15 por campo de alto poder. Se realiza biopsia de médula ósea no encontrando infiltración linfomatosa. Por lo que inicia tratamiento de primera línea con R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona). En su última evaluación, el paciente se encuentra en buen estado general (ECOG 1) y en su tercer ciclo de tratamiento con el esquema R-CHOP .
DISCUSIÓN
Los linfomas extranodales pueden originarse en cualquier parte fuera de la región linfoide nodal, donde una significativa porción de tejido linfoide se encuentra en el tracto gastrointestinal (GI). Éste se encuentra localizado en la lámina propia y sub-mucosa, donde su cantidad varía entre segmentos. Cada segmento puede presentar neoplasias linfoides primarias y también puede ser secundario a linfomas de grupos nodales contiguos (mesentérico o retroperitoneal).
Los linfomas primario gastrointestinales (GI) son raros y a su vez son la forma más frecuente de localización extranodal de los LNH, siendo cerca del 30% en frecuencia. La localización más frecuente es el estómago, y menos frecuentemente puede comprometer el resto del tracto GI, desde el esófago hasta el recto (8). Para el diagnóstico de un linfoma primario GI, Dawson et al. (8), postuló cinco criterios que deben cumplirse para el diagnóstico: ausencia de adenopatías palpables superficiales, estudios de imágenes normales, analítica hemática normal y compromiso predominante de un solo segmento del tracto GI con compromiso nodal (si existe) de la misma zona de drenaje del intestino y ausencia de compromiso del hígado o el bazo. Por otro lado, está el linfoma secundario donde el compromiso al tracto GI, es debido a linfomas en estadios avanzados, caracterizado por compromiso multifocal de los segmentos. Todo esto es debido a que por contigüidad los ganglios infiltran el tracto GI (8-10). El subtipo más frecuente es el Linfoma MALT, constituyendo el 50% de todos los linfomas gástricos, seguido de los linfomas difuso de células grandes B. El linfoma de células del manto o la poliposis linfomatoide corresponde cerca del 30% de los linfomas GI (8-10).
El linfoma folicular de tipo duodenal (LF-D) es una entidad nueva e infrecuente , que ha sido reconocida en la última actualización de la WHO del 2016. (5,10). Se caracteriza por ser localizado, sin compromiso nodal (3), presencia de inmunofenotipo similar al del linfoma folicular nodal y usualmente con la típica traslocación t(14:18)(q32:q21) (6,9,11). Casi siempre es diagnosticado en estadio temprano y tiene predilección por el sexo femenino, mientras que la mayoría de linfomas folicular nodales son diagnosticados en estadios avanzados (12). Clásicamente los pacientes son detectados incidentalmente por endoscopía, ya sea para un examen médico preventivo o por la estadificación de otros tipos de neoplasias, habiendo sido reportado inicialmente por estudios japoneses, donde la endoscopía de screening es de uso rutinario. (13-15). Las manifestaciones clínicas son usualmente síntomas gastrointestinales superiores , como: dolor abdominal , náuseas, vómitos y en algunos casos sangrado gastrointestinal alto. (13,15,16). No existe predilección en cuanto al sexo y el promedio de edad oscila entre los 59 y 65 años.
En la endoscopía, usualmente aparecen como nódulos blancos solitarios, múltiples o lesiones polipoideas entre 1 a 5 mm. Estas lesiones pueden volverse ulceradas, donde es importante que la biopsia abarque todo el área circundante, para un mejor rendimiento del diagnóstico. La segunda porción del duodeno es la más común , pero puede presentarse en cualquier parte del duodeno. En otras áreas del intestino delgado, como el yeyuno y el íleon pueden presentarse (6,11,13,16). Es importante mencionar que la enfermedad multifocal no es inusual, siendo esto demostrado en 2 estudios previos. Takata et al., muestra que la gran mayoría (85%) tenía compromiso de otras áreas del intestino, principalmente yeyunal (6,17,18).
Histológicamente, el LF-D muestra centros germinales bien circunscritos junto con centrocitos y pocos centroblastos sin macrófagos visibles y sin zonas de manto. Las células linfoides son pequeñas y con contorno nuclear irregular que generalmente están presentes fuera de las estructuras foliculares. Además, generalmente afecta la mucosa/submucosa, y las células tumorales se encuentran en el mucosal villi; siendo esto diferente con los subtipos de LF-GI, que se encuentran comúnmente entre las áreas submucosa y subserosa. El LF-D, por lo general es de bajo grado (Grado 1 y 2) y la transformación histológica es muy rara. Según lo reportado por Mori et al, el 4% de pacientes desarrolla transformación histológica a grado 3A (19), como lo mostró nuestra paciente. En cuanto al inmunofenotipo, las células neoplásicas muestran un similar patrón al del linfoma folicular-nodal (LF-N), expresando positividad de CD20, CD79a, CD10, BCL-6, BCL-2 y BACH2, y muestran una falta de expresión para los marcadores CD5, CD23, CD43, ciclina D1, MUM-1, Blimp-1 y células T (11).
Otra característica es en cuanto a la expresión del CD21, donde en el LF-D se encontró que las células dendríticas foliculares (CDF) del centro germinal se encuentra ubicado en la periferia y ocupa menos del 10% del centro germinal neoplásico (¨patrón duodenal¨), y que por otro lado en el LF-N y en el LF-GI, la red de CDF ocupa más de los dos tercios de los centros germinales (¨patrón nodal¨). En el estudio de Takata et al., se demostró que las células FL interactúan con los CDF del centro germinal y dan ventaja de crecimiento a las células del linfoma(13). Por lo que se deduce que la falta de CDF y esta interacción con las células neoplásicas, explican su naturaleza de bajo grado del LF-D (13,20).
A diferencia de la mayoría de los linfomas foliculares, el LF-D parece tener una patogénesis única que está relacionada con la inflamación y la estimulación del antígeno, compartiendo algunas similitudes con el linfoma del tejido linfoide asociado a la mucosa (MALT). Con respecto a los reordenamientos del gen de cadena pesada de la región variable de inmunoglobulina (IgVH), se ha encontrado que en el LF-D existe un mayor uso de VH4 y VH5, que los casos nodales. Este uso selectivo sugiere que existe algún mecanismo dependiente de antígeno y que está involucrado en el desarrollo tumoral, similar al linfoma MALT, que se desarrolla a partir de la inflamación crónica por H. pylori (11,14,21). El CD27 es una glicoproteína de miembro de la familia de receptores del factor de necrosis tumoral y marcador de células B de memoria y la citidina desaminasa inducida por activación (AID) es miembro de la familia de citidina desaminasa que edita ARN, que se expresa específicamente en las células B del centro germinal y se ha demostrado ser necesaria para la conmutación de clases de células B y está involucrado en la hipermutación. El LF-D muestra una expresión que difiere del resto de los Linfomas foliculares GI, con respecto a CD27 y el AID; mostrando éste positividad al CD27 y negatividad al AID, mientras que en el resto de linfomas GI es a la inversa (11). El diagnóstico diferencial de ésta única entidad son: la hiperplasia folicular atípica, el linfoma MALT, la leucemia linfocítica crónica/linfoma linfocito pequeño (LLC/LLP), el linfoma de células del manto y los linfomas foliculares nodales.
En la actualidad no existe un consenso del manejo para esta entidad por la escaza cantidad de literatura. Mori et al. (19) estudió a 27 pacientes, donde el 49% estuvo en observación y el 51% recibió algún tipo de terapia (radioterapia local en 2 pacientes e inmuno- quimioterapia en 12 pacientes). Todos los pacientes tuvieron un excelente pronóstico de sobrevida con una media de seguimiento de 49 meses. En el estudio de Schmatz et al. (16), describe 63 pacientes con esta entidad, donde el 41% fue a observación, el 33% a radioterapia, el 9% a rituximab mondroga, 3% quimioterapia con CHOP, 3% con R-CHOP, 2% con radioterapia más rituximab y el 3% con otros protocolos de quimioterapia. En el grupo de observación, el 29% tuvo regresión completa, el 100% de regresión completa con radioterapia, el 80% con Rituximab monoterapia y el 100% con la terapia combinada (quimioterapia +- radioterapia) tuvieron regresión. Al seguimiento se realizó la comparación entre el grupo de observación y los que recibieron tratamiento y encontraron que no hubo diferencia en sobrevida y tiempo de recurrencia. Harada et al., demostró que la radioterapia es un tratamiento efectivo y seguro para los estadíos I, con una dosis de 30,6 Gys en el sitio comprometido(22).
En la mayoría de casos reporte y estudios, se encontró que el manejo de elección fue la observación, con seguimientos tan largos como 6 años sin evidencia de enfermedad y en menor cantidad se encontró el uso de rituximab monoterapia y/o rituximab asociado a radioterapia; igualmente encontrándose excelentes resultados (19,23,24).
El caso que presentamos, se encuentra dentro del pequeño grupo de LF-D que tuvo grado 3a, correspondiente a un 4% según el estudio de Takata et al. (11); dado a ello y que la paciente cursó sintomática se decidió por un esquema más agresivo aunque data al respecto es limitada.
Nuestro caso constituye el segundo caso latinoamericano en ser reportado, siendo un LF-D grado 3A (25). Nuestra paciente cursó con enfermedad sintomática, por lo que inició tratamiento sistémico con el esquema R-CHOP. El LF-D es una entidad única en cuanto a su caracterización clínica, inmunofenotípica y genética, siendo diferente al linfoma folicular nodal y al resto de linfomas foliculares gastrointestinales.
Conflicto de intereses: ninguno.
Citar como: Castro D, Beltrán B, Quiñones MP, Palomino E, Cotrina E, Alva E, et al. Linfoma folicular tipo duodenal: reporte de caso y revisión de la literatura. Rev Gastroenterol Peru. 2019;39(3):276-9
REFERENCIAS BIBLIOGRÁFICAS
1. Freedman A. Follicular lymphoma: 2018 update on diagnosis and management. Am J Hematol. 2018;93(2):296-305. [ Links ]
2. Hiddemann W, Cheson BD. How we manage follicular lymphoma. Leukemia. 2014;28(7):1388-95. [ Links ]
3. Kahl BS, Yang DT. Follicular lymphoma: evolving therapeutic strategies. Blood. 2016;127(17):2055-63. [ Links ]
4. Diumenjo MC, Abriata G, Forman D, Sierra MS. The burden of non-Hodgkin lymphoma in Central and South America. Cancer Epidemiol. 2016;44 Suppl 1:S168-S177. [ Links ]
5. Aguiar-Bujanda D, Quiñones-Morales I, Camacho-Galán R, Llorca-Martínez I, Rivero-Vera JC, Bohn-Sarmiento U, et al. Primary duodenal follicular lymphoma successfully treated with rituximab. Clin Transl Oncol. 2007;9(7):471-2. [ Links ]
6. Iwamuro M, Kondo E, Takata K, Yoshino T, Okada H. Diagnosis of follicular lymphoma of the gastrointestinal tract: A better initial diagnostic workup. World J Gastroenterol. 2016;22(4):1674-83. [ Links ]
7. Yoshino T, Miyake K, Ichimura K, Mannami T, Ohara N, Hamazaki S, et al. Increased incidence of follicular lymphoma in the duodenum. Am J Surg Pathol. 2000;24(5):688-93. [ Links ]
8. Ghai S, Pattison J, Ghai S, O’Malley ME, Khalili K, Stephens M. Primary gastrointestinal lymphoma: spectrum of imaging findings with pathologic correlation. Radiographics. 2007;27(5):1371-88.
9. Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol. 2011;17(6):697-707. [ Links ]
10. Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127(20):2375-90. [ Links ]
11. Takata K, Sato Y, Nakamura N, Tokunaka M, Miki Y, Yukie Kikuti Y, et al. Duodenal follicular lymphoma lacks AID but expresses BACH2 and has memory B-cell characteristics. Mod Pathol. 2013;26(1):22-31. [ Links ]
12. Mamessier E, Song JY, Eberle FC, Pack S, Drevet C, Chetaille B, et al. Early lesions of follicular lymphoma: A genetic perspective. Haematologica. 2014;99(3):481-8. [ Links ]
13. Takata K, Okada H, Ohmiya N, Nakamura S, Kitadai Y, Tari A, et al. Primary gastrointestinal follicular lymphoma involving the duodenal second portion is a distinct entity: A multicenter, retrospective analysis in Japan. Cancer Sci. 2011;102(8):1532-6. [ Links ]
14. Yamamoto S, Nakase H, Yamashita K, Matsuura M, Takada M, Kawanami C, et al. Gastrointestinal follicular lymphoma: Review of the literature. J Gastroenterol. 2010;45(4):370-88. [ Links ]
15. Seki A, Iwamuro M, Yoshioka M, Fujii N, Okada H, Nose S, et al. Primary duodenal follicular lymphoma treated with rituximab monotherapy and followed-up for 15 years. Acta Med Okayama. 2015;69(5):301-6. [ Links ]
16. Schmatz AI, Streubel B, Kretschmer-Chott E, Püspök A, Jäger U, Mannhalter C, et al. Primary follicular lymphoma of the duodenum is a distinct mucosal/submucosal variant of follicular lymphoma: A retrospective study of 63 cases. J Clin Oncol. 2011;29(11):1445-51. [ Links ]
17. Iwamuro M, Kondo E, Otsuka F, Takata K, Yoshino T, Kawahara Y, et al. Detection of minute duodenal follicular lymphoma lesions using magnifying endoscopy. Acta Med Okayama. 2016;70(2):139-44. [ Links ]
18. Maeshima AM, Taniguchi H, Suzuki T, Yuda S, Toyoda K, Yamauchi N, et al. Comparison of clinicopathologic characteristics of gastric follicular lymphomas and duodenal follicular lymphomas. Hum Pathol. 2017;65:201-8. [ Links ]
19. Mori M, Kobayashi Y, Maeshima AM, Gotoda T, Oda I, Kagami Y, et al. The indolent course and high incidence of t(14;18) in primary duodenal follicular lymphoma. Ann Oncol. 2010;21(7):1500-5. [ Links ]
20. Lackraj T, Goswami R, Kridel R. Pathogenesis of follicular lymphoma. Best Pract Res Clin Haematol. 2018;31(1):2-14. [ Links ]
21. Tari A, Asaoku H, Kunihiro M, Tanaka S, Fujihara M, Yoshino T. Clinical features of gastrointestinal follicular lymphoma: Comparison with nodal follicular lymphoma and gastrointestinal MALT lymphoma. Digestion. 2011;83(3):191-7. [ Links ]
22. Harada A, Oguchi M, Terui Y, Takeuchi K, Igarashi M, Kozuka T, et al. Radiation therapy for localized duodenal low-grade follicular lymphoma. J Radiat Res. 2016;57(4):412-7. [ Links ]
23. Graham RL, Mardones MA1, Krause JR. Primary follicular lymphoma of the duodenum. Proc (Bayl Univ Med Cent). 2015;28(3):381-3. [ Links ]
24. Franco P, Filippi AR, Ciammella P, Botticella A, Namysl- Kaletka A, De Crescenzo A, et al. Primary duodenal follicular lymphoma: 6-years complete remission after combined radio- immunotherapy. Acta Gastroenterol Belg. 2011;74(2):337-42. [ Links ]
25. Hiromi JC, Casasbuenas D, Acosta J, Ricaurte O. Linfoma folicular primario duodenal: Informe de un caso y revisión de la literatura. Rev Col Gastroenterol. 2012;27(3):222-7. [ Links ]
Correspondencia:
Brady Beltrán
E-mail: bgbrady@hotmail.com