Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.3 Lima jul./set. 2019
REPORTE DE CASO
Hepatitis autoinmune y embarazo: serie de casos
Autoimmune hepatitis and pregnancy: a case series
Cesar Castro1a,2, Jeanne Caballero3a, Jorge Garavito1a,2b, Adelina Lozano1a,2b
1 Unidad de Hígado, Servicio de Gastroenterología. Hospital Nacional Arzobispo Loayza. Lima, Perú.
2 Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Clínica San Pablo. Trujillo, Perú.
a Gastroenterólogo/a
b Docente
RESUMEN
Reportamos cuatro casos de pacientes mujeres con diagnóstico de hepatitis autoinmune atendidas en la unidad de hígado del Hospital Nacional Arzobispo Loayza en el periodo 2014-2018, estas pacientes quedaron embarazadas durante el tratamiento. El embarazo en todos los casos llegó a su término sin ninguna complicación, las pacientes recibieron tratamiento inmunosupresor durante la gestación. Presentamos la secuencia de los hechos con sus resultados y una revisión de la literatura.
Palabras clave: Hepatitis autoinmune; Embarazo; Inmunosupresores (fuente: DeCS BIREME).
ABSTRACT
We report four cases of female patients diagnosed with autoimmune hepatitis treated in the liver unit of the National Hospital Arzobispo Loayza in the period 2014-2018, these patients became pregnant during treatment. Pregnancy in all cases came to an end without any complications, patients received immunosuppressive treatment during pregnancy. We present the sequence of events with their results and a review of the literature.
Keywords: Hepatitis, autoimmune; Pregnancy; Immunosuppressive agents (source: MeSH NLM).
INTRODUCCIÓN
No existen datos epidemiológicos claros de prevalencia e incidencia a nivel mundial, se conoce que en Noruega y Suecia la incidencia media es de 1 a 2 por 100 000 personas por año y su prevalencia es de 11a 17 personas por 100 000 personas por año, por lo cual se asume que la incidencia y prevalencia es similar para la población caucásica de América del Norte. Debido al carácter subclínico de esta enfermedad podría que la prevalencia e incidencia de esta enfermedad sean mayores (1,2). La prevalencia e incidencia de hepatitis autoinmune en Latinoamérica, y específicamente en Perú es desconocida.
La hepatitis autoinmune (HAI) es un trastorno que ha sido reconocido por más de 50 años. Descrita por primera vez por Waldenström en la década de 1950 como una forma crónica de la hepatitis con un fenotipo clásico de enfermedad hepática en mujeres jóvenes, a menudo en combinación con manifestaciones extra- hepáticas incluyendo artralgias, alteraciones endocrinas y amenorrea (3).
La HAI afecta con mayor frecuencia a las mujeres, con dos picos de edad (prepuberal y entre la cuarta y sexta década de la vida (4). Esta patología se caracteriza por una inflamación hepatocelular progresiva. El diagnóstico de HAI se basa en la histología, bioquímica y marcadores inmunológicos, tal como se detalla en el informe del Grupo Internacional de Hepatitis autoinmune (5).
A pesar de la oligomenorrea, frecuentemente asociada a HAI, el número de embarazos descritos en estos pacientes es cada vez más frecuente como consecuencia del mejor manejo clínico (4). La gestación puede afectar el curso clínico de la HAI y es impredecible; la HAI puede tener episodios de reactivación, remisión o exacerbación durante el embarazo y en el post parto (4).
El manejo óptimo durante el embarazo aún no está bien definido, y las reactivaciones durante la gestación ocurren entre el 7 al 33% de los embarazos y entre el 11% al 86% después del parto (4,6).
El objetivo de esta publicación es presentar nuestra experiencia del curso clínico de cuatro pacientes gestantes con diagnóstico de hepatitis autoinmune y hacer una revisión de la literatura a propósito de esta serie de casos.
CASOS CLÍNICOS
CASO 1
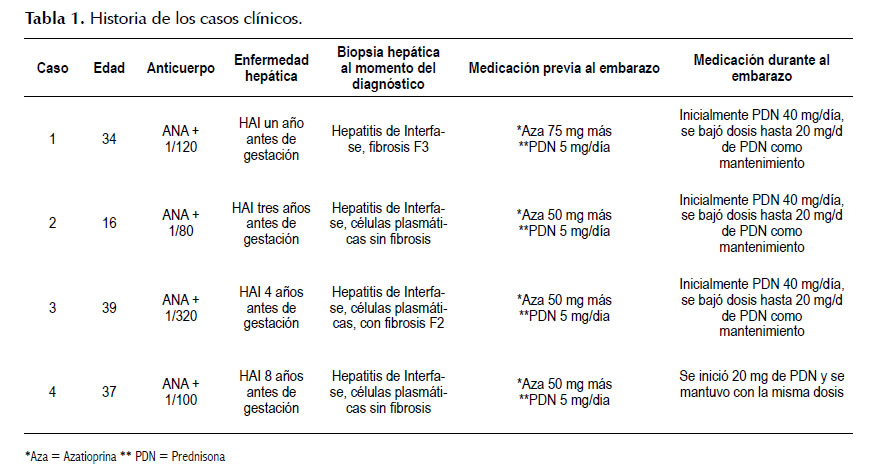
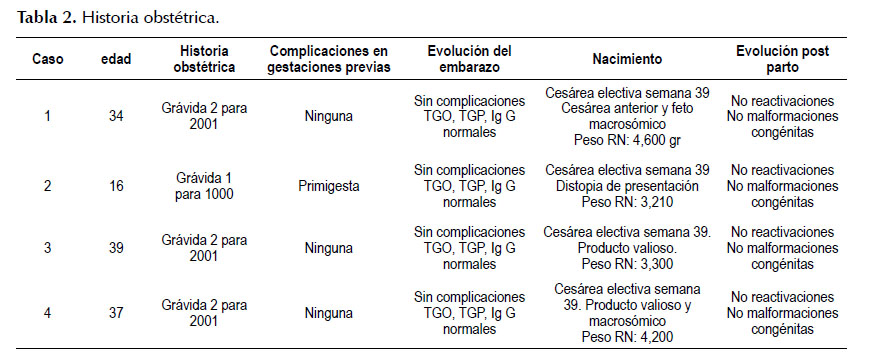
Paciente mujer de 34 años, profesora de inicial, natural y procedente de la ciudad de Lima. Antecedente de litiasis vesicular y de gestación a término; de un producto vivo de 4430 gramos, nacido por cesárea. La paciente fue admitida en consulta ambulatoria con historia de ictericia, náuseas, hiporexia y malestar general de 3 meses de evolución, con exámenes de laboratorio con TGO: 1300 UI/L; TGP: 1650 UI/L; HBsAg: (-), Anti HBc IgM: (-), Anti VHC: (-), ANA: (+) 1/320, AML: (-), Ig G: 3560, bilirrubina total 4 mg/dl, bilirrubina directa 2,9 mg/dl. Se realiza biopsia hepática con hallazgo de hepatitis de interfase, células plasmáticas y hallazgo de puentes fibróticos porta-porta. Se inicia tratamiento con prednisona 1 mg/k/día, posteriormente se agrega azatioprina 50 mg/d y se disminuye progresivamente la dosis de prednisona. Se evidencia normalización del nivel de transaminasas e inmunoglobulina G después de cinco meses, quedando con dosis de mantenimiento de prednisona 5 mg/d y azatioprina 75 mg/d. Después de 1 año de diagnóstico de HAI y de normalización de transaminasas, le diagnostican gestación uterina de 8 semanas por ecografía y, por temor de malformaciones fetales, suspende medicación sin indicación médica, y acude a consulta con TGO: 240 UI/L y TGP: 260 UI/L, se reinicia prednisona 40mg y se disminuye progresivamente con control de transaminasas y de Ig G a dosis de mantenimiento de 20 mg/día. La paciente acudió a controles periódicamente tanto a Ginecología como a la Unidad de Hígado. A las 39 semanas tuvo parto por cesárea electiva por cesárea anterior, dando a luz con recién nacido vivo de 4600 g. Actualmente con 50 mg de Azatioprina y 5 mg de prednisona en remisión bioquímica. El niño tiene 3 años a la fecha actual de la publicación y goza de buena salud y madre continúa con terapia de mantenimiento.
CASO 2
Paciente mujer de 19 años estudiante de psicología, natural y procedente de Lima con diagnóstico de hepatitis autoinmune desde los 14 años, debutó con cuadro de hepatitis aguda caracterizado por malestar general, decaimiento, náuseas, vómitos, TGP: 1276 UI/L, TGO: 1798 UI/L, inmunoglobulina G: 789, INR: 0,98, bilirrubina total 1 mg/dl ANA (+) 1/220, AML (-), AMA (-), marcadores virales de VHB y VHC negativos. Biopsia hepática: arquitectura hepática conservada, espacio porta ensanchado por infiltrado inflamatorio, hepatitis de interfase, algunas células plasmáticas y en dos espacios porta hay ductopenia. Inicialmente recibió tratamiento con prednisona 1 mg/k/d hasta normalizar transaminasas y luego se agregó azatioprina, quedando con dosis de mantenimiento de prednisona 5 mg/d y azatioprina 50 mg/día; mantuvo remisión bioquímica y al tercer año de tratamiento de mantenimiento con remisión sostenida bioquímica le diagnostican gestación uterina de 7 semanas por ecografía, decide suspender el tratamiento sin indicación médica. Tras dos semanas sin medicación los exámenes de transaminasas fueron: TGO: 270 UI/L y TGP: 320 UI/L, por lo que se indica reiniciar prednisona 40 mg/d, con lo que se consigue remisión de hipertransaminemia, se disminuye progresivamente la dosis y durante gestación permanece con prednisona 20 mg/d con remisión bioquímica sostenida, fue programada por ginecología para parto por cesárea por feto en presentación oblicua a las 39 semanas. El producto del embarazo nació sin alteraciones y pesó 3210 gramos. Después de tres meses de lactancia materna, se reintrodujo la azatioprina. Al año del parto y tras mantener remisión bioquímica se retira el tratamiento previa biopsia hepática sin alteraciones significativas en la arquitectura hepática; sin embargo, al mes de retirarlo presenta elevación de transaminasas, por lo que se reinicia la inmunosupresión con prednisona 40 mg/día y luego de disminuir las transaminasas a la segunda semana se agregó azatioprina 50 mg/día, manteniendo dosis de prednisona 5 mg/día más azatioprina 50 mg/día. El niño a la fecha actual de la publicación tiene 4 años y goza de buena salud. La madre continúa con terapia de mantenimiento y no ha tenido complicaciones.
CASO 3
Paciente de 39 años de profesión administradora de empresas, natural y procedente de Lima, con diagnóstico de HAI desde el 2012 con tratamiento por un año y suspensión voluntaria del mismo por normalización de las pruebas hepáticas. Después de un año de haber abandonado el tratamiento por tres meses de malestar general, decaimiento y náuseas, en el estudio de laboratorio encuentran, aumento de transaminasas, TGO: 450 UI/L y TGP: 480 UI/L, inmunoglobulina G: 2300, INR: 1,2, después de descartar otras causas de hepatitis aguda (citomegalovirus, herpes virus tipo 1 y 2, toxoplasma, epstein barr, hepatitis A,B y E). Se concluye que se trata de una reactivación de la HAI y se decide iniciar prednisona 40 mg/día y luego dos semanas, se inicia azatioprina 50 mg/día, después de tres meses de respuesta bioquímica con normalización de las transaminasas, se realiza test de embarazo por amenorrea de dos meses con resultado positivo. Por este motivo suspende voluntariamente el tratamiento; acude a cita a los 10 días con TGO: 72 UI/L, TGP: 69 UI/L e Ig G 1707. Se inicia 40 mg de prednisona a los 15 días se observa mejoría bioquímica TGO: 22 UI/L, TGP: 28 UI/L e Ig G 1591, se inicia el descenso progresivo de la prednisona hasta llegar a 20 mg/d con TGO: 14 UI/L y TGP: 13 UI/. Se dejó con dosis de mantenimiento hasta el final del embarazo con prednisona 20 mg/d. El ginecólogo programó la cesárea por producto valioso y nació a término con 3300 gramos. Al control post parto TGO: 17 UI/L y TGP: 14 UI/L e Ig G 1410. El bebé nació sin complicaciones, no malformaciones congénitas. La niña tiene dos años y goza de buena salud y la madre está en terapia de mantenimiento.
CASO 4
Paciente de 37 años de ocupación ama de casa, natural y procedente de Ica, con diagnóstico de HAI desde el 2010 con tratamiento de mantenimiento con azatioprina 50 mg por tres años y suspensión voluntaria del mismo, por transaminasas normales durante dos años, presentó una reactivación de la hepatitis autoinmune con elevación de transaminasas, TGO: 372 UI/L y TGP: 598 UI/L, inmunoglobulina G: 2344, INR: 1,1, anti VHA Ig M, Core Ig M VHV, anti VHC, negativos, TORCH IgM negativos. Se reinicia prednisona 40 mg/ día y cuando se consigue normalizar transaminasas a las tres semanas se introduce azatioprina 50 mg/día. Al año de la normalización de transaminasas y mientras estaba en terapia de mantenimiento con 5 mg de prednisona y 50 mg de azatioprina acude porque en una evaluación ecográfica se le diagnostica gestación uterina de 9 semanas. Suspendió el tratamiento sin indicación médica. El control de las transaminasas después de tres semanas de suspender el tratamiento fue normal y se decide iniciar 20 mg de Prednisona. A los 15 días se realiza nuevo control de con los siguientes valores: TGO: 20 UI/L, TGP: 22 UI/L e Ig G 1380. Se mantiene la misma dosis hasta el final del embarazo con controles de transaminasas cada 15 días inicialmente y después mensuales hasta el término de la gestación. Se realiza la cesárea por feto macrosómico, nacido a término con 4200 gr. El bebé nació sin complicaciones, no malformaciones congénitas. Al control post parto TGO: 19 UI/L y TGP: 20 UI/L e Ig G 1259. La niña tiene 8 meses al momento de la publicación, sin alteraciones en su desarrollo y la madre continúa con terapia de mantenimiento 5 mg/d de prednisona y 50 mg/día de azatioprina.
El resumen de las cuatro gestaciones se presenta en las Tablas 1 y 2.
DISCUSIÓN
La HAI y embarazo no es una asociación frecuentemente descrita, a propósito de estas cuatro pacientes con HAI que gestaron, hemos revisado la literatura en los diferentes aspectos del embarazo.
Los informes relacionados con el embarazo en pacientes con hepatitis autoinmune existen ya desde la década de 1970, pero con resultados desfavorables, con una alta incidencia de complicaciones obstétricas, incluyendo la pérdida temprana del feto, nacimiento prematuro, bajo peso al nacer y un alto índice de cesáreas. Por otra parte, las complicaciones maternas incluyen pre-eclampsia, reactivación de la enfermedad, descompensación hepática y muerte (3).
Seguridad de la gestación en hepatitis autoinmune. El embarazo no está exento de riesgo para la madre y el feto. Según algunas revisiones la mortalidad fetal va desde 19% a 24% (4,7) y la mayoría sucede antes de la semana 20 de gestación. La frecuencia de complicaciones serias maternas es del 9% (7) Los resultados adversos durante la gestación en HAI se han relacionado con la presencia de autoanticuerpos anti SLA y Ro/SSA (4). Hasta un 30% experimentaron reactivación en el post pato (8). En Suiza solo el 52% de las mujeres consultan con su médico antes de su gestación (8). Más de la mitad reducen o suspenden la medicación durante el embarazo o la lactancia. Las cesáreas son más comunes (16% vs 6,5%) comparado con las mujeres sanas (8). En nuestra experiencia las cuatro gestaciones no fueron programadas, y a pesar que las pacientes estaban en control de la HAI, no consultaron por una posible gestación. Todas las pacientes suspendieron la medicación al enterarse del embarazo, tres de las cuatro elevaron transaminasas motivo por el cual se inició la terapia inmunosupresora y se eligió prednisona con la finalidad de que puedan dar de lactar. Una de ellas no elevó transaminasas, pero igualmente se decidió dar dosis de mantenimiento con 20 mg/d de prednisona para evitar el riesgo de reactivación de la enfermedad.
Se esperan tasas de natalidad favorables con un bebé sano entre el 71% y el 86%. Estas tasas de nacidos vivos son comparables a los pacientes con otras enfermedades autoinmunes, pero siguen siendo inferiores a las tasas de nacidos vivos reportados para la población en general (3).
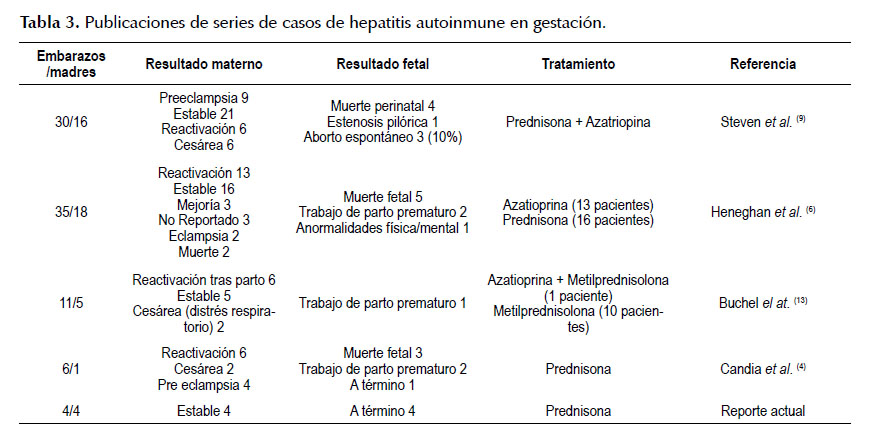
Se han reportado nacimientos pre término entre un 6% a 17% (9) Steven et al. (10) informaron una alta tasa de bajo peso al nacer, prematuridad, y cesáreas. Candia et al. (4), Schramm et al. (7) y Terrabuio et al. (11) han reportado que puede haber una alta tasa de aborto involuntario en el primer trimestre, también se informa de una tasa de parto prematuro del 33,3%. Las cuatro pacientes que presentamos tuvieron embarazos con reactivación de la enfermedad tras suspensión voluntaria de los fármacos; pero después de iniciada la inmunosupresión no se presentaron exacerbaciones de la HAI durante el embarazo ni después del parto, lo cual habría permitido los nacimientos a término en los cuatro casos con buen peso al nacer.
En nuestra serie de pacientes, todos los recién nacidos fueron concebidos bajo terapia con azatioprina, la misma que suspendieron recién entre la semana 7 y 10 de la gestación. La terapia de mantenimiento fue con prednisona solamente y se mantuvo post parto para que pudieran dar lactancia materna. A pesar de haber estado expuestas a la azatioprina durante las primeras semanas, en ningún caso hubo malformaciones congénitas. Sin embargo, los datos sobre su teratogenicidad se basan en modelos experimentales animales donde las dosis utilizadas son mucho más elevadas que las empleadas en la clínica habitual. De hecho, en animales no se observan alteraciones por debajo de una dosis de 5 mg/kg (12). Por otro lado, aunque la azatioprina pase la placenta, el hígado fetal carece de la enzima encargada de la conversión a mercaptopurina (inosinato fosforilasa) protegiendo al embrión en el periodo de organogénesis de la exposición a estos fármacos (13).
En cuanto a si estos fármacos aumentan el riesgo de malformaciones, los datos de la mayoría de los estudios (14-17), muestran una incidencia similar a la observada en la población general y en pacientes no tratados. Probablemente sean necesarios más estudios prospectivos y multicéntricos para establecer con mayor precisión este riesgo.
La HAI puede presentar episodios de reactivación durante el embarazo, o el puerperio. Candia et al. (4) reportan que, de los 101 embarazos estudiados, 35/101 (34%) presentaron reactivación durante el embarazo y 12/101 (12%), después del parto. Schramm et al. (7) reportaron reactivación durante la gestación en 21% y post parto en 52%, de manera interesante la reactivación durante la gestación fue alrededor de las 12 semanas y la reactivación post parto ocurrió al tercer mes posterior al parto y no hubo diferencia en las tasas de reactivación en las primeras y subsecuentes gestaciones. Sin embargo, no se han identificado los factores predictores de reactivación (18). En nuestra serie todos mantuvieron la enfermedad estable después de reiniciar la terapia inmunosupresora durante el embarazo y puerperio.
En la mayoría de los pacientes una reactivación de la HAI durante el embarazo, puede ser controlada por el aumento de la inmunosupresión; sin embargo, en casos raros, una reactivación puede provocar una descompensación hepática con la posible necesidad de un trasplante hepático (TH) o la muerte del paciente y/o el feto (3).
Westbrook RH et al. (3) reportaron un brote en la actividad de la HAI en 26/81 (33%) de los embarazos. y los eventos adversos posteriores al parto ocurrieron en 9 embarazos (11%); fue más frecuente en mujeres con cirrosis, en los pacientes que no estaban en terapia o que tuvieron un brote de enfermedad en el año anterior a la concepción. así mismo, los pacientes que tuvieron una exacerbación en asociación con el embarazo fueron más propensos a descompensarse desde el punto de vista hepático.
Así como se ha descrito reactivación de la HAI durante el embarazo o posterior al parto, también se ha descrito remisión espontánea durante la gestación (19). La gestación induce a cambios en la inmunidad materna. Más específicamente, conduce a un cambio de respuesta Th1 a una respuesta Th2. Existe un aumento en la producción de esteroides y otras hormonas (hormona liberadora de corticotropina por secreción placentaria, cortisol, estrógeno y progesterona), que inclinan el equilibrio hacia la respuesta Th2, mientras que, en el postparto se ha observado una reducción de estas hormonas. Debido a esto se especula que, durante el embarazo, puede mejorar la HAI mediante el aumento de la tolerancia inmunitaria (19,20).
Los niveles altos de estrógeno durante el embarazo favorecen un cambio de citoquinas que permiten la diferenciación y proliferación de linfocitos T citotóxicos infiltrantes del hígado a un perfil que tiene efectos antiinflamatorios (21). La actividad de la enfermedad puede mejorar mucho durante el embarazo y la reducción en la dosis o la eliminación de la medicación puede ser posible (20). Los cambios en las citocinas mediadas por la hormona; sin embargo, también contribuyen a la inestabilidad de la enfermedad a corto plazo, y como los niveles de estrógeno sanguíneo disminuyen al momento del parto, la HAI se exacerba entre el 12% al 86% de los casos (22). La anticipación de una exacerbación posparto justifica la reanudación de la terapia con corticosteroides a dosis completa durante el tercer trimestre (22). Por qué algunos pacientes con HAI tienen exacerbaciones durante la gestación y otros no, porque pacientes bien controlados durante la gestación presentan exacerbación en el periodo post parto se desconoce.
No existe vía de parto preferente esta debe ser elegida por indicación obstétrica, como fue el caso de nuestras pacientes.
El curso del embarazo en la HAI es muy variable, la seguridad del embarazo en estas pacientes permanece indefinida y la literatura publicada es escasa (3). Heneghan et al. (6) evaluaron la evolución del embarazo y el resultado fetal en 35 embarazos de 18 mujeres con HAI. La mayoría de sus pacientes mejoraron durante el embarazo, pero algunos recayeron en el período post-parto. Buchel et al. (20) que estudiaron 11 embarazos y reportaron 6 reagudizaciones de la HAI. Para evitar la reactivación post parto se requiere monitorización muy cercana, se aconseja cada tres semanas con controles de TGO, TGP por lo menos tres meses después del parto (23).
La gestación en pacientes con HAI, no es extremadamente frecuente, hemos extraído de la literatura publicada series de casos numerosos y la evolución de los mismos en estas pacientes.
¿Cómo definimos reactivación de la HAI durante el embarazo? La serie que señala la definición de reactivación es la de Heneghan et al., (6) quienes la definen de la siguiente manera: 1.- incremento de la actividad de las transaminasas dos veces el valor normal o 2.- un menor incremento de las transaminasas con incremento en la concentración de globulina sérica por encima de 35 g/l durante el resurgimiento de los síntomas.
¿Qué condiciona la reactivación durante la gestación? De acuerdo con Heneghan et al. (6), la evolución de la enfermedad no predice su comportamiento posterior durante el embarazo. Otra revisión (3) señala que la incidencia de un brote de activación en cualquier momento durante el período de gestación o en el período post-parto fue significativamente mayor en aquellas mujeres que no estaban en terapia, en comparación con los pacientes bajo tratamiento. Así mismo, los factores de riesgo asociados a un pobre resultado tanto en la madre como en el feto en pacientes con HAI se resumen en el siguiente cuadro (4).
El curso clínico severo que puede terminar en muerte fetal puede predecirse en la historia de gestaciones previas y la persistente actividad de la enfermedad. La presencia de cirrosis con hipertensión portal ensombrece el pronóstico. La mortalidad de la HAI sin cirrosis es similar a la población general. La pre eclampsia es un factor de riesgo importante para la madre y el feto con HAI. Tanto la preeclampsia como la hiperémesis están involucradas en las anormalidades hepáticas y hematológicas en estos pacientes (4).
Terapia durante la gestación. A pesar del curso indolente de la HAI durante el embarazo, la mayoría de los pacientes requieren terapia farmacológica y es importante identificar qué drogas podrían ser usadas sin causar daño al feto, de acuerdo a la FDA la prednisona es categoría C, droga que no cruza la placenta de manera significativa. No se ha asociado con efectos teratogénicos en humanos y parece ser preferido para el control de la actividad de la enfermedad durante la gestación en HAI (11).
La azatioprina y 6-mercaptopurina cruzan la placenta humana, pero raramente ingresan a la circulación fetal (11). La FDA ha categorizado azatioprina como categoría D durante el embarazo, lo que significa que se considera que es un riesgo potencial para el feto. Se ha reportado que 50 a 100 mg/d de azatioprina no incrementa el riesgo de defectos en los recién nacidos, aunque si se ha asociado con bajo peso al nacer y prematuridad (11).
Asimismo, la experiencia con la azatioprina en el embarazo se ha incrementado en pacientes con enfermedad inflamatoria del intestino, artritis reumatoide, lupus eritematoso sistémico o después de un trasplante de órganos sólidos (18). Las conclusiones de estos estudios corroboran que la azatioprina es segura e idealmente debe continuarse durante el embarazo para mantener la remisión de la enfermedad materna. No hay reportes de malformaciones congénitas en niños de madres tratadas por HAI (18).
Aunque solo el 1,2% de la cantidad de azatioprina es absorbida para ser excretada en la leche materna. No se recomienda durante la lactancia (11).
Las guías americanas (23), publicadas el 2010, recomiendan si es posible, interrumpir el tratamiento con azatioprina durante el embarazo (clase III, nivel C) mientras que las guías europeas (24), publicadas el 2015, recomiendan continuar para evitar una recaída, que en sí mismo representa un riesgo tanto para el feto y la madre. Ambas directrices europeas y americanas hacen hincapié en la importancia de informar a la mujer antes de un embarazo sobre los riesgos potenciales para el feto.
Westbrook et al. (3) reportaron que, durante embarazo, 61 pacientes (75%) estaban recibiendo tratamiento para el control de su HAI. De estos, 27 pacientes estaban en monoterapia de prednisolona (dosis media de 10 mg/ día, rango de 2,5 mg-40 mg), 7 estaban en monoterapia con azatioprina (rango, 1-2 mg/kg/día) y 25 pacientes estaban en terapia combinada de azatioprina (1-2 mg/ kg/día) y prednisolona (dosis media 5 mg (rango 2,5-20 mg). Además, un paciente estaba tomando tacrolimus (2 mg/día) en combinación con prednisolona. En total, 32 embarazos se produjeron en las mujeres con azatioprina. De éstos, hubo 21 nacimientos vivos, 6 interrupciones voluntarias, 4 abortos espontáneos y 1 muerte materna (y posterior del feto). De los nacidos vivos, no se informó de anomalías fetales. Todos los niños han cumplido los hitos de desarrollo normales en la mediana de 5 años de seguimiento.
Terrabuio et al. (11) señalan que sus pacientes con HAI antes de la concepción y embarazo, el 48,1% recibían azatioprina y prednisona; pero este régimen de tratamiento fue cambiado a prednisona 20 mg/día. El 5,5% de sus pacientes gestaron en tratamiento con prednisona y se mantuvieron con esa misma droga durante todo el embarazo.
En nuestra serie, las cuatro pacientes con HAI quedaron embarazadas mientras recibían terapia con azatioprina y prednisona, pero la suspendieron en la semana 7 y 10, pasando a terapia de prednisona solamente a dosis de 20 mg/día como mantenimiento y en ningún caso se presentó reactivación de la enfermedad, ni se han presentado malformaciones congénitas de los recién nacidos, hasta el momento de la actual publicación el desarrollo psicomotor de los niños es normal.
Para los pacientes que creen que la azatioprina es peligrosa para el feto o podría perjudicar sus resultados, el cambio de la doble terapia (azatioprina y prednisona) a 20 mg/d prednisona parece ser un manejo seguro (11).
Esta es la primera serie de casos reportados en nuestro país de pacientes con HAI, donde podemos observar que es posible llegar a embarazos a término, sin riesgo para la madre, así mismo que la terapia combinada de prednisona y azatioprina, no generó riesgos de malformaciones congénitas a pesar que se usaron en las primeras semanas de gestación.
El curso de HAI durante el embarazo es variable, la exacerbación durante y después del embarazo es una complicación que puede presentarse; por lo tanto, se debe aconsejar a los pacientes con HAI que permanezcan bajo control. El tratamiento óptimo para las pacientes embarazadas con HAI debe incluir prednisona a las dosis más bajas posibles, solo o en combinación con otro(s) agente(s) inmunosupresores, como la azatioprina, aunque no existen estudios específicos que evalúen completamente su beneficio y seguridad durante el embarazo, pero a la luz del resultado del tratamiento en otras enfermedades autoinmunes nos dan argumentos para pensar en su seguridad.
El embarazo no está contraindicado en la HAI, es más se espera un resultado satisfactorio tanto para la madre como para el feto.
Conflicto de intereses: No existe conflicto de intereses para la elaboración de la presente investigación.
Citar como: Castro C, Caballero J, Garavito J, Lozano A. Hepatitis autoinmune y embarazo: serie de casos. Rev Gastroenterol Peru. 2019;39(3):292-8
REFERENCIAS BIBLIOGRÁFICAS
1. Boberg KM, Aadland E, Jahnsen J, Raknerud N, Stiris M, Bell H. incidence and prevalence of primary biliary cirrhosis, primary sclerosing cholangitis, and autoimmune hepatitis in a Norwegian population. Scand J Gastroenterol. 1998;33:99-103. [ Links ]
2. Werner M, Prytz H, Ohlsson B, Almer S, Bjornsson E, Bergquist A, et al. Epidemiology and the initial presentation of autoimmune hepatitis in Sweden: a nationwide study. Scand J Gastroenterol. 2008;43:1232-40. [ Links ]
3. Westbrook R, Yeoman AD, Kriese S, Heneghan M. Outcomes of pregnancy in women with autoimmune. J Autoimmun. 2012;38(2-3):J239-44. [ Links ]
4. Candia L, Marquez J, Espinoza L. Autoimmune hepatitis and pregnancy: a rheumatologist’s dilemma. Semin Arthritis Rheum. 2005;35(1):49-56
5. Alvarez F, Berg P, Bianchi F, Bianchi L, Burroughs A, Cancado E, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-38. [ Links ]
6. Heneghan M, Norris S, O’Grady J, Harrison P, Mcfarlane I. Management and outcome of pregnancy in autoimmune hepatitis. Gut. 2001;48(1):97-102.
7. Schramm C, Herkel J, Beuers U, Kanzler S, Galle PR, Lohse AW. Pregnancy in autoimmune hepatitis: outcome and risk factors. Am J Gastroenterol. 2006;101(3):556-60. [ Links ]
8. Werner M, Björnsson E, Prytz H, Lindgren S, Almer S, Broomé U, et al. Autoimmune hepatitis among fertile women: strategies during pregnancy and breastfeeding. Scand J Gastroenterol. 2007; 42(8):986-91. [ Links ]
9. Benjaminov FS, Heathcoate J. Liver disease in pregnancy. Am J Gastroenterol. 2004;99:2479-88. [ Links ]
10. Steven MM, Buckley JD, Mackay IR. Pregnancy in chronic active hepatitis. Q J Med. 1979;48(192):519-31. [ Links ]
11. Terrabuio DR, Abrantes-Lemos CP, Carrilho FJ, Cancado EL. Follow-up of pregnant women with autoimmune hepatitis: the disease behavior along with maternal and fetal outcomes. J Clin Gastroenterol. 2009;43(4):350-56. [ Links ]
12. Platzek T, Bochert G. Dose-response relationship of teratogenicity and prenatal-toxic risk estimation of 6-mercaptopurine riboside in mice. Teratog Carcinog Mutagen 1996;16(3):169-81. [ Links ]
13. Gisbert JP. Safety of immunomodulators and biologics for the treatment of inflammatory bowel disease during pregnancy and breastfeeding. Inflamm Bowel Dis. 2010;16(5):881-95. [ Links ]
14. Francella A, Dyan A, Bodian C, Rubin P, Chapman M, Present DH. The safety of 6-mercaptopurine for childbearing patients with inflammatory bowel disease: a retrospective cohort study. Gastroenterology. 2003;124(1):9-17. [ Links ]
15. Moskovitz DN, Bodian C, Chapman ML, Marion JF, Rubin PH, Scherl E, et al. The effect on the fetus of medications used to treat pregnant inflammatory bowel-disease patients. Am J Gastroenterol. 2004;99(4):656-61. [ Links ]
16. Goldstein LH, Dolinsky G, Greenberg R, Schaefer C, Cohen- Kerem R, Diav-Citrin O, et al. Pregnancy outcome of women exposed to azathioprine during pregnancy. Birth Defects Res A Clin Mol Teratol. 2007;79(10):696-701. [ Links ]
17. Langagergaard V, Pedersen L, Gislum M, Norgard B, Sorensen HT. Birth outcome in women treated with azathioprine or mercaptopurine during pregnancy: A Danish nationwide cohort study. Aliment Pharmacol Ther. 2007(1);25:73-81. [ Links ]
18. Uribe M, Chavez NC, Mendez N. Pregnancy and autoimmune hepatitis. Ann Hepatol. 2006;5(3):187-9. [ Links ]
19. Muratori P, Loffreda S, Muratori L, Ferrari R, Afandi K, Cassani F, et al. Spontaneous remission of autoimmune hepatitis during pregnancy. Dig Liver Dis. 2002;34(8):608-9. [ Links ]
20. Buchel E, Van Steenbergen W, Nevens F, Fevery J. Improvement of autoimmune hepatitis during pregnancy followed by flare-up after delivery. Am J Gastroenterol. 2002;97(12):3160-5. [ Links ]
21. Whitacre CC, Reingold SC, O’Looney PA. A gender gap in autoimmunity. Science. 1999;283(5406):1277-8.
22. Czaja AJ. Autoimmune hepatitis in special patient populations. Best Pract Res Clin Gastroenterol. 2011;25(6):689-700. [ Links ]
23. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology. 2010;51(6):2193-213. [ Links ]
24. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J Hepatol. 2015;63(4):971-1004. [ Links ]
Correspondencia:
Adelina Lozano
E-mail:adeloza@hotmail.com