Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.39 no.4 Lima Oct./Dec. 2019
ARTÍCULOS ORIGINALES
Impacto del virus Epstein Barr en el cáncer gástrico en el Perú
Impact of the Epstein Barr virus on gastric cancer in Peru
Brady Beltrán Gárate1,2,a, Anais Camara1,a, María del Carmen Kapsoli Sánchez3,b, Denisse Castro Uriol1,2,a, Alejandro Yábar Berrocal3,b
1 Departamento Oncología Médica, Radioterapia Hospital Edgardo Rebagliati Martins. Lima, Perú.
2 Centro de Medicina de Precisión, Facultad de Medicina, Universidad de San Martin de Porres. Lima, Perú.
3 Departamento de Anatomía Patológica, Hospital Edgardo Rebagliati Martins. Lima, Perú.
a Oncólogo médico, b Anatomopatólogo
RESUMEN
El virus de Epstein Barr (VEB) es responsable del 10% del cáncer gástrico (CG) y se correlaciona con mejor tasa de sobrevida. En Perú, no existen estudios sobre prevalencia y características clínicas de CG VEB positivo. Objetivos: Determinar la prevalencia y las características clínico patológicas del CG VEB positivo. Materiales y métodos: 111 muestras de GC fueron examinadas centralmente por hibridización cromogénica in situ del RNA del VEB (EBER CISH). Resultados: El 8,4% de los casos fueron positivos para VEB. La mayoría de los casos VEB positivos tuvieron más de 60 años, varones y la localización, antro / píloro fue la más frecuente. La mayoría de los casos fueron de tipo intestinal y un patrón tubular con una tendencia a un mejor pronóstico en comparación con los casos de VEB negativo. Conclusión: CG VEB positivo es una entidad con una prevalencia de 8,4% en Perú con características clínicas y morfológicas distintivas.
Palabras clave: Virus Epstein-Barr; Cáncer gástrico; Sobrevida (fuente: DeCS BIREME).
ABSTRACT
Epstein Barr Virus (EBV) is responsible of 10% of Gastric Cancer (GC), correlating with better survival rates. In Peru, there were not studies about prevalence and clinical characteristics of CG EBV positive. Objective: Determine prevalence and clinicopathological characteristics of GC EBV positive. Materials and methods: 111 GC tumour samples were centrally screened by Chromogenic in situ hybridization (CISH) technique for EBV-encoded RNA (EBER) transcript. Results: 8.4% of cases were positive for EBV. Most cases EBV positive were more than 60 years old; male, antrum/pylorus had more frequent localizations. Most cases had an intestinal type and tubular patter and a tendency to better prognostic in comparison EBV negative cases. Conclusion: EBV positive GC is an entity with a prevalence of 8.4% in Peru with distinctive clinical and morphological characteristics.
Keywords: Epstein-Barr virus; Cancer, gastric; Survival (source: MeSH NLM).
INTRODUCCIÓN
El cáncer gástrico (CG) es uno de los tumores más frecuentes en el Perú (1) y representa el 14,7% de las causas de mortalidad por cáncer en varones y 13,4% en mujeres, en el Perú (2). Los factores de riesgo conocidos para el CG son: tabaquismo, dieta rica en sal, alta ingesta de carnes, reflujo biliar e infección por H. pylori (3,4).
El virus de Epstein-Barr (VEB) es el responsable del 10% del CG (5). El CG VEB positivo es una entidad que afecta más a varones, con localización más frecuente en los dos tercios superiores del estómago y estadios más tempranos con un pronóstico bueno en comparación con CG VEB negativo (5).
Este es el primer reporte peruano que pretende determinar la prevalencia y el rol pronóstico del CG VEB positivo.
MATERIALES Y MÉTODOS
El presente estudio corresponde a un estudio retrospectivo y analítico que se realizó de enero 2013 hasta diciembre del 2013 en el Servicio de Oncología Médica del Hospital Edgardo Rebagliati Martins -EsSalud.
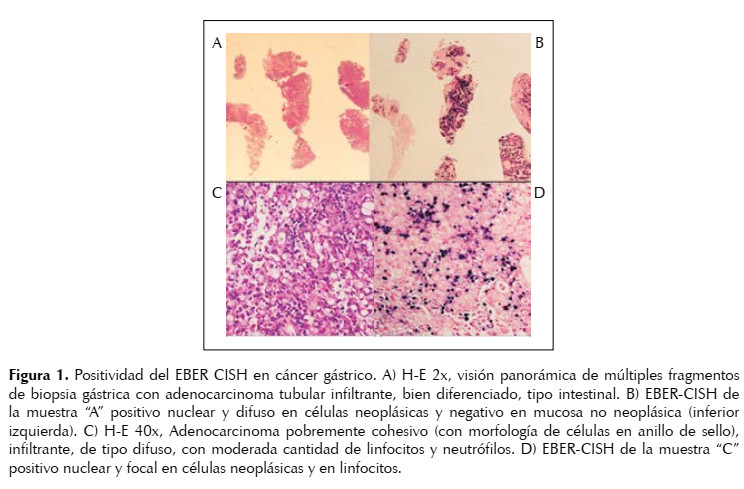
Se incluyeron 111 pacientes con diagnóstico de CG diagnosticados de manera consecutiva. Los criterios de elegibilidad fueron: mayores de 18 años, cualquier estadio clínico y tacos de parafina del tumor gástrico en buenas condiciones. La información clínica fue obtenida de las historias clínicas de los pacientes. Todos los casos fueron sometidos a la prueba de EBER CISH. La prueba se reportó como positiva cuando hubo marcaje nuclear solo en las células tumorales. Figura 1.
Las evaluaciones estadísticas incluyeron las tabulaciones descriptivas para caracterizar a los pacientes, la modalidad de tratamiento y respuesta. Las comparaciones de las características clínicas entre los pacientes con VEB (-) vs. VEB (+) fueron realizadas mediante la estadística de prueba exacta de Fisher. El tiempo de sobrevida global fue determinado entre la fecha de diagnóstico y la fecha de muerte o fecha del último control. La sobrevida global fue determinada mediante el método de Kaplan- Meier. Las comparaciones de las curvas de sobrevida fueron realizadas mediante test de Logrank. Todas las evaluaciones estadísticas se realizaron a un nivel de significancia del 5%.
RESULTADOS
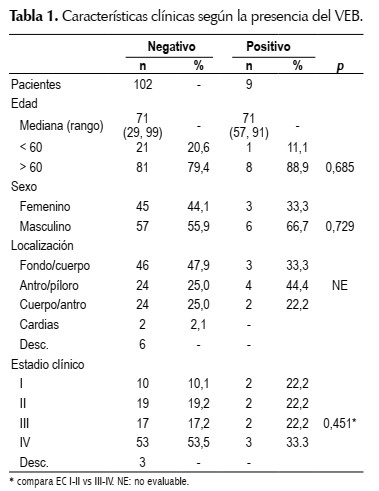
La prevalencia del CG VEB (+) fue del 8,1% (9/111). La mediana de edad fue de 71 años, similar para el grupo VEB positivo y VEB negativo. Con respecto al sexo, hubo una tendencia a un mayor número de varones en el grupo VEB positivo (66,7% vs 33,3% p=0,685). (Tabla 1).
Con respecto a la localización, el sitio más frecuente del grupo VEB negativo, con un 47,9% fue el fondo/ cuerpo mientras que en el grupo VEB positivo, la localización más frecuente fue en antro-píloro (44,4%). Con respecto al estadio clínico, el estadio IV fue el más frecuente en el grupo VEB positivo y VEB negativo con 53,5% vs. 33,3% respectivamente.
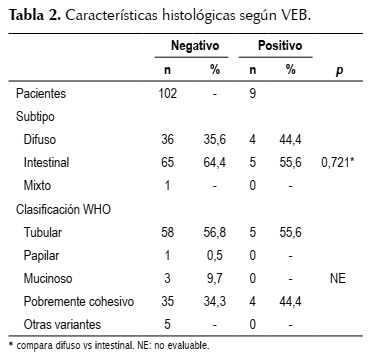
El tipo histológico intestinal se presentó con mayor frecuencia en ambos grupos al igual que el patrón tubular. Se identificaron 6 casos con positividad para el VEB pero sólo en los linfocitos del estroma tumoral, casos reportados como negativos. (Tabla 2).
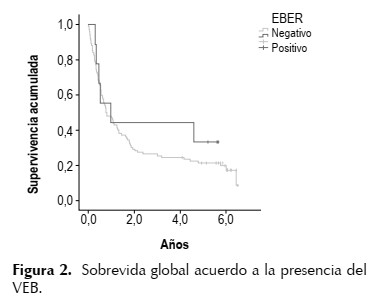
La mediana de seguimiento de los pacientes fue de 5,9 (IC95%: 5,6, 6,2) años, alcanzando una mediana de sobrevida global fue de 9,8 (IC95%: 6, 13) meses en el total de los casos, 9,4 meses en aquellos con VEB negativo y 11,8 meses en VEB positivo.
La tasa de sobrevida a 5 años en el total de pacientes fue de 22,4%, para el grupo VEB negativo fue de 21,4% y para el grupo VEB positivo de 33,3% (p=0,471). (Figura 2).
DISCUSIÓN
El cáncer gástrico (CG) es una neoplasia frecuente y ocupa el segundo lugar como causa de mortalidad en el mundo. En Perú, el CG en una causa importante de muerte (2). Los factores de riesgo para este cáncer son: el esófago de Barrett relacionado con el adenocarcinoma de la unión cardioesofágica (3), además, Helicobacter pylori, la gastritis atrófica y la metaplasia intestinal se asocian al adenocarcinoma gástrico (4).
En el 2014, la clasificación molecular (TCGA) identificó cuatro tipos moleculares de CG: VEB positivo, inestabilidad microsatélite (MSI), genoma estable (GS) e inestabilidad cromosómica (CIN). El 9% de los tumores fueron asociados al VEB (6), este se presenta en el 10% de la población mundial con CG en un rango del 2%-20% (7). En Latinoamérica, Brasil alcanza un 20% (8). Nuestro estudio muestra una prevalencia del 8,4% similar a lo descrito en Japón (9). En el estudio se identificaron 6 casos cuya expresión del virus estaba en los linfocitos del estroma. El significado clínico de este hallazgo es desconocido.
El mecanismo carcinogénico más importante responsable de este tipo de CG es la hipermetilación inducida por los genes virales. La proteína viral LMP2A induce hipermetilación del gen supresor tumoral, PTEN. Otros genes latentes y microRNAs virales poseen propiedades proliferativas, antiapoptótica y de motilidad (10). El perfil mutacional de esta neoplasia es característico. Las mutaciones ARID1A y BCOR son las más frecuentes (10,11). Sin embargo, también son frecuentes mutaciones en PIK3CA y amplificación del JAK2, CD274, PDL1 y PD-L2 (10,11).
Dentro de las manifestaciones clínicas del CG VEB positivo se tienen: predominio masculino, lo que se confirma en nuestro estudio (10,11). La localización es frecuente en el tercio superior o medio del estómago, lo que no ocurrió en nuestro estudio (12). El CG VEB positivo presenta menor T y N comparado a CG VEB negativo (13,14). El tipo histológico del CG VEB positivo es variable, sin embargo, estudios recientes muestran que mayoritariamente corresponden al tipo intestinal, tal como se presentó en nuestros casos (15).
El rol pronóstico del VEB en CG es controversial. Sin embargo, un estudio que involucra trece publicaciones con 4,599 pacientes sugiere que CG VEB positivo presenta un mejor pronóstico con una reducción del riesgo relativo de muerte del 28%. La sobrevida mediana del grupo VEB positivo fue de 8,5 años vs 5,3 años para el grupo VEB negativo (16).
Otro estudio muestra que el mejor pronóstico del CG VEB positivo ocurre solo en población asiática (12). Nuestro estudio mostró una tendencia a mejor sobrevida comparado con CG VEB (-) El pronóstico favorable correlacionaría con la respuesta immune potente de esta enfermedad.
Dentro del grupo EBV CG positivo se podrían encontrar diferencias pronósticas de acuerdo con la expresión de PDL1, PI3KCA, ARIDIA y PTEN (17-19). El reconocimiento de esta nueva entidad podrá establecer estrategias terapéuticas diferentes. Así, inhibidores de check point que son anti-PD1 o anti PD-L1, agentes inhibidores del PIK3CA o agentes hipometilantes podrían emerger como el armamentario dentro de la medicina de precisión para esta patología (20).
Este estudio tiene limitaciones pues es de naturaleza retrospectiva e incluye un número pequeño de pacientes. Futuros estudios prospectivos deberán contemplar un número importante de pacientes para poder determinar el verdadero rol pronóstico del VEB en CG.
En conclusión, CG VEB positivo se presenta con una prevalencia de 8,4%, en pacientes mayores de 60 años, varones, histología tipo intestinal y patrón tubular además de presentar una tendencia a un mejor pronóstico en comparación con los casos de VEB negativo.
Conflictos de intereses: El autor declara no tener ningún tipo de conflicto de interés.
Financiamiento: Con respecto a financiamiento, este corresponde a la Universidad de San Martin de Porres
REFERENCIAS BIBLIOGRÁFICAS
1. Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Dicker D, Pain A, Hamavid H, Moradi-Lakeh M, et al. The global burden of cancer 2013. JAMA Oncol. 2015;1(4):505-27. [ Links ]
2. Perú, Ministerio de Salud. Análisis de la Situación del Cáncer en el Perú, 2013. Lima: Dirección General de Epidemiología, MINSA; 2013. [ Links ]
3. Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol. 1995;19:S37-S43. [ Links ]
4. Moss SF. The clinical evidence linking Helicobacter pylori to gastric cancer. Cell Mol Gastroenterol Hepatol. 2016;3(2):183-91. [ Links ]
5. Naseem M, Barzi A, Brezden-Masley C, Puccini A, Berger MD, Tokunaga R, et al. Outlooks on Ebstein-Barr virus associated gastric cancer. Cancer Treat Rev. 2018;66:15-22. [ Links ]
6. Zhang W. TCGA divides gastric cancer into four molecular subtypes: implications for individualized therapeutics. Chin J Cancer. 2014;33(10):469-70 [ Links ]
7. Huang SC, Ng KF, Chen KH, Hsu JT, Liu KH, Yeh TS, et al. Prognostic factors in Epstein-Barr virus-associated stage I-III gastric carcinoma: implications for a unique type of carcinogenesis. Oncol Rep. 2014;32(2):530-8. [ Links ]
8. de Souza CRT, Almeida MCA, Khayat AS, da Silva EL, Soares PC, Chaves LC, et al. Association between Helicobacter pylori, Epstein-Barr virus, human papillomavirus and gastric adenocarcinomas. World J Gastroenterol. 2018;24(43):4928-38 [ Links ]
9. Tokunaga M, Uemura Y, Tokudome T, Ishidate T, Masuda H, Okazaki E, et al. Epstein-Barr virus related gastric cancer in Japan: a molecular patho-epidemiological study. Acta Pathol Jpn. 1993;43(10):574-81. [ Links ]
10. Van Beek J, zur Hausen A, Klein Kranenbarg E, van de Velde CJ, Middeldorp JM, van den Brule AJ, et al. EBV-positive gastric adenocarcinomas: a distinct clinicopathologic entity with a low frequency of lymph node involvement. J Clin Oncol. 2004;22(4):664-70. [ Links ]
11. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513(7517):202-9. [ Links ]
12. Song HJ, Srivastava A, Lee J, Kim YS, Kim KM, Ki Kang W, et al. Host inflammatory response predicts survival of patients with Epstein-Barr virus associated gastric carcinoma. Gastroenterology. 2010;139(1):84-92. [ Links ]
13. van Beek J, zur Hausen A, Klein Kranenbarg E, van de Velde CJ, Middeldorp JM, van den Brule AJ, et al. EBV-positive gastric adenocarcinomas: a distinct clinicopathologic entity with a low frequency of lymph node involvement. J Clin Oncol. 2004;22(4):664-70. [ Links ]
14. Murphy G, Pfeiffer R, Camargo MC, Rabkin CS. Metaanalysis shows that prevalence of epstein-barr virus-positive gastric cancer differs based on sex and anatomic location. Gastroenterology. 2009;137(3):824-33. [ Links ]
15. Park JH, Kim EK, Kim YH, Kim JH, Bae YS, Lee YC, et al. Epstein-Barr virus positivity, not mismatch repair-deficiency, is a favorable risk factor for lymph node metastasis in submucosa-invasive early gastric cancer. Gastric Cancer. 2016;19(4):1041-51. [ Links ]
16. Camargo MC, Kim WH, Chiaravalli AM, Kim KM, Corvalan AH, Matsuo K, et al. Improved survival of gastric cancer with tumour Epstein-Barr virus positivity: an international pooled analysis. Gut. 2014;63(2):236-43. [ Links ]
17. Liu X, Wang Y, Wang X, Sun Z, Li L, Tao Q, et al. Epigenetic silencing of WNT5A in Epstein-Barr virus-associated gastric carcinoma. Arch Virol. 2013;158(1):123-32. [ Links ]
18. Saito R, Abe H, Kunita A, Yamashita H, Seto Y, Fukayama M. Overexpression and gene amplification of PD-L1 in cancer cells and PD-L1(+) immune cells in Epstein-Barr virusassociated gastric cancer: the prognostic implications. Mod Pathol. 2017;30(3):427-39. [ Links ]
19. Kang HJ, Lee IS, Park YS, Ho WJ, Sohn D, Ahn JY, et al. Biomarkers of EBV-positive gastric cancers: loss of pten expression is associated with poor prognosis and nodal metastasis. Ann Surg Oncol. 2016;23(11):3684-92. [ Links ]
20. Sunakawa Y, Lenz HJ. Molecular classification of gastric adenocarcinoma: translating new insights from the cancer genome atlas research network. Curr Treat Options Oncol. 2015;16(4):17. [ Links ]
Correspondencia:
Brady Beltrán
E-mail: bgbrady@hotmail.com