INTRODUCCIÓN
La enfermedad inflamatoria intestinal (EII) comprende principalmente dos entidades: la enfermedad de Crohn (EC) y la colitis ulcerativa (CU) 1. Se considera un problema de salud mundial, con una prevalencia del 0.4% 2. En los últimos años la incidencia de la EC está en aumento (4,5/100 000), mientras que la de CU se mantiene constante (2/100 000) 2.
La mayoría de los casos se diagnostican entre la segunda y tercera década de la vida. La EC es más frecuente en varones (1,5:1), mientras que no existe predominio de sexo en la CU 2.
La presentación clínica de ambas enfermedades es heterogénea, lo cual nos obliga a realizar una terapia individualizada por paciente 3. Actualmente el objetivo del tratamiento de la EII está evolucionando, desde únicamente el control de los síntomas, hasta la modificación del curso de la enfermedad, mediante la normalización de los marcadores séricos, la remisión endoscópica e histológica 3,4.
En las últimas dos décadas se ha logrado un gran avance en comprender la patogénesis de la EII. Si bien es cierto que aún se desconoce con exactitud, se han identificado múltiples factores involucrados: vías inflamatorias, factores celulares y contribución de la microbiota, permitiendo desarrollar nuevas opciones terapéuticas 5.
Los fármacos anti-factor de necrosis tumoral (anti-TNF) ofrecen remisión significativa y duradera de la enfermedad 6. Sin embargo, aproximadamente el 30% de los pacientes no responden a la terapia de inducción y otro 30% pierde la respuesta durante el primer año de tratamiento 7.
No existe aún consenso sobre la definición de falta de respuesta primaria. En función al cuadro clínico se considera al no conseguir mejoría clínica con la terapia de inducción 8. En términos de tiempo, según los ensayos clínicos, la falta de respuesta a los anti-TNFs no debe evaluarse antes de las 14, 12 u 8 semanas posteriores a las infusiones iniciales con infliximab (IFX), adalimumab (ADA) y certolizumab respectivamente 9,10.
En la pérdida de respuesta secundaria, los pacientes que mejoraron inicialmente con la terapia de inducción, pierden respuesta durante la fase de mantenimiento. Tampoco existe una definición universal, pero la mayoría de los ensayos clínicos y la European Crohn´s and Colitis Organization (ECCO) se basan en índices de actividad clínico-endoscópicos para definir la respuesta y/o remisión (el índice de actividad de la EC (CDAI) o el índice de Mayo para CU) 10,11.
En los pacientes que reciben anti-TNFs y experimentan síntomas compatibles con recaída clínica, el primer paso es determinar si éstos se deben a una inflamación activa. Es importante tener en cuenta que hay otros trastornos que pueden imitar el cuadro de actividad, como el síndrome del intestino irritable, trastornos dietéticos, sobrecrecimiento bacteriano, y/o infecciones; por lo que deben considerarse dentro del diagnóstico diferencial 10,11. Basarse solo en la evaluación clínica no es totalmente confiable, por lo que se requiere de métodos objetivos como estudios endoscópicos y biomarcadores séricos o en heces 12.
Un mecanismo común implicado en el desarrollo de pérdida de respuesta secundaria es la inmunogenicidad, debido a la formación de anticuerpos contra los anti-TNFs. Estos pueden interferir con la unión a su receptor o acelerar la eliminación del fármaco a través del sistema reticuloendotelial 13. La formación de anticuerpos se correlaciona con niveles más bajos de fármaco en suero y menor duración de la respuesta. El porcentaje de anticuerpos positivos varía ampliamente entre los estudios (0,04 a 35%) 13.
Se ha propuesto un algoritmo de manejo que consiste inicialmente en verificar el adecuado cumplimiento de la administración del biológico y la medición de la concentración del fármaco. Si ésta es subterapéutica o indetectable, se sugiere evaluar los anticuerpos contra los anti-TNFs. Si a su vez estos son indetectables, se sugiere la intensificación de la terapia mediante duplicación de la dosis o acortamiento del intervalo de administración del anti-TNF. Si los anticuerpos son detectables, un cambio a un segundo anti-TNF con otra estructura molecular, es la opción farmacológica preferida. Por el contrario, si la medición de la concentración del fármaco se encuentra en rangos terapéuticos, independientemente de los anticuerpos contra los anti-TNFs, la conducta recomendada sería cambiar a un fármaco con diferente mecanismo de acción 14.
El objetivo de este estudio es evaluar la respuesta a la terapia con anti-TNFs, en pacientes con EII.
MATERIALES Y MÉTODOS
Protocolo de estudio
Estudio observacional, descriptivo, prospectivo, realizado en el Servicio de Gastroenterología del Hospital Nacional Guillermo Almenara Irigoyen - EsSalud de Lima-Perú. Se revisaron las historias clínicas de pacientes con diagnóstico establecido de CU y EC, que cumplían con los criterios de inclusión. El período de estudio comprendió desde enero 2015 hasta agosto 2018.
Criterios de inclusión
Pacientes con diagnóstico de CU y EC que cursaron con enfermedad moderada a severa con las siguientes características:
Criterios de exclusión
Pacientes con diagnóstico de CU y EC que cursaron con enfermedad leve.
Pacientes que recibieron terapia anti-TNF previa.
Pacientes con contraindicaciones absolutas para el uso de anti-TNFs: infecciones agudas o crónicas, trastornos desmielinizantes, insuficiencia cardíaca de clase III/IV y neoplasias malignas.
Definición de variables
Pérdida de respuesta secundaria: pérdida de eficacia clínica y endoscópica de un anti-TNF que había logrado previamente mejoría clínica y endoscópica durante la fase de inducción. Se utilizó el índice de actividad de la EC (CDAI) o el índice de mayo para CU; definiendo respuesta y remisión según los parámetros establecidos por las guías internacionalmente aceptadas.
Respuesta clínica se define como la reducción ≥3 puntos del basal del índice de Mayo o disminución >70 puntos del puntaje CDAI basal.
Remisión clínica se define como una puntuación total ≤2 del índice de Mayo o CDAI <150 puntos.
La dosis de inducción con Infliximab fue 5 mg/kg en las semanas 0, 2 y 6. La dosis de mantenimiento fue 5 mg/kg cada 8 semanas.
Intensificación de la terapia: aumento de la dosis de Infliximab hasta 10 mg/kg o acortamiento del intervalo entre las infusiones a cada 4 semanas.
Análisis estadístico
La estadística descriptiva del presente estudio está presentada como medida de frecuencias, porcentajes, medianas, medias, desviación estándar, así como rangos (mínimo; máximo) para datos continuos y como frecuencias relativas y absolutas para datos categóricos. Para determinar diferencias significativas se empleó la prueba de x² para variables cualitativas y t de Student para variables cuantitativas. El análisis estadístico fue realizado usando el programa SPSS versión 25, así como Microsoft Excel 2016.
RESULTADOS
Se incluyó 31 pacientes con EII tratados con infliximab en nuestro servicio, 23 con EC y 8 con CU. Todos los pacientes recibieron tratamiento biológico asociado con azatioprina como inmunomodulador, con respuesta inicial favorable a la fase de inducción.
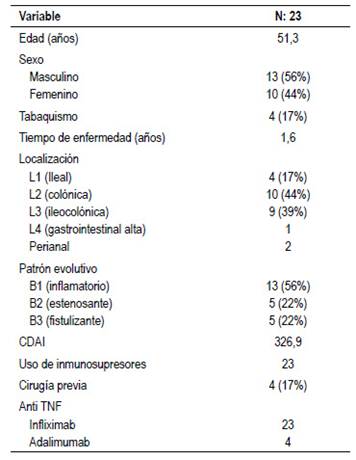
Los pacientes con EC tenían una media de edad de 51 años, la mayoría eran varones (56%) con un tiempo de enfermedad promedio de 1.6 años. La localización más frecuente fue colónica o ileocolónica. Sólo 2 pacientes presentaron compromiso perianal y 1 paciente compromiso gastrointestinal alto. El patrón evolutivo más común fue inflamatorio (56%), con un CDAI promedio de 326 al momento del inicio tratamiento anti-TNF. Tabla 1.
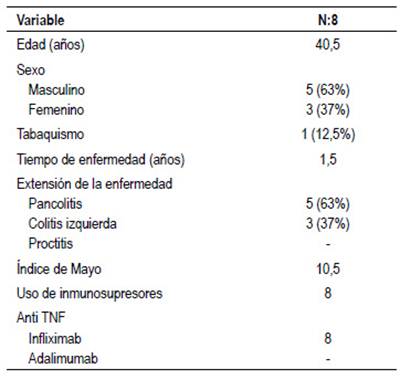
Los pacientes con CU presentaban una edad promedio de 40 años, siendo también la mayoría varones (63%) con un tiempo de enfermedad promedio de 1,5 años. El 63% presentó pancolitis y un índice de mayo promedio de 10,5 puntos al momento del inicio de la terapia biológica. Tabla 2.
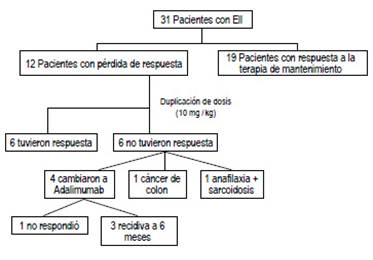
Durante el seguimiento observamos que 12 (38,7%) pacientes (3 con CU y 9 con EC) presentaron pérdida de respuesta a partir de los 6 meses del inicio de la fase de mantenimiento: 2 entre 6-12 meses, 4 entre 12-18 meses y 6 entre 18-24 meses (Figura 1). Como primera medida se les duplicó la dosis de infliximab a 10 mg/ kg, obteniendo respuesta en la mitad de los casos luego de 12 semanas.
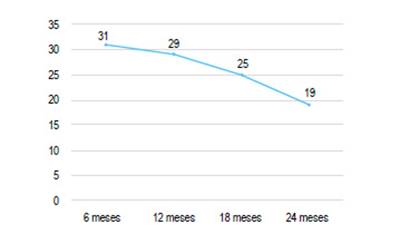
Figura 1 Respuesta a infliximab en pacientes con enfermedad inflamatoria intestinal con el paso de los meses.
De los 6 pacientes restantes, 4 cambiaron a adalimumab, 1 paciente presentó cáncer de colon durante el control endoscópico y 1 paciente presentó anafilaxia y sarcoidosis por lo que se suspendió el tratamiento. De los pacientes que recibieron Adalimumab, 3 (75%) presentaron recidiva endoscópica a partir de los 6 meses de tratamiento y 1 (25%) no respondió a la terapia de inducción por lo que fue sometido a colectomía. (Figura 2).
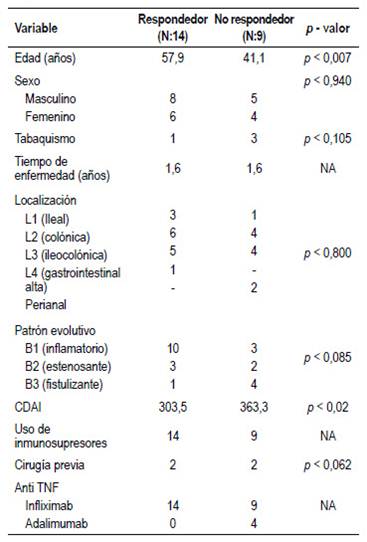
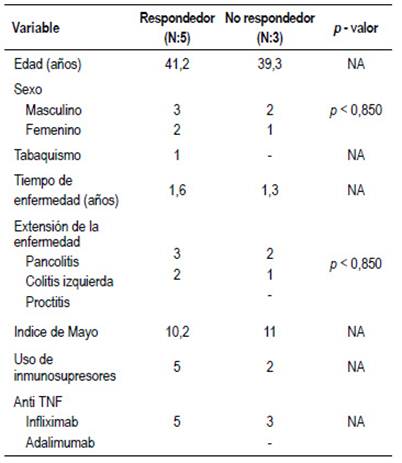
Al analizar el subgrupo de pacientes con EC, observamos que los no respondedores eran más jóvenes (promedio de edad 41 años), con mayor frecuencia de tabaquismo, patrón fistulizante y compromiso perianal. Además, habían presentado un CDAI más alto (363 vs 303). Sin embargo, las únicas variables que lograron demostrar una relación estadísticamente significativa con la pérdida de respuesta fueron una edad menor a 50 años (RR= 4,5 IC 95%, 1,2 - 17,2 p<0,007) y un CDAI mayor a 300 al momento del inicio de la terapia con infliximab (RR= 5,1 IC 95%, 1,2 - 21,9, p<0,02). (Tabla 3).
No se observaron diferencias estadísticamente significativas al comparar los pacientes respondedores y no respondedores con CU. (Tabla 4).
DISCUSIÓN
La terapia anti-TNF es efectiva en la EC y CU tanto en las fases de inducción y mantenimiento. Sin embargo, un gran porcentaje de pacientes que inicialmente respondieron al tratamiento, presentan pérdida de respuesta con reactivación clínica y/o endoscópica, siendo necesario la optimización de la terapia, uso de otra terapia o cirugía 15.
Los principales fármacos anti-TNF usados en nuestro medio para el tratamiento de la EII son infliximab y adalimumab. El primero es un anticuerpo monoclonal quimérico de origen 75% humano y 25% murino, mientras que el segundo es 100% humano. A pesar de esta diferencia y su implicancia en la producción de anticuerpos, sus tasas de efectividad inicial, pérdida de respuesta durante el mantenimiento y seguridad son muy similares 16.
En nuestro estudio se utilizó azatioprina como inmunomodulador, ya que se ha descrito en estudios previos una mayor tasa de remisión clínica, curación mucosa y menor producción de anticuerpos con esta asociación 17.
En la EC, la eficacia de infliximab fue demostrada inicialmente por Hanauer et al. en el estudio multicéntrico ACCENT-I, en el que de 573 pacientes, 58% respondió a la inducción a la segunda semana y 39% permaneció con remisión clínica en la semana 30 9.
Rutgeerts et al demostraron la eficacia de infliximab en la CU en los estudios ACT-1 y ACT-2 con 364 pacientes, logrando 38% remisión clínica y 62% curación mucosa a las 8 semanas de tratamiento 18. Posteriormente, se realizó seguimiento a 229 de estos pacientes hasta por 3 años, observando ausencia de actividad de la enfermedad en 65% de ellos con pocos efectos adversos 19.
En nuestro estudio se observó que 61% de los pacientes con EC y 62,5% con CU en tratamiento con infliximab, mantuvieron remisión de enfermedad durante 24 meses de seguimiento.
Según la evidencia actual, se estima que la pérdida de respuesta a anti-TNFs se da en aproximadamente 37% de los pacientes, con una tasa de 13 % por año de tratamiento 20. Según el estudio PROSIT realizado por Armuzzi et al. no habría diferencia en cuanto a tasas de respuesta inicial y pérdida de respuesta durante el mantenimiento con el uso de biosimilares 21.
En una revisión sistemática y meta-análisis realizada por Zhang et al. analizaron 26 estudios con 3212 pacientes con EC en terapia de mantenimiento con infliximab, durante el seguimiento de 1,1 años se observó pérdida de respuesta en 34% de los pacientes. Además identificaron como predictores de mala respuesta a la edad temprana de diagnóstico, enfermedad perianal y compromiso colónico 22.
Estas cifras son similares a nuestro estudio, en el que 39% de los pacientes presentaron pérdida de respuesta a infliximab durante nuestro seguimiento de 2 años. En el grupo de pacientes con EC, los factores asociados fueron la edad más temprana al momento del diagnóstico, tabaquismo, compromiso perianal, patrón fistulizante y CDAI al inicio del tratamiento más alto. Sin embargo, solo se observó diferencia estadísticamente significativa entre el grupo de respondedores y no respondedores con la edad más temprana (RR= 4,5 IC 95%, 1,2 - 17,2 p<0,007) y el CDAI al inicio del tratamiento (RR= 5,1 IC 95%, 1,2 - 21,9, p<0,02), probablemente por nuestro reducido número de pacientes.
En Latinoamérica son pocos los reportes de la experiencia con terapia biológica en EII. Un estudio en Chile de 16 pacientes con EC y 9 con CU, observó mejoría clínica durante la inducción en 88% y remisión endoscópica en 64% de los pacientes a los 6 meses 23. En otro hospital de Chile, Rojas et al. analizaron 15 pacientes en tratamiento con infliximab o adalimumab asociado a azatioprina, 93% respondieron a la terapia de inducción, y 73% mantuvieron la remisión endoscópica a los 6 meses. Además observaron pérdida de respuesta en 4 pacientes (26,6%). Dado la imposibilidad de medir niveles de biológicos o la presencia de anticuerpos en su país, la conducta realizada fue el cambio de terapia anti-TNF de infliximab a adalimumab sin mejoría en la respuesta 24.
En nuestra institución ocurre algo similar, no contamos con dosaje de anticuerpos o concentración sérica del fármaco para guiar el tratamiento biológico, por lo que empíricamente optimizamos la dosis de infliximab, mediante duplicación a 10 mg/kg, observando respuesta en 50% de los casos.
Idealmente, la ECCO recomienda la aplicación del algoritmo descrito anteriormente con terapia individualizada para tomar la decisión de optimizar la dosis, cambiar a un segundo anti-TNF o cambiar a un fármaco biológico con mecanismo de acción distinta 25,26, ya que existen algunos estudios que demuestran que frente a la optimización empírica presenta una tasa de respuesta similar pero con un costo 34% menor 27,28.
La optimización de dosis terapéutica del tratamiento biológico es más frecuente y precozmente requerida en la CU que en la EC 29. Esta se basa en la duplicación de dosis o acortamiento de intervalos. Según el estudio de Chaparro et al. en los pacientes que presentan pérdida de respuesta con esta estrategia se logra una respuesta clínica en aproximadamente 96% de los pacientes (56% remisión y 40% respuesta parcial) durante el seguimiento 30.
Aun no se ha logrado definir cuál de estas dos alternativas es mejor en cuanto a costo-efectividad. Katz et al. en un estudio multicéntrico con 168 pacientes, comparó la intensificación frente al acortamiento de intervalo, encontrando respuesta temprana en 77 vs 66 % y respuesta mantenida al año en 50 vs 39 % respectivamente, observando que el primer grupo es más costo-efectivo pero sin diferencia estadísticamente significativa 31.
Existe una tercera alternativa evaluada por Srinivasan et al, en un estudio de 423 pacientes con EC en terapia con infliximab, compararon el acortamiento de intervalo frente a una reinducción en pacientes con pérdida de respuesta, y obtuvieron tasas de efectividad similares en ambos grupos, pero el tratamiento fue menos costoso en los pacientes con reinducción 32.
Luego de la suspensión de un anti-TNF por intolerancia, falta de respuesta primaria o secundaria, la probabilidad de obtener respuesta clínica y/o remisión con un biológico de segunda línea es menor 33. Dos revisiones sistemáticas han evaluado la efectividad de un segundo fármaco anti-TNF en este grupo de pacientes. La primera, realizada por Da et al. estudió más de 1000 pacientes con EC y observó remisión clínica en 12-67% de los pacientes durante la fase de inducción y 29-72% durante la fase de mantenimiento 34. Posteriormente, Gisbert et al. analizaron 46 estudios en pacientes con EC y CU, obteniendo una tasa de remisión de 45% con un segundo fármaco biológico 35.
Asimismo, la efectividad específicamente de adalimumab en pacientes con pérdida de respuesta o intolerancia a infliximab fue comprobada por Panaccione et al en el estudio GAIN, que evaluó 310 pacientes con 21% de remisión luego de una dosis inicial y mantuvieron remisión 26,5% durante 96 semanas de seguimiento 36.
En nuestro estudio, en cuatro pacientes con pérdida de respuesta a infliximab que no respondieron a la duplicación de dosis, utilizamos adalimumab, obteniendo remisión clínica inicial en 75%, pero todos presentaron recidiva endoscópica a los seis meses.
La seguridad del tratamiento biológico en la EII ha sido evaluada en diversos estudios. Se estima que 13 a 69% de pacientes desarrollan efectos adversos, siendo la gran mayoría leves a moderados, mientras que menos del 4% descontinuan el fármaco por efectos adversos severos 34.
En nuestro estudio solo 1 paciente (3%) descontinuó el tratamiento por un efecto adverso severo, al presentar reacción tipo sarcoidosis pulmonar y anafilaxia. Esta complicación ocurre en aproximadamente 1 cada 2800 (0,04%) casos de pacientes con cualquier patología tratada con anti-TNFs 37. En EII se ha descrito 90 casos de reacción tipo sarcoidosis con anti-TNFs, de los cuales 16 eran tratados con infliximab 38.
En conclusión, nuestro estudio demuestra la pérdida de respuesta a la terapia de mantenimiento con infliximab en un tercio de pacientes con EII. Se requirió un aumento de la dosis para recuperar la respuesta en la mitad de estos pacientes. El cambio a adalimumab en pacientes no respondedores a la optimización terapéutica no parece ser efectivo. En países como el nuestro, sería ideal contar con las herramientas adecuadas para el correcto monitoreo terapéutico, como el dosaje de anticuerpos y concentración del fármaco.