INTRODUCCIÓN
El daño hepático inducido por fármacos (DILI) es la injuria causada a este órgano por la exposición de la persona a una droga, suplemento dietético o preparación herbolaria. El espectro de la enfermedad es variable y su presentación clínica es inespecífica pudiendo simular a casi todos los tipos de enfermedades hepáticas agudas y crónicas 1. Uno de los medicamentos que induce a toxicidad hepática es la terbinafina, derivado de alilamina sintética, utilizada en la terapia de la onicomicosis y que entró en la práctica clínica desde el año 1986. La incidencia de hepatotoxicidad por esta droga es poco frecuente y se calcula en 0,5-3 casos/ cien mil exposiciones 2.
Por otro lado, el 5 de marzo de 2020 se confirmó el primer caso importado de enfermedad por coronavirus 19 (COVID-19) en el Perú. Siete y medio meses después, el 20 de octubre de 2020, el Ministerio de Salud reportaba que desde el inicio de la pandemia se habían confirmado la ocurrencia en el país de 874 118 casos de coronavirus, así como de 33 875 defunciones por esta enfermedad. Además, se ha demostrado a nivel mundial que la infección por el coronavirus-2 del síndrome respiratorio agudo grave (SARS-CoV-2), puede producir disfunción hepática entre el 14,8 al 53% de los casos sintomáticos 3.
En este reporte presentamos el primer caso en nuestro país de un paciente que es afectado por una injuria hepática inducida por terbinafina, al cual se le asocia posteriormente una infección por SARS-CoV-2 en el contexto de una pandemia.
CASO CLÍNICO
Paciente varón de 40 años, natural y procedente de Lima, sin antecedentes de importancia, acude a consulta ambulatoria en el servicio de gastroenterología de la Clínica Delgado de Lima con un cuadro clínico iniciado 10 días antes, el 23 de junio del 2020, y que se manifiesta con naúseas, coluria e ictericia. Además, el paciente refiere haberse medicado con terbinafina, para el tratamiento de una onicomicosis, a la dosis de 250 mg diarios por 35 días consecutivos hasta el día de la consulta.
Los exámenes de laboratorio realizados ese mismo día 23 de junio, revelaron cifras anormales de: aspartato aminotransferasa (AST) 173 U/L, alanina aminotransferasa (ALT) 381 U/L, bilirrubina total 10 mg/dl, bilirrubina directa 9,1 mg/dl, fosfatasa alcalina (FA) 315 U/L, gammaglutamiltransferasa (GGTP) 212 U/l e Índice internacional normalizado de tiempo de protrombina (INR) cercano a 1. Se realizaron, además, exámenes serológicos para descartar hepatitis viral A, B, C y E que fueron negativos; marcadores de autoinmunidad como anticuerpo antinucleares (ANA) negativo; anticuerpo antimúsculo liso (ASMA) negativo; anticuerpo antimitocondriales (AMA) negativo; anticuerpo anti liver kidney microsome (LKM-1) negativo; anticuerpo anticitoplasma de neutrófilos con patrón perinuclear (pANCA) negativo; e, Inmunoglobulina (Ig) M: 1,8 g/L , Inmunoglobulina G: 11,8 g/L, Inmunoglobulina A: 0,6 g/L, todas en parámetros normales. La ecografía abdominal demostró ligera hepatomegalia e hiperecogenicidad periportal y la colangioresonancia magnética fue informada como normal.
En el siguiente control ambulatorio efectuado el 30 de junio, día 17 desde el inicio clínico, y con el diagnóstico presuntivo de “injuria hepática inducida por terbinafina”, se efectuaron nuevas pruebas de laboratorio con los siguientes resultados: las transaminasas descendieron casi en un 25%, la FA descendió discretamente, mientras que las bilirrubinas aumentaron asociándose a un prurito intenso, por lo que se indicó antihistamínicos y colestiramina, en el cuarto control ambulatorio la GGTP normalizó y por persistencia de prurito se asoció ácido ursodeoxicólico a dosis de 750 mg al día.
En el sexto control ambulatorio efectuado el 25 de agosto, día 73 desde el inicio clínico, las bilirrubinas totales alcanzaron la cifra de 27,9 mg/dl y el INR se prolongó a 1,35 por lo que se decidió realizar una biopsia hepática por guía ecográfica requiriendo para este procedimiento la hospitalización. Es así que como parte del protocolo de la Institución y hospitalización por la actual pandemia, se solicitaron pruebas para COVID-19 que dieron como resultado: Anticuerpos Ig G positivo y anticuerpos Ig M negativo seguido por una prueba molecular que resultó positiva; sin embargo, el paciente no presentaba ninguna sintomatología asociada a infección por SARS-CoV-2. La radiografía de tórax tenía características normales y los marcadores inflamatorios eran negativos. Ese mismo día se realizó la biopsia hepática, y al día siguiente se procedió al alta hospitalaria para que continúe con sus controles en forma ambulatoria.
Los hallazgos histológicos en la biopsia hepática se muestran en las Figuras 1 a 6.
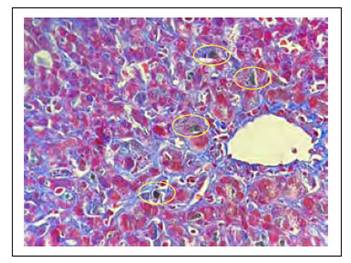
Figura 1 Con la tricrómica de Masson se evidencia colágeno joven, es decir que la tonalidad azul clásica del colágeno que se observa en la vena es más intensa que en las áreas sinusoidales, lo cual corrobora el hallazgo de necrosis en zona acinar 3. Resalta los tapones de bilis en los canalículos (circulo amarillo).
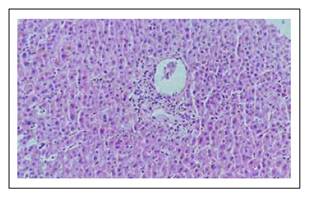
Figura 2 Los espacios porta mostraron leve infiltrado inflamatorio mixto a linfocitos, polimorfonucleares, que no rebasan la placa limitante. Uno de los 14 espacios porta de la biopsia muestra infiltrado inflamatorio mixto, leve, que no rebasa la placa limitante, en el acino se observan linfocitos y polinucleares. Se observa además linfocitos agrediendo el endotelio de la vénula de la microvasculatura portal.
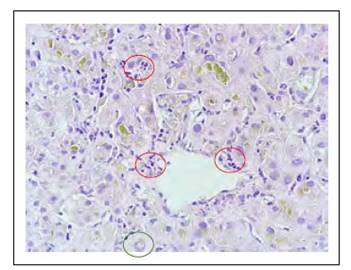
Figura 3 Necrosis focal en zona 3 (círculo rojo), algunos hepatocitos muestran núcleo glucogenado (círculo verde).
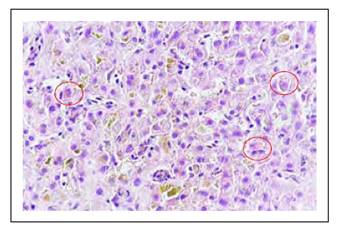
Figura 4 Colestasis intracanalicular e intracitoplasmática a predominio de la zona acinar 3. Ocasionales cuerpos apoptóticos (círculo rojo).
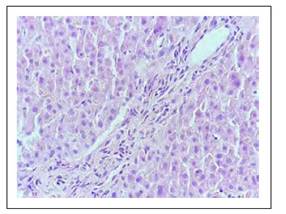
Figura 5 Espacio porta mediano, sin conducto biliar principal, hallazgo presente en más del 50% de los porta, es decir hay ductopenia.
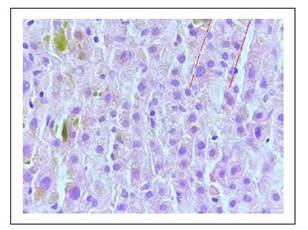
Figura 6 Hepatocitos dispuestos en cordones regulares, mostrando regeneración, trabéculas de hasta 3 hileras (líneas rojas).
El día 31 de agosto, día 79 desde el inicio clínico, las bilirrubinas totales alcanzaron un pico máximo de 37,9 mg/dl, pero con disminución de los niveles de FA, GGTP y transaminasas.
Desde el 14 de septiembre, día 93 de inicio clínico de la enfermedad, las bilirrubinas totales comenzaron a descender progresivamente hasta el día de su último control del 09 de octubre, día 118 de la enfermedad clínica. El prurito casi desapareció por lo que se suspendió la colestiramina y el ácido ursodeoxicolico. Los controles ambulatorios continúan.
DISCUSIÓN
La injuria hepática inducida por drogas es un diagnóstico de exclusión, por lo que se requiere realizar una detallada historia de los síntomas, tiempo entre el inicio del fármaco y la ictericia, uso de otras drogas hepatotóxicas, así como exámenes de laboratorio que descarten otras causas de enfermedad hepática aguda. DILI se puede clasificar de acuerdo al patrón de elevación de enzimas hepáticas en hepatocelular, colestásico y mixto. Para determinar el patrón de injuria se determina el valor R (R = ALT de paciente / ALT ULN (valor superior normal) ÷ FA de paciente/ FA ULN). Si el valor de R es >5 la injuria es hepatocelular, si es R es <2 la injuria es de patrón colestásico y si 2 <R< 5 la injuria es de patrón mixto 4. Además se puede utilizar algunas métodos para definir en forma objetiva la probabilidad de DILI como la escala de causalidad: Council of International Organization of Medical Sciences/Roussel Uclaf Causality Assessment Method (CIOMN/RUCAM) que relaciona tiempo entre exposición a la droga e injuria hepática, exclusión de otras etiologías alternativas, exposición a otras medicinas que podrían explicar DILI, factores de riesgo para reacción adversa hepática, evidencia en la literatura de DILI debido al fármaco sospechado y respuesta a re-exposición a la medicación 5.
La terbinafina interfiere con la biosíntesis del ergosterol de la membrana celular fungal por inhibición selectiva de la enzima escualeno 2-3 epoxidasa. La terbinafina oral es usada en la terapia de onicomicosis, típicamente en dosis de 250 mg una vez al día por 6 a 12 semanas 6. Puede causar injuria hepática, aunque con una incidencia baja, calculada entre 0,5 y 3 casos / cien mil exposiciones 2. Los mecanismos exactos por los que la terbinafina puede inducir daño hepático no han sido bien identificados. Se ha descrito la asociación entre el HLA-A*33:01 y la susceptibilidad para desarrollar hepatotoxicidad colestásica por terbinafina. Este fármaco experimenta una compleja biotransformación hepática y alguno de los metabolitos resultantes presenta capacidad de unirse a proteínas hepatobiliares y de promover una reacción inmunologica; en otras ocasiones, la toxicidad hepática es idiosincrásica. Los patrones de toxicidad incluyen el colestásico, hepatocelular y mixto pudiendo evolucionar a insuficiencia hepática aguda y síndrome del conducto biliar evanescente. Con relación a la injuria hepática que puede provocar, el periodo de tiempo entre la exposición a la droga y el inicio de la ictericia es usualmente entre 2 a 6 semanas, teniendo un pico máximo de bilirrubinas a las 3 a 5 semanas de la suspensión de la droga, con completa normalización de la función hepática entre las 2 y 12 meses 7,8.
La información clínica, de laboratorio (Tabla 1) sobre la evolución del caso que comentamos, corresponde claramente a la de un paciente afectado por una hepatotoxicidad inducida por terbinafina, con un patrón mixto tipo 2<R<5. Se utilizó la Escala CIOMS/ RUCAM para definir la causalidad de la injuria hepática, considerándola probable (8 puntos): comienzo de los síntomas entre 5 y 90 días tras el inicio del tratamiento (+2); evolución analítica favorable, con descenso de la fosfatasa alcalina y bilirrubinas >50% en los 180 días posteriores tras la retirada del fármaco (+2); exclusión de otras causas (+2) y hepatotoxicidad por terbinafina, descrita en el etiquetado (+2).
Tabla 1 Evolución de los exámenes de laboratorio.
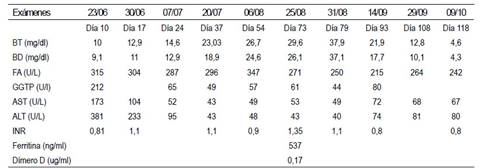
ALT: Alanino aminotransferasa; AST: Aspartato aminotransferasa; BT: Bilirrubina total; ; BD: Bilirrubina directa; FA: Fostatasa alcalina; GGTP: gammaglutamiltranspeptidasa; INR: Índice internacional normalizado de tiempo de protrombina
Debiendo destacar, sin embargo, que en este caso específico el pico máximo de las cifras de bilirrubinas se alcanzó recién en la décima primera semana de evolución del cuadro clínico, siendo este tiempo el más extenso que se haya reportado, hasta el momento en la bibliografía especializada, para este tipo de patología 9. Hecho singular, que podría interpretarse como resultado de los efectos sumatorios de la infección por COVID-19, asociada en este caso, en la historia natural de la hepatotoxicidad por terbinafina, no obstante la ausencia de algún síntoma, compromiso respiratorio o de signos de inflamación sistémica atribuibles a dicha infección.
Al respecto de esa posible sumatoria de efectos, se ha informado que la infección por SARS-CoV-2 puede producir, eventualmente, una significativa injuria hepática a través de varios mecanismos considerados válidos. Entre ellos: el efecto directo del virus en el hepatocito o epitelio biliar, la injuria relacionada con la respuesta inmune, la toxicidad de drogas usadas para su tratamiento, la hepatitis isquémica en pacientes con inestabilidad hemodinámica, y la falla multiorgánica 10,11.
Además en varios estudios se ha observado que la infección por SARS-CoV-2 puede producir una disfunción hepática importante en pacientes con enfermedad hepática crónica previa, llevando a descompensación y empeoramiento del estadio clínico de los pacientes con cirrosis hepática 12. Sin embargo no hay estudios que informen sobre pacientes con enfermedades hepáticas agudas, como la injuria hepática inducida por drogas, que tengan una evolución más grave de su enfermedad o una mayor susceptibilidad al SARS-COV 2.
En relación al resultado de la biopsia hepática esta evidenció un patrón histológico mixto de hepatitis aguda en resolución, además de ductopenia y colestasis, sin un componente inflamatorio significativo en los portas. Estos hallazgos histológicos, no son específicos de ninguna etiología, y sin el antecedente de hepatitis viral o en ausencia de criterios clínicos de hepatitis autoinmune y correlacionándolo con la temporalidad del consumo de terbinafina se concluye como posibilidad etiológica a la toxicidad por fármaco, debiendo correlacionarse con la clínica 13.
La injuria hepática inducida por drogas en la biopsia pueden producir cualquier patrón morfológico y el diagnóstico diferencial es amplio por lo que la comunicación y correlación clínica-anátomo patológica es sumamente importante.
Este es el primer reporte de un paciente que padece de una injuria hepática inducida por terbinafina, documentada con biopsia hepática, a la que se le asoció una infección por SARS-CoV-2, confirmada por prueba serológica y molecular, la cual podría haber prolongado el tiempo de colestasis sin, al parecer, alterar el pronóstico y la recuperación del paciente.















