INTRODUCCIÓN
La neoplasia quística mucinosa (NQM) primaria de hígado es una neoplasia poco usual de tipo epitelial que se caracteriza por la formación de quistes y que típicamente no tienen comunicación con los ductos biliares 1. Antes de la clasificación dada por la Organización Mundial de la Salud (OMS) en el 2010, estas lesiones eran denominadas como cistoadenomas hepatobiliares con estroma mesenquimal y fue descrita por primera vez por Wheeler and Edmondson in 1985 2. La NQM se encuentra dentro del grupo de las lesiones quísticas hepáticas, que afectan entre el 3 al 20% de la población y cuya incidencia aumenta con la edad. No obstante, la NQM representa menos del 5% de todas las lesiones quísticas del hígado y afectan casi exclusivamente a mujeres entre la cuarta y quinta década de la vida 2-5.
En la literatura mundial existen solo 250 casos descrito de estas lesiones 5,6, por lo que la presente publicación aporta un caso de Neoplasia quística mucinosa hepática, y hace una revisión de la literatura a fin de caracterizarla y distinguirla de otras lesiones quísticas originadas en el hígado.
CASO CLÍNICO
Mujer de 23 años refiere un tiempo de enfermedad de 10 meses caracterizado por hiporexia, náuseas, vómitos intermitentes, baja ponderal de aproximadamente 10 kg y hace un mes presenta ictericia en escleras y dolor abdominal en cuadrante superior derecho. Los estudios de imágenes, TEM abdomino-pélvica y colangioresonancia, revelaron, a nivel de los segmentos hepáticos 8, 7, 4 y 1, una lesión de 13,5 x 10,2 cm, hipodensa, lobulada, con múltiples tabiques de hasta 2,5 mm de espesor y pequeñas imágenes quísticas en su interior, que condiciona dilatación de la vía biliar intrahepática a predominio izquierdo y del colédoco (Figura 1). Los exámenes de laboratorio mostraron niveles de AFP en 1,66 U/Ml, CA 19-9 en 79,94 U/ Ml, CEA de <0,50 ng/mL, bilirrubina total en 285,8 umm/L, bilirrubina directa en 241,4 umm/L y bilirrubina indirecta en 44,4 umm/L.
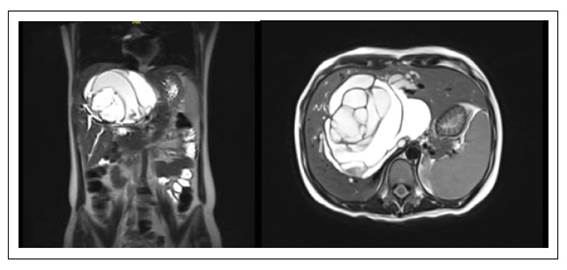
Figura 1 TEM abdomino-pélvica revela la presencia de una lesión de 13,5 x 10,2 cm en los segmentos hepáticos 8, 7, 4 y 1, con múltiples septos finos e imágenes quísticas en su interior.
Con estos estudios es programada a laparotomía exploradora, hallándose en el acto quirúrgico una tumoración a nivel de segmentos hepáticos 1, 4a, 4b, 5 y 8 de 15,0 x 15,0 cm, multilobulada, quística, que compromete la cápsula de Glisson hacia la cara posterior de la superficie hepática, impresionando depender del conducto colédoco proximal y extenderse hacia la vía biliar intrahepática derecha, por lo cual se le realizó trisegmentectomía hepática derecha más resección radical de vía biliar y reconstrucción de vía biliar con colédoco-yeyuno anastomosis término lateral y plastia de colédoco.
Macroscópicamente, se corroboró la presencia de una tumoración de aspecto quístico de 13,0 x 12,0 x 11,0 cm de superficie externa lisa color blanquecina, que, a los cortes seriados, produce la salida de un contenido líquido pardo oscuro e internamente la lesión tiene aspecto multiloculado de superficie lisa y con tabiques de hasta 0,5 cm de espesor. Además, parte de ella se proyecta hacia la vía biliar principal, generando gran dilatación de esta (Figura 2).
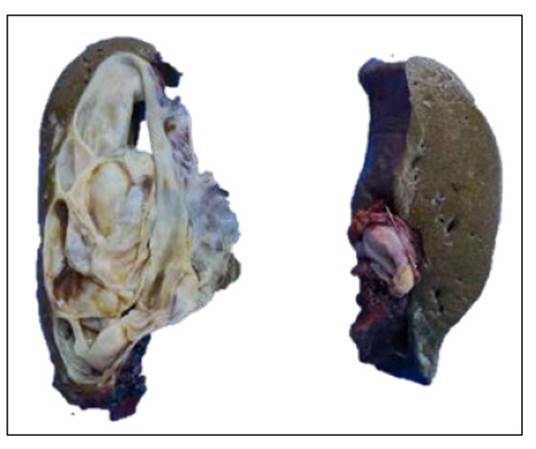
Figura 2 Se recibe producto de trisegmentectomía hepática derecha más resección radical de vía biliar. A los cortes seriados, el parénquima hepático es reemplazado por una lesión multiquística de tabiques finos y que, además, se proyecta intraluminalmente hacia la vía biliar principal, generando dilatación de ella.
A la microscopía, el parénquima hepático se encontraba reemplazado por una lesión quística conformada por tres capas: una interna de tipo epitelio de revestimiento mucinoso; debajo de ella se encuentra la capa estromal, que se caracteriza por ser hipercelular y de tipo ovárico; y por último la capa más externa es de tipo fibroso colagenizado, la cual además permite delimitarla del parénquima adyacente (Figura 3).
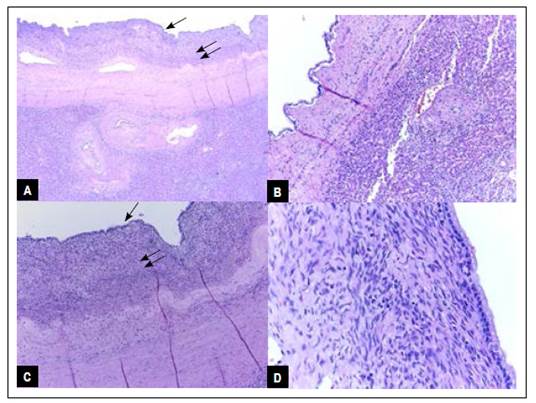
Figura 3 (A) El parénquima hepático, aún preservado en la parte inferior de la imagen, se encuentra en gran extensión reemplazado por una lesión quística caracterizada por estar formada por 3 capas; una interna epitelial (flecha), capa media estromal (doble flecha) y capa externa fibrosa (asteriscos). HE 50X. (B) A mayor aumento podemos nuevamente ver remanente de tejido hepático (***) y adyacente a él la lesión quística. HE 100X. (C) La capa interna (flecha) corresponde a un epitelio de revestimiento de tipo cuboidal con citoplasma mucinoso; debajo de ella, se observa la capa estromal (doble flecha) caracterizada por un estroma hipercelular denso tipo ovárico; finalmente la capa más externa (asteriscos) es una cápsula fibrosa que suele delimitarla y estar compuesta por tejido fibroso colagenizado. HE 200X. (D) El epitelio mucinoso y el estroma tipo ovárico son hallazgos histopatológicos fundamentales para el diagnóstico de NQM. HE 400X.
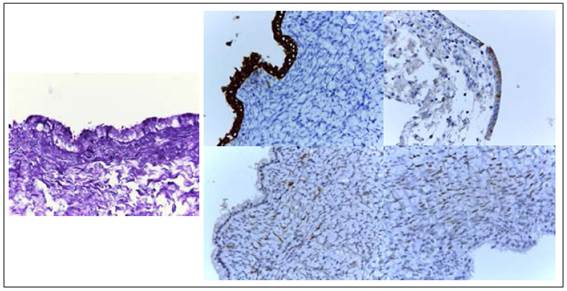
Para caracterizar el componente mucinoso de la capa epitelial de revestimiento, se realizó la coloración de PAS. Por otro lado, las pruebas especiales de inmunohistoquímica revelaron la expresión para CK7 y MUC5AC a nivel de las epiteliales; mientras, que las células estromales al ser de tipo ovárico fueron inmunoreactivas para receptor de estrógeno, receptor de progesterona e inhibina (Figura 4).
DISCUSIÓN
Las neoplasias mucinosas quísticas del hígado, son lesiones epiteliales formadoras de quistes que típicamente no muestran comunicación con el ducto biliar, compuestas de epitelio cuboidal a cilíndrico productor de mucina, asociado a un estroma subepitelial de tipo ovárico 1. Antes de la clasificación vigente dada por la Organización Mundial de la Salud (OMS), las lesiones quísticas hepáticas se subdividían en cistoadenoma o cistoadenocarcinoma 7,8. Posteriormente, en el 2010 la OMS, reclasificó a estas lesiones en neoplasia quística mucinosa (NQM) y neoplasia papilar intraductal de ductos biliares (NPI-B). A su vez se subclasificó a las NQM en neoplasia quística mucinosa con displasia de bajo grado/grado intermedio y en NQM con displasia de alto grado. Si bien la mayoría de serie de casos reportan que las NQM conllevan un riesgo extremadamente bajo de morbimortalidad tras una resección quirúrgica completa; existe un 20 a 30% de casos que pueden progresar a carcinoma si no son tratadas oportuna y adecuadamente 1,2,7,8. Las formas invasivas o de carcinoma asociado a NQM, constituyen el 0,41% de los tumores epiteliales hepáticos malignos 7.
En cuanto a su incidencia, son raros, representan menos del 5% de todos las lesiones quísticas del hígado, con aproximadamente 1 caso cada 20 000 a 100 000 personas por año 2-5. Afecta casi exclusivamente a mujeres con una edad media de 45 años 1,8,9 y cuando existen casos asociados a carcinoma invasivo suele presentar en pacientes mayores, a una edad media de 59 años 1,4,5. Los síntomas más típicos que aquejan a los pacientes son el dolor abdominal y la presencia de masa palpable en un 55 a 90% de casos 5,8. Las alteraciones laboratoriales suelen manifestarse por niveles elevados de CA 19-9 tanto sérico como del fluido del quiste, particularmente si está asociado a carcinoma invasivo 1,7,8.
Suelen ser lesiones solitarias y localizarse principalmente a nivel del lóbulo hepático izquierdo y ocasionalmente pueden originarse en el sistema biliar extrahepático 1.
La etiología de la NQM aún no se conoce con claridad, pero se propone dos principales teorías. Una postula la presencia de tejido ovario ectópico intrahepático, producto del depósito de células gonadales en el lado dorsolateral hepático durante la embriogénesis. Otra teoría propone que estas lesiones se generan por la presencia de restos embrionarios de vesícula biliar ectópicos intrahepático 7,8.
Macroscópicamente, son neoplasia bien delimitadas, multiloculares con un tamaño medio de 11 cm y la mayoría separadas del árbol biliar; sin embargo, una extensión intraluminal polipoide dentro del ducto biliar puede ocurrir en ocasionales casos 1,10.
El contenido suele ser un fluido mucinoso, de color claro o hemorrágico; más aún, en los casos asociados a carcinoma se reconocen áreas sólidas blanco grisáceas 1.
El estudio histopatológico de estas lesiones es característico, puesto la pared quística suele estar conformada por 3 capas, la más interna formada por un epitelio de revestimiento tipo cuboidal, cilíndrico o plano con citoplasma mucinoso a eosinofílico claro con núcleos orientados basalmente; una capa intermedia de tipo estromal caracterizada por un estroma hipercelular denso tipo ovárico, el cual es el hallazgo fundamental para el diagnóstico de estas lesiones y que, además pueden sufrir cambios tipo hialinización o luteinización focal en lesiones de gran tamaño u ocurridas en pacientes mayores; y la tercera capa corresponde a una cápsula fibrosa de tejido colagenizado que suele delimitar la lesión del parénquima hepático adyacente 1,5,7,8,11.
La vasta mayoría de las NQM hepáticas tienen displasia baja o de grado intermedio; y solo aislados casos muestran displasia de alto grado, que es caracterizado por atipia arquitectural substancial, así como pleomorfismo nuclear y numerosas figuras mitóticas. Raramente, pueden tener un componente de carcinoma invasivo asociado, que es más susceptible de ocurrir en tumores grandes y que presentan proyecciones papilares macroscópicas, este componente invasor es de tipo adenocarcinoma con patrón de crecimiento tubular o tubulopapilar y gran reacción desmoplásica 1,2,11.
La mucina del epitelio de revestimiento de estas lesiones quísticas puede ser resaltada con coloraciones histoquímicas especiales como la coloración PAS, en algunas regiones; no obstante, en el 50% de los casos, la mayor parte del epitelio que reviste la NQM es de tipo biliar no mucinoso, similar al epitelio de los ductos biliares no neoplásicos 1.
Los estudios de inmunohistoquímica revelan expresión positiva para CK7, CK8, CK18, CK19, EMA, CEA y MUC5AC a nivel de las células epiteliales de revestimiento. Mientras que las células estromales son inmunoreactivas para receptor de estrógeno, receptor de progesterona y α-inhibina 1,2,10.
A nivel molecular, la mutación del Kras se ha identificado en un 20% de casos, principalmente en aquellos que presentan displasia de alto grado 2.
El tratamiento de elección es la escisión completa de la lesión con márgenes negativos, lo cual asegura un pronóstico excelente; por el contrario, las recidivas son comunes después de una resección parcial 5,7,8. Por otro lado, si bien estas lesiones aumentan el riesgo de transformación maligna, los casos de adenocarcinomas invasivos originados en asociación con una NQM suelen tener mejor pronóstico que los colangiocarcinoma intrahepáticos convencionales 1,2,12.
En conclusión, las neoplasias quísticas mucinosas deben ser consideradas en el diagnóstico diferencial de los tumores quísticos hepáticos; puesto que al mal-diagnosticarlos como quiste simples o quistes hidatídicos, lesiones quísticas más prevalentes en hígado, conllevan a un tratamiento inadecuado y por ende al riesgo de recurrencia y transformación maligna.