INTRODUCCIÓN
El cáncer de colon y recto (CCR) es el tercer cáncer más frecuente y la cuarta causa de muerte por cáncer en el mundo 1. En Colombia, es la tercera causa de muerte por cáncer en ambos géneros 2. A nivel mundial, en 2018, hubo 1,8 millones de casos nuevos y más de 850 000 muertes por este tumor 1. Los programas de tamización (“screening”), han disminuido la incidencia, mortalidad y cirugías para esta neoplasia. Además, la colonoscopia es el examen “estándar de oro” para detectar y prevenir el CCR 3, ya que permite identificar y resecar los pólipos adenomatosos y serrados, que son los precursores de CCR 4. Sin embargo, un tercio de la población elegible, no acuden a la tamización 5) y en Estados Unidos (USA) 46-63% de las muertes por CCR, son atribuibles a la falta de tamización (6). Las sociedades científicas internacionales recomiendan que, la tamización se ofrezca a personas de ambos géneros a partir de los 50 años, ésta es la edad promedio para el riesgo del CCR 3,7-10. En nuestro país, esta recomendación ha sido respaldada por la Asociación Colombiana de Gastroenterología 2. Sin embargo, recientemente, se ha encontrado que la incidencia de CCR en el grupo de 40-49 años, ha aumentado 1,3% por año versus 0,5% en el grupo de 50 y 54 años 11. Así mismo, se ha encontrado que la mortalidad por CCR ha tenido una disminución constante en las personas mayores de 50 años, en contraste con las personas menores de 50 años en quienes se ha aumentado 12. Adicionalmente, en este grupo etario el CCR es el tumor más frecuentemente diagnosticado y también la causa más frecuente de muerte por cáncer 10. La declinación de la mortalidad en los mayores de 50 años se atribuye a la extensión de los programas de tamización 13. Recientemente la Asociación Americana de Cáncer (ACS), ha recomendado que la tamización para CCR se inicie a partir de los 45 años 10. Sin embargo, la mayoría de las asociaciones científicas no comparten esta recomendación y se ha planteado un gran debate al respecto 14. Teniendo en cuenta la controversia existente sobre la edad de tamización, decidimos realizar el presente trabajo prospectivo, en una población colombiana y para los propósitos de esta investigación, se implementó un programa específico de tamización en menores de 50 años, complementario a nuestro programa de tamización, que se inicia a partir de los 50 años. El objetivo de esta investigación es comparar la prevalencia de pólipos adenomatosos durante colonoscopia de tamización en personas de 45-49 años y compararla con la de personas de 50 a 75 años.
MATERIALES Y MÉTODOS
El presente es un estudio de casos y controles, realizado en el Centro de Gastroenterología y Endoscopia Digestiva de Bogotá, adscrito al programa de posgrado de la Universidad Nacional de Colombia, durante el período comprendido entre enero de 2018 y noviembre de 2019. Los datos fueron recolectados prospectivamente. El objetivo fue determinar la presencia de pólipos adenomatosos en personas sometidas a colonoscopia de tamización.
Pacientes
Se incluyeron personas consecutivas a quienes se les realizó colonoscopia de tamización. Los casos son las personas de 45-49 años y los controles las personas entre 50-75 años, a quienes se les realizó colonoscopia de tamización. Para la realización del presente estudio, durante el período de la investigación, se inició un programa específico de tamización en menores de 50 años, complementario a nuestro programa de tamización en individuos de 50-75 años y el cual implementamos desde hace 8 años. El protocolo y consentimiento informado fue aprobado, por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia. Todas las personas que aceptaron participar en el estudio firmaron el consentimiento informado.
Criterios de inclusión: 1. Se incluyeron las personas con colonoscopia completa hasta el ciego (identificación del orificio apendicular, válvula ileocecal y la convergencia de las tenías) 15. 2. Personas que tuvieran una calidad de la preparación del colon calificada por la escala de Boston de 6 o más, con dos puntos o más en cada segmento 16. 3. Las personas cuyos informes histológicos de todos los pólipos estuvieran disponibles.
Criterios de exclusión: 1. Colonoscopias indicadas por vigilancia, por tener cualquier factor de alto riesgo tales como: CCR en familiares de primer grado, antecedente de pólipos adenomatosos en familiares de primer grado, enfermedad inflamatoria intestinal y resección de pólipos colónicos previos.
Colonoscopias
Las colonoscopias fueron realizadas en decúbito supino previa preparación con polietilenglicol disuelto en 4L y en dosis divididas ("split-dose") 17. Se utilizaron colonoscópios marca Olympus 160 y 180. Todas las colonoscopias fueron realizadas, por colonoscopistas expertos con más de 10 000 procedimientos realizados. El tiempo de retirada de la colonoscopia debía ser mínimo 9 minutos 18 de la siguiente manera: tres minutos del ciego al ángulo hepático, tres minutos del hepático al esplénico, y tres minutos del esplénico al ano, sin contar el tiempo consumido para tomar biopsias por cualquier razón. Los procedimientos fueron realizados bajo sedación administrada por un anestesiólogo experto en sedación de procedimientos endoscópicos, utilizando remifentanilo y propofol basado en las recomendaciones publicadas 19. La calidad de la preparación fue informada con base en la escala de Boston 16.
Recolección de los datos
En un instrumento específico para este estudio, se recolectaron los siguientes datos: Edad, género, comorbilidades coexistentes, índice de masa corporal (IMC). Con base en el IMC los pacientes se clasificaron de la siguiente manera: normal (IMC 18,424,9 Kg/m2), sobrepeso (IMC 25-29,9 Kg/m2), obesidad (≥30 Kg/m2) 20. También se ingresaron otros hallazgos detectados durante la colonoscopia (hemorroides, divertículos, colitis segmentaria, ulcerativa, cánceres, etc.). La calidad de la preparación se expresó de acuerdo con la escala de Boston. Tiempo de retirada (siempre debió ser de 9 minutos o más), número, localización y tamaño de los pólipos, medidos con la pinza abierta (diámetro 6 mm).
Polipectomías
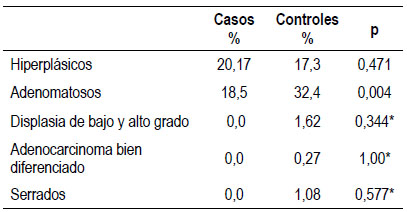
El método de resección de los pólipos dependía del tamaño. Los menores a 10, se resecaron con asafría 21,22) y los mayores a 10 mm, no pediculados y pediculados, de acuerdo con las técnicas descritas 23-25. Los pólipos mayores de 10 mm, se consideraron neoplasias avanzadas. Los pólipos menores de 10 mm se resecaron durante la colonoscopia y los mayores de 10 mm, fueron programados en otra sesión para polipectomía, de manera ambulatoria, siguiendo el proceso administrativo de nuestra institución, que incluye solicitar hemograma y pruebas de coagulación. Histológicamente los pólipos fueron clasificados como: hiperplásicos, adenomatosos y serrados 26. Así mismo, se consignó el porcentaje de pólipos en cada grupo y el porcentaje de pólipos adenomatosos (ADR: adenoma, detection, rate).
Análisis estadístico
El tamaño de la muestra se calculó teniendo en cuenta la presencia de pólipos de la población occidental, que en general la prevalencia está entre 20% a 60% y del 25% en personas de 50 años 27. Se consideró un nivel alfa de 0,05 y un poder de 80%. Con una prevalencia esperada de pólipos adenomatosos de 40% en los pacientes mayores 50 años y 20% en los menores de 50 años, en total se necesitan 164 participantes (82 en cada grupo).
Las variables y datos de cada paciente fueron consignados en el instrumento de recolección de datos y posteriormente analizados con los programas estadísticos, EPIDAT 4.1 y STATA versión Nº 13. Del total de pacientes llevados a colonoscopia de tamización y posterior comparación por subgrupos, con unos intervalos de confianza del 95%, se tendrá en cuenta un valor de p menor a 0,05 como estadísticamente significativo. Para las variables cualitativas y cuantitativas se realizó un análisis univariado reportando frecuencias absolutas y relativas, además de medidas de tendencia central y dispersión, respectivamente. Para determinar si existían diferencias estadísticamente significativas, se emplearon las pruebas Chi2 y la prueba exacta de Fischer en el caso de que los valores esperados fueran menor de 5. Se realizaron modelos de regresión logística por grupos etarios, para evaluar los factores de riesgo relacionados con el desenlace.
RESULTADOS
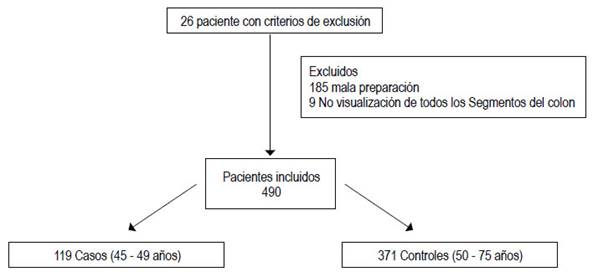
En el presente estudio se encontraron 684 pacientes elegibles y finalmente ingresaron 490 pacientes. Los 185 pacientes excluidos se debieron a diferentes motivos, Figura 1. De los pacientes incluidos, hubo 119 casos y 371 controles, con una relación de 1:3. La edad promedio de los casos fue 48 años (DE 1,8 años) y de los controles 62 años (DE 6,7 años). En ambos grupos fue más frecuente el género femenino con 75,6 y 73,3% respectivamente. Las comorbilidades de cada grupo fueron similares y se muestran en la Tabla 1.
Tabla 1 Características generales de los pacientes.
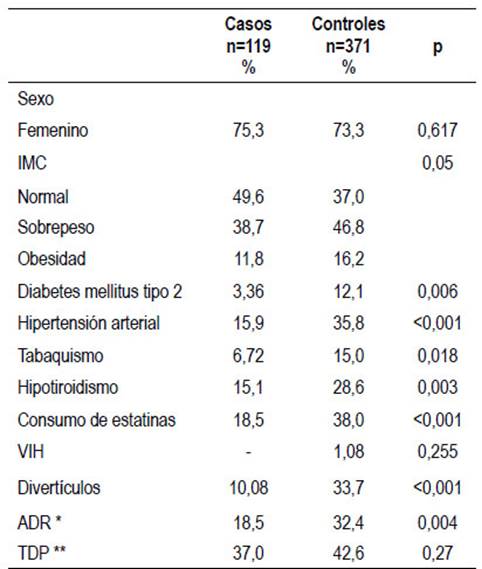
*ADR: tasa de detección de adenomas; ** TDP: tasa de detección de pólipos
Pólipos encontrados
Se encontraron pólipos en el 36,7% (IC 95% 28,646,1) de los casos y en el 42,5% (IC 95% 37,6-47,7) de los controles (p=0,279). Los pólipos adenomatosos se detectaron en 18,5% (IC 95% 12,4-26,6) de los casos y 32,4% (IC 95% 27,7-37,2) de los controles (p=0,004), Figura 2. Al diferenciar por sexo, en los casos, en las mujeres los pólipos adenomatosos se encontraron en 17,8% (IC 95% 11,1-27,2) y en los hombres en 20,7% (IC 95% 9,3-39,6) (p=0,725), y en los controles en las mujeres los pólipos adenomatosos se encontraron en 30,5% (IC 95% 25,3-36,2) y en los hombres en 37,7% (IC 95% 28,3-47,3) (p=0,212). Tabla 2.
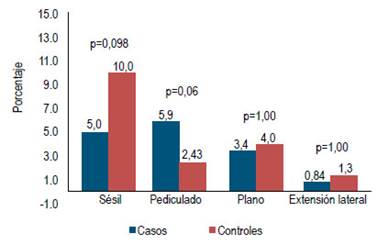
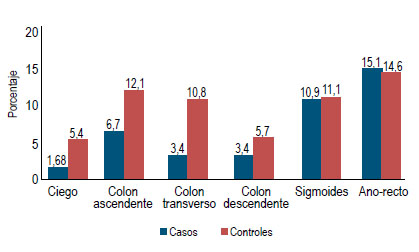
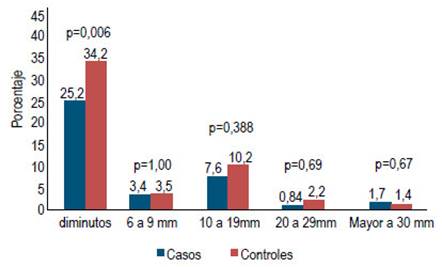
El tamaño y localización de los pólipos de ambos grupos se muestran en las Figuras 3 y 4. Hubo un caso de adenocarcinoma en los controles.
Otros hallazgos colonoscópicos
Divertículos: en los casos y controles se encontraron divertículos en 10,0% y 34% respectivamente (p<0,001). Hubo hemorroides grado I, II, y III en el 84,0% y no se documentó hemorroides en el 15,9%. Se encontró colitis segmentaria en 0,6% de los controles y ninguna en los casos. Por otra parte, la tasa de intubación cecal fue del 98,6%.
DISCUSIÓN
En el presente estudio de casos y controles, se encontraron pólipos en 37,0 y 42,6% respectivamente, sin diferencias estadísticamente significativas (p<0,27) y pólipos adenomatosos en 18,5% y 32,4% respectivamente (p<0,004). Internacionalmente, un indicador de calidad de las colonoscopias de tamización en individuos de 50 años o más es detectar pólipos adenomatosos en por lo menos el 25% de los pacientes 28. En nuestro estudio la ADR global fue de 32%, en personas mayores de 50 años, es superior al 25% exigido internacionalmente. Desconocemos si esto se podría deber a una mayor prevalencia de pólipos adenomatosos en nuestra población, o a dos factores rutinarios durante la ejecución de la colonoscopia como son: la participación activa de nuestras enfermeras, que están entrenadas en la detección de estas lesiones, una estrategia que ha demostrado que aumenta la tasa de detección de pólipos en más del 25% 29. El otro factor es que, el tiempo de retirada en nuestro estudio fue mínimo de 9 minutos, en vez de seis minutos, tradicionalmente recomendado como es estándar para detectar más pólipos adenomatosos 30. En el grupo control la detección de pólipos en mujeres y en hombres fue 30,5% y 37,4% respectivamente, los cuales están por encima del 20 y 30% respectivamente exigidos internacionalmente 31. En los pacientes menores de 50 años (casos), la ADR fue 18,5%. Pocos estudios han investigado la ADR en este grupo etario. En el estudio de Tharsis G et al. 32, la prevalencia de adenomas en pacientes de 45 a 50 años fue 9,7%. Ignoramos si la mayor ADR en los “casos” de este estudio, se debe a las mismas razones expuestas para la optimista tasa de ADR lograda en el grupo “control”. En nuestro estudio, el 76,7% de los adenomas de los casos, estaban en el colon izquierdo, el cual es ligeramente superior a publicaciones internacionales que han encontrado que más de la mitad de los adenomas están en esa localización 33.
Haber encontrado pólipos adenomatosos en 18,5% de las personas menores de 50 años podría favorecer la reciente recomendación de la Asociación Americana de Cáncer de implementar tamización a partir de los 45 años 10. Los modelos que evalúan las colonoscopias de tamización en menores de 50 años, favorecen esta estrategia al encontrar que teóricamente disminuirían aún más la mortalidad por CCR en personas de 50 años o más, al eliminar más tempranamente los pólipos adenomatosos que son las lesiones precursoras de esos tumor 4. Además, en las últimas décadas, la incidencia de CCR ha aumentado casi tres veces en las personas menores de 50 años, comparado con la de personas de 50 años en adelante 11. En nuestro país no hay estudios epidemiológicos sobre el comportamiento dinámico de esta neoplasia en los diferentes grupos etarios y por el momento desconocemos el impacto que pudiera tener, ésta relativamente alta prevalencia de pólipos adenomatosos en personas menores de 50 años: También, se ignora, si sería costo eficaz descender la edad de tamización para el CCR a los 45 años. En países desarrollados, se ha estimado que iniciar la tamización a los 45 años, podría resultar en una ganancia de aproximadamente 25 años de vida por 1 000 individuos examinados 34. Se ha considerado que, si se aumenta la ventana de tamización a población entre los 45 a 50 años, se podrían evitar 29 400 casos de CCR y posteriormente 11 100 muertes por esta enfermedad en los próximos 5 años 35. Para determinar el impacto de esa estrategia en nuestro medio, se necesitarían estudios poblacionales. Si bien, todavía existe controversia sobre disminuir la edad de tamización por debajo de los 50 años 10,34,36, nuestros hallazgos de pólipos adenomatosos en 1 de cada 5 personas asintomáticos menores de 50, es similar a lo esperado en mujeres de 50-75 años, asintomáticas, que es un grupo en el cual se recomienda colonoscopia de tamización 3 y por tanto, teóricamente podría parecer pertinente indicar colonoscopia de tamización a partir de los 45 años, aunque se necesitarían más estudios para determinar en cada país la costo-efectividad de esa recomendación 3,7-10. En los controles fueron significativamente más frecuentes diabetes mellitus tipo 2, hipertensión arterial, hipotiroidismo y divertículos, probablemente debido a que estas entidades, aparecen más frecuentemente conforme aumenta la edad. En los controles también se encontró que a mayor sobrepeso y obesidad mayor prevalencia de pólipos. Este hallazgo ha sido ampliamente descrito en la literatura 37 y también en un trabajo colombo-venezolano 38.
En conclusión, en este trabajo colombiano, la prevalencia de pólipos en general, fue similar en menores y mayores de 50 años (37,0 vs 42,6%, p<0,27). En contraste, la prevalencia de adenomas es mayor en personas mayores de 50 años que en menores de 50 años (18,5% y 32,4%, p<0,004). Sin embargo, en los menores de 50 años, hubo adenomas en 1 de cada 5 individuos, que es similar a lo esperado en mujeres de 50 a 75 años, en las cuales está indicada la tamización. Con base en este hallazgo, intuitivamente, estaría indicado iniciar la tamización a partir de los 45 años. En menores de 50 años, encontramos casi dos veces más adenomas que lo encontrado en otros países (18,5% vs 9,7%). Se necesitan más estudios a nivel nacional, para determinar si está relativamente alta prevalencia de adenomas en menores de 50 años, es consistente y sí tendría impacto en la prevención y mortalidad del CCR en Colombia.