INTRODUCCIÓN
La infección por Helicobacter pylori (HP) es la infección crónica más común en humanos 1,2. Esta bacteria generalmente no invade el tejido gástrico, pero lo hace más susceptible al daño del ácido péptico generando una reacción inflamatoria y produce una gastritis crónica que, en muchos casos, no causa síntomas ni progresa, pero en otros, produce úlcera péptica, o gastritis atrófica que luego se convierte en metaplasia intestinal y eventualmente a carcinoma gástrico 3-5.
La prevalencia de infección por HP es alrededor de 50% a nivel global y esta cifra llega al 45,5% en el Perú 6.
Debido a la alta prevalencia de la infección y las complicaciones de la misma el Seguro Social de Salud (EsSalud) priorizó la realización de la presente guía de práctica clínica (GPC) con el objetivo de brindar recomendaciones para el diagnóstico y manejo de la infección de HP en enfermedades gastroduodenales en adultos.
La presente GPC está dirigida a todo personal de salud que participa en la atención multidisciplinaria del paciente con infección de H. pylori en enfermedades gastroduodenales, en los servicios o unidades de gastroenterología, medicina interna, medicina familiar y medicina general de cada nivel de EsSalud.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión extensa, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG): Se conformó un GEG, que incluyó metodólogos y médicos gastroenterólogos.
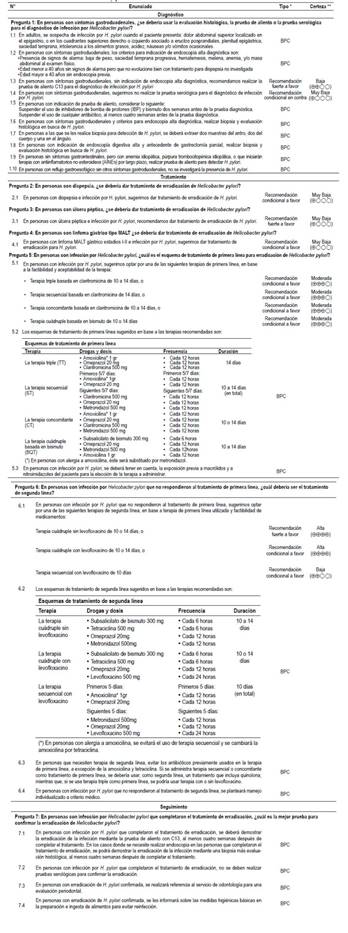
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 7 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Tabla 1 Lista de recomendaciones y puntos de Buena Práctica Clínica.
* Recomendación (R) o puntos de buena práctica clínica (BPC)** La certeza de la evidencia solo se establece para las recomendaciones, mas no para los puntos de BPC
Búsqueda y selección de la evidencia: Para cada pregunta PICO, desde septiembre de 2019 a marzo 2020, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Cochrane Central Register of Controlled Trials -CENTRAL-) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC) (Material Suplementario 1 y 2). Cuando se encontraron RS de calidad aceptable según el instrumento A Measurement Tool to Assess Systematic Reviews (AMSTAR II) (7), se escogió una para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia: Para cada desenlace de cada pregunta PICO, se evaluó la certeza de la evidencia siguiendo la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) (Material Suplementario 3) según la cual, la evidencia puede ser de alta, moderada, baja, o muy baja certeza. (Tabla 1) 8.
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 1) usando los marcos Evidence to Decision (EtD) de la metodología GRADE 9,10. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud, 4) Equidad, 5) Factibilidad de las opciones en los establecimientos de salud de EsSalud, y 6) Uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple.
Formulación de buenas prácticas clínicas: El GEG formuló buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica (Tabla 1).
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión extensa fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 104-IETSI-ESSALUD-2020.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Desarrollo de recomendaciones
La presente GPC abordó siete preguntas clínicas, en relación a tres temas: diagnóstico, manejo y seguimiento de infección por H. pylori. En base a dichas preguntas se formularon 12 recomendaciones (tres fuertes y nueve condicionales), 17 BPC, y dos flujogramas (uno de diagnóstico y otro de manejo) (Tabla 1, Figuras 1 y 2).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación.
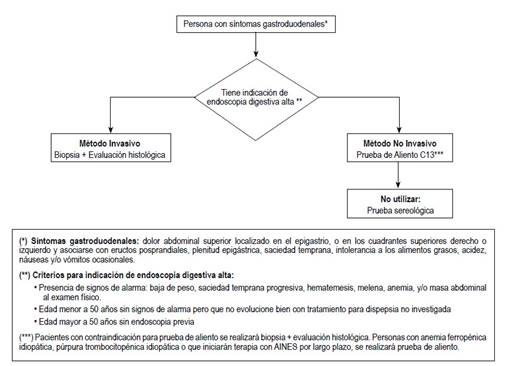
Pregunta 1. En personas con síntomas gastroduodenales, ¿se debería usar la evaluación histológica, la prueba de aliento o la prueba serológica para el diagnóstico de infección por Helicobacter pylori?
BPC-1.1 y 1.2: Para responder esta pregunta, primero, se plantearon las características de sospecha de infección por HP 11 y los criterios para evaluar la necesidad de endoscopía alta diagnóstica en pacientes con síntomas gastroduodenales 2,12 (Tabla 1).
Con respecto a las pruebas diagnósticas, a pesar de que no existe una prueba de referencia ideal, generalmente, la biopsia más evaluación histológica, extraída a través de la endoscopia, es considerada la prueba de referencia. Se puede optar por una prueba diagnóstica no invasiva como son: la prueba de aliento que detecta la enzima ureasa y la prueba serológica que detecta anticuerpos para HP, ambas disponibles en nuestro contexto.
Evidencia: Se realizó una búsqueda sistemática para responder esta pregunta, encontrando tres RS, de las cuales RS de Best 2018 13 fue la más reciente. Esta RS evaluó la exactitud diagnóstica de la prueba de aliento y serológica teniendo como referencia la evaluación histológica y sus resultados sugieren que la prueba de aliento tendría mayor exactitud (tres estudios de diagnóstico, sensibilidad [S]: 99% [IC 95%: 92 a 100], especificidad [E]: 95% [IC 95%: 90 a 98]) que la prueba serológica (S: 91% [IC 95%: 82 a 96], E: 86% [IC 95%: 72 a 93]).
Recomendación-1.3: Debido a la alta sensibilidad y especificidad de la prueba de aliento, se emitió una recomendación a favor de su uso en pacientes sin indicación de endoscopia alta diagnóstica. A pesar de la baja certeza de la evidencia, se emitió una recomendación fuerte debido a que es la alternativa no invasiva con mayor exactitud.
Recomendación-1.4: Debido a la baja sensibilidad y especificidad de la prueba serológica, se emitió una recomendación en contra de su uso. Debido a la baja certeza de la evidencia, y a que, en ciertos contextos, la prueba serológica es la única accesible, se emitió una recomendación condicional.
BPC-1.5: Debido a que el consumo de antibióticos, inhibidor de bomba de protones (IBP) y bismuto disminuyen la exactitud de la prueba de aliento 14,15, las personas sometidas a esta prueba deberán evitarlas semanas previas a la prueba (Tabla 1).
BPC-1.6 y 1.7: Si el paciente presenta síntomas gastroduodenales y criterios para endoscopia alta diagnóstica, se realizará biopsia y evaluación histológica en busca de HP 16,17.
BPC-1.8: Se debe tener en cuenta que, en pacientes con síntomas gastroduodenales y gastrectomía parcial, la prueba de aliento disminuye su exactitud diagnóstica 18, por ende, se debe realizar una endoscopia alta diagnóstica y evaluación histológica en estos pacientes.
BPC-1.9 y 1.10: Existen algunos subgrupos poblacionales sin síntomas gastrointestinales, pero con anemia idiopática, púrpura trombocitopénica idiopática, o que iniciarán terapia con antiinflamatorios no esteroideos (AINEs) por largo plazo, en los que se ha sugerido que la terapia de erradicación de HP mejoraría su condición 19,20 y evitaría el desarrollo de úlcera 21, por lo que se les debe realizar prueba de aliento para detectar HP. Sin embargo, en paciente con enfermedad por reflujo gastro-esofágico (ERGE) pero sin otros síntomas gastroduodenales no se ha hallado beneficio de la erradicación de HP 22, por lo que, en esa población, no se investigará la presencia de HP.
Pregunta 2. En personas con dispepsia, ¿se debería dar tratamiento de erradicación de Helicobacter pylori?
Evidencia: Se realizó una búsqueda sistemática, encontrando tres RS, de los cuales se seleccionaron la RS de Kang 2019 23 y la RS de Du 2016 24 por ser las más actuales y reportar los desenlaces priorizados. Ambas compararon el tratamiento de erradicación de HP contra placebo o no tratamiento. La RS de Kang 2019 encontró que el tratamiento de erradicación de HP aumenta la probabilidad de mejoría de síntomas dispépticos (18 ECA, RR 1,18 [IC 95%: 1,07 a 1,30]), y no presenta más efectos adversos (5 ECA, RR 2,55 [IC 95%: 0,88 a 7,36]) 23. La RS de Du 2016 encontró que el tratamiento de erradicación de HP disminuye el riesgo de desarrollo de úlcera (6 ECA, RR 0.35 [IC 95%: 0,18 a 0,68]), pero no tiene efecto en la calidad de vida (siete ECA, SMD 0.01 [IC 95%: -0,11 a 0,08]) 24.
Recomendación-2.1: Debido a que la evidencia señala beneficio de al tratamiento de erradicación de HP en pacientes con dispepsia, se emitió una recomendación a favor de su uso, pero, dado que los efectos fueron valorados como pequeños y la certeza de evidencia fue muy baja, se emitió una recomendación condicional.
Pregunta 3. En personas con úlcera péptica, ¿se debería dar tratamiento de erradicación de Helicobacter pylori?
Evidencia: Se realizó una búsqueda sistemática, encontrando una RS, Ford 2016 25. Esta RS comparó el tratamiento de erradicación de HP contra el placebo o no tratamiento, y encontró que el tratamiento de erradicación disminuye el riesgo de no curación de úlcera duodenal (34 ECA, RR 0,66 [IC 95%: 0,58 a 0,76]), pero no de úlcera gástrica (15 ECA, RR 1,23 [IC 95%: 0,90 a 1,68]), además, reduce el riesgo de recurrencia de úlcera duodenal (27 ECA, RR 0,20 [IC 95%: 0,15 a 0,26]) y gástrica (12 ECA, RR 0.31 [IC 95%: 0,22 a 0,45]), pero aumenta el riesgo de eventos adversos (43 ECA, RR 2,30 [IC 95%: 1,77 a 2,99]), y no cambia la probabilidad de alivio completo de síntomas (dos ECA, RR 0,86 [IC 95%: 0,42 a 1,74]) .
Recomendación-3.1: El GEG consideró que el balance favorece el tratamiento de erradicación de HP en pacientes con úlcera péptica, y emitió una recomendación a favor. A pesar que la certeza fue muy baja, el GEG consideró que los efectos fueron grandes, por ende, emitió una recomendación fuerte.
Pregunta 4: En personas con linfoma gástrico tipo MALT ¿se debería dar tratamiento de erradicación de Helicobacter pylori?
Evidencia: Se realizó una búsqueda sistemática, encontrando solo la RS de Zullo 2010 26 de estudios observacionales que evaluó la tasa de remisión de linfoma MALT después del tratamiento de erradicación de HP y encontró que el 77,5% (32 estudios observacionales, [IC 95%: 75,3 a 79,7]) de las personas con linfoma MALT y tratamiento de HP, presentaban remisión de linfoma MALT.
Recomendación-4.1: El GEG consideró que la alta tasa de remisión de linfoma Malt después de tratamiento de erradicación de HP es alta, y emitió una recomendación a favor, pero, dado que la certeza de la evidencia fue muy baja, se emitió una recomendación condicional.
Pregunta 5. En personas con infección por Helicobacter pylori, ¿cuál es el esquema de tratamiento de primera línea para erradicación de Helicobacter pylori?
Evidencia: Se realizó una búsqueda sistemática, encontrando cuatro RS, de los cuales se seleccionaron la RS de Yeo 2016 27 y la RS de Li 2015 28 por ser las más actuales y reportar los desenlaces priorizados.
La RS de Yeo 2016 27 realizó un network neta-análisis (NMA) y comparó varios esquemas de tratamiento de primera línea contra la terapia triple basada en claritromicina (TT) de 7 días (117 ECA) encontrando que la terapia secuencial (ST) de 14 días (OR 3,74 [IC 95%: 2,37 a 5,96]) y la terapia concomitante (CT) de 10 días o más (OR 2,80 [IC 95%: 2,06 a 3,82]), fueron más eficaces que los otros esquemas. Asimismo, debido a la potencial resistencia a metronidazol o claritromicina en la región (29-31) el GEG se consideró las terapias triple basado en claritromicina de 10 días (TT-C-10 ) (OR 1,32 [IC 95%: 1,04 a 1,69]) o de 14 días (TT-C-14) (OR 1,72 [IC 95%: 1,37 a 2,17]), y la terapia cuádruple basado en bismuto (BQT-14) (OR 2,64 [IC 95%: 1,21 a 5,78]) que también son superiores al comparador, aunque no tan efectivas como la ST de 14 días y la CT de 10 días o más 27.
La RS de Li 2015 28 también realizó un NMA y comparó varios esquemas de tratamiento contra la terapia triple basada en claritromicina de 7 días a más encontrando que los esquemas ST (OR 1,00 [IC 95%: 0,85 a 1,18]), CT (OR 1,13 [IC 95%: 0,83 a 1,48]), TT-C10 o 14 (OR 1,10 [IC 95%: 0,94 a 1,26]) ni la terapia de bismuto de 10 o 14 días (B-10 o 14) (OR 1,08 [IC 95%: 0,85 a 1,34]) presentaban mayores efectos adversos que el comparador.
Recomendación-5.1: El GEG sugiere hacer la elección del esquema de tratamiento de primera línea entre cuatro opciones en base a la factibilidad y aceptabilidad de la terapia:
La terapia triple de 10 o 14 días resultó ser más efectiva que la referencia, además de ser, probablemente la más aceptada, por ende, se emitió una recomendación a favor de su uso. A pesar de que la certeza de la evidencia fue moderada, el GEG consideró que no es la opción terapéutica más eficaz, por ende, se decidió emitir una recomendación condicional.
La terapia secuencial de 14 días basada en claritromicina fue una de las de mayor eficacia, por ende, se emitió una recomendación a favor de su uso. A pesar de que presenta una certeza de evidencia moderada, se consideró que la aceptabilidad por los médicos y pacientes podría ser baja por la complejidad del esquema, por lo que decidió emitir una recomendación condicional.
La terapia concomitante de 10 días o más basada en claritromicina fue una de las de mayor eficacia, por ende, se emitió una recomendación a favor de su uso. A pesar de que presenta una certeza de evidencia moderada, se consideró que la aceptabilidad por los médicos y pacientes también podría ser baja por la complejidad del esquema, por lo que decidió emitir una recomendación condicional.
La terapia cuádruple con bismuto de 14 días es más efectiva que el comparador y presenta una opción para contrarrestar la resistencia nitroimidazoles, por ende, se emitió una recomendación a favor de su uso. A pesar de que la certeza de la evidencia fue moderada, el GEG consideró que no es la opción terapéutica más eficaz, por ende, se decidió emitir una recomendación condicional.
BPC-5.2 y 5.3: El GEG presenta los esquemas de tratamiento de primera línea sugeridos en base a las terapias recomendadas 1 y además, considera que se debe evaluar la posible resistencia antibiótica en los pacientes 29-31 en base a su exposición previa a macrólidos y a nitroimidazoles 32,33 (Tabla 1).
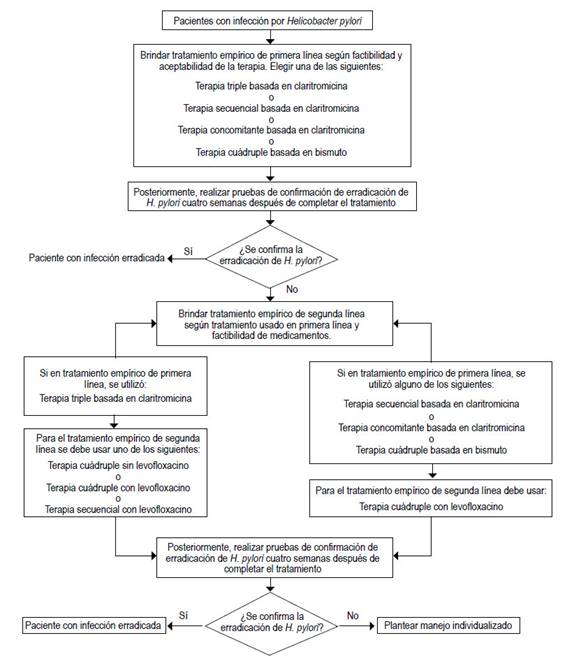
Pregunta 6. En personas con infección por Helicobacter pylori que no respondieron al tratamiento de primera línea, ¿cuál debería ser el tratamiento de segunda línea?
Evidencia: Se realizó una búsqueda sistemática, encontrando siete RS, de los cuales se seleccionaron la RS de ECA de Yeo 2019 34 debido a que fue la más reciente, y la RS de Wu 2011 35 por reportar otros desenlaces priorizados.
La RS de ECA de Yeo 2019 34 realizó un NMA y comparó varios esquemas de tratamiento de segunda línea contra la terapia triple con quinolona de 7 días (26 ECA), encontrando que la terapia cuádruple en base a quinolona de 10 a más días (Q-BQT-≥10) (OR 4,29 [IC 95%: 1,67 a 12,12]), la terapia cuádruple sin quinolona de 10 a más días (non-Q-BQT-≥10) (OR 2,25 [IC 95%: 1,10 a 4,62]) y la terapia secuencial en base a quinolona (ST) (OR 2,91 [IC 95%: 1,16 a 7,65]) superaron a la terapia de referencia.
La RS de Wu 2011 35 comparó la terapia triple con quinolona contra terapia cuádruple con bismuto, y encontró que la terapia triple con quinolona tiene menos riesgo de presentar eventos adversos que la terapia sin quinolona (7 ECA, OR 0,27 [IC 95%: 0,18 a 0,41]) y de descontinuación de terapia debido a eventos adversos (5 ECA, OR 0,18 [IC 95%: 0,08 a 0,40]).
Recomendación-6.1: El GEG sugiere hacer la elección del esquema de tratamiento de segunda línea entre tres opciones en base a terapia de primera línea utilizada y factibilidad de medicamentos:
La terapia cuádruple sin quinolona de 10 o 14 días de duración es más eficaz que el comparador, por lo que se emitió una recomendación a favor de su uso. Debido a que presenta una certeza de evidencia alta, ofrece una alternativa ante la resistencia a quinolonas, una problemática de nuestro contexto 36-41, y es aceptable por el personal y los pacientes, se emitió una recomendación fuerte, a pesar de presentar mayores efectos adversos que las demás terapias.
La terapia cuádruple con quinolona de 10 o 14 días de duración, también, es más eficaz que el comparador, por lo que se emitió una recomendación a favor de su uso. A pesar de la alta certeza de la evidencia, el GEG tomó en cuenta la problemática de resistencia a las quinolonas en nuestro país 36-41, así como la limitada factibilidad de uso de este medicamento, por lo que decidió emitir una recomendación condicional.
La terapia secuencial en base a quinolona de 10 días de duración, también, es más eficaz que el comparador, por lo que se emitió una recomendación a favor de su uso. Debido a la baja certeza de la evidencia, la problemática de la resistencia antibiótica a quinolonas 36-41, la limitada factibilidad del medicamento y la posible baja aceptabilidad del esquema por los pacientes, el GEG decide emitir una recomendación condicional.
BPC-6.2 y 6.3: El GEG presenta los esquemas de tratamiento de primera línea sugeridos en base a las terapias recomendadas 34,42, y además remarca la necesidad de tomar en cuenta la resistencia antibiótica generada por el tratamiento de primera línea, para la elección de la terapia de segunda línea 33,42-44 (Tabla 1).
BPC-6.4: En personas con infección por HP que no respondieron al tratamiento de segunda línea, se planteará manejo individualizado a criterio médico.
Pregunta 7: En personas con infección por Helicobacter pylori que completaron el tratamiento de erradicación, ¿cuál es la mejor prueba para confirmar la erradicación de Helicobacter pylori?
Evidencia: Se realizó una búsqueda sistemática, no se encontraron RS ni ECAS que respondan a la pregunta formulada. En tal sentido, el GEG formuló puntos de buena práctica clínica.
BPC-7.1 y 7.2: De acuerdo con la GPC de la American College of Gastroenterology (ACG) 2 y el IV consenso de Florencia 1, se plantean los métodos adecuados y no adecuados 45 para la confirmación de erradicación de HP (Tabla 1).
BPC-7.3 y 7.4: El GEG planteó algunas propuestas para evitar la reinfección en base a fuerte correlación entre la presencia de HP en el estómago y en la cavidad oral sugerida por algunos estudios 46,47, el probable beneficio la evaluación odontológica 48 y de las medidas de higiene 49 (Tabla 1).