INTRODUCCIÓN
La infección crónica por el virus de la hepatitis C (VHC) es un problema de salud pública con más de 71 millones de casos a nivel global, de los cuales, aproximadamente 400 mil fallecen por complicaciones como cirrosis hepática, carcinoma hepatocelular (CHC) y falla hepática 1. En el Perú, la prevalencia de infección por VHC ha ido en incremento de 0,3% para el año 2000 2 a 1,25% para el 2017 3, a la vez, se reporta una mortalidad de 0,04 por cada 100 000 habitantes 4. Los genotipos más frecuentes, en el Perú son los genotipos 1a, 1b, 2b y 3a, y el 85% corresponde al genotipo 1 (65% al subtipo 1a y 15% subtipo al 1b) 5.
Con respecto al curso de la enfermedad, entre el 50 y 80% de los pacientes infectados desarrolla la forma crónica. De estos, el 30% desarrolla una infección crónica estable; un 40%, una fibrosis hepática progresiva lenta; y el otro 30%, una fibrosis progresiva acelerada del hígado 6. El subdiagnóstico y el diagnóstico tardío son los principales problemas en el control de la infección, pues, a nivel mundial se considera que solo el 30% de los casos son diagnosticados de manera oportuna 7. En el Perú los datos de prevalencia reportan un total de 400 000 personas infectadas; sin embargo, según expertos, esta cifra dista mucho del total de pacientes diagnosticados en nuestro sistema de salud 2. Por lo expuesto, será relevante la mejoría de estrategias de tamizaje, especialmente, en poblaciones de alto riesgo.
El uso de antivirales de acción directa (AAD) ha demostrado modificar el curso natural de la enfermedad evitando la progresión a fibrosis hepática y reduciendo su morbimortalidad, lo cual, ha sido valorado especialmente en pacientes mayores de 18 años 8. Sin embargo, al existir múltiples esquemas de tratamiento, surge la necesidad de valorar su eficacia y seguridad en estadíos avanzados de fibrosis hepática, en pacientes con o sin tratamiento previo y en escenarios como postrasplante hepático o renal, coninfección con VIH o hepatitis B, o enfermedad renal crónica 9.
Dado que el diagnóstico oportuno y tratamiento individualizado con AAD, según el escenario clínico, podría reducir la morbilidad y la mortalidad relacionada con la evolución de la infección por VHC, el Seguro Social de Salud del Perú (EsSalud) priorizó la realización de la presente guía de práctica clínica (GPC) para establecer recomendaciones basadas en evidencia para gestionar adecuadamente los procesos y procedimientos asistenciales en la presente condición.
METODOLOGÍA
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión extensa, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_ pract_clini.html ). En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía local (GEG): Se conformó un GEG, que incluyó metodólogos, médicos gastroenterólogos, infectólogos e internistas.
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 4 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (population, intervention, comparator, outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (outcomes) de interés.
Tabla 1 Lista de recomendaciones y puntos de buena práctica clínica.

* Número de recomendación (R) y de punto de buena práctica clínica (BPC).
** Punto de buena práctica clínica (BPC).
*** La certeza de la evidencia solo se establece para las recomendaciones, mas no para los puntos de BPC.
Búsqueda y selección de la evidencia: Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2019 se buscó revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Cochrane) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC sobre el tema) (Material suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
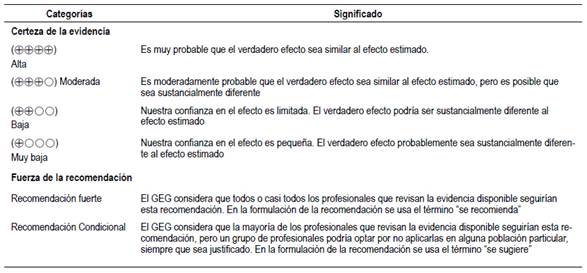
Evaluación de la certeza de la evidencia: La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (Tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) 10. Para presentar el resumen de los estudios, se usó tablas de resumen de evidencias (summary of findings [SoF]) de GRADE (Material suplementario 2).
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE 10. Para ello, se tuvo en consideración: 1) beneficios y daños de las opciones, 2) valores y preferencias de los pacientes, 3) aceptabilidad por parte de los profesionales de salud, 4) factibilidad de las opciones en los establecimientos de salud de EsSalud, y 5) uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Se le asignó a cada recomendación el nivel de certeza más bajo alcanzado por alguno de los desenlaces críticos de su pregunta.
Puntos de buena práctica clínica: El GEG formuló puntos de buena práctica clínica (BPC), usualmente en base a su experiencia clínica. Los puntos BPC se presentan en la Tabla 2 y su justificación se halla disponible en la versión extensa de la presente GPC.
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión extensa fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 151-IETSI-ESSALUD-2019.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Recomendaciones
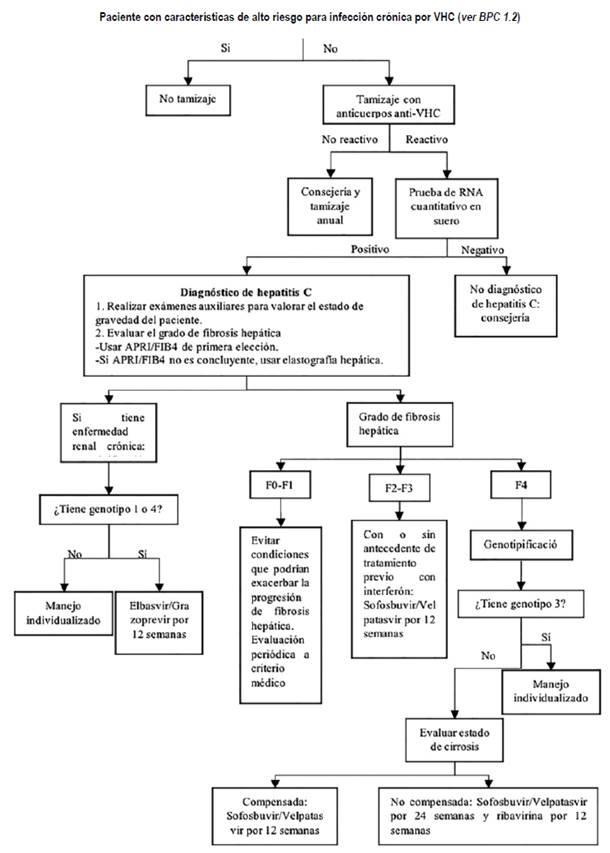
La presente GPC abordó 4 preguntas clínicas sobre tamizaje, diagnóstico, estadiaje y tratamiento. En base a dichas preguntas se formularon 13 recomendaciones (8 fuertes y 5 condicionales), 27 BPC, y 01 flujograma de tratamiento (Tabla 1, Figura 1).
La presente GPC se enfoca en pacientes mayores de 18 años con infección crónica por hepatitis C. En estas personas se abordó la realización de la prueba de tamizaje serológica (pregunta 1), el uso de la prueba cuantitativa de RNA viral (pregunta 2), el uso del índice APRI y/o del FIB-4 para estadiaje (pregunta 3) y el uso de terapias antivirales de acción directa (pregunta 4).
A continuación, se expondrá las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación. Todos los enunciados (recomendaciones o BPC) se encuentran enumerados en la Tabla 1, por lo cual en el texto solo se mencionará el número del enunciado al cual se hace referencia. Los datos numéricos de los beneficios y daños para cada pregunta se exponen en las tablas SoF, que se pueden consultar en el Material suplementario 2.
Pregunta 1: ¿Se debería realizar una prueba de tamizaje a las personas con alto riesgo de tener infección por VHC?
Se encontraron 5 RS y se consideró la RS de la Guía de la OMS 11 para responder a esta pregunta debido que fue de buena calidad, la búsqueda fue relativamente reciente e incluyó un mayor número de estudios. La RS incluyó 16 estudios observaciones (EO) que evaluaron el uso de tamizaje de infección crónica por VHC. Se encontró que la probabilidad de encontrar un caso positivo 2, 31 veces mayor cuando se realiza un tamizaje en un paciente de alto riesgo.
Realizar una prueba de tamizaje podría ser útil para identificar pacientes con infección crónica por VHC ya que usualmente es asintomática. El GEG tomó en cuenta que realizar la prueba de tamizaje riesgo implicaría una disminución de daños por la progresión a fibrosis hepática en grupos de alto. Por lo cual, se decidió emitir una recomendación a favor de realizar una prueba de tamizaje en pacientes con alto riesgo de infección por el VHC.
A pesar de que a certeza de la evidencia fue baja, se consideró que el tamizaje es menos costoso cuando se realiza en pacientes de alto riesgo al implicar un menor número de pruebas con respecto a cuando se realiza en población general. Además de ser relativamente factible y aceptado por la mayoría de los pacientes con riesgo alto de infección por el VHC y por los especialistas, por lo cual, se decidió emitir una recomendación fuerte. En la BPC 1,2 de la Tabla 1 se define a los pacientes de alto riesgo.
Pregunta 2: ¿Cuál prueba debería solicitarse para confirmar el diagnóstico de infección por VHC?
Se consideró a la RS de la guía de la OMS 2015 8, por ser la única que respondió a la pregunta e incluyó 4 estudios observacionales realizados en pacientes con tamizaje positivo para VHC que evaluaron la sensibilidad de las pruebas de RNA cualitativas y cuantitativas para detectar el RNA viral en sangre, pero no se realizó metaanálisis debido a que las poblaciones eran heterogéneas, y no todos usaron la misma prueba de referencia. Dentro de los estudios incluidos, se reportó que las sensibilidades tanto de la prueba cuantitativa como de la cualitativa, fueron superiores al 87%, siendo ligeramente mayor para la prueba cuantitativa.
Dado que la prueba cualitativa aporta menos información y parece tener menor sensibilidad que la prueba cuantitativa; se decidió formular una recomendación a favor de realizar la prueba cuantitativa para confirmar el diagnóstico de infección crónica por el VHC.
A pesar de que la certeza de la evidencia fue muy baja en términos de sensibilidad y especificidad para elegir una prueba sobre otra, pero dado que la prueba cualitativa implicaría un similar uso de recursos que la prueba cuantitativa, además de ser igualmente factible y aceptado por los médicos y pacientes, pero considerando que la prueba cuantitativa aporta más información, el GEG consideró que el uso de la prueba cualitativa no sería justificable, por lo cual, se decidió emitir una recomendación fuerte para el uso de las pruebas cuantitativas.
Pregunta 3: En los pacientes con infección crónica por el VHC, ¿Cuál prueba debería usarse para determinar el estadiaje de la fibrosis hepática?
Para conocer el estadiaje de fibrosis hepática se pueden utilizar pruebas invasivas y no invasivas. La prueba de referencia y considerada como estándar de oro es la biopsia hepática que frecuentemente se basa en el sistema Metavir 12. Sin embargo, debido a que la biopsia es una prueba con alto uso de recursos y potenciales daños, se suelen utilizar pruebas no invasivas tales como APRI 13 (índice AST/plaquetas), el índice AST/ALT 14, el índice FIB-4 15 y el fibrotest 16. Estas pruebas utilizan como referencia el estadiaje con el sistema Metavir para la determinación de sus puntos de corte considerando un Metavir ≥ F2 para fibrosis significativa y un Metavir ≥ F4 para cirrosis.
Se encontraron 5 RS y se consideró la RS de la OMS del 2016 17 por ser la de mayor calidad y considerar un mayor número de estudios. Esta RS valoró la sensibilidad y especificidad para determinar el estadiaje de fibrosis hepática e incluyó 207 estudios observaciones. En los metaanálisis de esta RS se encontró que las 3 pruebas con mejor precisión para determinar el estadiaje de fibrosis hepática fueron el APRI, FIB-4 y elastografía hepática. La elastografía hepática goza de mayor sensibilidad y especificidad que APRI, FIB-4, y estas 2 pruebas tienen una sensibilidad y especificidad similar.
Considerando que las sensibilidades y especificidades del APRI y el FIB/4 fueron similares; sin embargo, la elastografía hepática incurre en un uso alto de recursos en comparación con las otras 2 pruebas, se decidió formular una recomendación a favor de realizar el APRI y/o FIB-4 como primeras pruebas para evaluar el estado de fibrosis hepática y en caso de existir duda o no poder aplicar el APRI y/o FIB-4 se realizaría la elastografía hepática.
A pesar de que la certeza de la evidencia es baja a moderada para ambas pruebas, puesto que el uso de APRI y/o FIB-4 es más factible e implica un menor uso de recursos en comparación con la elastografía hepática; se decidió emitir una recomendación fuerte para el uso del APRI y/o FIB-4 y condicional para el uso del elastografía hepática.
Pregunta 4: En pacientes adultos con infección crónica por el VHC, ¿cuál terapia con antivirales de acción directa es la más clínicamente efectiva y segura?
Actualmente existen múltiples estrategias terapéuticas con antivirales de acción directa (AAD) para el manejo de VHC cuya eficacia podría variar de acuerdo con el estadio de enfermedad, comorbilidades, falla virológica previa, y trasplante hepático o renal previo 18.
En el 2018, IETSI realizó un análisis de impacto presupuestal para comparar el uso de recursos de los AAD. En este análisis se concluyó que, con respecto a los AAD que se usan en los pacientes sin hemodiálisis, la combinación Sofosbuvir/Velpatasvir incurrió en menor uso de recursos; y con respecto a los pacientes en hemodiálisis, la combinación Grazoprevir/Elbasvir incurrió en menor uso de recursos 19.
Para esta pregunta clínica se realizaron ocho preguntas PICO en diferentes escenarios, para todos los casos se realizó una búsqueda de evidencia, como se cita a continuación:
Preguntas 4.1-4.6: Pacientes sin cirrosis (F2 a F3) o cirrosis compensada (F4 y Child A) nunca antes tratados, sin cirrosis (F2 a F3) o cirrosis compensada (F4 y Child A) antes tratados, post-trasplante hepático, post-trasplante renal, coinfección por VIH, coinfección por VHB
En la búsqueda sistemática de evidencia se encontró:
-para pacientes sin cirrosis (F2 a F3) o cirrosis compensada (F4 y Child A) nunca antes tratados: 03 RS 20-22.
-para pacientes sin cirrosis (F2 a F3) o cirrosis compensada (F4 y Child A) antes tratados: 03 RS .20-22
-para pacientes en post-trasplante hepático: 05 ECA 23-27.
-para pacientes en post-trasplante renal: 03 ECA28-30 .
-para pacientes con coinfección por VIH: 06 ECA 31-36.
-para pacientes con coinfección por VHB: 01 RS 37.
En los estudios se encontró una proporción de respuesta viral sostenida (RVS) mayor a 90% para la mayoría de los AAD. Así mismo, la prevalencia de discontinuación de la terapia debido a eventos adversos fue baja en todos los AAD.
Los AAD evaluados tuvieron similar eficacia y seguridad. Sin embargo, la terapia con Sofosbuvir/ Velpatasvir fue la menos costosa en la evaluación de uso de recursos. Por ello se decidió formular una recomendación a favor del uso de Sofosbuvir/ Velpatasvir en estos pacientes. A pesar de que la certeza de evidencia fue muy baja, pero teniendo en cuenta que el uso de los otros esquemas más costosos no se justificaría a la luz de la evidencia se decidió emitir una recomendación fuerte.
Pregunta 4.7: Enfermedad renal crónica (TFG < 30 ml/min por 1.73m2) o diálisis
Para esta población especialmente en VHC genotipos 1 o 4, luego de la búsqueda sistemática, se encontró una RS 21 para valorar el esquema Glecaprevir/Pibrentasvir y 5 ECA 38-42 para los esquemas Grazoprevir/Elbasvir y Viekira, a partir de los cuales, se concluye que los esquemas Glecaprevir/Pibrentasvir y Grazoprevir/ Elbasvir presentan similar eficacia mientras que el esquema Viekira una menor eficacia. Así mismo, los efectos adversos se aprecian comparables entre los esquemas de Glecaprevir/Pibrentasvir y Grazoprevir/ Elbasvir, mientras que en el esquema Viekira se aprecia una ligera tendencia a mayores eventos adversos. Ninguno de los esquemas presentó eventos adversos serios relacionados con la droga. Así el GEG consideró que los esquemas Glecaprevir/Pibrentasvir y Grazoprevir/Elbasvir presentan buen balance de riesgo/ beneficio.
Se consideró que los esquemas Glecaprevir/ Pibrentasvir y Grazoprevir/Elbasvir ofrecen el mejor balance riesgo/beneficio y que el esquema Grazoprevir/Elbasvir es el menos costoso 19. Por ello, el GEG consideró realizar una recomendación a favor de Grazoprevir/Elbasvir en pacientes con ERC (TFG < 30 ml/min por 1.73m2) y VHC genotipo 1 o 4. A pesar de que la certeza de evidencia fue muy baja, pero considerando que el uso de los otros esquemas más costosos no se justificaría con la evidencia disponible, se decidió emitir una recomendación fuerte.
PICO 4.8: Cirrosis descompensada (F4 y Child-Pugh B o C)
Para esta población, luego de la búsqueda sistemática, se encontraron cinco RS, de las cuales se seleccionaron dos 43,44, por ser las de mejor calidad metodológica. La evidencia encontrada concluye que el esquema con Sofosbuvir/Velpatasvir con o sin ribavirina tuvo una mejor RVS a las 12 semanas y una mejora importante de la calidad de vida con respecto a los otros esquemas con AAD en pacientes con genotipo de VHC diferente al genotipo 3. Por otra parte, el esquema de Sofosbuvir/ Velpatasvir tuvo una menor frecuencia de eventos adversos con respecto al esquema de Sofosbuvir/ Velpatasvir con ribavirina y otros AAD.
Considerando que el uso de Sofosbuvir/Velpatasvir con o sin ribavirina, presentan una alta frecuencia de RVS a las 12 semanas y una frecuencia de eventos adversos aceptable y esperada según el estadio de enfermedad hepática, se decidió formular una recomendación a favor del uso de Sofosbuvir/Velpatasvir por 24 semanas o Sofosbuvir/Velpatasvir más ribavirina por 12 semanas en pacientes con genotipo de VHC diferente al genotipo 3. A pesar de que la calidad de la evidencia fue baja, debido a que el uso de los otros esquemas más costosos no se justificaría con la evidencia disponible, se decidió emitir una recomendación fuerte para el uso de Sofosbuvir/Velpatasvir. Sin embargo, considerando que la certeza fue baja y que en nuestro medio es difícil encontrar ribavirina y la factibilidad podría verse seriamente afectada, se decidió emitir una recomendación condicional para el uso de Sofosbuvir/ Velpatasvir más ribavirina.