INTRODUCCIÓN
El Helicobacter pylori (Hp) es una bacteria gram negativa, espiralada que se encuentra en la superficie luminal del epitelio gástrico e induce inflamación crónica de la mucosa superficial y profunda 1. Suele adquirirse en los primeros años de vida 2 y persiste por muchos años si no es manejada adecuadamente 2. Esta es una de las infecciones crónicas más comunes 2, con una prevalencia mayor del 50% a nivel mundial 1. En el Perú, la prevalencia de la infección difiere entre estratos socioeconómicos, siendo de 58,7% en niveles medio-alto y más del 80% en el nivel bajo 3,4.
La presencia de esta bacteria en la mucosa gástrica predispone el desarrollo de enfermedades del tracto gastrointestinal superior y extra digestivas 5. Entre las más comunes están la gastritis aguda y crónica, úlceras gástricas o duodenales, cáncer gástrico y linfoma de tejido linfoide asociado a mucosas (MALT) 1,5. La Organización Mundial de la Salud ha clasificado a esta bacteria como un carcinógeno tipo I, considerándola como el factor de riesgo más importante para desarrollar adenocarcinoma gástrico 6,7.
La mayoría de infecciones por Hp son asintomáticas, lo que ocasiona una demora en su diagnóstico y tratamiento, e incrementa el riesgo de complicaciones de las enfermedades a las que predispone. El último consenso de Kyoto sobre la gastritis por Hp recomienda que todo paciente con la infección, sintomático o no, reciba tratamiento para la erradicación de la bacteria debido al impacto que tiene el manejo precoz de la misma en la historia natural de las enfermedades a las que favorece 8.
Uno de los métodos no invasivos más confiables para el diagnóstico de Hp es el test del aliento con carbono 13 (TC13) 9. Este es un método seguro y simple para el diagnóstico inicial y confirmación de la erradicación de la bacteria luego del tratamiento 10,11. Diversos estudios han demostrado una alta sensibilidad (mayor del 95%) y especificidad (entre 90 -100%) de esta prueba en adultos 12; además de sus ventajas: bien tolerado, fácil de realizar, útil en pacientes con comorbilidades que contraindiquen procedimientos endoscópicos, no es operador-dependiente y sus resultados son casi inmediatos. Una prueba con resultado positivo indica la presencia de la bacteria Hp en mucosa gástrica y la necesidad de tratamiento 12. Estas características las comparte con el test del aliento con carbono 14 (TC14), el cual se continúa utilizando en Perú. La principal diferencia entre ambos es que el carbono 13 es un isótopo estable no radiactivo y seguro en embarazadas y niños mayores de 6 años 9,12-14.
El TC13 se basa en la capacidad de producción de ureasa del Hp, enzima que permite hidrolizar la urea marcada con carbono 13 contenida en el kit diagnóstico, desdoblándola en amonio y dióxido de carbono marcado. Este último se absorbe a través de la mucosa del estómago y llega al torrente sanguíneo hasta llegar a los pulmones donde se excreta a través del aire espirado y es ahí donde es detectado por un espectrómetro de masas de isótopos estables 15-18.
Debido a la alta prevalencia de infección por Hp, riesgo de cronicidad y complicaciones irreversibles que ocasiona, es imprescindible la confirmación del diagnóstico y erradicación de la infección después de un tratamiento adecuado; siendo ventajosa la implementación de un test no invasivo, costo - efectivo, fácilmente disponible y rápido dentro del protocolo habitual en nuestro medio 19. Si bien el TC13 ha demostrado una buena utilidad diagnóstica en otros países, aún no se ha explorado su rendimiento en la población peruana, lo cual es necesario para recomendar su uso rutinario. El objetivo del presente estudio fue evaluar un test del aliento con carbono 13 de fabricación China como método diagnóstico no invasivo para la infección por Hp en población peruana y compararlo con el procedimiento estándar para el diagnóstico de Hp (endoscopía digestiva con toma de biopsia gástrica) de dos establecimientos de salud en una población peruana.
MATERIALES Y MÉTODOS
El presente estudio tiene como objetivo evaluar el test del aliento con carbono 13 urea [13C] Breath Test Kit fabricado por Shenzhen Zhonghe Headway Bio-Sci & Tech Co., Lt. como método diagnóstico no invasivo de la infección por Hp en una población peruana a través de la determinación de la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y utilidad diagnóstica del mismo.
Se realizó un estudio transversal y descriptivo sobre una base de datos secundaria recopilada por el Servicio de Gastroenterología del Hospital Cayetano Heredia y Clínica Cayetano Heredia de noviembre de 2017 a agosto de 2018. Se incluyeron 112 pacientes mayores de 18 años con indicación de una endoscopía digestiva alta con toma de biopsia gástrica y lectura histopatológica para detección de Hp por su médico tratante. Previo al procedimiento endoscópico (aproximadamente 1 - 2 horas antes), se les realizó el TC13. Se excluyó a los pacientes que consumieron antibióticos o compuestos de bismuto en el mes previo al procedimiento, inhibidores de bomba de protones en las últimas dos semanas o que presentaron algún episodio de sangrado intestinal en las últimas cuatro semanas 8.
Se usó el test del aliento Urea [13C] Breath Test Kit fabricado por Shenzhen Zhonghe Headway Bio-Sci & Tech Co., Ltd, (sensibilidad 95% y especificidad 95 - 100% según fabricante) autorizado por su representante en el Perú, Hospicare S.A.C., siguiendo las indicaciones de fábrica para su aplicación. Primero, se obtuvo una muestra de aliento en la bolsa control y se selló herméticamente. Luego, se administró a los pacientes una cápsula de urea [13C] con 100 ml de agua. Después de 30 minutos, se obtuvo la segunda muestra de aliento en una segunda bolsa y fue sellada herméticamente.
Estas dos bolsas con aliento fueron sometidas a la máquina analizadora del test del aliento donde se obtuvo el valor DOB (delta over baseline) que representa la abundancia de carbono 13 en la bolsa "prueba" menos la abundancia de carbono 13 en la bolsa "control" sobre la abundancia natural de carbono 13 por mil. Según las indicaciones del fabricante, un DOB mayor o igual a 4 es considerado como positivo.
Posteriormente, todos los pacientes fueron sometidos a la endoscopía programada, independientemente del resultado de la prueba de aliento. Se tomaron 5 biopsias (2 en antro, 2 en cuerpo y una en el ángulo) de acuerdo al protocolo de Sydney modificado. Este procedimiento se realizó con endoscopios de luz blanca y pinzas convencionales de toma de biopsia, con el paciente bajo sedación, previo ayuno de 12 horas y llevado a cabo tanto por endoscopistas experimentados como en entrenamiento bajo supervisión, "ciegos" a los resultados del test del aliento.
Se consideró como único patrón de referencia para definir la infección por Hp el resultado positivo de lectura histopatológica de las biopsias gástricas, debido a que esta es la única prueba usada rutinariamente en ambos centros para el diagnóstico. Cada muestra histopatológica fue analizada por 1 solo patólogo y se contaron con 5 diferentes a lo largo del análisis de las muestras incluidas en este estudio. Todos eran "ciegos" a los resultados del test del aliento de los participantes.
Las definiciones utilizadas para la caracterización histopatológica en los establecimientos considerados en este estudio son:
-Presencia de Hp: identificación de bacilos compatibles con Hp utilizando la tinción de hematoxilina y eosina.
-Densidad de Hp: evaluada semicuantitativamente a través de la presencia de Hp en el campo más comprometido de la biopsia según la siguiente clasificación: Ausente, una cruz (1 a 20 bacterias por campo), dos cruces (21 a 100 bacterias por campo) y tres cruces (100 bacterias por campo). Esta es una clasificación individual usada por el departamento de Anatomía Patológica de ambos centros.
-Presencia de metaplasia intestinal o displasia.
El análisis de datos se realizó con el programa Stata v15.0 (Stata Corporation, College Station, Texas, USA). Se describieron las características demográficas de la población en función al promedio y frecuencias absolutas y relativas respectivamente. Se determinó la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo del estudio y para determinar la eficiencia de la prueba se usó el coeficiente de verosimilitud (likelihood ratio) positivo y negativo, considerando el intervalo de confianza (IC) en cada valor. Además, se graficó la curva Receiver Operating Characteristic (ROC) con todos los posibles puntos de corte en la base de datos, con lo que se determinó el mejor punto basado en la selección de valores de sensibilidad, especificidad y likelihood ratio; y se evaluó el poder diagnóstico a través del área bajo la misma y su intervalo de confianza al 95%. Para el análisis de los valores DOB se reportó el promedio, media, desviación estándar (DS) y rango intercuartílico (RIQ). Se utilizó la prueba no paramétrica de U de Mann Whitney para evaluar la diferencia promedio de DOB en los grupos de Hp positivo y negativo por lectura histopatológica. Finalmente, se evaluó si un mayor valor de DOB en el test del aliento se asocia significativamente a una mayor densidad de Hp en la lectura histopatológica a través de la prueba no paramétrica de Kruskal-Wallis y Rho Spearman.
El trabajo de investigación fue aprobado por el Comité Institucional de Ética e Investigación (CIEI) de la UPCH (Constancia 23 - 22 - 19 con fecha 24 de setiembre de 2019).
RESULTADOS
La base de datos analizada incluye un total de 124 pacientes, de los cuales 112 fueron incluidos en el análisis siguiendo los criterios de inclusión y exclusión. Del total analizado, 85 fueron mujeres (75,9%) y la edad promedio fue 53 (DS: 13,5 años, rango de 18 a 79 años). Al menos una endoscopía previa fue reportada en 48 pacientes (42,9%) y 91 (81,3%) refirió nunca haber recibido tratamiento previo para la infección por Hp.
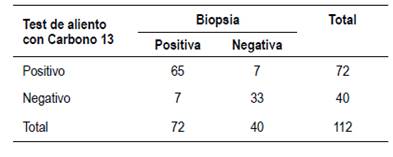
El test del aliento fue positivo en 72 pacientes (64,3%) y negativo en 40 (35,7%) (Tabla 1).
Se halló una sensibilidad de 90,3% (IC 95% 0,810,96) y una especificidad de 82,5% (IC 95% 0,67-0,93), valor predictivo positivo de 90,3% (IC 95% 0,81-0,96), valor predictivo negativo de 82,5% (IC 95% 0,67-0,93) (Tabla 2), likelihood ratio positivo (LR+) de 5,16 (IC 95% 2,62-10,15) y likelihood ratio negativo (LR-) de 0,12 (IC 95% 0,06-0,24).
Según el resultado histológico de las biopsias gástricas, 72 pacientes (64,3%) fueron positivos para infección por Hp y 40 (35,7%) fueron negativos (Tabla 1).
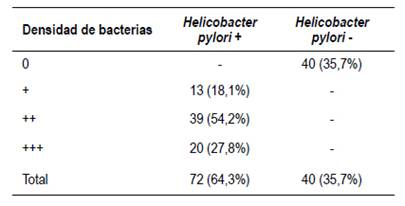
De los resultados positivos, la mayoría fueron valorados en 2 cruces (54,2%) según la cantidad de bacterias por campo (Tabla 3).
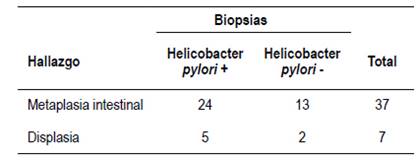
Además, en 37 (33,0%) se halló metaplasia intestinal y 7 (6,3%) displasia (Tabla 4). Se evidenció que la mayoría de alteraciones estaban presentes en las biopsias con resultado positivo para Hp.
En los pacientes con test del aliento positivo, el mínimo valor de DOB encontrado fue de 4,8 y el máximo de 111,67; mientras que, en los pacientes con resultado negativo, el mínimo valor fue de -2,66 y el máximo de 3,8. La mediana de DOB fue de 20,86 (RIQ: 35,01 - 9,6) en los pacientes con TC13 positivo.
En los pacientes con biopsia positiva para Hp, se obtuvo una media del DOB en 23,95 (DS 21,02) y una mediana de 18,98 (RIQ: 32,06 - 8,41). En los pacientes con biopsia negativa se obtuvo una media del DOB de 5,04 (DS 14,76) y una mediana de 0,59 (RIQ -0,29 - 3,35). La diferencia entre los valores de DOB en los pacientes con resultados de biopsia positivos y negativos fue significativa (p=0,000) y se halló un grado de asociación entre la cantidad de cruces de Hp y el valor de DOB (coeficiente de Spearman de 0,63 y p<0,05).
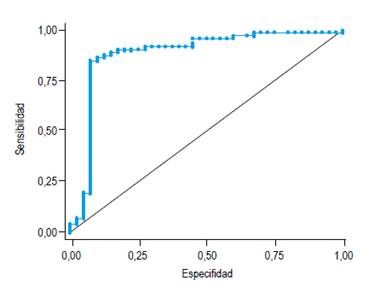
La utilidad diagnóstica de la prueba en estudio fue evaluada mediante el área bajo la curva ROC cuyo valor obtenido fue de 0,88 (IC 95%: 0,8 - 0,96). Además, el análisis exploratorio en la curva graficada (Figura 1) permitió determinar como mejor valor un DOB de 4,8 con una sensibilidad de 90,3%, especificidad de 82,5% y LR+ y LR- de 5,16 y 0,12 respectivamente. La exactitud diagnóstica de la prueba, es decir, los resultados verdaderos positivos y verdaderos negativos del total de pacientes estudiados fue 87,5%.
DISCUSIÓN
El TC13 es un método no invasivo de gran utilidad para determinar la infección y erradicación de Hp. Sin embargo, en el Perú no se han realizado estudios para evaluar su rendimiento diagnóstico.
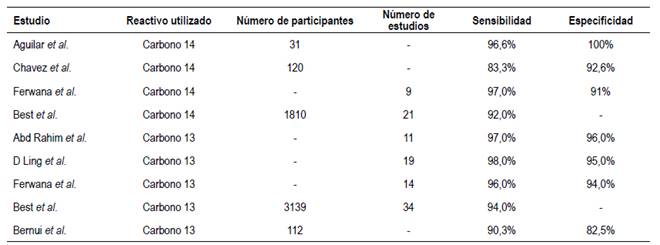
En este estudio se determinó la sensibilidad y especificidad de un test comercial de TC13 fabricado en China, comparándolo con el patrón de referencia de dos centros hospitalarios para el diagnóstico de Hp: la endoscopía con toma de biopsia gástrica. Se obtuvo una sensibilidad de un 90,3% y una especificidad de un 82,5%. Estos cálculos son menores a los hallados en otros estudios a nivel internacional: Abd Rahim et al. concluyeron en un meta análisis de población asiática una sensibilidad y especificidad global de 97% y 96%, respectivamente 20; D Ling et al., una sensibilidad y especificidad de 98% y 95%, respectivamente 21. Los resultados también fueron inferiores a los obtenidos con el TC14 en este país: sensibilidad y especificidad de 96,6% y 100% hallado por Aguilar et al. en el 2007 con 31 pacientes 22; y 83,3% y 92,6% respectivamente en una tesis de la UPCH realizado en el 2019 con 120 pacientes 23. Asimismo, estudios internacionales reportan una sensibilidad entre 92 - 96% y especificidad alrededor del 91% para el TC14 12,24. Tabla 5.
El valor predictivo positivo y negativo de la prueba fue de 90,3% y 82,5% respectivamente. Estos valores varían de acuerdo a la prevalencia por lo que en la población peruana considerando su alta prevalencia de infección por Hp, el VPP tiende a ser mayor y el VPN, menor. El coeficiente de verosimilitud (likelihood ratio) positivo y negativo fueron de 5,16 y 0,12, respectivamente, indicando que una persona infectada tiene 5 veces mayor probabilidad de tener un test del aliento positivo. Estos resultados evidencian que la prueba estudiada tiene una utilidad buena para cambiar la probabilidad pre-test de infección por Hp.
El área bajo la curva ROC hallada fue de 0,88 (IC 95% 0,80 - 0,96), que indica que esta prueba posee un poder de correcta clasificación muy útil 25, y debido a que el intervalo de confianza no incluye 0,75, la prueba del TC13 es capaz de discernir entre portadores y no portadores de la infección por Hp 26.
Los resultados verdaderos representan el 87,5% del total, indicando una exactitud diagnóstica considerable. Los falsos positivos representan el 9,7% del total, probablemente debido a la presencia de otros microorganismos productores de la enzima ureasa a lo largo del tracto digestivo tales como Helicobacter heilmanni 27. Además, la infección por Hp puede adoptar un patrón en parches en la mucosa gástrica por lo que puede no ser detectada por la biopsia y sí por el test del aliento que involucra a toda la superficie del estómago. Finalmente, este porcentaje de falsos resultados podría estar afectado por la falta de verificación del cumplimiento de criterios de exclusión e inclusión al momento de construir la base de datos secundaria, ya que la ingesta de ciertos medicamentos puede disminuir la probabilidad de obtener un resultado positivo 8.
El fabricante del test utilizado sugiere como punto de corte de DOB un valor de 4; sin embargo, el análisis exploratorio para la construcción de la curva ROC evidenció a 4,80 como umbral más adecuado para obtener la mayor sensibilidad y especificidad en la población estudiada. Originalmente, Logan et al determinaron como mejor umbral un DOB igual a 5, basándose en estudios europeos sobre la distribución normal de la concentración de carbono 13 en el aliento de pacientes nunca antes infectados por Hp, siendo este el valor más utilizado tradicionalmente. Estudios más recientes demostraron otros posibles puntos de corte con validez adecuada comprendidos entre 2 y 5, rango considerado una zona gris en la que los resultados del DOB pueden ser no concluyentes por la variación espontánea del dióxido de carbono en el aliento de los pacientes y la precisión analítica de los equipos de lectura de la prueba 28. Es posible que el valor de punto de corte más adecuado en la población peruana sea diferente a los tradicionalmente utilizados, por lo que es conveniente la construcción de curvas ROC con tamaños muestrales más representativos que contribuyan a determinar el mejor umbral.
La concentración de urea en las cápsulas utilizadas en el presente estudio es de 75 mg, para la cual se recomienda un umbral de DOB entre 3 y 5, que coincide con el valor más óptimo hallado en el análisis estadístico. La sensibilidad y la especificidad con el mejor punto de corte encontrado en este estudio coincide con los valores sugeridos por el fabricante; sin embargo, debido a que en la base de datos no existe ningún paciente que haya obtenido un valor DOB entre 4 y 4,8, no fue posible evaluar si algún punto de corte entre esos valores podría conllevar a una mayor sensibilidad y especificidad. Mientras no se desarrollen otros estudios que tengan el poder de evaluar esta brecha, se debe seguir utilizando el umbral establecido 28).
Otro de los objetivos de este estudio fue determinar si la abundancia de la bacteria determinada mediante histopatología (número de cruces) se asocia con el valor del DOB. La prueba Rho de Spearman evidenció un coeficiente positivo de 0,63 que califica como un nivel de asociación moderada a fuerte 29, lo que confirmó que estadísticamente existe una asociación positiva entre ambas variables: a mayor densidad de Hp en la biopsia gástrica, también se observan mayores valores de DOB.
Estudios internacionales evidencian una alta validez diagnóstica del TC13 con resultados comparables al TC1412-14 por lo que se infiere que los resultados inferiores obtenidos en este estudio y otras investigaciones locales se podrían deber a los pequeños tamaños de muestra con los que se trabajó y se sugiere un mayor número de investigaciones similares en hospitales de diversos niveles socioeconómicos para obtener una muestra más representativa de la población.
Otra limitación es el uso de la histología de biopsias gástricas como única prueba de referencia en lugar de dos pruebas confirmatorias, lo que podría explicar el menor valor de especificidad de este test en comparación a la literatura disponible. Además, se debe considerar un posible sesgo de confiabilidad inter evaluador ya que cada muestra fue evaluada por 1 patólogo y se contó con 5 evaluadores diferentes a lo largo del tiempo. Finalmente, no se descarta que los resultados inferiores obtenidos con este test se deban a características intrínsecas de la prueba utilizada, por lo que se recomienda realizar más estudios con TC13 de diferentes fabricantes con el objetivo de evaluar con mayor precisión el rendimiento de esta prueba en la población peruana.
El TC13 utilizado en este estudio es una prueba no invasiva, práctica y sencilla de realizar, lo que permite al paciente y al evaluador obtener resultados de forma rápida. Además, debido a que no conlleva riesgos de exposición a radiación, es una herramienta útil en niños mayores de 6 años y gestantes, y podría ser una buena alternativa para pacientes con impedimento para estudios invasivos como alternativa a la endoscopia. Sin embargo, debido a la discrepancia entre los resultados internacionales y locales obtenidos hasta el momento, aún no se puede recomendar el uso clínico rutinario o preferente de este examen. Por los beneficios ya descritos que ofrece esta prueba diagnóstica, es de vital importancia realizar estudios con mayores tamaños muestrales, protocolos estandarizados y de diferentes fabricantes para evaluar su rendimiento y características y poder proponerlo como de elección para el diagnóstico no invasivo de infección gástrica por Hp en el Perú.