INTRODUCCIÓN
Los antivirales de acción directa (AAD) constituyen el estándar actual de terapia para hepatitis C crónica, con altas proporciones de eficacia o efectividad, seguridad y tolerabilidad 1. No obstante, la evidencia en pacientes VIH-positivos es limitada 2.
En Perú, fuera de un reporte reciente que incluye 63 pacientes con hepatitis C crónica tratados con AAD 3, no se ha reportado experiencia clínica con AAD para hepatitis C crónica en pacientes VIH-positivos. Con este objetivo, se presenta una serie de casos sobre la experiencia clínica en el Servicio de Infectología del Hospital Guillermo Almenara Irigoyen, EsSalud.
MATERIALES Y MÉTODOS
Población de estudio
Estuvo conformada por una serie consecutiva de pacientes VIH-positivos tratados con AAD para hepatitis C crónica entre mayo de 2019 y abril de 2020 en el Servicio de Infectología del Hospital Nacional Guillermo Almenara Irigoyen, EsSalud. Los pacientes fueron identificados a partir de la base de datos electrónica del Servicio de Infectología para la atención médica de pacientes VIH-positivos (CB01).
Evaluación de los pacientes
Los pacientes fueron evaluados y tratados con AAD siguiendo el procedimiento establecido por EsSalud 4,5 . Para adecuar la terapia antirretroviral (TARV) a los AAD disponibles, se utilizó el portal de interacciones medicamentosas de la Universidad de Liverpool (https://www.hiv-druginteractions.org/checker).
Recolección de datos
Las variables incluidas en el estudio al momento de que los pacientes cumplieron con los requisitos para la terapia contra hepatitis C fueron las siguientes: edad; sexo; recuento de linfocitos T-CD4+ y carga viral del VIH de los últimos seis meses; TARV; marcadores de infección por virus de hepatitis B (VHB) y carga viral de este si hubo exposición al virus; serología para HTLV1; última carga viral detectable del virus de hepatitis C (VHC) y puntaje de fibrosis hepática FIB-4. Para evaluar el puntaje de fibrosis hepática, se empleó el portal electrónico de la Universidad de Washington, Fibrosis-4 (FIB-4, https://www.hepatitisc.uw.edu/page/ clinical-calculators/fib-4).
Los datos respecto a la infección por VIH, HTLV-1 y la TARV se obtuvieron a partir de la base de datos electrónica del Servicio de Infectología. Los datos de laboratorio sobre la infección por VHC y coinfección con VHB se recabaron a partir de la base de datos del laboratorio de biología molecular del hospital.
El desenlace central del estudio fue la respuesta viral sostenida (RVS) del VHC en términos de carga viral a las 12 semanas de completada la terapia con AAD. Los datos sobre tolerabilidad y seguridad se dejaron abiertos a criterio clínico. Durante la terapia con AAD, no se consideró la realización de controles de laboratorio con pruebas de bioquímica o hematología, salvo la evolución o criterio clínico. Los pacientes fueron instruidos para comunicar si presentaban algún problema durante la terapia con AAD.
RESULTADOS
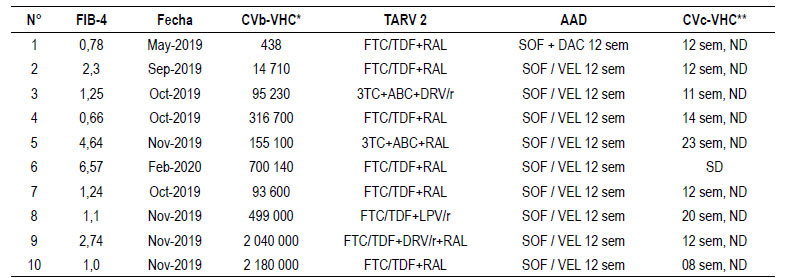
Se incluyeron a diez pacientes en el estudio, dos fueron mujeres (20%). La media de edad de los pacientes de la serie fue 48 años, con una desviación estándar de 13 años. Los datos sobre edad, sexo, recuento de linfocitos T-CD4+, carga viral del VIH y el esquema de TARV antes de la terapia con AAD se presentan en la Tabla 1. Como es apreciable, todos los pacientes de la serie tenían controlada la infección por VIH antes de la terapia con AAD.
Tabla 1 Características generales.
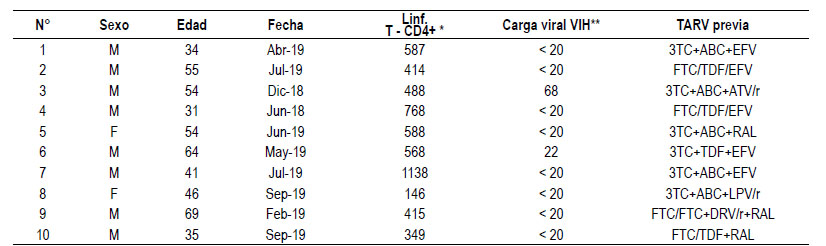
* Expresado en células/microlitro; ** expresada en copias/ml; 3TC: lamivudina, ABC: abacavir, EFV: efavirenz, FTC: emtricitabina, TDF: tenofovir, ATV/r: atazanavir/ritonavir, RAL: raltegravir, LPV/r: lopinavir/ritonavir, DRV/r: darunavir/ritonavir
Los datos sobre coinfección con VHB, HTLV-1 y carga viral del VHC antes de la terapia con AAD se presentan en la Tabla 2. Ninguno de los pacientes tuvo una coinfección crónica adicional por VHB (Ag HBs negativo). No obstante, la mitad de la serie estuvo expuesta a este con base en el hallazgo de anticuerpos frente a proteínas del core del VHB (Ac anti-HBc). La carga viral del VHB en estos pacientes fue no detectable. Adicionalmente, es pertinente mencionar que la TARV de estos pacientes incluía emtricitabina (FTC) y fumarato de disoproxilo de tenofovir (TDF, en adelante solo tenofovir) en combinación de dosis fija (FTC/TDF), medicamentos con actividad frente al VHB. Un paciente tuvo evidencia de coinfección asintomática por HTLV-1 (caso 2). Dos pacientes presentaron evidencia clínica de cirrosis compensada, un varón (caso 6) y una mujer (caso 5). Aunque esta última comenzó a desarrollar ascitis importante, con necesidad de paracentesis evacuatoria, mientras se concretaba la adquisición de los AAD aprobados por la institución en su caso. En este caso no hubo necesidad de otras paracentesis evacuatorias durante la terapia con AAD y el periodo de seguimiento hasta la medición de la RVS. Por otra parte, solo un paciente de la serie tuvo una comorbilidad crónica relevante adicional antes de la terapia con AAD: se trata de una paciente con cáncer de cérvix uterino en controles por oncología médica luego de haber sido operada y recibir radioterapia (caso 8).
Tabla 2 Carga viral de VHC previa y datos sobre coinfecciones con VHB y HTLV.
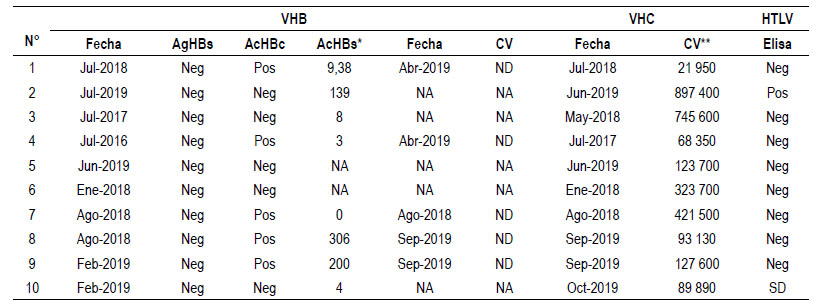
* Expresado en UI/ml; carga viral, ND: no detectable por debajo de 7 UI/ml; NA: no aplica; ** carga viral expresada en UI/ml; SD: sin datos.
Los datos sobre FIB-4, los esquemas de TARV y de AAD en simultáneo, así como las cargas virales de VHC basales y de control luego del tratamiento se presentan en la Tabla 3. La puntuación de FIB-4 mide el grado de fibrosis hepática de forma indirecta. La puntuación fue alta en los casos 5 y 6, compatible con fibrosis avanzada y con la evidencia clínica de cirrosis de estos casos. Por otra parte, los pacientes de la serie no tuvieron experiencia con terapia para el VHC, excepto los casos 6 y 7, quienes recibieron mucho tiempo atrás, y sin éxito, interferón y ribavirina. Todos los pacientes de la serie completaron un esquema de terapia de 12 semanas. El primer paciente de la serie recibió sofosbuvir y daclatasvir en formulaciones separadas. El genotipo del VHC de este paciente fue 1a. Los nueve pacientes restantes recibieron sofosbuvir y velpatasvir (SOF/VEL), ambos formulados en una sola tableta por día. No hubo necesidad de contar con el genotipo del VHC de estos pacientes para la solicitud de AAD por tratarse de un esquema de cobertura pan genotipo. La tolerancia a estos en la serie presentada fue adecuada. Tampoco hubo necesidad de controles de laboratorio de bioquímica o hematología durante el tratamiento. La evaluación de la RVS del VHC fue realizada en nueve casos, con un resultado no detectable, es decir, un conteo por debajo de 13 UI/ml en todos ellos. En el caso restante, no se pudo realizar dicha evaluación por dificultades en la comunicación con el paciente (caso 6).
DISCUSIÓN
La serie de casos presentada es la primera experiencia clínica reportada en Perú sobre la terapia con AAD para hepatitis C crónica en pacientes VIH-positivos. En la presente serie, la efectividad, la tolerabilidad y la seguridad de dos esquemas de AAD con base en sofosbuvir fueron óptimas.
La serie presentada tuvo una carga de coinfecciones importante. La mitad estuvo expuesta al VHB. Uno de nueve tuvo una coinfección adicional con HTLV-1. La frecuencia de la exposición al VHB en esta serie es alta comparada con la de pacientes infectados solo con VIH. La frecuencia de la coinfección con HTLV-1 es similar a la de una cohorte grande de pacientes VIH-positivos de nuestro servicio 6. Dichos hallazgos remarcan la importancia de una tamización sistemática de estos virus en pacientes VIH-positivos con fines preventivos. En línea con esto, no hubo necesidad de monitorear las cargas virales del VHB en los pacientes expuestos al mismo (con Ac anti HBc) dado que recibían FTC/TDF como parte de la TARV. Esta medida es compatible con las recomendaciones para evitar la reactivación de hepatitis B en el curso de la terapia con AAD para hepatitis C.
Los resultados de la serie presentada fueron consistentes con estudios similares tanto en escenarios de ensayos clínicos como de la práctica clínica real 7. También con el de cohortes grandes de Brasil 8 y España 9,10). No obstante, en la práctica clínica real de pacientes VIH-positivos, hay poca experiencia clínica reportada con SOF/VEL, lo que resalta el presente estudio. Estos resultados son mejores a otros de la práctica clínica real con porcentajes de RVS del VHC subóptimas, es decir, por debajo del 90% 11,12.
El primer ensayo clínico de sofosbuvir y daclatasvir para hepatitis C crónica en pacientes VIH-positivos se publicó en 2015 13. En dicho ensayo, que fue aleatorizado, un esquema de 12 semanas con sofosbuvir y daclatasvir fue superior a otro de ocho semanas en pacientes sin tratamiento previo. Mientras que, en el primer ensayo clínico de SOF/VEL para hepatitis C crónica en una cohorte de pacientes VIH-positivos, un esquema de 12 semanas fue muy efectivo, aun considerando la heterogeneidad de la cohorte entera de pacientes. El ensayo se publicó en 2017 14.
Por otra parte, la simplificación de los esquemas de AAD en una sola tableta, sumado a su actividad predecible pan genotipo, hace que dichos esquemas sean preferidos en la práctica clínica actual 1. SOF/ VEL cumple con dichas características, por lo que su empleo está vigente.
No obstante, se pudieron emplear otros esquemas de AAD en la serie de casos presentada, incluso con menos tiempo de terapia. Por ejemplo, un esquema de ocho semanas con sofosbuvir y ledipasvir en una sola tableta se empleó exitosamente en pacientes con hepatitis C crónica VIH-positivos, con una carga viral de VHC menor a seis millones de UI/ml 15. Los pacientes de la serie presentada cumplen con dicho parámetro; pero el esquema no estuvo disponible. Por otro lado, la combinación de glecaprevir y pibrentasvir en una sola tableta, que actualmente también forma parte de la primera línea de terapia para hepatitis C crónica, es efectiva en un régimen de ocho semanas en pacientes VIH-positivos, sin cirrosis 16. Este producto cuenta con registro sanitario vigente en Perú 17.
De otro lado, un aspecto que resulta crucial para el manejo adecuado de los pacientes con hepatitis C crónica VIH-positivos es el de las interacciones entre los antirretrovirales y los AAD. Según el portal de interacciones con medicamentos para el VIH de la Universidad de Liverpool 18, hay una contraindicación absoluta para el uso en simultáneo de efavirenz con velpatasvir, debido a una reducción significativa en los niveles séricos del segundo. Esto hizo que efavirenz fuera reemplazado por raltegravir, un inhibidor de integrasa ampliamente disponible en la institución, dado su mejor perfil de interacciones como producto y como clase a la que pertenece. Ocurrió lo mismo con daclatasvir, aunque se pudo superar la situación incrementando la dosis de 60 a 90 mg; pero esta última formulación del producto no estuvo disponible. Para dicho caso, el paciente involucrado recibió raltegravir en lugar de efavirenz. Este cambio se tuvo que producir en la mitad de los pacientes de la serie. Con relación a ello, el uso de inhibidores de integrasa ha sido asociado de forma independiente con una mejor respuesta virológica del VHC en pacientes VIH-positivos 11. La interacción con potencial efecto clínico entre tenofovir y velpatasvir fue manejada de forma expectante, por ser temporal. La interacción incrementa los niveles séricos del primero. Nuevamente, este aspecto es crucial en el manejo de este tipo de pacientes por lo que debe abordarse apropiadamente.
La terapia para hepatitis C crónica en pacientes VIH-positivos es costo-efectiva 19, por lo que todos los pacientes deberían ser tratados oportunamente y en serie, inde-pendientemente del estadio de fibrosis hepática. Para ello, se requiere un esfuerzo y organización real de los programas de VIH; pero aun eso no será suficiente. Asimismo, los esfuerzos deberían orientarse a la prevención de la coinfección con hepatitis B o C, o HTLV-1 y al diagnóstico temprano.
El estudio tiene dos limitaciones importantes. En primer lugar, la serie de casos es pequeña. No obstante, refleja la baja prevalencia de la coinfección con VHC en pacientes VIH-positivos de nuestro medio, donde la transmisión (o adquisición) de dichos virus es eminentemente sexual. Ello en contraste con una prevalencia alta en regiones donde el uso de drogas por vía intravenosa es frecuente. En segundo lugar, no se evaluaron otros desenlaces fuera de la supresión virológica sostenida del VHC. Efectivamente, no se evaluaron los cambios en la fibrosis hepática, por ejemplo 20. No obstante, ello se podría realizar en el seguimiento de los pacientes como parte de las evaluaciones que siguen por la TARV.
En conclusión, se presentó la primera experiencia clínica en Perú con AAD para hepatitis C crónica en pacientes VIH-positivos. La respuesta virológica, la tolerabilidad y la seguridad frente a daclatasvir y velpatasvir, cada uno junto o combinado con sofosbuvir, fueron óptimas en la serie de casos presentada.