INTRODUCCIÓN
Los gastrinomas son tumores neuroendocrinos que secretan gastrina y configuran el síndrome de Zollinger- Ellison, produciendo úlceras pépticas 1-3. Representan el 0,1 a 0,2% de los tumores gástricos 4, el 75% de los casos se presentan como lesión esporádica y el 25% en el contexto de una Neoplasia Endocrina Múltiple tipo 1 5-7. La localizaciones más frecuentes ocurren en duodeno (40-60%) y páncreas (20%) 3; sin embargo, se han descrito algunos casos de gastrinomas primarios de ganglios linfáticos 1,2. El diagnóstico de estos últimos es controversial, puesto que algunos autores sugieren que podrían ser resultado de microgastrinomas no detectados con metástasis a ganglios linfáticos 1. A continuación, presentamos el caso de un paciente con Síndrome de Zollinger-Ellison producto de un gastrinoma primario de ganglio linfático.
CASO CLÍNICO
Paciente varón de 64 años con antecedente de hipotiroidismo, hiperplasia benigna de próstata y cinco episodios de hemorragia digestiva alta en un periodo de 36 años, los cuales se estudiaron con endoscopía digestiva alta, encontrando úlceras gástricas y duodenales con estigmas de sangrado que fueron cauterizadas y manejadas médicamente.
Fue referido a nuestro hospital con un tiempo de enfermedad de 7 días caracterizado por melena, astenia, disnea, diaforesis, sensación de alza térmica y disminución ponderal. Se le diagnosticó anemia leve (Hb 9 g/dL), hipoalbuminemia (2,72 g/dL), neumonía adquirida en la comunidad y derrame pleural izquierdo, este último fue manejado con un tubo de drenaje torácico y antibioticoterapia de amplio espectro. Los estudios del líquido pleural fueron negativos para células tumorales, BK, ADA y gérmenes comunes y hongos.
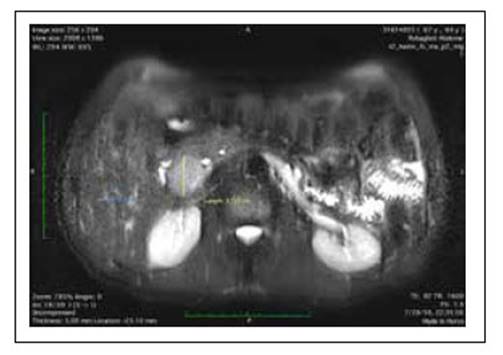
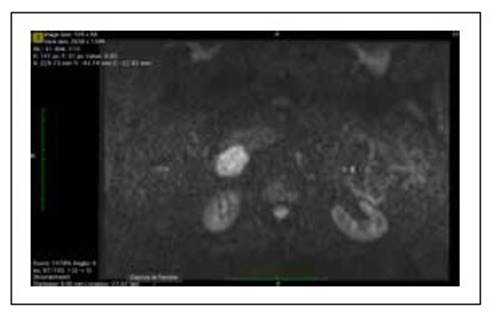
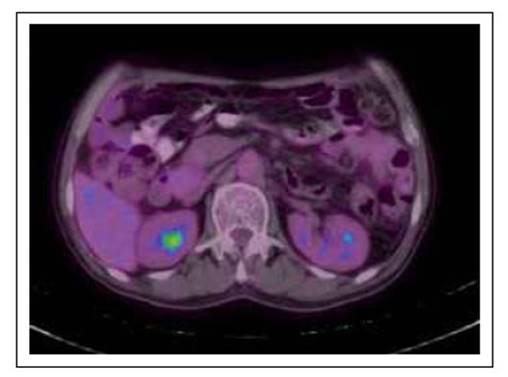
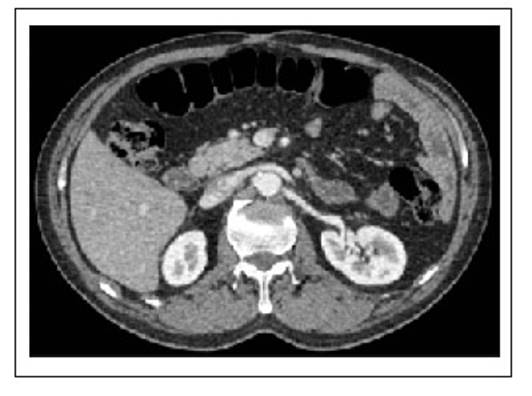
Se le realizó estudios de imágenes para descartar neoplasia oculta, el estudio de resonancia magnética nuclear de abdomen evidenció una adenomegalia en cadena pericoledociana, ubicada lateral al colédoco, entre la segunda porción duodenal y la vena cava inferior, de morfología ovoide, isointensa en T2, de 31x24x52 mm, sin realce significativo de contraste (Figura 1) y con intensa restricción de la difusión (Figura 2). Asimismo, se observó engrosamiento de la pared gástrica de 10 mm a nivel de fondo, así como del colon sigmoides de 12 mm, asociado a adenopatías circundantes y escaso líquido libre en cavidad peritoneal. También se le realizó estudios de Pet Scan en la cual no se evidencia que la imagen realce con el radiotrazador (Figura 3).
La resonancia magnética cerebral no encontró lesiones hipofisiarias.
Se realizó endoscopía digestiva alta sin alteraciones y en la colonoscopía se evidenció únicamente hemorroides internas de primer grado y dolicocolon. Se amplió el estudio con ecoendoscopía que visualizó un conglomerado ganglionar en hilio hepático, en estrecho contacto con duodeno y cabeza de páncreas, e intercavo-aórtico, no se evidenció ninguna masa ni alteraciones en el parénquima pancreático, wirsung, colédoco ni estructuras vasculares. Se le realizó biopsia por punción aspiración con aguja fina, cuyo resultado anatomo patológico resultó en una neoplasia de patrón organoide, monomorfo y vascularizado, compatible con tumor neuroendocrino
Se inició estudio para descartar síndrome de Zollinger-Ellison. Se obtuvo un valor de gastrina sérica de 609 ng/L (VN 0-100 ng/L); CEA 1,70 ng/mL (VN 0-6,2 ng/mL) y CA 19-9 52,1 U/mL (VN <33 U/mL).
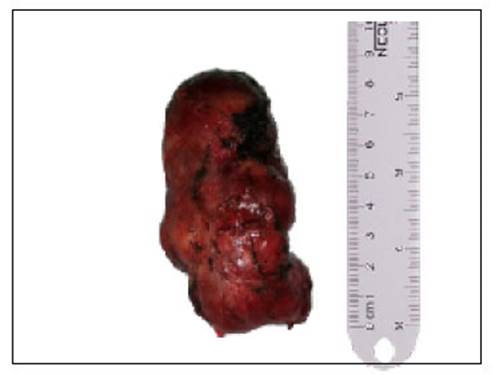
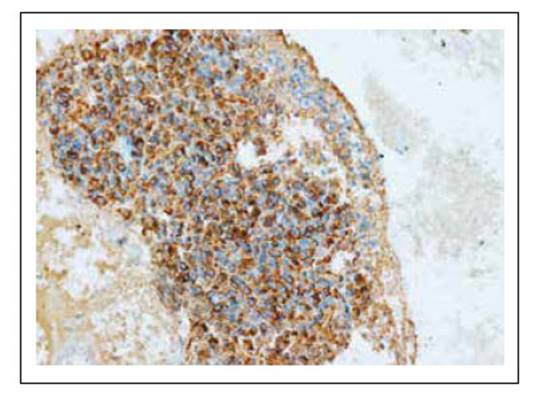
Se llevó a cabo una Junta Médica Multidisciplinaria y ante el diagnóstico de un tumor neuroendocrino funcionante tipo gastrinoma de ganglio linfático, se decidió intervenir quirúrgicamente. El paciente fue sometido a una laparotomía exploratoria que evidenció una tumoración que se ubica en la zona retroduodenal y retropancreática de 7 cm de diámetro, de consistencia dura, móvil, con presencia de vascularización, se realizó ecografía intraoperatoria con transductor de 7,5 MHz no encontrando lesiones duodenales, hepáticas ni en páncreas, la lesión no dependía del páncreas. Dicha lesión fue resecada completamente y enviada para estudio de anatomía patológica. La biopsia quirúrgica de la pieza operatoria obtenida informó a la macroscopía como ganglio retroperitoneal de 8,5x4x3 cm (Figura 4), mostrando a la microscopia un patrón organoide, monomorfo y vascularizado a la tinción de eosina/hematoxilina (Figura 5), los estudios de inmunohistoquímica determinaron cromogranina (+) (Figura 6), sinaptofisina (+) (Figura 7), CD56 (+) y Ki67 < 2% (Figura 8), concluyendo como diagnóstico anatomo patológico final Tumor Neuroendocrino G1 pseudoglandular de bajo índice mitótico < 2%.
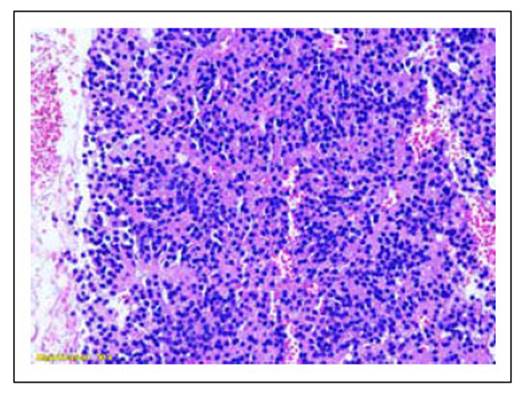
Figura 5 Tinción de eosina-hematoxilina 10X. Neoplasia de patrón organoide, monomorfo y vascularizado compatible con tumor neuroendocrino.
El paciente evolucionó favorablemente y fue dado de alta a los siete días de la cirugía. El control postoperatorio de gastrina a la semana y a los seis meses fue de 32,3 ng/L y 21,9 ng/L respectivamente, mientras que el control al año de la cirugía fue de 19,6 ng/L. Asimismo, el control tomográfico al año de la cirugía no evidencia ninguna lesión en el espacio previo ni en otra parte del abdomen; sin compromiso hepático ni líquido libre en cavidad abdominal (Figura 9). Actualmente, el paciente se encuentra asintomático.
DISCUSIÓN
Los gastrinomas son tumores neuroendocrinos con una incidencia muy baja, entre 0,5 a 4 casos nuevos por millón de personas por año 6. Suelen localizarse en duodeno y páncreas 1-3,7,8, en un espacio anatómico conocido como el triángulo del gastrinoma: la confluencia del conducto cístico y colédoco como límite superior, la segunda y tercera porción duodenal como límite inferior y el cuello y cuerpo de páncreas medialmente 2,6,7.
La evidencia de la existencia de verdaderos gastrinomas primarios de ganglios linfáticos, respecto a microgastrinomas del duodeno y el páncreas, radica en los valores bioquímicos de gastrina luego de la resección de los mismos 2,3,5-8. En tal sentido, el gastrinoma primario de ganglio linfático puede definirse como un tumor confinado a uno o más ganglios linfáticos peripancreáticos resecados, sin evidencia de otra localización extranodal y con resultados normales de gastrina y de imágenes postquirúrgicas 3,6. En el caso presentado, luego de la resección quirúrgica, el paciente se ha mantenido asintomático, con controles imagenológicos y bioquímicos negativos para una recurrencia de la enfermedad; encajando con la definición antes mencionada.
Sin embargo, la controversia en el diagnóstico de estos tumores se fundamenta en la posibilidad de la existencia de microgastrinomas no detectados con metástasis a ganglios linfáticos, sabiendo que solo el 10% de los gastrinomas primarios de duodeno son evidenciados preoperatoriamente en estudios de imágenes 3,7,8. Se reporta que un 10% de los pacientes con síndrome de Zollinger-Ellison esporádico se debe a un gastrinoma primario de ganglio linfático 1,5. En este contexto, el diagnóstico de un gastrinoma primario de ganglio linfático es de exclusión.
La cirugía cumple un rol importante en el manejo del síndrome de Zollinger-Ellison, pues permite controlar la hipersecreción ácida y las complicaciones que las úlceras pépticas traen consigo, cuando el manejo médico con inhibidores de bomba de protones no logran resolver los síntomas 2,3. A su vez, se sabe que hasta el 90% de estos tumores tienen potencial maligno, con tendencia al desarrollo de metástasis hepática, incrementado la morbilidad de los pacientes 3,4,8. En tal sentido, se reportan tasas de curación postquirúrgica cercanas al 82% 6, con una sobrevida libre de enfermedad a los 5 años de hasta el 81% 8, que prácticamente duplica la de aquellos tumores primarios de duodeno (45%) y páncreas (39%).
Para ello, es necesario hacer una exploración quirúrgica que permita descartar la presencia de enfermedad oculta, implementando el uso de ecografía intraoperatoria, el uso de transluminación e incluso la duodenotomía, a fin de alcanzar mayores tasas de curación y reducir la posibilidad del desarrollo de metástasis a distancia por gastrinomas no identificados 3,9. Asimismo, debe llevarse a cabo la resección ganglionar peripancreática, así como de los ganglios del tronco celiaco y del ligamento hepático 5,9.
En conclusión, reportamos el caso de un paciente con síndrome de Zollinger-Ellison esporádico debido a un gastrinoma primario de ganglio linfático, el cual se resolvió luego de su resección quirúrgica, con controles bioquímicos e imagenológicos negativos. La existencia de gastrinomas primarios de ganglios linfáticos debe tenerse en cuenta y ser sospechada como un diagnóstico de exclusión, a fin de lograr una identificación, exploración quirúrgica exhaustiva y resección temprana, disminuyendo la morbilidad que estos tumores traen consigo.