INTRODUCCIÓN
El síndrome antifosfolipídico (SAF) pediátrico se caracteriza por eventos tromboembólicos que ocurren por la presencia persistente de anticuerpos antifosfolipídicos 1. Dentro de las manifestaciones clínicas se encuentra la trombosis venosa, trastorno de piel y alteraciones hematológicas 2. Estos pueden afectar diversos órganos entre ellos el hígado produciendo el Síndrome de Budd-Chiari 3.
El síndrome de Budd-Chiari (SBC) se produce por una obstrucción del flujo venoso del hígado 4. Alukal et al, han reportado un incrementó en las hospitalizaciones por esta enfermedad en Estados Unidos, de 4,9 a 10,5 casos por millón de habitantes entre los años 1998 a 2017 5. Dentro de las manifestaciones clínicas del SBC destacan el dolor abdominal, ascitis y hepatomegalia 4; sin embargo, la sintomatología puede variar según el sitio de obstrucción y porción del hígado involucrada 4. La asociación de SBC y SAF, ha sido reportada en la población adulta siendo los pacientes con SBC agudo los que tienen peor pronóstico (6. En la población pediátrica existen limitados reportes 7.
El objetivo del presente reporte fue describir el caso de una adolescente con SBC como manifestación inicial de SAF secundario por lupus eritematoso sistémico (LES), que recibió terapia anticoagulante con controles inadecuados con posterior deterioro clínico al seguimiento.
CASO CLÍNICO
Una adolescente de 15 años fue a urgencias con fiebre, vómitos alimentarios, distensión abdominal y orina colúricas durante una semana. Presentaba desde hace tres años lesiones maculares hiperpigmentadas y pruriginosas que conformaban costras y descamaciones hemáticas que se iniciaban en las extremidades inferiores y posteriormente se diseminaban por todo el cuerpo asociadas a la pérdida de cabello y el enrojecimiento de la zona malar durante la exposición a la luz solar. En los meses siguientes se sumó el amarillamiento de las escleróticas y ligera distensión abdominal, no controlados médicamente por la limitación de recursos económicos. Desde dos meses antes del ingreso, se observa que la paciente presentaba un aumento de su volumen abdominal que le impedía realizar sus actividades cotidianas, a pesar del cual no contaba con controles médicos. La paciente carecía de hospitalizaciones, enfermedades o intervenciones quirúrgicas previas. La madre falleció cuando la paciente tenía 8 años por dengue hemorrágico.
En la exploración física del ingreso tenía una frecuencia cardíaca de 124 latidos/minuto, una frecuencia respiratoria de 20/minuto, una temperatura de 38,5°C, una saturación de oxígeno del 98% (FiO2 del 21%). En la exploración física preferencial mostraba palidez e ictericia en piel y mucosas, lesiones circulares hiperpigmentadas de +/- 0,5cm distribuidas por el cuerpo y edema en las extremidades inferiores. No existían adenopatías. El murmullo vesicular estaba disminuido en bases de ambos hemitórax y el abdomen presentaba distensión marcada (ascitis), con telangiectasias, circulación colateral, matidez desplazable y dolor a la palpación. El resto del examen fue normal.
En las analíticas se encontró hemoglobina 7,7 g/dL, leucocitos 6780 células/mm3, recuento absoluto de neutrófilos 4000 células/mm3, plaquetas 200 000/mm3, reticulocitos 21%, fibrinógeno 499 mg/dL, dímero D 1, 73 mg/dL, lactato deshidrogenasa 1537 mg/dL, urea 18 mg/dL, creatinina 0,53 mg/dL, electrolitos séricos normales, aspartato aminotransferasa 73, alanina aminotransferasa 23, bilirrubina total 4,1 (directa 3,0; indirecta 1,1), proteínas totales 6,4 mg/dL, albúmina 3 mg/dL, fosfatasa alcalina 893 mg/dL, gamma glutamil transpeptidasa 274, el perfil de coagulación era normal. La prueba de Coombs directa fue positiva y la de haptoglobina fue de 1. Los hemocultivos fueron negativos, la serología para VIH, VHB, VHC, virus de Epstein Barr y citomegalovirus fue negativa.
Por ascitis, se realizó una ecografía abdominal que encontró el hígado con ecotextura micronodular de 132 mm sugerente de cirrosis con signos de hipertensión portal y con abundante fluido abdominopélvico (pozo mayor de 516 mm) y una ecografía Doppler que concluye en ausencia de flujo en la vena suprahepática derecha y media, así como ausencia de flujo en la vena cava inferior sugestiva de trombosis (Figura 1). Por ello, se realizó una tomografía abdominal en fase venosa, que encontró una extensa trombosis de la vena cava inferior y trombosis de las venas suprahepáticas derecha y media, además de una alteración en la perfusión hepática relacionada con la congestión debida al síndrome de Budd Chiari (Figura 2). Igualmente, se realizó una ecocardiografía, que fue normal, y una endoscopia digestiva alta por la sospecha de varices esofágicas, cuyo resultado fue normal, y se realizó una paracentesis evacuadora, que obtuvo un líquido ascítico amarillento con 2431 g/dL de proteínas (ratio líquido peritoneal/suero-proteínas 2,4), glucosa 84, 11 células por campo, de predominio mononuclear, cultivos negativos y ADA (adenosina deaminasa) negativo.
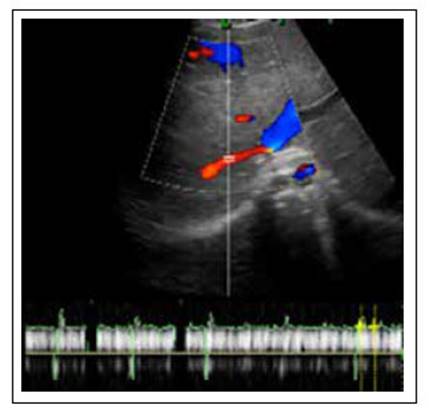
Figura 1 Ecografía Doppler del hígado. Se evidencia venas suprahepáticas media y derecha sin flujo Doppler color.
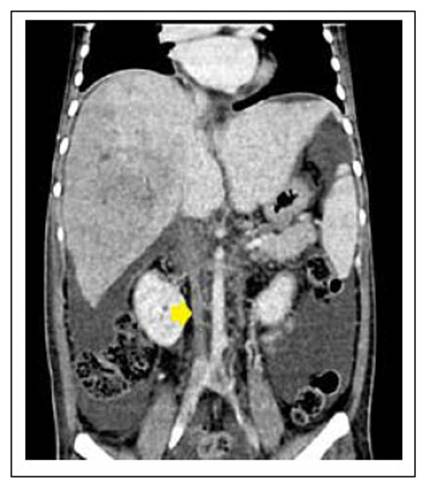
Figura 2 Tomografía abdominal fase venosa. Se evidencia extensa trombosis de vena cava inferior con trombosis de venas suprahepáticas derecha y media.
Debido a la edad de la paciente, el historial de lesiones hiperpigmentadas de larga evolución y a la trombosis de vasos venosos, se realizaron estudios immunológicos obteniendo complemento C3 26 mg/dL, C4 0 mg/ dL, IgM anti cardiolipina 156 (<12 negativo), anti B2 glicoproteína IgM 137 (<20 negativo), anticoagulante lúpico (positivo), anticuerpos antinucleares (ANA) negativos y anticuerpos citoplasmáticos antineutrófilos (ANCA) negativos. A partir de estos resultados, se propuso el diagnóstico de síndrome antifosfolípido activo asociado a trombosis de la vena cava inferior y un posterior control de ANA y ANCA.
Durante la hospitalización la paciente persistía con vómitos biliosos, intenso dolor abdominal, sugerente de probable isquemia mesentérica; además, de trastorno del sensorio. Por ese motivo, y asociado al síndrome antifosfolipídico de probable afectación hepática y mesentérica, fue transferido a la Unidad de Cuidados Intensivos (UCI) por la sospecha de SAF catastrófico donde se inició con metilprednisolona de pulso 30 mg/ kg durante 5 días, seguida de prednisona 1 mg/kg cada 24 hrs, inmunoglobulina 400 mg/kg/día durante 5 días y heparina sódica 75 IU/kg en bolo y luego 20 IU/kg/hora en infusión continua durante 7 días manteniéndose un control del tiempo de tromboplastina parcial activado entre 60-85 segundos, previo a la infusión de heparina, se le administró plasma fresco congelado 15 cc/kg. Tras completar 7 días de terapia con heparina, se mantuvo enoxaparina 1 mg/kg/subcutánea cada 12 horas. Recibió también cobertura antibiótica con cefotaxima 150 mg/kg/día y metronidazol 30 mg/kg/ día durante 7 días, propanolol 20 mg vía oral cada 8 horas, espironolactona 200 mg cada 12 horas, furosemida 20 mg cada 8 horas y manejo del dolor con analgésicos. La paciente evolucionó favorablemente y fue transferida a la unidad de hospitalización pediátrica.
En esa unidad, debido a la ascitis persistente, se realizó una segunda paracentesis evacuadora, obteniéndose un líquido amarillento con gradiente de albúmina >1,1, 89 células por campo, predominantemente mononucleares, estudio de Gram, cultivo y ADA negativos. También fue realizado un segundo Doppler hepático, que concluyó que no había flujo en la vena suprahepática media con posible revascularización de la vena suprahepática derecha (previamente trombosada) y aparente flujo lento en la vena cava inferior infrarrenal (previamente con extensa trombosis), y un Doppler renal concluyó que las venas y arterias renales eran permeables asociadas a colaterales venosas bilaterales. Por esta razón, se realizó una cavografía inferior (técnica de Seldinger con abordaje de la vena femoral común derecha) que concluyó en una obstrucción crónica completa de la vena cava inferior en toda su extensión además de un drenaje venoso por el sistema ácigos/hemiacigos que desemboca en la aurícula derecha por una vena ácigos hipertrófica.
En el control de las pruebas inmunológicas se obtuvo una disminución de los anticuerpos: anti cardiolipina IgM 95,9 (antes 156), anti B2 glicoproteína IgM 112,3 (antes 137), anticoagulante lúpico (positivo), anticuerpos antinucleares (ANA) positivos (patrón moteado 1: 640) y perfil de anticuerpos nucleares extraíbles (ENA) positivo para anti ds-DNA, anti Sm, anti RNP, anti histona. Con estos resultados se realizó el diagnóstico de lupus eritematoso sistémico (LES) asociado a síndrome antifosfolípido. Antes de iniciar el tratamiento del LES, se realizó un examen del fondo de ojo, un ecocardiograma y una ecocardiografía, cuyos resultados fueron normales.
Con los nuevos resultados, se continuo con prednisona (25 mg mañana y 20 mg tarde) y se agregó hidroxicloroquina 200 mg VO cada 24 hrs, gabapentina 150 mg VO cada 8 hrs (por dolor en articulaciones), vitamina K 10 mg EV cada 15 días, azatioprina 50 mg VO cada 24 hrs, carbonato de calcio 500 mg cada 24 hrs, calcitriol 0,25 mg VO cada 24 hrs, se mantuvo la enoxaparina combinada con Warfarina 5 mg VO cada 24 hrs por 4 días y luego se continuo solo con Warfarina. La paciente evolucionó favorablemente y fue dada de alta.
La paciente en el seguimiento tuvo controles irregulares de IRN no objetivos (1 - 1,4), debido a los bajos recursos económicos que tenía pues procedía de una provincia de Perú (Pucallpa-región selvática). A los 11 meses del diagnóstico previo, ingresó por emergencia en mal estado general, caracterizado por dolor abdominal intenso y vómitos de 2 días de evolución, falleciendo a las horas del ingreso, por paro cardiorrespiratorio.
DISCUSIÓN
El SBC puede presentarse como una manifestación abdominal inicial del SAF 3, con la sintomatología caracterizada por fiebre, distensión abdominal, ascitis, ictericia y hepatoesplenomegalia, según la localización de la trombosis 4.
La trombosis constituye la principal complicación del SAF y puede afectar a vasos arteriales y venosos de cualquier tamaño 2. Un estudio europeo multicéntrico de 121 pacientes pediátricos con SAF 8, reportó a 72 (60%) pacientes que desarrollaron trombosis venosa, 39 (32%) con trombosis arterial y tres (2%) con trombosis arterial y venosa mixta 8. Otro estudio en Estados Unidos reportó que de 17 pacientes con SAF, el primer evento trombótico arterial ocurrió en seis (35,3%) pacientes; mientras que, la trombosis venosa se presentó en 11 (64,7%) pacientes 1. En general, podemos observar que la trombosis venosa es más común que la trombosis arterial.
El diagnóstico de SBC se realiza mediante la exploración clínica y estudios de imagen como la ecografía Doppler donde se evidencia la ausencia de flujo de una vena principal, colaterales intrahepáticas o subcapsulares con flujo continuo 4. En nuestra paciente, las características clínicas más los hallazgos ecográficos como la ausencia de la vena suprahepática y de la vena cava inferior, confirmaron el diagnóstico. Además, la paciente refería que durante tres años había presentado lesiones maculares hiperpigmentadas y pruriginosas que formaban una costra hemática y descamación que se iniciaba en las extremidades inferiores, hecho que nos hizo sospechar una manifestación cutánea inicial del SFA. Las manifestaciones cutáneas en el SFA se reportan en el 18% de los pacientes 8, por lo que posiblemente estén relacionadas con lo descrito, sin embargo, no se realizaron estudios cutáneos en nuestra paciente para confirmarlo.
La evaluación clínica y los hallazgos de laboratorio confirmaron el diagnóstico de SAF en la paciente 9, ya que presentaba una extensa trombosis de la vena cava inferior y resultados positivos para anticuerpos lúpicos, anticuerpos anticardiolipina IgM/IgG y anticuerpos antiglicoproteína I beta 2. También cumplía los criterios de LES 10, ya que presentaba fiebre, hemólisis autoinmune, ANA positivo (1:640), anticuerpos antifosfolípidos positivos, C3 y C4 disminuidos y anticuerpos antidsDNA positivos. En efecto, el SAF puede ser de causa primaria o secundaria (asociado a otras enfermedades autoinmunes), como el lupus eritematoso sistémico (LES). Un estudio realizado en Estados Unidos informó de que la enfermedad autoinmune más común asociada al SAF pediátrico era el LES, y en el 52% de estos pacientes la trombosis se produjo antes o en el momento del diagnóstico del LES, como en el caso de nuestra paciente 8.
Dentro del tratamiento del SBC se describe a la terapia trombolítica, colocación de stent endovascular percutáneo, derivación portosistémica intrahepática transyugular (TIPS), derivación quirúrgica y trasplante de hígado alogénico 4. Espinosa et al 6, en una revisión de 43 casos de pacientes con SBC y SAF, encontró que el tratamiento más usado fue la anticoagulación 84% y sólo en el 29% se realizó cirugía 6. Asimismo, Chinen et al 11, reportó una mujer de 34 años con SAF y SBC agudo, caracterizado por fiebre, distensión abdominal y trombosis de las venas hepáticas, recibió infusión de heparina sódica por 9 días, luego se cambió a Warfarina con un rango objetivo INR de 2,5 a 3,0. A diferencia de Chinen, nuestro caso presentó un SBC subagudo pues el tiempo de presentación fue de 2 a 3 meses, siendo esta la presentación más frecuente de SBC 4. Sin embargo, el manejo fue similar, pues inicialmente nuestra paciente recibió heparina no fraccionada, luego infusión continua por una semana seguido de heparina de bajo peso molecular y para la prevención de eventos trombóticos recurrentes se cambió a Warfarina vía oral, similar a un caso previo 11.
Los casos reportados en pediatría son limitados. Elmas et al. 7, reportó en una niña de 14 años, que acudió a la emergencia por dolor abdominal, vómitos y ascitis de dos semanas de evolución, fue diagnosticada de SBC secundario a SAF, recibió heparina de bajo peso molecular seguido de anticoagulación con Warfarina; sin embargo, no hubo respuesta al tratamiento realizándose al final trombectomía y stent venoso hepático, siendo candidata para el trasplante hepático 7.
Nuestra paciente recibió pulsos de metilprednisolona e inmunoglobulina, este tratamiento se administró debido a la sospecha de un probable SAF catastrófico 12, pues tenía compromiso de dos órganos (hepático y mesentérico probable), aparición de manifestación clínica como el dolor abdominal súbito que hiciera sospechar un infarto mesentérico, presencia de los anticuerpos antifosfolipídicos y confirmación de trombosis venosa.
No se consideró el manejo quirúrgico en la paciente, debido a que no se cuenta con el equipo necesario para estos procedimientos y porque en la tomografía se evidenciaba múltiples colaterales venosas que drenaban hacia el sistema ácigos y hemiácigos, las cuales desembocaban en la aurícula derecha por una vena ácigos hipertrófica, motivo por el cual se prefirió solo el manejo farmacológico. El trasplante está indicado en pacientes que progresan a la cirrosis como lo reportado por Reshetnyak el at. 13, los cuales realizaron trasplante hepático ortópico exitosamente en varón de 22 años con SBC secundario a SAF; sin embargo, el seguimiento y controles deben de ser adecuados, los cuales no se pudo lograr en la paciente.
En conclusión, el SBC puede presentarse como manifestación inicial del SAF, por lo que un diagnóstico oportuno puede mejorar la calidad de vida del paciente, aunque el pronóstico no sea óptimo en el seguimiento, como en el presente caso.















