INTRODUCCIÓN
El uso de la gastrostomía endoscópica percutánea (GEP), ha aumentado de forma exponencial en las últimas dos décadas, después de más de 40 años de su descripción inicial 1, debido a su sencillez y seguridad 2). La Sociedad Europea de Endoscopia Gastrointestinal, recomienda la GEP en los pacientes que requieren un soporte enteral por más de 4 semanas, debido a patologías que impiden la ingesta oral, tales como entidades neurológicas que causan disfagiorofaríngea, incluyendo demencias en etapas tempranas, tumores obstructivos de la orofaringe, de cabeza y cuello, cáncer de esófago, estenosis esofágicas benignas y otras condiciones agudas o crónicas que generan catabolismo intenso, en los cuales la ingesta oral es insuficiente 3). No obstante ser un procedimiento seguro, puede haber complicaciones con una tasa de incidencia variable 4), aunque las complicaciones graves son poco frecuentes 5). Las complicaciones menores ocurren hasta en el 10 % de los casos 6 y la mortalidad relacionada con el procedimiento es inferior al 1% 7). Entre las complicaciones mayores se encuentran la fascitis necrotizante; perforación intestinal, gástrica o esofágica; peritonitis; sangrado o desarrollo de fístulas 8). El grupo de pacientes con indicaciones reales y que se benefician de este procedimiento es cada vez más selecto 3,9). El inicio del soporte nutricional enteral, luego de la realización de una gastrostomía endoscópica percutánea (GEP), tradicionalmente se ha diferido entre 12 a 24 horas 10). Los resultados de diferentes investigaciones sugieren que una administración de alimentos más temprana podría ser una opción 11). Sin embargo, el retraso en el inicio de la alimentación después de la colocación de PEG continúa practicándose ampliamente 12). El inicio de la alimentación no se debe retrasar, ya que sus beneficios han sido demostrados de forma consistente; es considerada la primera vía de alimentación para los pacientes críticos, se asocia con un menor riesgo de infecciones nosocomiales, mortalidad en la unidad de cuidados intensivos (UCI), estancia, mortalidad hospitalaria, y la duración de la ventilación mecánica 13). Un beneficio secundario sería la evidente reducción de la necesidad de nutrición parenteral y de los costos añadidos 14). Hasta donde investigamos, no existen investigaciones prospectivas en Colombia ni en Latinoamérica que hayan estudiado cuál es el momento ideal para empezar a utilizar la gastrostomía, y esta brecha en el conocimiento ha generado mitos y recomendaciones, que se basan fundamentalmente en opiniones de expertos y narraciones de tradición oral. Todo lo anterior nos motivó a realizar en Colombia esta investigación prospectiva, para determinar la seguridad de la administración temprana de la alimentación a través de la GEP.
MATERIALES Y MÉTODOS
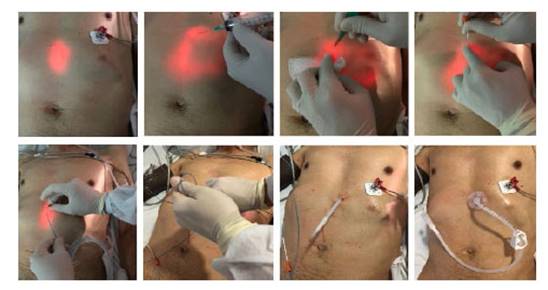
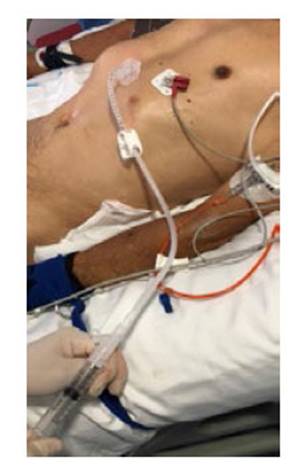
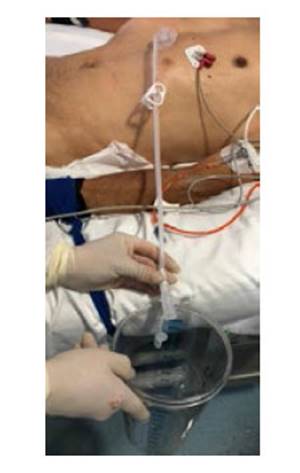
Este es un estudio prospectivo, aleatorizado, multicéntrico, realizado en instituciones de tercer y cuarto nivel de Bogotá y Cundinamarca, a partir de junio de 2020 a mayo de 2022. Antes de programar la GEP, todos los pacientes fueron valorados por el servicio de gastroenterología y fonoaudiología. Durante estas evaluaciones se verificó que cumplieran con los criterios para su realización y que no existieran contraindicaciones. Pre-procedimiento, todos tenían cuadro hemático y pruebas de coagulación. Se contraindicaba el procedimiento si el conteo de plaquetas era inferior a 50 000 por mm3 o el INR (International Normalized Ratio) >1,5 o el tiempo parcial de tromboplastina > de 50 segundos; signos de sepsis, peritonitis, carcinomatosis peritoneal o gastrectomía 15). También se contraindicaba el procedimiento si había inestabilidad hemodinámica o respiratoria 16). Los familiares de los pacientes firmaron el consentimiento informado para la ejecución del procedimiento y la participación en el presente estudio. Después del procedimiento, en la sala de recuperación los pacientes fueron aleatorizados mediante una aplicación móvil generadora de números aleatorios o RNG por una enfermera capacitada. La calculadora utiliza una serie de algoritmos matemáticos para generar los números al azar. Para este modelo se escogió como número mínimo el uno 1), número máximo el diez 10), el resultado era restringido a una respuesta. De tal forma que si el número obtenido era impar se asignaba al grupo A y si el resultado era un número par se asignaba al grupo B. En el grupo A (impar), la nutrición se inició a las 4 horas y en el Grupo B (par) a las 12 horas. Para la ejecución del procedimiento, todos los pacientes debían tener un ayuno de mínimo 8 horas. A todos se les administró profilaxis antibiótica con cefalosporina de primera generación (cefazolina 1 gramo IV) media hora antes del procedimiento; de acuerdo con la evidencia publicada al respecto 17 y cuando el paciente estaba anticoagulado, se omitió la última dosis de anticoagulantes 15). La gastrostomía se realizó por la “técnica de tracción” 18), según la técnica original descrita por Gauderer 1), con la participación de dos operadores: uno manejaba el endoscopio y el otro el sitio percutáneo del procedimiento, con el paciente en decúbito supino (Figura 1). Éste realiza la limpieza y asepsia de la pared abdominal y la cubre con campos estériles. El primer operador introduce el endoscopio en la forma usual y distiende el estómago para lograr el contacto de la pared anterior del estómago, con la pared abdominal 18). Entre ambos, identifican el sitio de transiluminación e indentación mediante el dedo aplicado externamente. Para facilitar la transiluminación, la sala de endoscopia debía estar oscura (con la luz apagada). Todos los procedimientos se realizaron bajo sedación, administrada por un anestesiólogo, utilizando propofol y remifentanil, en dosis variables, dependiendo de su criterio. Tres horas después del procedimiento, todos los pacientes fueron valorados. En ausencia de complicaciones inmediatas, se indicó al servicio tratante el inicio de la nutrición según el grupo asignado. A todos los pacientes, se les registró el perímetro abdominal, y se consideró como distensión abdominal una variación de 2 cm, luego del inicio de la nutrición. Se realizaron dos métodos clínicos para estimar el volumen gástrico residual (VGR); uno fue mediante la aspiración del contenido gástrico con jeringa, y el segundo conectando la sonda de gastrostomía a un reservorio y drenando por gravedad 19 (Figuras 2 y 3); antes se verificaba que el tope externo estuviera en la distancia registrada durante el procedimiento, para de esta forma evitar una subestimación por migración del extremo distal al duodeno. Se consideró un residuo alto cuando el drenaje obtenido era mayor o igual a 500 ml 20). El protocolo y el consentimiento informado fueron aprobados por el Comité de Ética.
Análisis estadístico
Asumiendo la probabilidad de un evento en el grupo de control de 0,6 y la probabilidad de un evento en el grupo experimental de 0,85, poder estadístico de 0,8, coeficiente alfa de 0,05, el tamaño requerido de cada grupo se estimó en 50 con la prueba Chi-cuadrado. Se realizaron análisis descriptivos de las características demográficas, intolerancia, complicaciones, mortalidad asociada a la gastrostomía endoscópica de los dos grupos de pacientes según inicio de nutrición (4 horas y 12 horas), mortalidad según indicación de la gastrostomía endoscópica de los dos grupos. Las variables cualitativas se presentan en frecuencias absolutas y relativas y las cuantitativas mediante valores mínimos y máximos, medianas y rangos intercuartílicos. Se realizaron análisis bivariados de los desenlaces según el inicio de la nutrición enteral y para ver las diferencias entre los grupos se calcularon Chi2 y Test exacto de Fisher, determinándolas como estadísticamente significativas aquellas con valores de p inferiores a 0,05. Se calcularon razones de riesgo con intervalos de confianza al 95% entre los dos grupos de pacientes de estudio.
Consideraciones éticas
El presente estudio se realizó de conformidad con los principios establecidos por la Asociación Médica Mundial en la Declaración de Helsinki (2013) y cumpliendo la normatividad nacional estipulada en la Resolución 8430 de 1993 del Ministerio de Salud de Colombia sobre la Investigación en Salud.
RESULTADOS
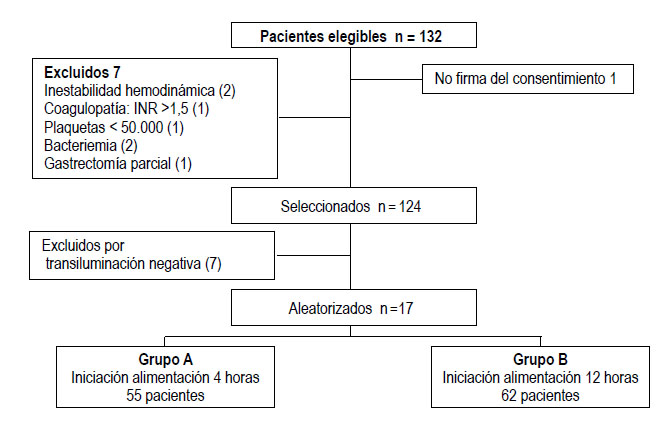
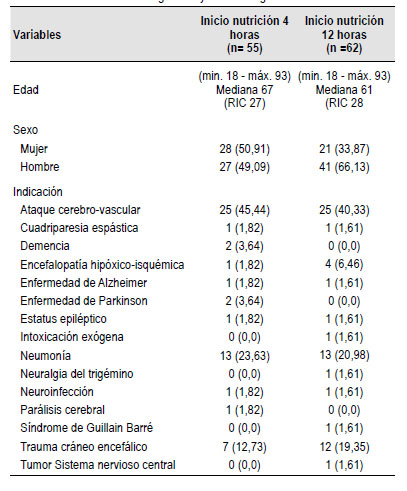
Durante el período del estudio, junio de 2020 a mayo de 2022, se realizaron 117 gastrostomías, asignando de manera aleatoria 55 pacientes en el grupo A y 62 pacientes al grupo B, figura 4. El 58% de los pacientes fueron hombres. La mediana de edad fue de 67 con rango intercuartílico (RIC: 27) años en el grupo A y de 61 (RIC: 27) años en el grupo B. La indicación más común para la colocación de la GEP fue el soporte nutricional a largo plazo. La enfermedad más frecuente de alteración de la función deglutoria fue la enfermedad cerebrovascular (43%), seguido por complicaciones de neumonía viral, COVID-19 (26%) y el trauma craneoencefálico (16%). Las características generales de los grupos evaluados se muestran en la Tabla 1.
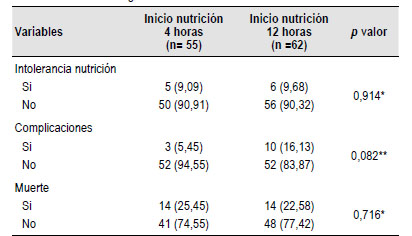
No hubo diferencias estadísticamente significativas entre los grupos evaluados respecto al porcentaje de intolerancia a la nutrición, riesgo relativo RR intolerancia nutrición = 0,93 (IC 0,30-2,90). Un total de 11 pacientes (9%), desarrollaron algún tipo de intolerancia, 4 pacientes (3%) desarrollaron un alto residuo gástrico (mayor a 500 ml), 2 pacientes diarrea (1,7%), 2 pacientes distensión abdominal (1,7%), 1 paciente vómito (0,85%), 1 paciente dolor abdominal (0,85%). No hubo diferencias en la mortalidad entre los grupos evaluados (Tabla 2), (RR) muerte = 1,12 (IC0,59-2,15). Las características comparativas de los grupos se muestran en la Tabla 2.
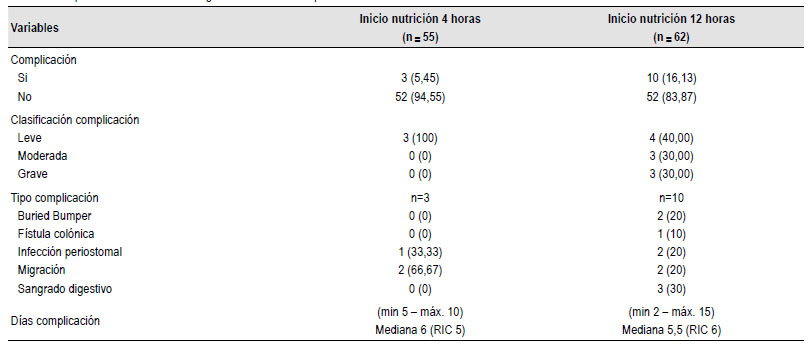
Globalmente, no hubo diferencias entre los grupos con respecto a complicaciones posoperatorias, (RR) complicaciones = 0,34 (IC 0,09 - 1,16). Hubo complicaciones en 13 pacientes, la mayoría de ellas leves (6%), la migración o retiro inadvertido de la sonda fue la más frecuente(3,4%), el sangrado se presentó en 3 pacientes (2%), se documentó infección periostomal que requirió manejo antibiótico complementario en el 2% de los pacientes, ninguno requirió el retiro de la gastrostomía. Hubo 2 casos de síndrome de “buried bumper” (1,7%) que se lograron resolver vía endoscópica. Se presentó una complicación grave, en un paciente que desarrollo una fistula colo- cutánea por lesión intestinal no advertida durante el procedimiento endoscópico. Estas complicaciones se muestran en la Tabla 3.
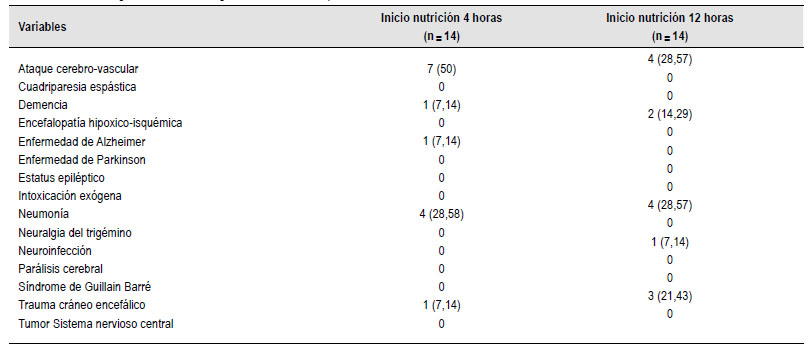
Hubo 28 muertes, que corresponden al 24% de los pacientes intervenidos, todas ellas relacionadas con descompensación de las patologías de base, y ninguna relacionada con GEP. La mediana de días al fallecimiento fue de 7 (RIC:7) en el grupo A y de 13 (RIC:14) en el grupo B. Estudios recientes han cuestionado el uso de gastrostomía endoscópica en pacientes con enfermedad cerebrovascular y demencia avanzada; decidimos realizar un análisis de mortalidad según la indicación que motivo su implementación (Tabla 4). Observamos en nuestra cohorte que los pacientes con enfermedad cerebrovascular representaron el mayor porcentaje de muertes (9,4%) seguidos por los pacientes con COVID-19 un 6,8% de las muertes. Estos desenlaces, se muestran en la Tabla 4.
DISCUSIÓN
En Colombia y en Latinoamérica, no existe consenso sobre cuál es el momento ideal para el inicio de la nutrición luego de realizar la GEP. La mayoría de las recomendaciones actuales son obsoletas y continúan siendo una adaptación de las recomendaciones de pacientes con gastrostomías quirúrgicas 21. Los estudios y metaanálisis publicados al respecto incluyen pacientes cuya antropometría difiere totalmente de la población latinoamericana 22, por ejemplo, la talla de un colombiano promedio es de 1,71 m, 8 cm. menos que un estadounidense y 10 cm. si se compara con un alemán 23); se infiere que los resultados de estas importantes investigaciones no son extrapolables a nuestra población. En Colombia no existen protocolos basados en resultados de investigaciones, sino múltiples formas de abordar el inicio de la nutrición después de una GEP. Todas esas conductas, difieren en la forma y el momento para alimentar a los pacientes, pero en general oscilan entre 12 y 24 horas después de la colocación de la GEP, siendo más frecuentemente recomendado que sea después de 24 horas. Adicionalmente, encontramos que dentro de algunas instituciones no existe concordancia al respecto, entre el servicio de gastroenterología, la unidad de cuidado intensivo o los especialistas de hospitalización general.
El presente estudio, aleatorizado multicéntrico y prospectivo, es el primero que se hace en Colombia y en Latinoamérica para determinar la seguridad de la alimentación temprana a través de GEP. Con más de 100 pacientes hospitalizados incluidos y asignados aleatoriamente a dos grupos con características basales similares, con respecto a la edad e indicaciones del procedimiento, se encontró que la iniciación de la nutrición a las 4 horas después de realizar el procedimiento es una conducta segura sin diferencias significativas con la alimentación a las 12 horas. Estos resultados son similares a otro estudio prospectivo y aleatorizado que comparó la iniciación de la nutrición a las 4 y 24 horas 24). A diferencia de este estudio, nuestra comparación fue entre 4 y 12 horas, con el fin de acortar aún más el intervalo y determinar diferencias en ese lapso más estrecho. Recientemente Wesley et al., publicaron un estudio retrospectivo con 295 pacientes en el que compararon el inicio de nutrición en tres grupos (12 vs 24 vs 48 horas) concluyendo que la alimentación por sonda de forma temprana (12 horas) después de la colocación de PEG es segura comparada con la alimentación más tardía 25). Nuestro estudio, en contraste con ese estudio internacional, fue prospectivo y aleatorizado y utilizó 4 horas como límite inferior para iniciar la alimentación con la GEP.
En un reciente meta análisis 26) en el cual se evaluaron más de 700 publicaciones y finalmente sólo incluyó cinco estudios aleatorizados, tres de Estados Unidos y dos de Alemania, que juntos sumaron 355 pacientes y cada estudio con un tamaño de muestra inferior a 85 pacientes y con un puntaje de Jadad de 2, es decir estudios de mala calidad 27), con lo cual se puede magnificar el beneficio de la intervención, concluyó que la alimentación por la GEP a las tres horas es igualmente segura que la administrada después de 24 horas. Comparado con esos estudios internacionales, nuestro trabajo tiene un mayor tamaño muestral y comparó 4 versus 12 horas. En el presente estudio, la causa más común para la GEP fue la alteración de la deglución secundaria a enfermedad cerebrovascular (45%), a diferencia de otro estudio colombiano en el cual la principal indicación fueron las enfermedades neurológicas degenerativas para realizar la PEG 28).
En el presente estudio la segunda causa más frecuente para indicar la GEP fueron complicaciones por COVID-19, lo cual se explica porque esta investigación se realizó durante esa pandemia. Después de iniciar el soporte nutricional no se encontró una mayor intolerancia al iniciar de forma temprana, RR= 0,93 (IC 0,30-2,90), presentándose en bajo porcentaje distensión abdominal, un residuo gástrico alto cuantificado clínicamente por aspiración con jeringa o drenaje, dolor, vómito, o diarrea en los dos grupos. Para el caso de complicaciones, se distribuyeron en igual porcentaje, (RR) = 0,34 (IC 0,09-1,16), la mayoría fueron leves, siendo más frecuente la migración o retiro inadvertido de la sonda, por lo cual de manera inmediata se iniciaron talleres de educación a los cuidadores, enfermeras y familiares con respecto al manejo y cuidados de la sonda. Un paciente tuvo fistula colo-cutánea, la cual es una complicación infrecuente pero descrita en la literatura 29), la cual se produce por la introducción inadvertida del trocar en el colon interpuesto entre la pared abdominal y la cara anterior del estómago. Esta complicación fue una sorpresa ya que durante la ejecución de la GEP se siguió estrictamente la técnica descrita (1,18,28). Esta complicación puede pasar desapercibida y se debe sospechar como en nuestro caso, por la aparición de diarrea al administrar la nutrición o cuando hay salida de materia fecal por la sonda 30). No obstante el correcto seguimiento de la técnica, se debe insistir en cada detalle durante la ejecución de la GEP y contar con una adecuada transiluminación de la pared abdominal durante su realización y favorecer la evaluación de un “trayecto seguro” mediante la succión continua durante la punción y si el vacío se pierde antes de la salida de la aguja a la cavidad gástrica, esto supone la interposición de una víscera 31). En este caso se realizó un tratamiento conservador, retirando la sonda para conseguir el cierre del trayecto fistuloso. En nuestra investigación, la alimentación no se asoció a mayor riesgo de muerte durante los primeros 30 días, (RR) muerte = 1,12 (IC 0,59 - 2,15).
Hubo 28 fallecimientos distribuidos de forma similar en ambos grupos de investigación y todos relacionados con la evolución de sus enfermedades previas. Coincidimos con múltiples investigaciones internacionales en que la enfermedad cerebrovascular representó el mayor porcentaje de muertes (9,4%) incluso superando a los pacientes con COVID-19 grave, que supondría un pronóstico clínico más ominoso 32). Esa mayor mortalidad en pacientes con enfermedad cerebrovascular sugiere que en ese grupo de pacientes se debe evaluar cuidadosamente de manera individual, la indicación y el pronóstico de cada paciente. Recientemente un estudio inglés, con una cohorte de pacientes de 2007 a 2018 con enfermedad cerebrovascular, encontró que la GEP se asoció con una reducción de la sobrevida 33). Este estudio tiene algunas fortalezas que incluye un adecuado tamaño demuestra, siendo uno de los pocos estudios prospectivos y aleatorizados publicado hasta el momento. Consideramos que sus resultados pueden tener impacto en la práctica diaria y modificar la iniciación de la alimentación a través de GEP. También tiene limitaciones, no estimamos el efecto de las comorbilidades en cada uno de los pacientes, y medicamentos que pueden haber predispuesto un trastorno del vaciamiento gástrico.
En conclusión, en el presente trabajo se encontró que la alimentación por la GEP a las cuatro horas es segura y no tiene diferencias en cuanto a complicaciones comparada con la administración a las 12 horas. Por lo anterior consideramos que, con base en esos resultados, la nutrición se debería iniciar tempranamente evitando gastos innecesarios por hospitalización y el paciente pos- procedimiento podría permanecer no más de 4 horas, haciendo de la GEP un procedimiento ambulatorio. Como este trabajo solo incluyó pacientes a quienes se les hizo una GEP, sus resultados no se pueden extrapolar a pacientes sometidos otro tipo de gastrostomías.