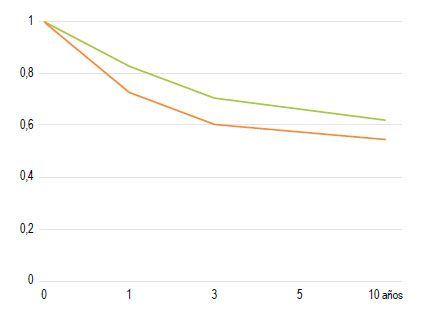INTRODUCCIÓN
El cáncer colorrectal (CCR) es uno de los tumores malignos más frecuentes del mundo y su incidencia y mortalidad han permanecido elevadas en los recientes decenios, lo que supone una grave amenaza para la salud pública 1. La incidencia del CCR está aumentando en los países con menor desarrollo, donde los recursos para la colonoscopia son escasos, mientras que las tasas de incidencia y prevalencia parecen estabilizarse en los países desarrollados 2. En Colombia el CCR es el tercero en incidencia y mortalidad, después del de mama y pulmón 3.
Está demostrado que la colonoscopia es una herramienta eficaz para detectar y eliminar las lesiones preneoplásicas y neoplásicas tempranas en el colon y el recto. Además, la polipectomía puede reducir casi un 30% la incidencia de la mortalidad global por CCR (cáncer de colon: 29-37%, cáncer de recto: 27%, respectivamente) 4. Sin embargo, algunos cánceres se detectan durante el intervalo entre la colonoscopia precedente informada como normal y el posterior examen de seguimiento. Por lo tanto, este subgrupo de CCR puede denominarse CCR de intervalo, que algunos expertos definen como el CCR que se desarrolla desde los 3 a 5 años de una colonoscopia inicial negativa para neoplasia 5, el término implica un cáncer en el contexto de una tamización. El CCR post colonoscopia (CCRP) se refiere más a una medida de calidad en la colonoscopia.
La prevalencia del CCRP parece ser inferior al 10% 6). Un metaanálisis informó una prevalencia de CCRP que oscilaba entre el 1,8 y el 9% de todos los cánceres colorrectales, con una prevalencia en el análisis conjunto del 3,7% o el 4,3%, dependiendo sí el CCRP se definía como diagnosticado entre 6 y 36 meses o entre 6 y 60 meses después de la colonoscopia 7). Estas cambiantes cifras se explican por la falta de una precisa definición del CCRP, a los diferentes métodos de cálculo de la tasa, así como a los diversos criterios de inclusión/exclusión en los estudios 8). La garantía de calidad para la colonoscopia acoge las directrices de diferentes grupos de trabajo combinados quienes han aconsejado que las unidades de endoscopia deberían tener como objetivo una tasa de CCRP <5% y que todos los CCRP diagnosticados en los 3 años siguientes a una colonoscopia normal deben notificarse como un evento adverso. Cada unidad endoscópica debe tener una política para registrar los datos de CCRP 9).
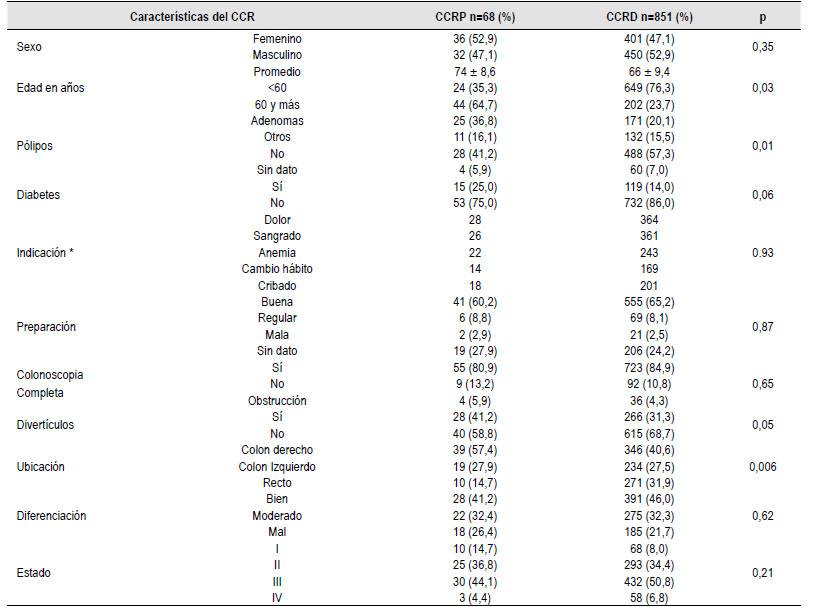
Hoy en día, los principales problemas existentes en términos del CCRP son: no ha habido hasta ahora ningún procedimiento eficaz para prevenir y supervisar el CCRP, así como los médicos no dan suficiente importancia a buscar y registrar el CCRP 10,11). Además, hay evidencias de que los médicos no se ciñen a las directrices recomendadas para la colonoscopia de vigilancia debido a la falta de conocimiento y a la ignorancia de estas 12,13), lo que dificulta la detección oportuna del CCR. Los factores de los pacientes que han demostrado previamente estar asociados al CCRP incluyen la edad avanzada, el sexo femenino, los antecedentes de pólipos o adenomas grandes, la presencia de enfermedad diverticular y un mayor número de comorbilidades destacándose recientemente la diabetes mellitus 6,14). Los factores de riesgo endoscópico incluyen procedimientos realizados por clínicos sin experiencia o no gastroenterólogos, la mala preparación y los procedimientos incompletos 15,16). Varios estudios han informado de una predilección por el lado derecho del CCRP, lo que puede reflejar dificultades técnicas en la evaluación del colon derecho en comparación con el izquierdo, o quizás una diferencia en la biología del tumor 17). De hecho, un estudio reciente investigó el perfil molecular del CCRP, demostrando tasas más altas de inestabilidad de microsatélites en comparación con los cánceres detectados de novo, lo que apunta a una diferencia en la biología del tumor 18. Además, los adenomas serrados, que corresponden aproximadamente al 25% de los pólipos serrados y hasta el 10% de los pólipos del colon, se ubican más frecuentemente en el colon derecho, lo que se podría traducir una importante proporción de los cánceres de colon postcolonoscopia 19).
La Organización Mundial de Endoscopia (OME) propuso un enfoque para investigar y categorizar los CCRP detectados dentro de los 3 y 4 años de una colonoscopia normal. El objetivo era identificar los casos de CCRP y su etiología, acuñar un sistema de categorización del CCRP, cuantificar la proporción de CCRP evitables y proponer una tasa objetiva para el cálculo de los CCRP detectados en los 3 años siguientes a una colonoscopia normal 20).
A continuación, evaluamos una serie de pacientes intervenidos o no por cáncer colorrectal a quienes se les encontró colonoscopias que descartaba neoplasia en los 6 a 36 meses previos a la colonoscopia que documentó la presencia del CCR, describimos las características demográficas, clínicas, colonoscópicas y las características del tumor y la sobrevida y los comparamos con los pacientes en los que se documentó la neoplasia en la colonoscopia inicial, además aplicamos en los pacientes con CCRP las recomendaciones de la OME para calcular su tasa y definir la potencial etiología del CCRP.
MATERIALES Y MÉTODOS
El presente es un estudio ambispectivo que se llevó a cabo en el Instituto de Cancerología de la Clínica Las Américas Auna y la Clínica El Rosario en la ciudad de Medellín, y se recopiló la información a partir de los pacientes que con diagnóstico histológico de CCR se remitieron para manejo de orden curativo o paliativo. Se recuperaron retrospectivamente los datos de las colonoscopias previas en la que se documentó el cáncer de colon en una cohorte de seguimiento prospectivo, y las colonoscopias precedentes en los 6 meses a 3 años, en las que NO se observó CCR de los pacientes remitidos a la consulta de las instituciones citadas.
Definición de términos
El CCR se definió como un adenocarcinoma entre el ciego y la línea dentada. El CCR detectado (CCRD) es el cáncer encontrado en la primera colonoscopia o bien tras más de tres años de una colonoscopia previa. El CCRP se definió como el CCR encontrado entre 6 y 36 meses después de una colonoscopia índice en la que: no se detectó ninguna neoplasia, o bien se extirpó la neoplasia detectada. En caso de múltiples colonoscopias anteriores, sólo se consideró la más reciente a la del diagnóstico de cáncer.
La indicación de la colonoscopia se clasificó en una de las cinco categorías siguientes o sus combinaciones: anemia por falta de hierro, sangrado digestivo, dolor abdominal, cambio de los hábitos intestinales o tamización.
La edad, el sexo, comorbilidades como la diabetes, presencia de divertículos, antecedente de pólipos resecados o no, la indicación de la colonoscopia, la calidad de la preparación, la ubicación del cáncer, y el estadio del cáncer colorrectal se compararon y analizaron en los grupos de CCRP y CCRD.
La localización de la enfermedad se dividió entre el colon proximal (del ciego a la flexura esplénica), el colon distal (del colon descendente al sigmoide) y el recto.
Criterios de inclusión y exclusión
No se incluyeron los pacientes con antecedentes de cirugías previas ni las personas diagnosticadas de CCR en una institución externa y trasladadas para su manejo a las instituciones del estudio. Se excluyeron los pacientes cuyos cánceres colorrectales fueron diagnosticados por imágenes (4 pacientes) y los pacientes con antecedentes de síndrome de poliposis adenomatosa familiar que invariablemente lo llevará a CCR (3 pacientes), pacientes con enfermedad inflamatoria intestinal (2 pacientes con Crohn y 9 pacientes con CU).
Aplicación de la Metodología de la Organización Mundial de Endoscopia (OME) para CCRP
El consenso de la OME recomienda que los servicios endoscópicos revisen sus casos de CCRP “para determinar la explicación más plausible para el CCRP”. La OME recomendó dos intervalos diferentes de CCRP. Un intervalo de 6 a 48 meses para evaluar la calidad en la colonoscopia sobre la base de que la “explicación más plausible” para los cánceres que aparecen después de 48 meses es un “probable nuevo cáncer”. Se propuso un intervalo más corto, de 6 a 36 meses (CCRP-3y), para la garantía de calidad o la evaluación comparativa. La OME reconoció que sus recomendaciones debían ser puestas a prueba.
Análisis Estadístico
Los datos demográficos y las características clínicas de la población del estudio se resumieron utilizando la media y la desviación estándar para la variable continua (edad) y frecuencias para las variables categóricas (sexo, raza, antecedentes familiares, localización del cáncer y estadio de la enfermedad). Para las variables continuas se realizó la prueba t, y para las categóricas la prueba de chi-cuadrado. Se utilizó un análisis de regresión logística para determinar el riesgo comparativo de los factores que muestran significancia.
El análisis estadístico se realizó con SPSS versión 22.0 (desarrollado por SPSS Inc., Chicago, Illinois, EUA) se utilizó un nivel de confianza del 95%, y el nivel de significancia se fijó en p <0,05.
RESULTADOS
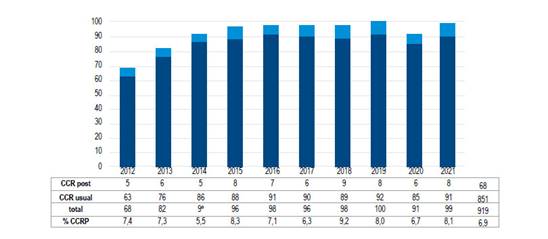
Un total de 68 pacientes con CCRP se encontraron en los 10 años del período de estudio en que se manejaron 919 pacientes con cáncer colorrectal. La tasa de CCRP se calculó con base en la formula sugerida por la OME; el número de CCRP dividido por el total del número de CCRP más el número de cánceres detectados, expresado en porcentaje 20). Estos cánceres post colonoscopia representaron el 6,9% (IC del 95%, 4,4%-7,6%) de los cánceres colorrectales manejados. Los cánceres de intervalo o post colonoscopia se diagnosticaron en promedio 22,8 meses después de que los pacientes se sometieran a la colonoscopia índice. (Figura 1).
Aspectos demográficos
De los 911 pacientes evaluados, la edad media en el momento del diagnóstico de CCR era de 71 años (28-88 años). Se distribuyeron en 482 hombres (52%) y 437 mujeres (48%). Los pacientes con cánceres post colonoscopia eran en promedio de mayor edad (8 años mayores en promedio) y no hubo una propensión por el género. En la Tabla 1 se recogen las diferentes características de los dos grupos de estudio.
Antecedentes y aspectos clínicos
El número total de colonoscopias previas a la colonoscopia que determinó la presencia del CCR (colonoscopia índice) fue de 1638; 390 pacientes se realizaron colonoscopia de primera vez, en 399 pacientes se realizaron dos colonoscopias, en 87 casos 3 colonoscopias, en 32 pacientes 4 colonoscopias, y, 5 y 6 colonoscopias en 5 y 6 pacientes respectivamente.
Se encontró más frecuentemente el antecedente de resección de pólipos adenomatosos en el grupo con CCRP (36,8% versus 20,1%). Se tuvo en cuenta en los antecedentes la presencia de diabetes, encontrándose una tendencia a presentar más diabetes en pacientes con CCRP (25%) que en los diagnosticados de novo (14%).
La indicación de la colonoscopia podía ser multicausal y lo más frecuente era por el dolor abdominal (28%), seguido por el sangrado anorrectal (26%), estudio de anemia (22%), cambios en el hábito intestinal (14%) o por razones de tamización o cribado (18%).
Aspectos colonoscópicos
En la preparación para la colonoscopia, se encontró reportada la calidad de esta en solo – de los informes, tanto para el CCRP como el CCRD. Se alcanzó el ciego para ambas formas de cáncer en el 80% de las veces sin diferencias entre ambos grupos. Los divertículos fueron más frecuentemente encontrado sen el CCRP (41,2%) que en CCRD (31,3%).
Ubicación de los tumores
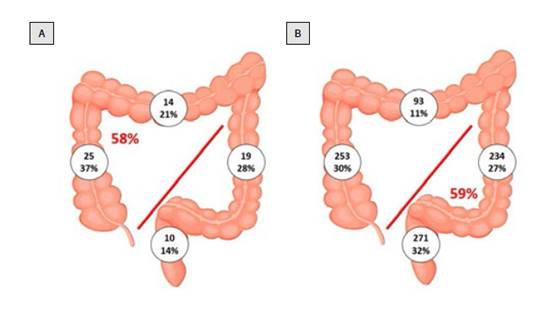
Se evidenció en el estudio una diferencia significativa (p=0,006) de los tumores inadvertidos en el colon derecho 39 (57,4%) que en el colon izquierdo 19 (27,9%) y solo 10 (14%) en recto, mientras que en los tumores diagnosticados de novo la distribución de las neoplasias muestra el patrón esperado, con predominio de lesiones en colon izquierdo y recto 505 (59%), y menos frecuentes las lesiones en colon derecho 346 (41%). (Figura 2)
Grado de diferenciación
Hubo más tumores indiferenciados en el grupo de CCRP (26,4% versus 21,7%) pero no se encontró una diferencia significativa.
Estado de los tumores
No se demostró una diferencia significativa en los estados tumorales del CCRP y el CCRD, predominando en el CCRP las lesiones más tempranas (Estados I y II en 51,5%) mientras en las neoplasias con diagnóstico de novo los estados III y IV fueron los más frecuentes (57,6%).
Análisis univariado de factores de riesgo de CCRP
La edad promedio del grupo de CCRP y el grupo de cáncer usual fue de 74 y 66 años, respectivamente, siendo significativamente mayor el grupo de CCRP y no hubo diferencia entre los dos grupos con respecto al género. En el grupo de CCRP, el cáncer colorrectal derecho fue significativamente mayor y representó el 58% mientras en el grupo de cáncer con diagnóstico de novo, el cáncer colorrectal derecho representó el 41%. En ambos grupos, el ciego se alcanzó en una similar proporción durante la colonoscopia.
Análisis multivariado de los factores de riesgo de CCRP
Se observó que los mayores de 60 años tenían un riesgo estadísticamente significativamente mayor de CCRP que los menores de 60 (razón de posibilidades [OR]) 2,14, 95% intervalo de confianza [IC] 1,14-4,66, p = 0,025). Y se encontró que el cáncer colorrectal derecho tenía un riesgo estadísticamente significativamente mayor de CCRP que el cáncer colorrectal izquierdo (OR 2,42; IC del 95%: 1,21-5,46; p = 0,015). Además, cuando se corrigieron y analizaron estos dos factores, se confirmó que ambos factores, como la edad y la ubicación del cáncer colorrectal, eran factores de riesgo independientes para el CCRP (edad: OR 2,36; IC del 95%: 1,23-5,311; p=0,016); Ubicación: OR 2,766, IC del 95% 1,27-6,14, p = 0,009).
En el análisis multivariado, el CCRP fue un factor predictivo significativo de mortalidad en comparación con el CCRD (aHR: 1,33; 95% CI: 1,2-1,5). El cáncer en colon proximal también fue un factor predictivo significativo de la mortalidad específica por cáncer en comparación con el cáncer distal (aHR: 1,79; IC del 95%: 1,64-1,96).
Análisis causal de CCR según la propuesta de la Organización Mundial de Endoscopia (OME)
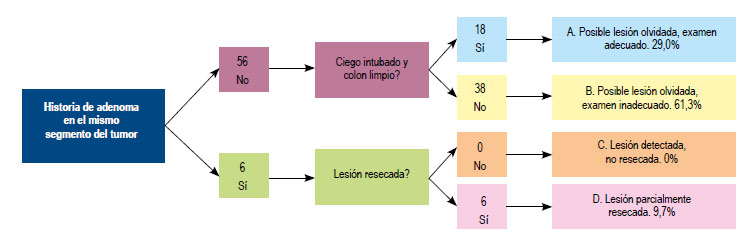
Seis pacientes con CCRP no pudieron ser clasificados, porque no se pudo localizar el informe/fotografías originales, así que el análisis se hizo con 62 pacientes. Evaluando los 62 pacientes con CCRP, 29% CCRP se clasificaron como posible lesión omitida, con colonoscopia previa adecuada (A); 61,3% CCRP se clasificaron como posible lesión omitida, con colonoscopia previa inadecuada (B); no hubo lesiones detectadas no resecadas (C); y 9,7% de CCRP se clasificaron como probable resección incompleta de lesión previamente identificada (D) (Figura 3).
Análisis de sobrevida
El seguimiento de esta cohorte fue de 10 años y 561 (61%) de todos los pacientes con CCR murieron, en 304 (33,1%) la muerte estaba relacionada con el cáncer. La probabilidad de supervivencia específica del cáncer a 1, 3, 5 y 10 años para toda la cohorte completa fue del 83,2% (81,5-82,9%), 70,6% (69,8-71,6%), 66,1% (65,1-67,1%) y 63,4% (62,4- 64,4%), respectivamente.
Es crucial utilizar un análisis de supervivencia condicional para evitar el sesgo al requerir que los pacientes con CCRP sobrevivan al menos 6 meses y hasta 36 meses para estar disponibles para el análisis. Esto aumenta artificialmente los tiempos de supervivencia de los pacientes con CCRP y puede ser la razón por la cual se informan mejores o iguales tiempos de supervivencia en otros estudios.
La Figura 4 muestra que el CCRP tuvo una peor supervivencia específica por cáncer que el CCRD (log-rank p < 0,001). La probabilidad de supervivencia específica del cáncer a 1, 3, 5 y 10 años para CCRP fue del 73,4% (IC del 95%: 72,2-74,7%), 61% (IC del 95%: 56,3-65,4%), 58% (IC del 95%: 54-62%) y 55,2% (IC del 95%: 51-60%), respectivamente. La probabilidad de supervivencia específica del cáncer a 1, 3, 5 y 10 años para el CCRD fue del 83,0% (IC 95%: 82,3-85%), 71,5% (IC 95%: 70,3-72,5%), 67% (IC 95%: 65,6-67,6%) y 63,0% (IC 95%: 62,0-65,3%).
DISCUSIÓN
Recientemente, evaluamos en nuestro medio las características del cáncer gástrico post endoscopia 21), sin embargo, a la fecha no conocemos ningún estudio en el país que determine la incidencia y compare las características del CCRP con el CCR con un diagnóstico por colonoscopia de primera intención. El presente estudio analiza las diferencias clínicas, colonoscópicas y la sobrevida del CCRP y se compara con el CCRD. Además, con base en la propuesta de la OME se realiza una aproximación a las potenciales causas del CCRP.
El CCRP puede representar una oportunidad perdida para un diagnóstico más temprano y presumiblemente un mejor pronóstico para el paciente. Por lo tanto, el CCRP se ha convertido en un importante marcador de calidad de la colonoscopia, siendo quizás el más importante 22).
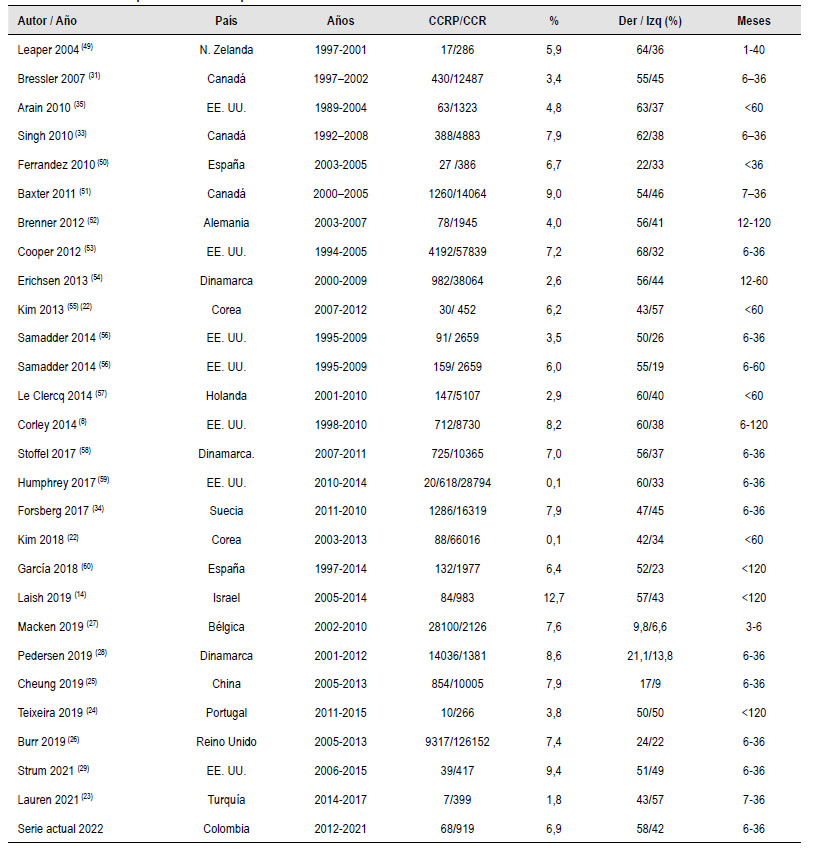
La tasa de CCRP se calculó con base en los lineamientos de la OME, y nuestra tasa de 6,9% es mayor a la coreana del 0,1% 23), la turca del 1,8% 24), o la portuguesa del 3,8% 25), pero comparable al 7,9% en Suecia 16), 7,9% de Hong Kong 26), 7,4% en Reino Unido (27) y 7,6% en Bélgica 28), pero inferior al 8,6% de Dinamarca 29), el 9,4% de EUA 30 y el 12,8% de Israel 14 (Ver Anexo).
Nuestro hallazgo de un mayor número de CCRP en el colon derecho está en consonancia con estudios anteriores 31-35). Es probable que esto se relacione con procedimientos incompletos o una mala preparación, ya que el colon derecho es más difícil de limpiar con los agentes orales, los puntos de referencia son menos claros y es más difícil técnicamente alcanzar el colon proximal y mantener una posición adecuada del colonoscopio. Además, cada vez hay más evidencia de que los pólipos y cánceres en el colon derecho son una entidad diferente. El CCRP se asocia a la inestabilidad de los microsatélites y el fenotipo metilador de islas CpG (CIMP) 36). Los adenomas serrados sésiles son más frecuentes en el colon derecho e igualmente son más difíciles de detectar a la colonoscopia por su apariencia plana 37).
También encontramos una asociación entre el CCRP y un diagnóstico previo de diverticulosis, lo que coincide con estudios anteriores 31,32,35). En general, se sabe que la enfermedad diverticular dificulta la realización de una colonoscopia, con un aumento del dolor del paciente, una alteración de la mucosa de las zonas afectadas y el riesgo de confundir el tejido neoplásico con una zona de inflamación diverticular 38).
Un estudio belga reciente ha ratificado el concepto que los CCRP son prevenibles 28), demostrando una diferencia de más de 10 veces en las tasas de CCRP entre los colonoscopistas con bajos números de colonoscopias anuales, baja detección y resección de pólipos, siendo más propensos a presentar CCRP. El estudio identificó varios factores relacionados con el paciente y con el procedimiento que aumentan la probabilidad de CCRP, los cuales coinciden en su mayoría con otros estudios, con la excepción del hallazgo de que la sedación profunda se asocia con una menor tasa de CCRP. Estas asociaciones consistentes indican que los colonoscopistas deben estar especialmente atentos cuando realicen colonoscopias a pacientes de alto riesgo (enfermedad inflamatoria intestinal, síndromes polipósicos adenomatosos) y cuando inspeccionen el colon derecho.
Cuando la visualización no es óptima, o cuando el procedimiento no ha logrado una intubación cecal profunda, debe haber una decisión definitiva y documentada de repetir el estudio, realizar otro procedimiento o no seguir investigando. Esta última opción puede ser totalmente adecuada teniendo en cuenta las preferencias del paciente y las comorbilidades relevantes.
Muchos autores han atribuido las grandes variaciones en las tasas de CCRP a diversos factores, como las diferencias en el diseño del estudio (retrospectivo frente a prospectivo), las diferentes definiciones y los métodos utilizados para calcular la tasa de CCRP, los diferentes conjuntos de datos utilizados (datos administrativos frente a datos clínicos), las diferencias en la población estudiada (indicaciones de cribado frente a las colonoscopias diagnósticas) y las diferencias en la experiencia y las especialidades de los endoscopistas 27,31).
Estos hallazgos dan lugar a diversos comentarios sobre la calidad de la colonoscopia, su correlación con el CCRP y la consiguiente implicación de las políticas de tamización y seguimiento. En primer lugar, actualmente está bien establecido que la tasa de detección de adenomas (TDA) es el principal indicador de calidad de la colonoscopia, dada la asociación inversa entre este parámetro y la tasa de cáncer de intervalo en el cribado del CCR 39,40). Se ha demostrado recientemente que el establecimiento de un programa de formación específico dirigido a los responsables de las unidades de endoscopia conlleva una mejora de la calidad de la prueba en todas ellas, así como que el aumento de la TDA se asocia a una mejora de los resultados del cribado en términos de menor incidencia de CCRP 41). Todo ello nos permite concluir la necesidad de monitorizar de forma regular y sistemática determinados parámetros de calidad relacionados con la colonoscopia, especialmente la TDA, así como establecer mecanismos de acreditación y reacreditación de las unidades de endoscopia y sus profesionales (42), una práctica bien arraigada en los países anglosajones, pero con escasa o nula implementación en nuestros servicios de salud.
En segundo lugar, es evidente que, directa o indirectamente, la tasa de CCRP determina las estrategias de vigilancia. A falta de una fuerte evidencia científica que establezca la regularidad en forma precisa con la que deban realizarse las exploraciones colonoscópicas en los pacientes que han sido diagnosticados por una neoplasia colorrectal, ya sea CCR, adenoma o lesión serrada, el intervalo entre colonoscopias viene determinado por la probabilidad de desarrollar lesiones metacrónicas tras la resección de la lesión inicial. Esta probabilidad se ha establecido a partir de estudios observacionales, que pretenden estimar el riesgo de desarrollar nuevas lesiones en función de las características del tumor inicial 43). Dado el carácter retrospectivo de los estudios, es difícil determinar fehacientemente la calidad de la colonoscopia (especialmente la proporción de exámenes mal preparados y exámenes incompletos) y del endoscopista, por lo que probablemente se sobreestima el riesgo intrínseco de las lesiones detectadas y, en consecuencia, se recomiendan intervalos más cortos de lo necesario entre colonoscopias. Esta circunstancia refuerza la importancia de reevaluar el riesgo asociado a las neoplasias colorrectales incorporando la calidad de la colonoscopia como cofactor en el análisis y, sobre todo, la relevancia de los estudios aleatorios actualmente en curso 44).
Por último, es obvio que a pesar de la implementación de programas con mejoras de la calidad en la colonoscopia 45 y de que hay más evidencia científica de los riesgos inherentes en las diferentes lesiones pre o neoplásicas, el desarrollo del CCRP nunca podrá evitarse totalmente. Por lo tanto, una tercera línea de actuación debe ir encaminada a establecer nuevos enfoques para identificar la presencia de lesiones residuales tras el tratamiento endoscópico y/o la detección precoz de lesiones metacrónicas. Mientras que lo primero posiblemente se consiga con la mejoría tecnológica de la calidad de las imágenes, lo segundo podría lograrse con el uso de biomarcadores en suero, plasma, heces o tejidos, derivados de las alteraciones moleculares propias del tumor y detectables en los correspondientes fluidos corporales 46). La incorporación de estos marcadores biológicos permitiría disminuir el número de colonoscopias y, en consecuencia, la probabilidad de los efectos secundarios inherentes a cualquier procedimiento invasivo.
Este estudio tiene algunas limitaciones. En primer lugar, se trata de un estudio centrado en dos instituciones y con un tamaño de muestra reducido. En segundo lugar, aunque hemos utilizado nuestra base de datos de cáncer colorrectal recopilada de forma prospectiva, este estudio tiene un componente retrospectivo con la suposición de una fuente de entrada de datos fiable y precisa durante todo el período de estudio. Siempre existe la posibilidad de que se produzcan sesgos y errores en la introducción de datos con esta suposición. Aunque no hemos tenido en cuenta la experiencia individual específica del endoscopista y las cifras de la tasa de detección de adenomas, todos los endoscopistas han tenido al menos 3 años de experiencia como colonoscopistas independientes. Los endoscopistas están obligados a seguir manteniendo este nivel de habilidades y ser capaces de demostrarlo a través de una evaluación regular, de allí que cobra valor la recertificación profesional.
Hacia el futuro se espera la inteligencia artificial sea capaz de proporcionar un rendimiento diagnóstico de alto nivel, independientemente del nivel de habilidad del endoscopista 47. Igualmente se esperan datos sobre el papel de la cápsula colonoscópica y su impacto en el diagnóstico certero del CCR 48,49.
Igualmente, con la expectativa de tener estudios más robustos en números y con una óptima calidad metodológica, los resultados aquí aportados pretenden contribuir a concienciar a todos los profesionales implicados sobre la relevancia de este problema y el contar con una tasa de prevalencia del CCRP local (6,9%), supone un avance para implementar las medidas para la solución del problema.
En conclusión, la tasa corregida de CCRP en nuestra cohorte fue del 6,9%, la cual es similar a las tasas comunicadas en la literatura. Se observó una relación significativa del CCRP con la mayor edad, antecedente de adenomas en colon, enfermedad diverticular y la ubicación en colon derecho, y una tendencia a relacionarse con la diverticulosis y la diabetes mellitus. De acuerdo con lo propuesto por la OME las causas del CCRP son lesiones pasadas por alto en 90%, en casi 2/3 por un examen inadecuado y en 10% por resecciones incompletas de adenomas. El CCRP afecta negativamente la sobrevida de los pacientes.