INTRODUCCIÓN
La lesión hepática inducida por fármacos (LHIF) constituye un evento clínico poco habitual que puede tener diferentes grados de severidad pudiendo llevar al trasplante hepático e incluso la muerte; siendo la toxicidad por paracetamol la principal causa de insuficiencia hepática aguda en los Estados Unidos 1.
La tamsulosina y la dutasterida son medicamentos comúnmente usados como monoterapia o combinados en el tratamiento de la hiperplasia benigna de próstata (HBP), cuyo mecanismo de acción es bloquear los receptores alfa1-adrenérgicos e inhibir la 5-alfa reductasa respectivamente. Estos fármacos se caracterizan por su buen perfil de seguridad. Se han reportado casos de hepatotoxicidad asociados al uso de tamsulosina; sin embargo, no existen reportes de hepatotoxicidad por el uso de dutasterida o el uso combinado de tamsulosina y dutasterida.
REPORTE DE CASO
Se presenta el caso de un varón de 64 años, con diagnóstico de hiperplasia benigna de próstata, por la cual recibe tratamiento con tamsulosina 0,4mg/dutasterida 0,5 mg, el cual inició 4 meses antes del episodio actual. Tiene antecedente de hígado graso no alcohólico, síndrome metabólico e hipertensión arterial con medicación habitual: losartan y bisoprolol, los cuales viene recibiendo desde hace 2 años. Refiere algunos años previos al episodio actual haber recibido tratamiento con tamsulosina y dutasterida en distintos periodos y de manera individual y por un período corto, además de levofloxacino 4 meses antes del ingreso por 3 semanas. Niega historia de consumo de alcohol y sustancias herbales, procedimientos quirúrgicos y transfusiones.
El paciente acude con tiempo de enfermedad de 4 días, caracterizado por dolor abdominal de moderada intensidad a nivel de hipocondrio derecho, asociado a náusea, astenia, con desarrollo posterior de ictericia. Examen físico: Ictericia de piel y escleras. Dolor a la palpación a nivel de hipocondrio derecho. No visceromegalia.
En la analítica se evidenció hiperbilirrubinemia directa con transaminasemia (>5 veces al límite superior normal) y elevación de GGTP (TGO:139UI/L, TGP:330 UI/L, GGTP:661 UI/L). Ecografía abdominal con hallazgo de esteatosis hepática. Serologías virales y autoinmunes con resultados negativos, incluyendo IgM VHA, AgsVHB, Anticore total VHB, anti-VHC, IgM VHE, IgM para Citomegalovirus, IgM para virus de Epstein Barr, anticuerpos antinucleares, anti músculo liso y antimitocondriales. Ecografía abdominal sin evidencia de cálculos biliares, así como colangioresonancia donde indican vesícula biliar sin presencia de lito y vía biliar sin alteraciones.
Al momento de la primera evaluación se decide suspender el uso de tamsulosina/dutasterida, posterior a lo cual se evidencia mejoría clínica y laboratorial con disminución de los niveles de transaminasas en más del 50% del valor basal en la primera semana.
Ante la presencia de estudios de etiología negativos se sospecha de probable hepatotoxicidad por tamsulosina/dutasterida, se evalúa las escalas de causalidad CIOMS-RUCAM: 6 puntos (Probable) y Naranjo: 4 puntos (Posible).
En la Tabla 1 se muestran los valores de la hepatograma previo al inicio del tratamiento con tamsulosina/dutasterida; en la evaluación inicial del paciente y la posterior evolución al suspender el fármaco.
Tabla 1 Valores de la hepatograma antes y después del inicio del tratamiento con tamsulosina/dutasterida y posterior a la suspensión del fármaco.
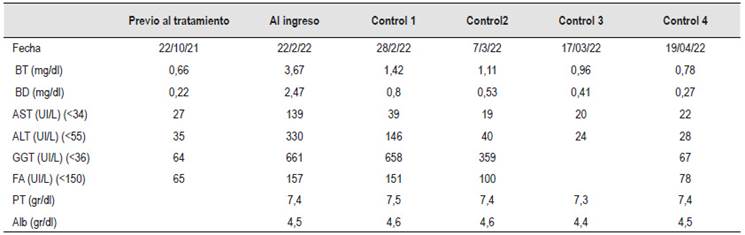
ALT: Alanino aminotransferasa; AST: Aspartato aminotransferasa; BT: Bilirrubina total; BD: Bilirrubina directa; FA: Fosfatasa alcalina; GGTP: gammaglutamiltranspeptidasa; PT: Proteínas totales; Alb: Albumina
DISCUSIÓN
La lesión hepática inducida por fármacos (LHIF) constituye un reto diagnostico debido a su naturaleza impredecible de presentación y la capacidad de simular todas las formas de enfermedad hepática aguda y crónica 1.
En países occidentales el paracetamol es la principal causa de LHIF. En los Estados Unidos se ha reportado una incidencia anual de LHIF de 3/100 000 habitantes, mientras que en la población europea se ha descrito una incidencia que oscila entre 2,3 y 13,9/100 000 habitantes 1.
En América se creó el LATINDILIN con el fin de identificar y caracterizar los casos de LHIF en esta región. Los grupos farmacológicos reportados con mayor frecuencia fueron los antibióticos (32%) y los musculoesqueléticos (14%). La amoxicilina-clavulanato y la nitrofurantoina, constituyen los antibióticos con mayor número de casos reportados de hepatotoxicidad 2. Dicho reporte se correlaciona con lo publicado en los Estados Unidos, donde indican que los antimicrobianos son responsables de la mayor cantidad de injuria hepática 1.
Tradicionalmente la LHIF se clasifica como intrínseca (directa) e idiosincrática. La primera es predecible, dosis dependiente y presenta un periodo de latencia corto, mientras que la segunda tiene un periodo de latencia variable de días a semanas y no está relacionado con la dosis del fármaco. Se han descrito factores de riesgo que pueden aumentar la predisposición a desarrollar un DILI los cuales pueden estar asociados al individuo como la edad, el género, consumo de alcohol y lesiones hepáticas de base; y factores asociados al fármaco como la dosis, el metabolismo del medicamento, la lipofilicidad, uso de medicación concomitante, entro otros 1-3.
La presentación clínica de la LHIF es muy variable; puede ir desde la hipertransaminasemia asintomática hasta la falla hepática, por lo que es importante evaluar la toxicidad hepática teniendo en cuenta exposiciones previas al fármaco, tiempo de consumo del fármaco, periodo de latencia y antecedente de enfermedad hepática, a fin de descartar otro diagnostico alterno o confusor 4.
Se han descrito patrones de daño hepático: hepatocelular, colestásico o mixto. Se evalúan mediante la estimación del valor R el cual se expresa como la relación entre los valores séricos de aspartato aminotransferasa (TGP) y fosfatasa alcalina (FA), ambos expresados como múltiplos del límite superior normal (LSN), obtenidos al momento de la evaluación inicial. Una relación R >5, indica daño hepatocelular, <2 indica daño colestásico y 2-5 indica daño mixto, siendo el primero el patrón de daño más frecuente con un 52%-75% de los casos notificados 1. El diagnostico de la LHIF sigue siendo de exclusión por lo que, dentro de la evaluación del daño hepático, se debe de solicitar serología viral (hepatitis A, B, C, E, virus de Epstein Barr, Citomegalovirus); serología autoinmune (anticuerpos antinucleares, anti-músculo liso, y antimitocondrial) y descartar enfermedades metabólicas de depósito (saturación de transferrina y ceruloplasmina) 3. Se realizará ecografía abdominal para descartar patología biliar o parenquimatosa. La biopsia hepática se reserva ante duda diagnostica o ante la no mejoría de la LHIF posterior a la suspensión del agente causal 5.
Se han desarrollado múltiples escalas que evalúan causalidad, como CIOMS (Consejo de la Organización Internacional de las Ciencias Médicas), Naranjo y María y Victorino, siendo la primera la más utilizada. La escala CIOMS-RUCAM, categoriza la LHIF en cinco grados de probabilidad: definido, probable, posible, improbable y excluido, de acuerdo con la puntuación alcanzada 1. Estas escalas relacionan tiempo de exposición a la droga e injuria hepática, exclusión de otras etiologías alternas, exposición a otras drogas que podrían explicar la LHIF, factores de riesgo de reacción adversa hepática, evidencia previa de toxicidad al fármaco y respuesta a la reexposición al medicamento 6; sin embargo, presentan limitaciones como su variada confiabilidad y reproducibilidad interobservador; así como la baja capacidad diagnostica cuando están implicados más de un fármaco en un mismo momento 1-4.
La red DILIN categoriza la probabilidad de que un medicamento pueda generar lesión hepática basada en los reportes previamente publicados y en el número de casos reportados 7. (Tabla 2)
El tratamiento de la LHIF implica la suspensión del probable agente causal y la derivación a un área critica a aquellos con mayor riesgo de progresión del daño hepático (INR >1,5, desarrollo de encefalopatía hepática y/o ascitis). Se recomienda evitar la reexposición al medicamento. Con estas medidas se produce una recuperación espontánea en más del 90% de los casos. Por otra parte, se han realizado estudios para evaluar otras opciones terapéuticas como la acetilcisteína, resina de ácido biliar, silimarina, entre otros; sin embargo, estos medicamentos se usan como tratamientos específicos de hepatotoxicidad a un fármaco y no de manera generalizada 1-3.
Actualmente, para el manejo de la HBP se emplean frecuentemente bloqueadores de los receptores alfa1 adrenérgicos e inhibidores de la 5-alfa reductasa, ya sea como monoterapia o como terapia combinada, los cuales pueden presentar efectos adversos como ginecomastia, alteraciones de la eyaculación, disfunción eréctil, ortostatismo, entre otros.
Existe escasa literatura respecto a la hepatotoxicidad asociada al uso de dichos fármacos, encontrándose 2 reportes de casos de elevación de transaminasas sin clínica significativa tras el uso de finasteride por un cuadro de alopecia, los valores de transaminasas se normalizaron tras la suspensión del medicamento 8. A pesar de que la dutasterida se metaboliza en el hígado por la isoenzima CYP3A4, sólo se han reportado elevaciones transitorias de transaminasas, que rara vez requirieron modificación de la dosis. Actualmente no existen reportes de injuria hepática clínicamente significativa tras su uso 9.
Se ha descrito que los inhibidores de la 5 alfa reductasa incrementan el contenido lipídico intrahepático, la resistencia hepática a la insulina, así como la lipogénesis de novo, lo cual conlleva a mayor riesgo de alteraciones metabólicas, así como de la función hepática 10.
Con relación al uso de tamsulosina existen escasos reportes de injuria hepática clínicamente significativa, siendo considerado este un evento raro. En los casos reportados de hepatotoxicidad, en uno de ellos el cuadro clínico simulo una colangitis aguda luego de 11 días de haber iniciado la medicación, con el desarrollo de fiebre, dolor abdominal e ictericia con patrón hepatocelular. En el segundo reporte se evidencia una alteración en el perfil hepático asintomático. En ambos casos hubo resolución completa de la bioquímica hepática posterior a la suspensión del fármaco 11,12.
El uso de levofloxacino 4 meses previos al episodio actual podría ser un confusor, sin embargo, la hepatotoxicidad por levofloxacino se considera rara y presenta un periodo de latencia corto (1 a 3 semanas) y clínicamente desarrollan características inmunoalérgicas como fiebre, erupción y eosinofilia, características que no se encuentran en el presente caso 13.
La tamsulina y dutasterida se metabolizan en el hígado por el citocromo P450, la primera por el CYP3A4 / 2D6 y la segunda por el 3A4/3A5, teniendo ambos la posibilidad de generar intermediarios tóxicos 9-14, posiblemente el uso combinado generaría un sinergismo, potenciando la producción de estos intermediarios lo que ocasionaría un mayor daño hepático, como lo sucedido en nuestro caso.
En el caso reportado, habiendo excluido otras patologías hepáticas, se plantea la posibilidad de hepatotoxicidad debido a la terapia combinada tamsulosina/dutasterida, teniendo una evaluación de causalidad probable con la escala CIOMS-RUCAM, así como una evolución clínica compatible con una injuria hepática por fármacos, caracterizada por una rápida mejoría de los niveles de transaminasas y del cuadro clínico posterior a la suspensión del fármaco.
















