INTRODUCCIÓN
El cáncer de páncreas es una de las neoplasias malignas con peor pronóstico en términos de sobrevida global, la cual se ha incrementado 2,3 veces en el número de casos, yendo de 195 000 a 448 000 casos de 1990 a 2017 respectivamente Se estima que la incidencia de esta patología aumente a 18,6 por cada 100 mil habitantes con un crecimiento anual promedio de 1,1% hacia el año 2050. Esta neoplasia ocupa el cuarto lugar como causa general de muerte en USA y Europa, y se espera que para el año 2030 sea la segunda causa global de muerte por cáncer, luego del cáncer de pulmón 1-3).
Este terrible panorama que presenta el cáncer de páncreas se debe al diagnóstico tardío de la enfermedad, a una biología muy agresiva y heterogénea, así como a una falta de respuesta a los agentes antineoplásicos, lo que conlleva a una rápida progresión de la enfermedad y eventualmente la muerte 4).
Se estima que el 90% de los casos de cáncer de páncreas se originan por mutaciones espontáneas, mientras que el 10% de ellos tienen una base hereditaria. El tabaquismo es el factor de riesgo más importante para el desarrollo de esta enfermedad, duplicando el riesgo de este en fumadores; Igualmente la obesidad se ha asociado a una mayor incidencia de cáncer de páncreas en estudios epidemiológicos 5,6).
El cáncer de páncreas es más frecuente en pacientes adultos mayores con un pico de incidencia entre los 60 y 80 años y una edad media de 73 años. El pico de incidencia varía según el sexo estando este entre los 65-69 años en varones y entre los 75-79 años en mujeres. Es importante señalar que más del 90% de los casos son diagnosticados después de los 50 años 7-9).
En el Perú, la incidencia de cáncer de páncreas es de 3,9 casos por 100 mil habitantes con una distribución similar entre hombres y mujeres con una media de edad de presentación de 70 años. Se estima que en el año 2020 se registraron en el Perú 1606 nuevos casos y 1540 fallecidos por esta patología representando el 4,4% del total de fallecidos por neoplasias malignas en el país 10-12).
Por estas razones creemos que es importante contribuir con el conocimiento de esta patología en nuestro país, por lo que nuestro objetivo es analizar la analizar la presentación epidemiológica y la sobrevida de los pacientes con adenocarcinoma ductal de páncreas en una serie de pacientes tratados en la Clínica Delgado AUNA de Lima Perú, en el periodo 2015 al 2021.
MATERIALES Y MÉTODOS
Se realizó un análisis de cohorte retrospectivo de los pacientes con el diagnostico anatomopatológico de adenocarcinoma ductal de páncreas que fueron atendidos en la Clínica Delgado AUNA en el periodo comprendido entre enero del 2015 y febrero del 2021.
Los factores que se evaluaron incluyeron la edad, el sexo, el estadío clínico-radiológico al momento del ingreso, la sintomatología, el tamaño del tumor, el tabaquismo, la obesidad, la localización de la lesión, el tratamiento quirúrgico, la quimioterapia antes o después de la cirugía, y la supervivencia global según el estadío.
Se clasificó el estadío de los pacientes según las imágenes (estadío clínico-radiológico utilizando resonancia magnética y/o tomografía computarizada) como resecables, borderline, localmente avanzados o metastásicos, según la clasificación de la NCCN (Tabla 1).
Se definió la oligometástasis como la presencia de metástasis en un solo órgano y en un número no mayor a 4. Se evaluaron los niveles de CA 19-9 al momento del diagnóstico o al ingreso a nuestra institución. En los pacientes ictéricos, el valor de CA19-9 se consideró únicamente en aquellos casos en los que la bilirrubina total fuera menor a 2 U/mL.
La neoadyuvancia, que se define como el tratamiento quimioterápico previo a la resección quirúrgica en pacientes oncológicos, se indicó a aquellos pacientes que presentaban un tumor resecable de alto riesgo (CA 19-9 mayor a 500 U/ml) o aquellos que presentaban un tumor resecable borderline (BR) o localmente avanzado.
La mortalidad operatoria se definió como cualquier muerte ocurrida dentro de los 90 días posteriores a la cirugía o durante la hospitalización, sin importar el tiempo transcurrido desde la realización de la cirugía.
Análisis estadístico
Se realizaron estadísticas descriptivas (conteos y porcentajes) para las variables categóricas y se estimaron promedios y rango para las variables cuantitativas. La supervivencia fue estimada con el método de Kaplan Meier y se usó la prueba de logrank para determinar diferencias estadísticamente significativas. La supervivencia fue calculada desde la fecha de diagnóstico hasta la fecha de fallecimiento para los pacientes muertos o fecha de cierre del estudio para los pacientes vivos.
Se realizaron evaluaciones de los supuestos de proporcionalidad de riesgos mediante el uso de gráficos de log-log de supervivencia en el análisis de Cox.
Consideraciones éticas
Dado que se trata de un análisis de datos secundarios, se ha garantizado con rigurosidad la integridad de los pacientes, manteniendo su anonimato y respetando los principios éticos fundamentales. El presente estudio ha obtenido la aprobación del Comité de Ética de la Universidad Continental mediante el oficio N°0147-2023- CIEI-UC, fechado el 23 de marzo de 2023.
RESULTADOS
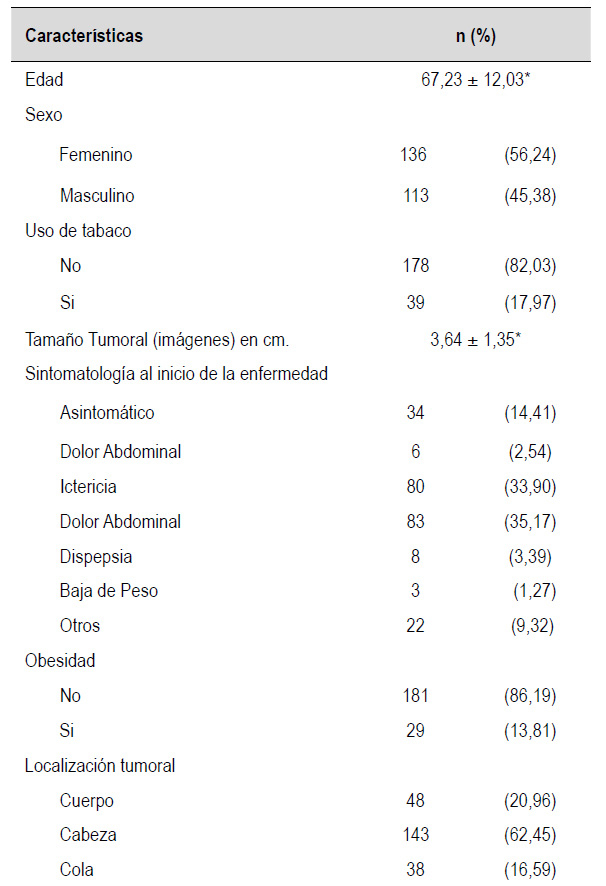
En nuestra serie, se incluyeron 249 pacientes con el diagnóstico de adenocarcinoma ductal de páncreas. Al examinar las características demográficas de la población, se observó que el género femenino fue el más predominante, representando el 56,24% del total. La edad promedio de los pacientes fue de 67,23 años (Tabla 2).
Entre los síntomas más frecuentes se encontraron la ictericia y el dolor. Sin embargo, al analizar los síntomas según la ubicación del tumor, se observó que, en los pacientes con tumores en la cabeza del páncreas, el 52,24% presentó ictericia y el 24,63% experimentó dolor abdominal. Por otro lado, en los casos en los que el tumor se localizaba en el cuerpo y la cola del páncreas, solo el 4,35% y el 2,7% mostraron ictericia, respectivamente, mientras que el 36,96% y el 62,16% experimentaron dolor abdominal.
En relación con los factores de riesgo para el adenocarcinoma de páncreas, el tabaquismo fue el más prevalente, afectando al 17,97% de los pacientes. En segundo lugar, la obesidad estuvo presente en el 13,81% de los casos.
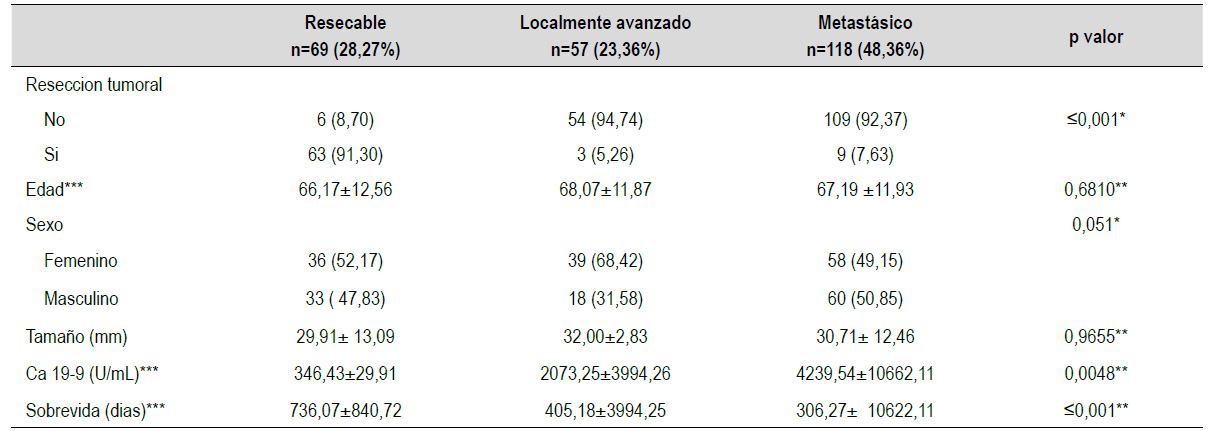
Al evaluar el estadío clínico-radiológico al momento del diagnóstico, se observó que el 28,27% se presentaron en un estadío resecable, 23,36 % se presentaron con un estadío borderline y/o localmente avanzado y 48,36% fueron etiquetados con un estadío metastásico.
De los 87 pacientes diagnosticados como resecables en las imágenes, 81 (93%) fueron sometidos a cirugía, 6 de ellos no fueron operados por que presentaban mal estado general, se negaron a la cirugía o fueron enviados a terapia neoadyuvante por tener un marcador mayor a 500 U/mL. Sólo en 62 pacientes (76%) sometidos a cirugía se pudo completar una resección.
De 66 casos catalogados como BR y/o Localmente avanzado en las imágenes, 31 (47%) fueron sometidos a cirugía, de estos 11 fueron metastásico.
Cincuenta y siete (59%) pacientes de los 96 con sospecha de enfermedad metastásica en las imágenes, fueron operados, existiendo 6 casos (5%) sin evidencia de metástasis durante el acto quirúrgico, los cuales fueron resecados (Tabla 3).
El estadío clínico radiológico al ingreso se modificó en muchos casos por los hallazgos encontrados durante la laparoscopía y/o la cirugía como describimos anteriormente, siendo en total 110 los pacientes considerados en estadío metástasico, 62 pacientes en estadíos localmente avanzados y 69 en estadíos resecables quirúrgicamente.
El nivel del marcador tumoral CA 19-9 se encontró elevado por encima de los valores de referencia en el 77% de los pacientes.
Se encontró una diferencia significativa del valor del marcador tumoral Ca 19-9 en relación con el estadío clínico radiológico, pues los pacientes con la condición de enfermedad resecable tenían un nivel promedio de 339 U/mL (0-6000 U/mL), aquellos con enfermedad localmente avanzada un nivel promedio de 2073 U/ mL (0,72-18 000 U/mL) y los de enfermedad metastásica un valor de 4011 U/mL (0,65-77 000 U/mL).
En cuanto las cirugías realizadas, se efectuó cirugía resectiva en 75 pacientes, en 54 (72%) casos se realizó duodenopancreatectomía, en 19 (25%) casos se realizó una pancreatectomía distal y en 2 (3%) casos fue pancreatectomía total.
En 5 pacientes con oligometástasis se realizó una pancreatectomía con resección de metástasis luego de que recibieran tratamiento de rescate con quimioterapia.
Se inició un tratamiento neoadyuvante en 34 pacientes, en 14 (41%) pudo realizarse la resección quirúrgica, de este grupo no todos completaron la neoadyuvancia debido a complicaciones como toxicidad, sepsis, obstrucción intestinal.
El valor del CA19-9 podría ser un factor independiente de sobrevida en los pacientes resecables con cáncer de páncreas, pudimos ver que los pacientes resecables con un Ca 19-9 mayor de 200 U/mL tenían una media de sobrevida más corta (27,99 meses) que los resecados con Ca 19-9 menor de 200 U/mL (37,72 meses) (Figura 1), debido a que la NCCN considera como punto de corte el valor de 500 U/mL.
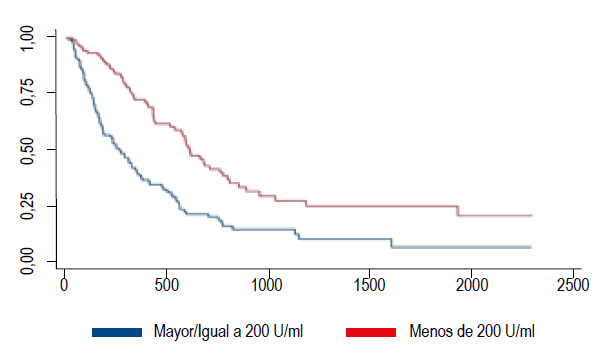
Figura 1 Comparativa en curvas de Supervivencia entre pacientes resecados con Ca 19-9 mayor o igual a 200 U/mL y Ca 19-9 menor de 200 U/mL.
Al relacionar el tamaño del tumor con el estadío clínico, se comprobó la asociación que a más avanzada la enfermedad, mayor el tamaño tumoral, sin embargo, no se encontró asociación estadísticamente significativa en la sobrevida al realizar regresión Cox con la variante tamaño tumoral.
Cuando evaluamos la sobrevida a largo plazo de los pacientes comparando aquellos en los que el tumor fue resecado en comparación con los que no fueron resecados usando la prueba de Chi2 comprobándose la existencia de diferencia estadísticamente significativa entre ambas curvas, pues la curva de supervivencia de los resecados fue mejor en relación con los no resecados (p< 0,001) (Figura 2).
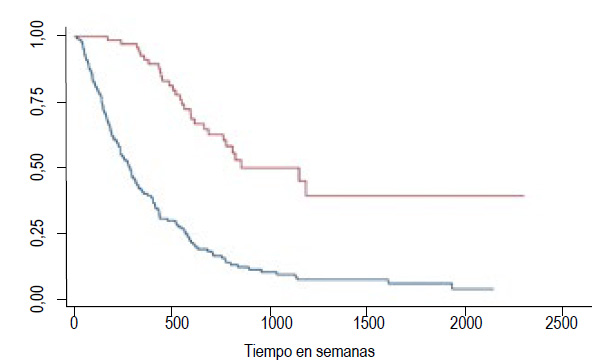
Figura 2 Curvas de supervivencia de Kaplan-Meier comparando pacientes resecados y pacientes no resecados (Chi2=56,75; p< 0,0001).
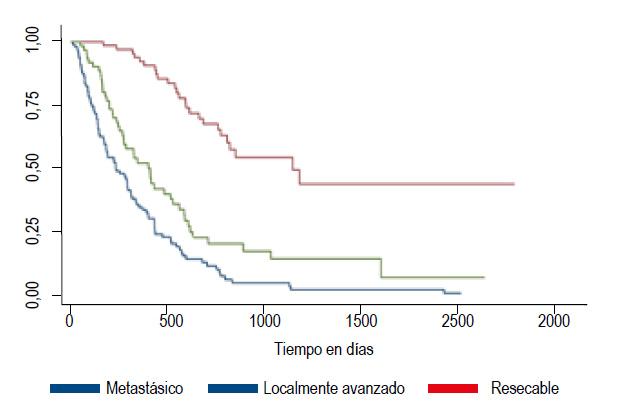
El análisis de comparación de supervivencia en cada grupo de acuerdo con el estadío se observó que los pacientes con estadío metastásico presentaron una media de supervivencia de 7,69 meses, los pacientes con estadío localmente avanzado tuvieron una media de supervivencia de 13,47 meses y los pacientes con estadío resecable presentaron una media de supervivencia de 37,72 meses (Figura 3).
En cuanto al análisis de relación entre variables y supervivencia se utilizó la regresión de Cox, evidenciándose que los pacientes con la condición de “resecado” tiene 91,3% (1-0,870813=91,29) menos posibilidades de morir (reducción relativa de riesgo), siendo este hallazgo estadísticamente significativo (p<0,001).
Cuando se comparó si los pacientes sometidos a neoadyuvancia y luego sometidos a resección tenían más sobrevida que los pacientes resecados de primera intención se aprecia que la curva de supervivencia KaplanMeier de los pacientes con neoadyuvancia tuvieron mejor expectativa de vida (mayor supervivencia) que los que fueron sometidos a resección de primera intención (Figura 4).
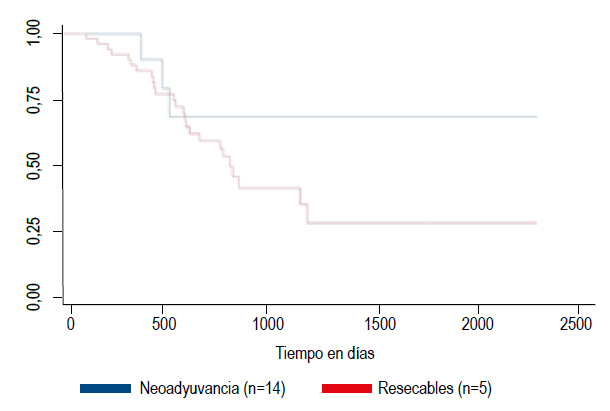
Figura 4 Curvas de supervivencia de Kaplan-Meier comparando pacientes resecados y pacientes no resecados (Chi2=56,75; p< 0,0001).
De la misma manera, la neoadyuvancia presenta una reducción relativa de riesgo de mortalidad de 68,5% (1- 0,31511=68,489).
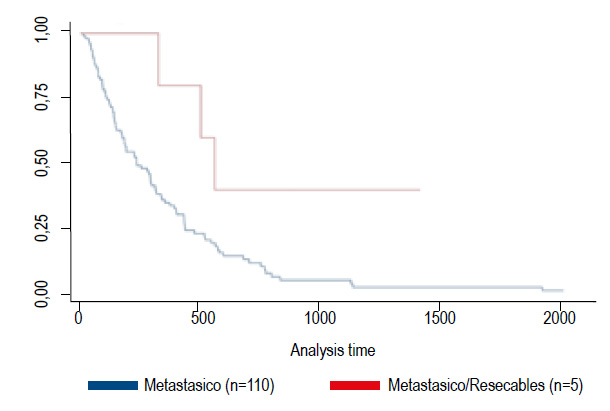
En el grupo de pacientes metastásicos (110 pacientes) se destacaron 5 casos que presentaban oligometástasis, a los cuales luego de recibir tratamiento con quimioterapia de rescate y presentar una muy buena respuesta se les realizo una pancreatectomía con resección completa, Estos casos por ser una terapia no convencional previo a la cirugía, se discutió y aprobó cada uno de ellos, siendo evaluados por el grupo multidisciplinario de tumores pancreáticos. Estos pacientes presentaron una sobrevida media de 22,51 meses.
Al comparar la sobrevida de los pacientes oligometastásicos que fueron resecados en comparación con los metastásicos sin resección, pudimos evidenciar que los oligometastásicos que fueron sometidos a resección tuvieron mejor expectativas de vida (mayor supervivencia) que los pacientes metastásicos (Figura 5).
DISCUSIÓN
En el presente trabajo realizamos una evaluación descriptiva de las características clínico-patológicas del adenocarcinoma ductal de páncreas en nuestra institución, así como de los factores asociados a la supervivencia de los pacientes.
El pico de incidencia del cáncer de páncreas que observamos en el presente estudio se encuentra entre los 60 y 80 años con una edad media de 71 años 13). Esto se correlaciona con algunas series observadas en Dinamarca y en otros países que muestran una distribución similar en cuanto a la edad de presentación de esta patología 14).
Existe una presentación ligeramente más alta en varones (5,5 x 100 mil habitantes) que en mujeres (4 x 100 mil habitantes). En nuestra casuística el pico de edad fue de 67 años siendo los pacientes ligeramente más jóvenes, y al igual que en el resto del mundo más del 90% se presentó después de los 50 años 15). En cuanto al sexo se presentaron más frecuentemente en mujeres (55%) que en hombres (45%), aunque este hallazgo no es estadísticamente significativo, al igual que en las series observadas en otros países 16).
El cáncer de páncreas generalmente se presenta con síntomas inespecíficos a pesar de encontrarse en estadíos avanzados, siendo la sintomatología más frecuentemente descrita la pérdida de peso, la anorexia, la ictericia y el dolor abdominal. En nuestros casos la sintomatología cambiaba drásticamente de acuerdo con la localización del tumor, siendo la ictericia la más frecuente en más de la mitad de los casos, cuando el tumor se encontraba en la cabeza de páncreas, mientras que cuando se localizaba en cuerpo y/o cola fue el dolor el síntoma más frecuente en el 53% de los casos. Es la misma situación que ha sido descrita por autores en otros países, donde se recomiendan pruebas de descarte seriadas e inclusive inteligencia artificial para identificar tempranamente el cáncer de páncreas, dado el alto índice de portadores asintomáticos de esta patología, los cuales van a desarrollar síntomas de forma tardía, en el proceso de la enfermedad 17-19).
Existe una fuerte asociación entre el riesgo de desarrollar cáncer de páncreas y el tabaquismo, y se sabe que el hábito de fumar duplica el riesgo de este en fumadores, siendo el factor ambiental más importante en el desarrollo de esta enfermedad, sin embargo, sólo el 18% de nuestros pacientes eran fumadores 20,21).
En este estudio encontramos que el 23% de los pacientes con diagnóstico histopatológico de adenocarcinoma ductal de páncreas presentaba un marcador (CA 19-9) dentro de los rangos normales (menor a 34 U/mL), lo cual se correlaciona con diferentes publicaciones donde se muestra que el CA 19-9 no tiene un rol en el screening de pacientes asintomáticos, tampoco siendo de mucha ayuda en el paciente sintomático donde la sensibilidad y especificidad de la prueba rodea los 79-81% y 82-90% respectivamente 22,23).
Los niveles de elevación del CA 19-9 están íntimamente relacionados al tamaño tumoral y al estadío, encontrándose una correlación directa entre el tamaño del tumor y el CA 19-9, por ello, hoy en día la utilidad más grande del marcador ca 19-9 radica en ser usado para el pronóstico siendo utilizado en el monitoreo de seguimiento de los pacientes con terapia neoadyuvante o adyuvante 24). Además de ser utilizado para catalogar a los pacientes resecables de alto riesgo (CA 19-9 > 500 U/mL) los cuales deben de ir a neoadyuvancia, es por eso que llama la atención en este estudio, que los pacientes catalogados como resecables que tenían un CA 19-9 pre operatorio menor de 200 tenían una sobrevida estadísticamente mayor que aquellos que presentaban un Ca 19-9 mayor a 200 25-27).
Cuando analizamos la efectividad de las imágenes podemos ver que existía diferencias entre los hallazgos operatorios y los reportes de imágenes previos, por lo que de los tumores catalogados en el preoperatorio como resecables solo en el 76% de ellos se pudo completar la pancreatectomía. En este grupo de pacientes catalogados como resecables que no se pudo efectuar una pancreatectomía, el 47% fue por que presentaban metástasis al momento de la cirugía; de la misma manera, en los pacientes catalogados radiológicamente como metastásicos que fueron sometidos a laparoscopia, se encontró que, en 6 casos, no presentaban metástasis, por lo cual fueron sometidos a una pancreatectomía 28). Esto se puede evidenciar también en otras series de casos similares, donde las tasas de metástasis oculta pueden llegar a 26% en relación a lo encontrado en los estudios preoperatorios 29,30).
Una de las razones por la cual el cáncer de páncreas tiene tan baja sobrevida a largo plazo es porque es diagnosticado en forma tardía, esto se observa en este trabajo, ya que al momento del diagnóstico el 69% de los pacientes ya estaban en etapa avanzada.
Esto complica mucho, el poder ofrecer una alternativa de tratamiento que tenga un posible efecto “curativo”, lo que se traduce en una expectativa de vida muy corta 31,32).
Al evaluar la sobrevida de acuerdo con el estadío de la enfermedad pudimos ver que esta fue mucho mayor en los estadíos iniciales, los pacientes con estadío resecables tuvieron el mejor pronóstico con una sobrevida de 37,72 meses, mientras que en los localmente avanzados fue de 13,47 meses y en los metastásicos fue de 7,69 meses.
Por primera vez la sobrevida a 5 años en el año 2020 se está acercando al 10% comparada al 5,6% reportado hasta la década del 2000, siendo esta leve mejora atribuida a la terapia con múltiples agentes citotóxicos, lo cual ha permitido ofrecer un tratamiento sistémico mucho más efectivo, y por primera vez poder ofrecer una terapia que disminuya el estadío de la enfermedad avanzada, permitiendo a los pacientes, que respondan al tratamiento, tengan una posibilidad quirúrgica 23). Lo cual podemos evaluar en nuestro trabajo, en los pacientes que recibieron neoadyuvancia y en aquellos pacientes metastásicos que se pudieron resecar 33-38).
La terapia neoadyuvante se ha establecido como el standard de tratamiento en los pacientes en estadío borderline (BR) y localmente avanzado(LA), dada la efectividad de las nuevas terapias en disminuir el estadiaje y mejorar el grado de resecabilidad. La neoadyuvancia tiene una efectividad entre 50-70% en los BR y 10-30% en los LA, respectivamente.
Cuando comparamos la sobrevida en el grupo de pacientes que recibió neoadyuvancia pudimos ver que esta era mayor cuando se comparaba al grupo que fue directo a cirugía, sin embargo, el análisis estadístico no mostro diferencia, esto se podría explicar por el reducido número de pacientes que componían nuestra muestra. Sin embargo, la neoadyuvancia está mejorando los niveles de sobrevida en todo el mundo, inclusive en los casos más avanzados 39,40).
En un grupo de pacientes se logró optimizar el estadío clínico de metastásico a “resecable”, ya que estos respondieron al tratamiento con quimioterapia de rescate y luego fueron llevados a cirugía resectiva, logrando una mejor sobrevida respecto a los pacientes metastásicos que no pudieron ser intervenidos quirúrgicamente.
En este momento se están desarrollando estudios prospectivos fase III para evaluar si puede considerarse la resección quirúrgica en pacientes con cáncer de páncreas oligometastásicos que respondan a la quimioterapia y así poder definir el real beneficio de esta terapia 42,43).
Estos cambios que se han promovido en estos últimos años nos ha permitido realizar una resección quirúrgica al 30% de nuestros pacientes (75 casos), este alto porcentaje de pacientes resecados es mayor a lo usualmente reportado, en donde solo se puede ofrecer cirugía en el 15-20% de los casos, esto se puede deber a que el uso de terapia neoadyuvante y la quimioterapia de rescate aumenta el porcentaje de resección al cambiar de estadío a los pacientes, siendo sumamente relevante, ya que sabemos que la resección quirúrgica es el tratamiento definitivo para tratar de curar esta enfermedad 21,41-43).
Este estudio tiene las limitaciones propias del análisis de serie de casos, entre ellas, la poca validez externa, dado que no representa una muestra aleatorizada sino que se representa a una población atendida en un hospital privado del Perú, adicionalmente, el sector que representa esta población, puede estar segmentado debido a las características propias de la población que se atiende en este tipo de nosocomio, lo cual puede sub representar algunos segmentos de la población, sin embargo, el número incluido nos permite conocer cómo se presentan estos pacientes, y sobre todo poder conocer la sobrevida de estos, en cada estadío de la enfermedad y como esta puede cambiar de acuerdo al tratamiento recibido. Permitiéndonos evaluar y comparar nuestra realidad con el resto de las publicaciones.
En conclusión, nuestra investigación revela una prevalencia ligeramente mayor de cáncer de páncreas en el género masculino en comparación con el femenino, con un pico de incidencia a los 67 años y más del 90% de los diagnósticos manifestados después de los 50 años. Aunque no se evidencia una diferencia significativa en la frecuencia entre sexos, esta tendencia concuerda con datos internacionales. Los síntomas exhiben variabilidad en función de la localización del tumor, destacándose la ictericia en tumores en la cabeza y el dolor abdominal en aquellos ubicados en el cuerpo o cola del páncreas. A pesar de la fuerte asociación entre el tabaquismo y el riesgo de cáncer de páncreas, solamente el 18% de los sujetos estudiados presentaban antecedentes de tabaquismo. El marcador tumoral CA 19-9, aunque presenta limitaciones en su idoneidad para el cribado, muestra una correlación directa con el tamaño del tumor y su estadío, revelando su valor pronóstico y su pertinencia en el seguimiento clínico. Específicamente, niveles inferiores a 200 U/ml se asocian con una supervivencia prolongada en pacientes considerados resecables, subrayando su utilidad en la estratificación del riesgo y la toma de decisiones terapéuticas. La neoadyuancia debe ser siempre tomada en consideración, dada su mejoría en la sobrevida global de los pacientes tratados con cáncer de páncreas.