INTRODUCCIÓN
La enfermedad hepática esteatósica asociada a la disfunción metabólica (MASLD). se considera una manifestación del síndrome metabólico y está muy extendida en todo el mundo, especialmente en países industrializados con altas tasas de obesidad, diabetes y dislipidemia. Por lo tanto, está claro que la enfermedad es más común en Occidente 1).
MASLD es la causa más común de enfermedad hepática, afectando a más del 30% de la población siendo un problema de salud pública, con una prevalencia creciente en todo el mundo a medida que crecen las tasas de obesidad 2).
La prevalencia de la MASLD aparentemente se acerca al 20%. Al mismo tiempo, la prevalencia estimada de esteatohepatitis tiende a ser baja, típicamente del 5%, pero puede ser mayor dependiendo de la presencia de un componente de riesgo de fibrosis avanzada 3). MASLD es más común en personas obesas (75% frente a 16%). De igual modo, en personas con diabetes tipo 2 es más frecuente (34% al 74%) 4).
Los factores de riesgo para desarrollar fibrosis avanzada por esteatohepatitis no alcohólica en personas con diabetes incluyen factores del síndrome metabólico: dislipidemia, obesidad central y resistencia a la insulina. También otros factores de riesgo para una mayor progresión de la esteatohepatitis, como la edad avanzada, niveles elevados de alanina aminotransferasa (ALT) y aumento de la ferritina 5).
Se debe tomar en cuenta que muchas de estas estimaciones están basadas en investigaciones mundiales de prevalencia y factores de riesgo asociados a fibrosis usando estudios no invasivos como predictores de riesgo clínico tipo NAFLD SCORE o FIB 4 6). Existe investigaciones que han estudiado factores de riesgo independientes de fibrosis avanzada en sujetos con MASLD. Un paciente con MASLD con fibrosis a menudo tiene uno o más factores del síndrome metabólico, tales como la dislipidemia, resistencia a insulina o diabetes, obesidad e hipertensión arterial. Un estudio de revisión sistemática de una población con MASLD señala que los factores que se asocian son la edad, obesidad, resistencia a insulina y progresión del síndrome metabólico y también el IMC, la hipertensión arterial (HTA), perímetro abdominal y la resistencia a la insulina, constituyen factores primordiales del riesgo 7). Un estudio en Marruecos encontró que la enfermedad hepática esteatósica se correlacionó significativamente con dislipidemia (p=0,006), sobrepeso (p=0,00015), obesidad (p=0,001) e hipertrigliceridemia (p=0,0003) 8). En otro estudio, pacientes con cirrosis por esteatohepatitis asociada a disfunción metabólica (MASH) el 71% tenían diabetes y 41% hombres con una edad de 62 años a lo largo de una mediana de seguimiento de 47 meses, unos 30 pacientes desarrollaron carcinoma hepatocelular (CHC). En este estudio la diabetes estuvo asociada con más riesgo de desarrollar CHC (p=0,04, HR = 3,6) y también tras el análisis de regresión logística (HR = 4,2; p=0,02). Además, la edad avanzada (por década, HR = 1,8; p< 0,01) y albúmina sérica baja (HR = 2,1; p< 0,01) estuvieron asociadas de forma significativa con más riesgo de desarrollar CHC en el análisis multivariado 9). En Perú, se investigaron los parámetros histológicos, bioquímicos y clínicos de 9 pacientes y se encontró que un 55% presentaba obesidad, dislipidemia, y el 22,2% presentaban diabetes. El 100% encontró niveles elevados de transaminasas. Un 33% tenía cirrosis y MASLD 10). También, en Perú en pacientes hospitalizados por cirrosis hepática donde la principal comorbilidad asociada a MASH fue la diabetes mellitus (19,3%) 11). En una clínica privada en Lima se halló que variables como el IMC, peso y elevación en niveles de transaminasas son más frecuentes en las personas con afecciones hepáticas severas como esteatohepatitis y cirrosis. Asimismo, en dicho estudio, la prevalencia de esteatohepatitis y cirrosis fue en 80% y 44% respectivamente. Además, se encontró que 5 pacientes con cirrosis (prevalencia 10%) eran obesos, y 3 de ellos tenían un IMC superior a 40 kg/m2 12). En otro estudio se analizaron pacientes con diagnóstico de MASLD y DM2 con buen control glucémico, los parámetros metabólicos significativos que se asociaron con una mayor frecuencia de MASLD fueron los niveles de triglicéridos, una mayor dosis de metformina, los niveles altos de HbA1C y era más frecuente en sexo femenino 13).
El objetivo de este estudio fue determinar factores de riesgo sociodemográficos, antropométricos, bioquímicometabólicos, clínicos y comorbilidades asociadas a fibrosis avanzada por enfermedad hepática esteatósica asociada a disfunción metabólica en pacientes con diabetes mellitus tipo 2.
MATERIALES Y MÉTODOS
La investigación fue de enfoque cuantitativo, tipo observacional, analítico de casos y controles. Los casos que se incluyeron estaban constituidos por pacientes con diabetes mellitus tipo 2 con fibrosis avanzada por enfermedad hepática esteatósica asociada a disfunción metabólica durante el periodo de estudio. Los controles fueron pacientes con diabetes mellitus tipo 2 con enfermedad hepática esteatósica asociada a disfunción metabólica sin fibrosis avanzada tratados en el consultorio de endocrinología del Hospital Nacional Dos de Mayo entre 2009 a 2018. Se realizó un muestreo no probabilístico por conveniencia. Para evitar el error sistemático se aplicó análisis de regresión logística. Se consideró caso 87 pacientes de ambos sexos, de 18 a 75 años de edad, con DM2 y diagnóstico de MASLD y presencia de esteatosis en la ecografía, catalogada como leve, moderada o severa, asociada a niveles elevados de transaminasas sin evidencia de enfermedad hepática viral, autoinmune o ingesta de fármacos hepatotóxicos o alcohol de modo crónico. Además, con fibrosis hepática avanzada definida por 3 paneles clínicos que en todos los pacientes deberían estar los 3 en rango de fibrosis avanzada de F3-F4 (APRI >1,5, FIB 4 >3,25 y NALFD score >0,67) que se incluyeron en la evaluación para aumentar precisión y fue aplicable al estudio ya que el diseño era de tipo retrospectivo. Asimismo se consideró tras la revisión de historia si asociado a estos 3 paneles clínicos contaban o no con resultado positivo de fibrosis avanzada de acuerdo a biopsia hepática mediante el uso de tinción tricrómica y a 87 controles de ambos sexos de 18 a 75 años de edad, con DM2 con EHGNA, precisada por ultrasonografía como la presencia de esteatosis, leve, moderada o severa, asociada con niveles elevados de transaminasas sin evidencia de alguna enfermedad hepática viral o autoinmune o ingesta de fármacos hepatotóxicos o alcohol de modo crónico. Además, sin fibrosis hepática avanzada definida por 3 paneles clínicos que en todos los pacientes deberían estar en rango de ausencia de fibrosis avanzada (APRI < -1,455) (14) que se incluyeron en la evaluación para aumentar precisión y fue aplicable al estudio ya que el diseño era de tipo retrospectivo. Asimismo, se consideró tras la revisión de historia si asociado a estos 3 paneles clínicos contaban o no con resultado negativo de fibrosis avanzada biopsia hepática mediante el uso de tinciones tricrómicas.
Interpretación <-1,455: predictor de ausencia de fibrosis significativa (F0-F2 fibrosis) ≤-1,455 a ≤0,675: puntuación indeterminada >0,675: predictor de presencia de fibrosis significativa (F3: fibrosis avanzada-F4 cirrosis)
Se consideraron criterios de exclusión: hígado graso: de causa secundaria: utilización de isoniazida, amiodarona, glucocorticoide, tamoxifeno, valproato, metrotexato, antecedentes de hepatitis C y B, antirretrovirales, enfermedades autoinmunes, hipopituitarismo, hipotiroidismo y enfermedad de Wilson; personas medicadas con análogos de GLP-1, pioglitazona o vitamina E; historia o antecedente de malignidad e ingesta de alcohol crónico >20 g/día en mujeres o 30 g en varones dentro de la ficha de recolección de datos que fue validada previamente y con confiabilidad aceptable.
Para la determinación de la fuerza de asociación fue calculado el “odds ratio” (OR) teniendo en cuenta el intervalo de confianza a 95% (IC 95%). En cuanto a las pruebas estadísticas, para analizar relaciones o asociaciones entre variables categóricas fue aplicada la prueba chi-cuadrado de Pearson. Luego de encontrar el valor estimado p<0,05, se realizó una corrección de Yates. Según la prueba de normalidad de cada variable numérica, se planteó realizar la prueba de “U de Mann Whitney” o “T de student” dependiendo de la variable. Para ajustar las posibles variables de confusión, fue realizado un análisis de regresión logística binaria (todo valor p<0,05 fue considerado significativo). Se procesaron todos los datos en SPSS vers. 21 y Excel 2016, y se optimizó el modelo de regresión logística usando el método de selección de variables de Forward (Wald).
Se respetó la confidencialidad de la información de cada participante. En el presente estudio no hubo contacto directo con los pacientes porque solo se trabajó con historias clínicas.
Para su aprobación, el protocolo de investigación se presentó al “comité de ética del hospital Nacional Dos de Mayo”, lugar donde fue realizado el estudio de investigación.
RESULTADOS
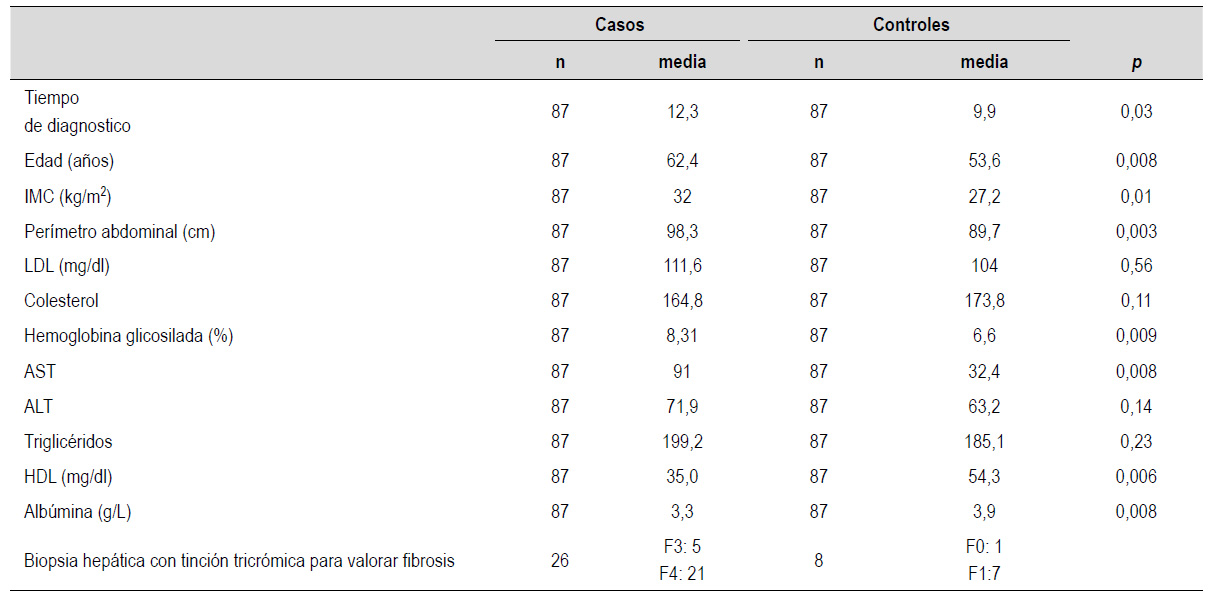
La media de la edad, IMC, perímetro abdominal, el tiempo de diagnóstico de ambos grupos, LDL colesterol, hemoglobina glicosilada, transaminasas aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT), triglicéridos, HDL y albumina se muestran en la Tabla 1.
Tabla 1 Características clínicas, bioquímicas e histológicas de pacientes con fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en diabéticos tipo 2.
Los factores de riesgo sociodemográficos son presentados en la Tabla 2. Se aprecia que el 37,9% son varones, mientras que el 62,1% son mujeres.
Respecto a la edad, los pacientes con DM2 mayores de 60 años que presentaron fibrosis hepática avanzada, tuvieron 3,72 veces más riesgo de desarrollarla, que los menores de 60 (Tabla 2).
Tabla 2 Factores de riesgo sociodemográficos según fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en diabéticos tipo 2
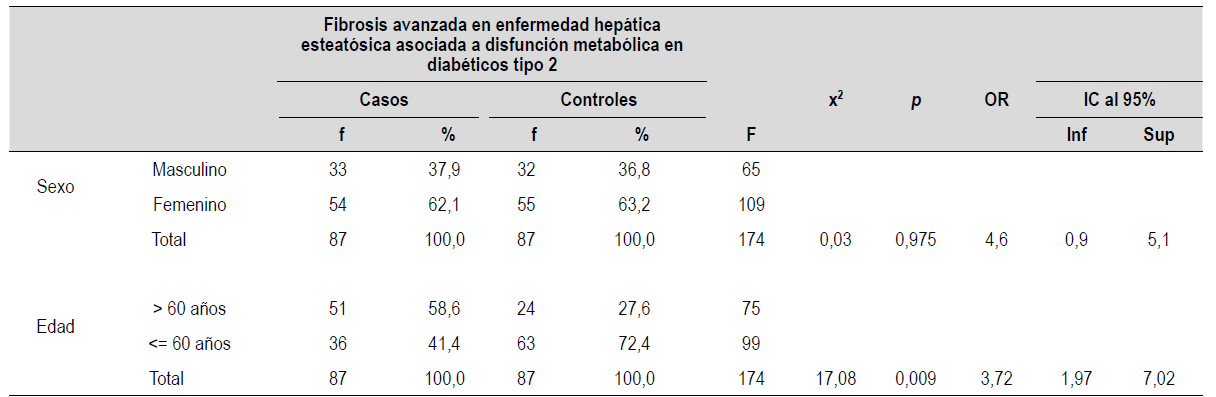
p<0,05 significativo
En la Tabla 3 se puede apreciar el resultado de los factores de riesgo antropométricos de los dos grupos, destacando el perímetro abdominal en pacientes mujeres asociado a fibrosis avanzada con asociación significativa.
Tabla 3 Factores de riesgo antropométricos según fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en diabéticos tipo 2.
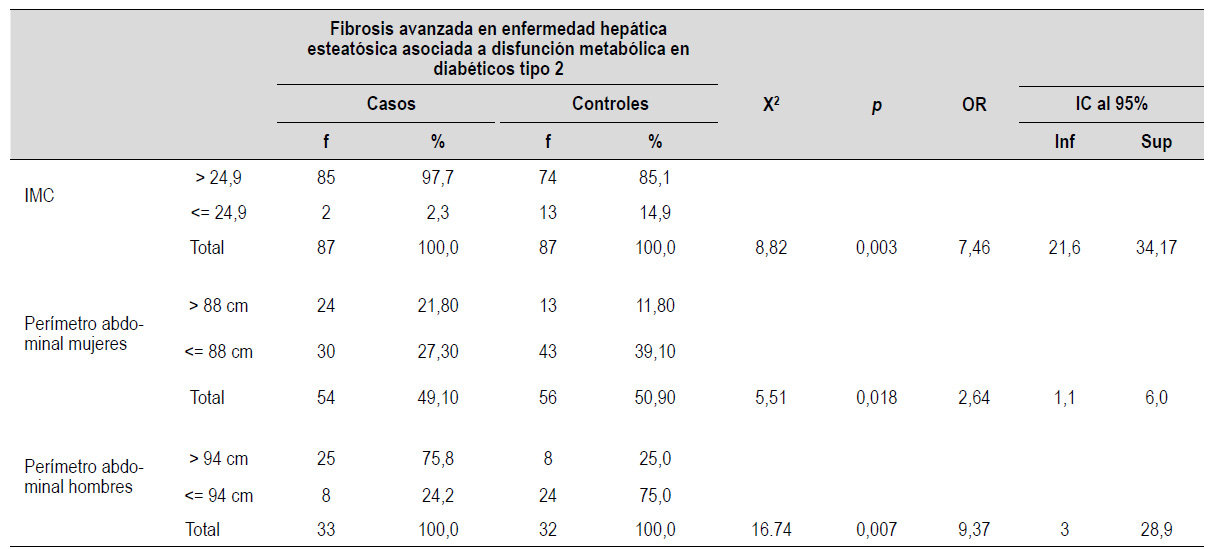
p<0,05 significativo, IMC= Índice de masa corporal
Referente a los factores de riesgo clínico se evaluaron variables tales como el tiempo de enfermedad y complicaciones de la diabetes mellitus (Tabla 4).
Tabla 4 Factores de riesgo clínicos según fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en diabéticos tipo 2
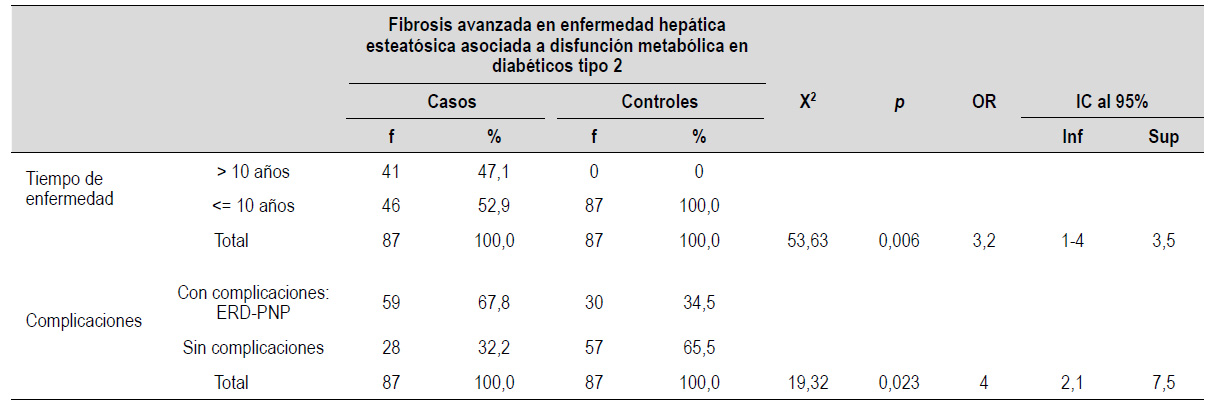
p<0,05 significativo, ERD: Enfermedad renal diabética, PNP: Polineuropatía periférica
Se encontró asociación significativa entre la variable tiempo de enfermedad y complicaciones crónicas como polineuropatía periférica y enfermedad renal diabética.
En la Tabla 5 se muestra la presencia de comorbilidades principales evaluadas.
Tabla 5 ERC e HTA según fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en pacientes con DM2.
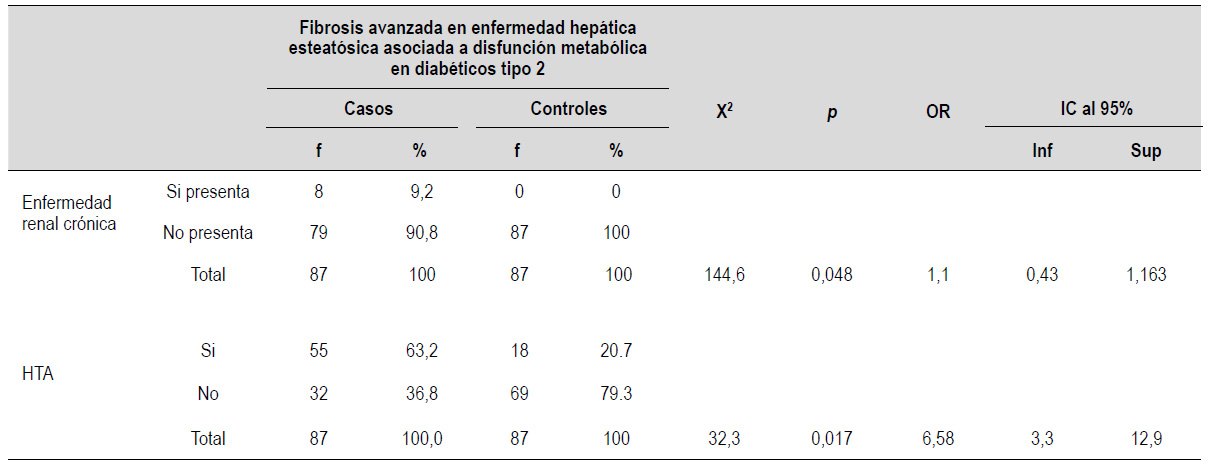
p<0,05 significativo
La ERC no está asociado a fibrosis avanzada en forma significativa (p=0,048). Asimismo, se aprecia que, del total de casos, el 63,12% presentan HTA y existe asociación significativa con la fibrosis avanzada en esteatohepatitis asociada a disfunción metabólica (MASH) (p<0,05).
Tabla 6 Factores de riesgo bioquímico-metabólicos según fibrosis avanzada en enfermedad hepática esteatósica asociada a disfunción metabólica en diabéticos tipo 2.
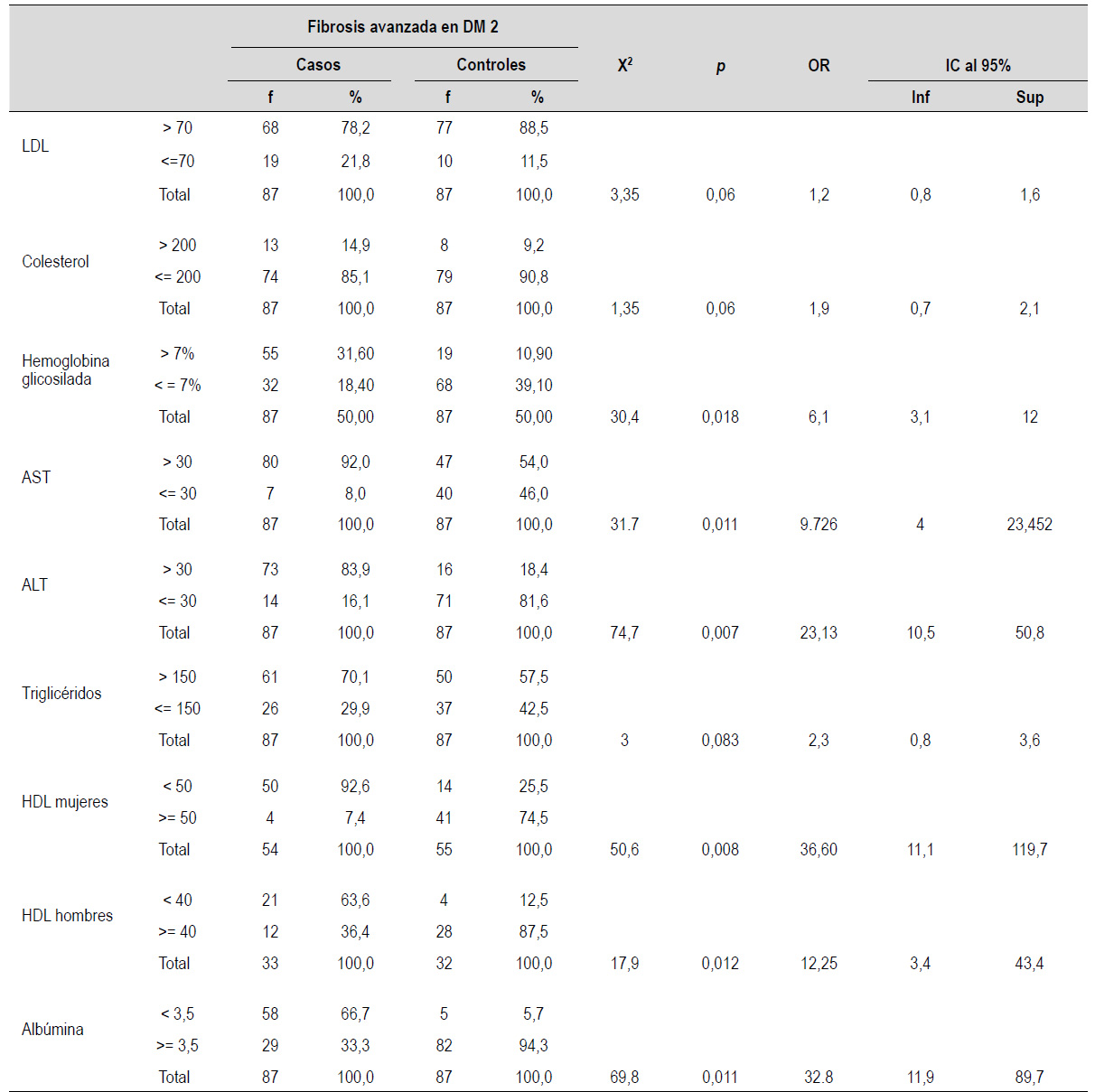
*p<0,05 significativo
Las principales variables examinadas sobre factores de riesgo bioquímico-metabólicos se incluyen en la Tabla 6 mostrando los resultados de acuerdo con el OR e intervalo de confianza.
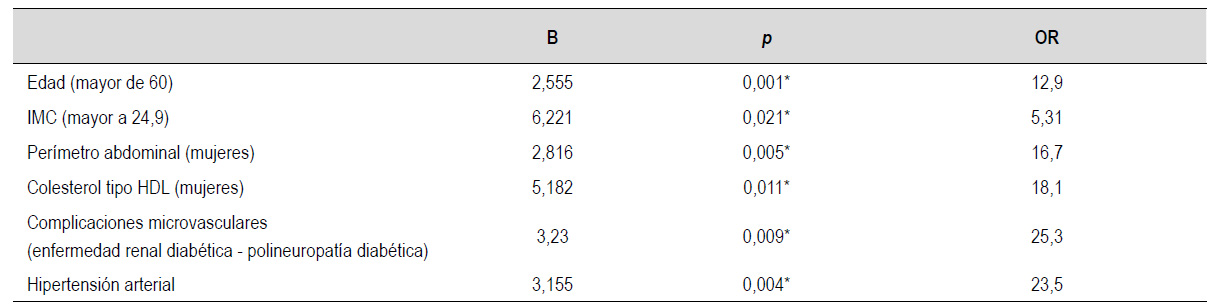
En el modelo de regresión logística multivariado, se aplicó la prueba de Wald con la finalidad de determinar la mayor capacidad predictora y la mayor fuerza de asociación de las variables de estudio para enfermedad hepática avanzada de los cuales solo seis tuvieron asociación significativa (Tabla 7).
DISCUSIÓN
La edad mayor a 60 años se encontró como un factor de riesgo significativo para MASLD con fibrosis avanzada (Tabla 1). Como se puede observar 62,4 años fue la edad media de los casos y 53,6 años para el grupo control (p<0,05) tras el análisis de regresión logística. Se reconoce que la prevalencia de MASLD tiene su pico máximo en los varones de 50 años y entre los 60 a 69 años para las mujeres 15) las cuales son cifras muy parecidas a las encontradas en nuestro estudio. Asimismo, la edad mayor a 50 años es muy probable de padecer esteatohepatitis en estadio de fibrosis más grave y de cirrosis 16,17).
El perímetro abdominal en varones en riesgo se asocia con el grupo de los casos (p<0,05; OR=9,37). Mientras el perímetro abdominal en mujeres en riesgo se asocia con el grupo de los casos (p<0,05; OR=7,46)
En el análisis multivariado la circunferencia abdominal de mujeres en riesgo influye significativamente al evento del estudio (p<0,05; OR=16,7) este resultado se puede equiparar con Atri y col, concluyeron que las mujeres con obesidad visceral en riesgo (83 cm), predice MASLD 18).
La obesidad visceral está asociada a insulino resistencia y es el peor pronóstico reconocido de MASLD (19). La literatura indica que la circunferencia abdominal es un factor colateral de la grasa visceral, sin embargo, hay estudios no concluyentes que aseveran que la circunferencia abdominal es factor pronóstico de fibrosis avanzada 20).
Nuestros resultados reportan que los pacientes con IMC (mayor 24,9) se asocia al grupo de los casos (p<0,05; OR=503) observamos fue un factor de riesgo independiente de fibrosis en ambos sexos, se deduce el IMC sirve para estratificar pacientes con riesgo de fibrosis, de forma similar se encontró que el IMC y la circunferencia abdominal herramientas útiles como predictores de fibrosis 21). De la misma manera, nuestros resultados coinciden con la conclusión que para los pacientes con MASLD, la obesidad podría predecir un peor pronóstico a largo plazo 22).
En nuestro estudio observamos, que el tiempo de enfermedad de DM2 se asocia con la MASLD (pp<0,05); según la literatura la presencia MASLD en fase más avanzada relacionada a cirrosis, carcinoma hepatocelular y muerte, acrecienta las complicaciones de la DM2 23). En el análisis multivariado, el tiempo de enfermedad de DM no se asocia con el desarrollo de fibrosis hepática, al parecer según la literatura, otros factores en el tratamiento de la diabetes como el control de lípidos influyen en el impacto que pueda tener la enfermedad sobre el desarrollo de la fibrosis avanzada en MASLD 24).
Nuestros resultados indican que la polineuropatía diabética se asocia con MASLD (p<0,05), este resultado se aproxima a la literatura encontrada que la fibrosis hepática podría estar asociada con PND en personas con DM2 25). Asociar la polineuropatía diabética y MASLD, está todavía en desarrollo, algunos estudios limitados metodológicamente concluyen que la fibrosis es un factor de riesgo independiente del desarrollo de neuropatía periférica 25). Asimismo en estudios con evidencia histológica se ha encontrado que la neuropatía periférica podría ser un marcador clínico útil de fibrosis en MASLD 26).
También observamos que la enfermedad renal diabética (ERD) se asocia con la fibrosis avanzada (p<0,05) resultado similar a lo reportado en la literatura , donde se demuestra que los pacientes con MASLD tenían función renal alterada, asimismo, encontraron que la prevalencia de insuficiencia renal en pacientes con MASLD depende de la gravedad de la enfermedad hepática y de la presencia de diabetes mellitus 27). Asimismo, este resultado coincide con un metaanálisis donde se concluyó que la MASLD estuvo asociada con una prevalencia de enfermedad renal crónica dos veces mayor (OR=2,12). Se han reportado resultados similares en un metaanálisis más reciente que incluyó a 96 500 personas (un tercio con MASLD) seguidas durante una mediana de 5,2 años 28).
Se debe tener en cuenta que la ERD y la MASLD tienen vías fisiopatológicas comunes en relación a que en ambas hay un aumento de citocinas que contribuyen a la lipogénesis de novo, alteraciones del microbiota intestinal y además que existen susceptibilidades genéticas que, actuando en paralelo, contribuyen a la acumulación de grasa ectópica y activación de células estelares.
En ese sentido la asociación de tanto la enfermedad renal diabética y la polineuropatía diabéticas en pacientes con DM2 con MASH y fibrosis avanzada es un área de investigación a futuro pues su conocimiento tendrá una gran importancia en el proceso diagnóstico precoz y tratamiento por la relación de estas complicaciones crónicas de la DM y mayor riesgo de desarrollo de fibrosis hepática 29).
Nosotros encontramos que la HTA se asociaba con la MASLD (p<0,05). La hipertensión arterial y diabetes forman parte del síndrome metabólico cuya compatibilidad es habitual. En el contexto de MASLD la presencia de hipertensión puede aumentar aún más la severidad de la enfermedad por hígado graso y esto se pudo corroborar en este estudio 30).
Nuestros resultados reportan que la hipertensión arterial se asocia con la MASLD y la fibrosis hepática (p<0,05) , este resultado es semejante a un estudio donde se demostró que el desarrollo y la persistencia de hipertensión durante 5 años se asoció con un mayor riesgo de aparición de enfermedad hepática esteatósica asociada a disfunción metabólica (OR=1,45) 31), del mismo modo en un estudio se encontró una asociación bidireccional similar entre MASLD e hipertensión tras un período de seguimiento de 6 años 32).
Se encontró asociación entre el nivel de HDL bajo, LDL mayor 70 mg/dL, triglicéridos mayores a 150 mg/dl, elevación de nivel de transaminasas, un nivel elevado de hemoglobina glicosilada, y la presencia de hipoalbuminemia, pero tras la aplicación de un modelo de regresión logística se encontró significancia estadística sólo en el nivel bajo de HDL en mujeres (Tabla 7).
El nivel de HDL-C menor a 50 mg/dL en el género femenino se asocia MASLD (p<0,05), este resultado se asemeja a la literatura, además, se encontró que la MASLD se asoció con obesidad visceral y colesterol HDL menor a 50 en pacientes con diabetes tipo 2 33). En otro estudio se observó asociación entre un nivel de HDL-c menor a 50 mg/dL y los riesgos de MASLD encontrándose a este como un predictor de progresión 34).
Una alteración en la función de los macrófagos THP1 es importante en la fisiopatología de MASLD dado que ellos intervienen en la remoción de esteres de colesterol a nivel periférico y median la acción de HDL reduciendo la lipotoxicidad 35). En nuestros resultados llama la atención que no se encontró un nivel elevado de colesterol LDL como factor de riesgo lo que puede ser consecuencia del hecho de que en las etapas avanzadas de la MASLD (es decir, fibrosis significativa) los perfiles lipídicos de rutina no muestran necesariamente alteraciones metabólicas severas 36).
Dentro de las fortalezas del estudio es de destacar que este estudio es uno de los primeros que evalúa factores de riesgo en un grupo especifico de pacientes como son los pacientes con diabetes mellitus 2 en relación con el riesgo de desarrollar fibrosis hepática. Este conocimiento puede ser de utilidad para médicos especialistas y no especialistas en estratificar el riesgo de fibrosis hepática en función a las características clínicas, bioquímicas, presencia de complicaciones crónicas de la diabetes y comorbilidades asociadas para tener una actitud de intervención diagnóstica y terapéutica más intensiva en función al riesgo de fibrosis. Asimismo, a diferencia de otros estudios realizados en centros de cirugía bariátrica, este es un estudio original a partir de una población heterogénea de pacientes con diabetes tipo 2 atendidos en un Hospital Nacional de Lima que, por ende, refleja también las carencias de nuestro sistema de salud y puede ser una herramienta para políticas de salud pública en nuestro medio. De tal forma que si no se toma en cuenta este grupo de pacientes en el futuro va a conllevar un aumento en forma significativa en la morbi-mortalidad por complicaciones hepáticas y cardiovasculares.
En cuanto a las limitaciones del estudio presentado, es importante mencionar que una gran parte de los pacientes no tenía resultados histológicos derivados de biopsias hepáticas. Esto se debe a la complejidad del procedimiento y al hecho de que no es una práctica común en el servicio de gastroenterología, como se pudo verificar al revisar las historias clínicas. Sin embargo, esta limitación se abordó en el diseño del estudio al establecer que, en ausencia de resultados histológicos, todos los pacientes seleccionados para ser incluidos en la investigación debían contar con resultados que indicaran un grado significativo de fibrosis hepática. Estos resultados se basaron en la coincidencia de las evaluaciones de tres calculadoras de riesgo de fibrosis: el score FIB-4, APRI y NAFLD. Esta elección se hizo siguiendo las recomendaciones de las guías de diagnóstico y tratamiento vigentes.
Otra limitación de acuerdo con el tipo de diseño de estudio es que en el caso de un estudio de casos y controles no permite hacer un seguimiento de los controles en el tiempo lo cual es útil al estudiar relaciones en factores de riesgo.
Asimismo, se considera como una limitación que pese que se excluyo el consumo de alcohol de acuerdo con la ficha de recolección de datos en el diseño del estudio como parte de hábitos nocivos es posible que aun tras es evaluación haya dentro del grupo estudiado de por tratarse de un estudio retrospectivo de tipo casos y controles pacientes con consumo de alcohol además de MASLD, lo que ahora se llama Met-ALD o etiología mixta. Además de ello el conocimiento de la nomenclatura actual ha variado respecto a la época en que se diseño este estudio que fue en 2019.
Asimismo, en relación con el tipo de medida de asociación como el OR al tener un valor más extremo puede sobreestimar un riesgo a diferencia de otras medidas de asociación como el riesgo relativo. Además de acuerdo a la nueva nomenclatura que considera la denominación de enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD) al cumplir los pacientes evaluados con DM2, ellos corresponderían a un fenotipo de MASLD de alto riesgo de fibrosis y este riesgo es aún mayor en forma individual dado que además de la DM2 hay presencia en ellos de sobrepeso, obesidad, la dislipidemia u obesidad visceral y complicaciones crónicas de la DM que elevan aún más el riesgo de fibrosis 37-39).
En conclusión, los factores de riesgo para el desarrollo de fibrosis avanzada, en pacientes con diabetes mellitus tipo 2 y enfermedad hepática esteatósica asociada a disfunción metabólica encontrados en el presente estudio son edad mayor de 60 años, sobrepeso y obesidad de acuerdo con el IMC, obesidad visceral en mujeres, complicaciones tardías microvasculares de la DM2, nivel bajo de HDL en mujeres y la hipertensión arterial como principal comorbilidad.