INTRODUCCIÓN
Las enfermedades del parénquima hepático son evaluadas inicialmente mediante estudios de imágenes y exámenes de laboratorio, y aunque actualmente también se utilizan métodos no invasivos como la elastografía hepática; en algunos pacientes, se puede requerir aún una biopsia hepática para determinar la etiología, el estadiaje o el pronóstico 1-3. La literatura reporta que el resultado de la biopsia hepática puede modificar el diagnóstico en el 14% de los pacientes y el abordaje terapéutico hasta en el 18% de los casos 4.
La biopsia hepática puede obtenerse a través de la vía percutánea, transyugular, quirúrgica o ser guiada por endosonografía (EUS). El abordaje percutáneo tiene algunas limitaciones como el error de muestreo y una tasa de eventos adversos de hasta el 60% en las dos horas posteriores al procedimiento. Además, existen complicaciones que incluyen el dolor, hipotensión transitoria, hematoma intrahepático o subcapsular y sangrado 2,5,6. La biopsia transyugular tiene la limitación de no poseer la visualización directa del parénquima hepático durante la punción, siendo asociada a complicaciones como hematomas, fístula arteriovenosa hepática, punción de la cápsula hepática y hemorragia intraperitoneal 7. La tasa de complicaciones va del 1,3 al 20,2% y la mortalidad fluctúa entre 0,1 a 0,5% 6.
La biopsia hepática guiada por EUS ha sido reportada como un procedimiento con un rendimiento diagnóstico entre 90 a 100% con un perfil bajo de eventos adversos; algunos estudios han registrado una tasa de eventos adversos de 1,8% y una tasa de mortalidad de hasta 0,02% 2,4,8. Las ventajas de este abordaje incluyen la posibilidad de biopsiar ambos lóbulos hepáticos, además se puede utilizar el modo Doppler color que permite evitar la punción de vasos; reportándose menor dolor abdominal, mayor satisfacción por parte del paciente y la posibilidad de realizarse también en pacientes obesos, en quienes se presenta más dificultad técnica con otros abordajes 3,9.
Las biopsias hepáticas han ido evolucionando a través del tiempo y pueden ser realizadas con diferentes tipos de agujas y técnicas de aspiración. La biopsia con aguja de Tru-Cut varía en precisión diagnóstica y posee cierta dificultad técnica debido a la rigidez de la aguja 2. La biopsia guiada por EUS con aguja de aspiración fina Nº 19 (FNA) ha reportado una tasa de rendimiento diagnóstica de 90 a 100% 10-12; porcentajes similares a los casos de biopsias con aguja fina (FNB) guiadas por EUS 5,12.
Posteriormente se han ido realizando varios estudios que comparan las biopsias con FNA vs. FNB, evidenciando resultados controversiales a favor de una u otra técnica 5,12-14. Al comparar los tamaños de aguja, un estudio prospectivo encontró una mayor fragmentación tisular en las biopsias con las FNB Nº 22G vs. FNA Nº 19; esto podría deberse al menor diámetro de la muestra obtenida con la aguja Nº 22 en comparación con la número 19 1,15. En relación con los eventos adversos en un estudio se reportó un mayor porcentaje de dolor severo con las FNB (25%) vs las FNA (5%); sin embargo, la diferencia no fue significativa. Se ha planteado que uno de los factores puede ser la mayor irritación peritoneal en el sitio de punción en la cápsula hepática que es ligeramente mayor con la aguja de biopsia 12. Khan et al. concluye que la evaluación citológica de las muestras obtenidas mediante una punción con FNA puede no ser suficiente en todos los casos. De modo que, si se tiene la accesibilidad y se requiere la evaluación de la arquitectura tisular, una tinción con inmunohistoquímica o algún análisis molecular, el método con FNB podría ser el preferido 13.
En nuestra región, no existen estudios previos en donde se describa la efectividad, la seguridad o la técnica de las biopsias dirigidas por EUS para el diagnóstico de enfermedad hepática parenquimal. Presentamos los resultados obtenidos en un Hospital Público de nivel de atención III-2 en Lima, Perú. El objetivo del presente estudio fue determinar la efectividad y la seguridad de la biopsia hepática guiada por endosonografía en enfermedad hepática parenquimal.
MATERIALES Y MÉTODOS
Población de estudio
Se incluyeron a todos los pacientes mayores de 18 años (hospitalizados o ambulatorios) que fueron sometidos a una biopsia guiada por EUS para el estudio de una enfermedad parenquimal hepática en el Hospital Nacional Edgardo Rebagliati Martins en Lima-Perú, durante el periodo comprendido entre marzo del 2018 a octubre del 2022. Se trata de un estudio observacional, analítico de tipo cohorte prospectivo.
Los criterios de inclusión fueron pacientes mayores de 18 años en estudio de una enfermedad parenquimal hepática con pruebas de imagen y sanguíneos cuyos resultados fueron insuficientes y que tenían por tanto la indicación de una biopsia hepática guiada por EUS. Los criterios de exclusión fueron pacientes con plaquetas < 50 000 o trastornos de coagulación (INR >1,5), uso de anticoagulantes sin posibilidad de ser suspendidos o reemplazados por terapia puente previamente a procedimiento, la presencia de una lesión hepática o enfermedad maligna subyacente conocida o diagnosticada durante el estudio, y condición de embarazo.
La biopsia guiada por EUS fue realizada con una aguja de aspiración fina Nº 19 (FNA o FNB) y los pacientes firmaron un consentimiento informado antes de la realización de dicho procedimiento.
Los datos incluidos en el estudio fueron las características demográficas de los pacientes como edad y sexo, el año del procedimiento, el lóbulo hepático biopsiado, el número de pases y tipo de técnica utilizada, si la muestra fue adecuada o no para el diagnóstico histopatológico, la longitud del espécimen obtenido, el número de espacios porta completos, el tipo de diagnóstico histopatológico y su especificación, así como los eventos adversos, que fueron registrados hasta las 48 horas post procedimiento por seguimiento clínico en aquellos hospitalizados y por seguimiento telefónico en aquellos ambulatorios.
Técnica de biopsia
La evaluación ecoendoscópica fue realizada en la posición lateral decúbito izquierda, con un ecoendoscopio lineal Pentax. Todos los pacientes recibieron sedación endovenosa con midazolam y petidina administrados por el personal de enfermería e indicados por el médico operador. Los procedimientos fueron realizados por uno de los 5 ecoendoscopistas expertos del Servicio de Gastroenterología del hospital.
Las biopsias se realizaron mediante una aguja de aspiración fina (FNA) o con una aguja fina de biopsia (FNB) ambas Nº 19. Se realizó uno a tres pases según el criterio del médico al realizar el examen (Figura 1).
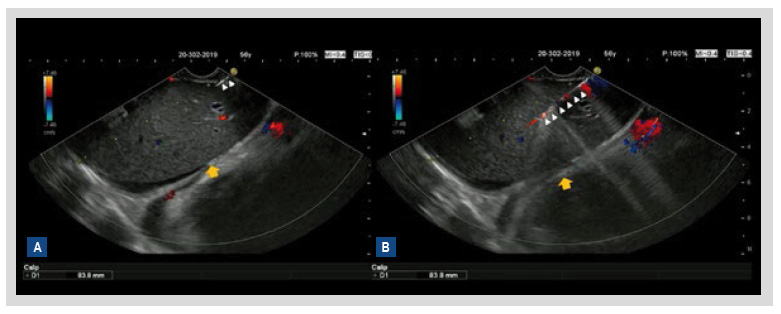
Figura 1 Biopsia hepática guiada por endosonografía. (A) Ingreso de aguja de aspiración fina Nº19 (flechas blancas) a lóbulo hepático izquierdo (flechas amarillas). (B) Se aprecia aguja dentro de parénquima hepático (flechas blancas), se realiza biopsia utilizando también modo Doppler color.
El método de succión incluyó la técnica seca y la húmeda. En la técnica seca se retiró el estilete y se conectó a una jeringa de 10 o 20 ml para mantener la succión después de pasar la aguja dentro del tejido. Para la técnica húmeda se retiró el estilete y luego se instila 2 a 3 ml de heparina en el lumen de la aguja. Después de la punción, el tejido hepático se introdujo en un frasco con formol y fue enviado anatomía patológica (Figura 2).

Figura 2 Muestras de biopsias hepáticas guiadas por endosonografía con longitudes de aproximadamente 20 mm.
Los médicos patólogos utilizaron tinciones de hematoxilina-eosina (H.E), ácido peryodico de Schiff (PAS), tricrómica de Masson y reticulina, para la evaluación de las biopsias, reportaron la longitud de las muestras enviadas preprocesamiento, el número de espacios porta completos y describieron los cambios histológicos significativos. (Figuras 3A y 3B).
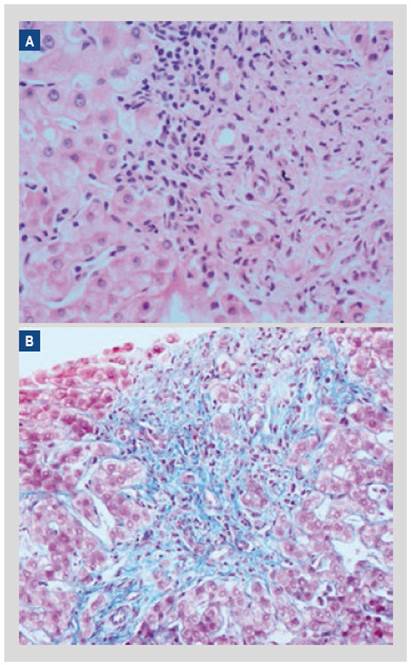
Figura 3 Biopsia hepática mediante EUS con diagnóstico de síndrome de sobreposición: hepatitis autoinmune y colangitis biliar primaria. (A) Tinción hematoxilina-eosina: espacio porta con alteración de su arquitectura, se observa proliferación ductular, inflamación crónica que incluye células plasmáticas y hepatitis de interfase. (B) tinción tricrómica de Masson: resalta la presencia de expansión fibrosa moderada del espacio porta con algunos tractos fibrosos irregulares.
Definiciones de variables
La efectividad se definió como el rendimiento diagnóstico de una muestra obtenida por biopsia guiada por EUS con FNA, lo cual implicaba que la muestra le permita al patólogo realizar un diagnóstico histopatológico, el cual podía ser específico o descriptivo.
La seguridad del procedimiento se refería a las complicaciones del procedimiento, las cuales se definieron como cualquier evento clínico no esperado post procedimiento. Estas incluyeron dolor abdominal, perforación, sangrado, neumotórax, fístula biliar, infecciones y mortalidad.
Análisis estadístico
Las variables cuantitativas fueron descritas con valores de la media, desviación estándar y mediana y rango según su distribución, la cual fue evaluada previamente con la prueba de Shapiro-Wilk. Las variables categóricas fueron descritas con porcentajes y frecuencias. Las asociaciones entre las variables cuantitativas y cualitativas se estudiaron mediante análisis bivariados. Para las variables cuantitativas con distribución normal se utilizó la prueba T de student, y para las de distribución anormal, se realizó la prueba de Mann-Whitney-Wilcoxon. Las asociaciones entre las variables cualitativas se estudiaron mediante la prueba chi cuadrado. Un valor de p<0,05 se consideró como estadísticamente significativo. Todo el análisis estadístico se realizó utilizando el programa STATA versión 14.
RESULTADOS
Entre marzo del 2018 y octubre 2022, 48 pacientes que cumplían con los criterios de inclusión y exclusión se incluyeron en el estudio. La media de edad fue 53,10 años (34-74) y 56,25% del total de pacientes fueron mujeres. El año 2022 fue en el que se realizaron más procedimientos (31,25%); mientras que el año 2020 fue el de menor número de procedimientos (8,33%).
En relación con la técnica de biopsia, 32 muestras (66,67%) fueron realizadas con 2 pases y 39 biopsias (85,25%) eran del lóbulo hepático izquierdo. En 40 pacientes (83,33%) se utilizó la técnica de succión húmeda con heparina. En 33 pacientes (68,75%) se utilizó la aguja FNA y en 11 pacientes (31,25%) se utilizó la FNB.
Dentro de las 48 horas post procedimiento se reportó un evento adverso serio (2,08%). Un paciente presentó hemorragia digestiva alta por desgarro de la región subcardial; la cual fue tratada exitosamente mediante endoscopia. Se realizó inyectoterapia, termocoagulación con argón plasma y colocación de 4 hemoclips.
El rendimiento diagnóstico fue de 77,08% (Tabla 1) y la longitud media de la muestra obtenida fue de 13,98 mm (desviación estándar 7,34) y una mediana de 8 espacios porta completos (rango 0-50). Los diagnósticos histopatológicos se muestran en la Tabla 2; siendo la hepatitis autoinmune el hallazgo más frecuente.
Tabla 1 Rendimiento diagnóstico de las biopsias guiadas por endosonografía para el diagnóstico de enfermedad parenquimal hepática.
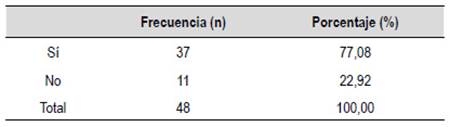
Tabla 2 Diagnóstico histopatológico de los pacientes sometidos a biopsia guiada por EUS para el diagnóstico de enfermedad hepática parenquimal.
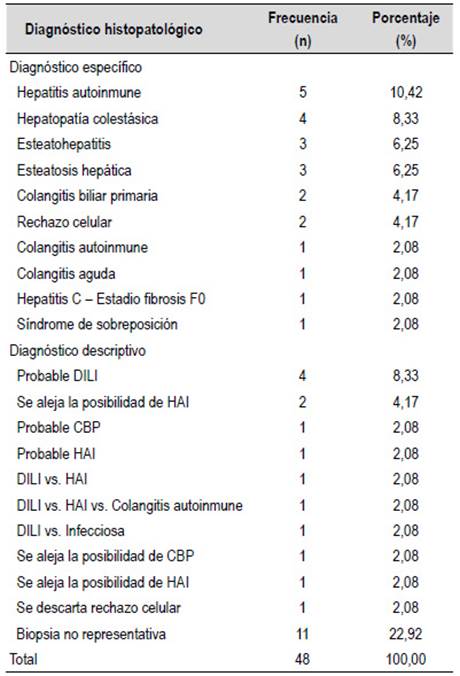
HAI: Hepatitis autoinmune, CBP: Colangitis biliar primaria, DILI: Injuria hepática inducida por drogas
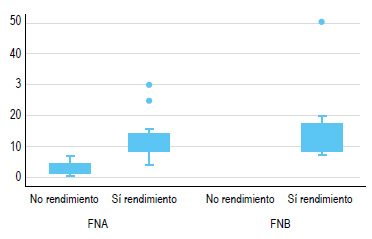
Según los análisis bivariados, se encontró una diferencia estadísticamente significativa entre el número de espacios porta de la biopsia y la técnica de succión (p=0,03); así como entre el número de espacios porta con el rendimiento diagnóstico (p=0,000). También hubo diferencias entre el rendimiento diagnóstico y el tipo de aguja utilizada (p=0,01) y el número de espacio porta y el tipo de aguja (p=0,003) (Figura 4). El mismo hallazgo se encontró entre el año en el que se realizó el procedimiento y el rendimiento diagnóstico (p=0,03). Sin embargo, no existe una diferencia entre la longitud media de la biopsia con la técnica de succión, ni con el rendimiento diagnóstico ni con el tipo de aguja.
DISCUSIÓN
El presente estudio es uno de los primeros en el país que describe la efectividad y seguridad de las biopsias hepáticas guiadas por EUS para el diagnóstico de enfermedad hepática parenquimal, incluyendo la especificación del tipo de aguja utilizada. Estudios previos han sugerido que la biopsia guiada por EUS puede obtener muestras con un rendimiento diagnóstico comparable con las obtenidas mediante el abordaje percutáneo o transyugular 16.
En relación con el rendimiento diagnóstico, no existe una definición validada, pero puede comprender a una muestra que sea adecuada para llegar a un diagnóstico histopatológico o aquella biopsia que cumpla con los requisitos de longitud del espécimen y el número de espacios porta completos. Sin embargo, tampoco existe un consenso de valores estandarizados de estas medidas pues varían según el método de abordaje o patología. Algunas sociedades de gastroenterología consideran que una biopsia hepática guiada por EUS idealmente debe tener una longitud total mayor igual a 15 mm y con 6 o más espacios porta completos 6,12,17. Aunque estos valores pueden variar en el caso de las hepatitis virales crónicas donde se requiere una estadificación, necesitando una longitud óptima mayor igual a 20 mm y al menos 11 espacios porta completos, para así reducir el error de muestreo que puede subestimar la fibrosis 18. En el presente trabajo solo uno de los pacientes presentó un diagnóstico final de hepatitis crónica viral. DeWitt y colaboradores reportaron un rendimiento de las biopsias hepáticas por EUS con aguja Tru-Cut de hasta el 90% pero con medidas de las biopsias menores, ellos incluyeron a 21 pacientes hallando una longitud media de 9mm y una mediana de 2 espacios porta completos 7.
En nuestro estudio se encontró una longitud media de 13,98 mm con una mediana de 8 espacios porta completos y un rendimiento diagnóstico de 77,08%. Sin embargo, debe considerarse que la mayoría de las biopsias (68,75%) se realizaron con una aguja FNA y al relacionar las variables sí se encontraron diferencias significativas entre el tipo de aguja utilizada y el rendimiento diagnóstico, así como con el número de espacios porta (a favor de las FNB). Cabe mencionar que considerando que esta técnica de biopsia recién se ha implementado en los últimos años en nuestro país, este porcentaje de rendimiento diagnóstico es alentador y creemos que en un futuro esta tasa podría aumentar con un mayor número de pacientes y con el tipo de técnica con diferentes agujas que se va perfeccionando año tras año.
Otros estudios han encontrado un rendimiento diagnóstico de hasta el 100% en biopsias hepáticas mediante EUS, con una longitud media de 14,7 mm y una mediana de 18 espacios porta completos 12,19. Mientras que al comparar las biopsias realizadas con FNA vs. FNB la literatura reporta resultados controversiales. Un estudio en el 2015 encontró que con la FNB Nº 19 se obtenían muestras con una mayor longitud media y más número de espacios porta completos, con un mayor porcentaje de diagnósticos histológicos (p=0,006) 20. Khan et al., obtuvo un rendimiento diagnóstico similar entre el grupo EUS-FNB y EUS-FNA pero solo si en el último grupo se realizaba con el método ROSE (evaluación rápida por un citopatólogo en la sala de endoscopia) 13. Y el estudio publicado por Chin et al., demostró además que las muestras con FNB tenían una mayor longitud media y un mayor número de espacios porta comparados con el grupo FNA 12. Por otro lado, Mohan et al., presentó un metaanálisis que reportó un rendimiento diagnóstico de 95,8% con FNA y además este subgrupo obtuvo muestras más adecuadas que los pacientes sometidos a FNB 5. Un estudio comparativo realizado por Patel y colaboradores mostró superioridad de las biopsias con FNA Nº 19 en términos de muestras adecuadas al compararlas con biopsias obtenidas con FNB Nº 22 y con dos FNB Nº 19 (una de tipo Tru-cut y otra no Tru-cut) 15.
Al comparar las variables se encontró además una diferencia significativa entre la técnica húmeda y con el número de espacios porta y el rendimiento diagnóstico. Efectivamente, estudios previos han demostrado que la biopsia guiada por EUS con técnica húmeda consigue muestras con mayor celularidad y núcleos completos, más espacios porta y una mayor longitud de la muestra cuando se compara con la técnica seca, obteniendo un mejor rendimiento diagnóstico 20,21. Además, el uso de heparina con la técnica húmeda ha reducido la formación de coágulos en la aguja facilitando así la manipulación del tejido 12. Sin embargo, en nuestro estudio no se encontró una diferencia significativa entre la técnica de succión y la longitud media de la muestra. En realidad, la longitud media de la muestra tampoco mostró diferencias con el rendimiento diagnóstico.
Además, este estudio sugiere que las biopsias hepáticas por EUS tienen un buen perfil de seguridad y representan una buena opción vs. la vía percutánea, transyugular o quirúrgica. En nuestro estudio existió solo un evento adverso serio: una esfacelación subcardial; no se registró ningún caso de mortalidad. DeWitt y et al., no reportaron complicaciones inmediatas o tardías después de la biopsia guiada por EUS 7. Ching et al., no encontraron efectos adversos serios post procedimiento, pero en el análisis por subgrupos hallaron una mayor tasa de dolor abdominal en el grupo FNB vs. FNA, aunque esta diferencia no fue significativa 12. En un metaanálisis que incluyó a 437 pacientes, con una tasa global de efectos adversos de 2,3%, tampoco se encontró una diferencia estadísticamente significativa entre los efectos adversos de dos subgrupos: biopsia con FNA Nº 19 (0,9%) vs. FNB (2,7%) 5. En el estudio de Sbeit et al., se encontró una mayor cantidad de complicaciones reportadas en los estudios que comparaban FNB (4,9%) vs. FNA (0,3%), pero también con un p mayor a 0,05 (p=0,07) 19.
Dentro de las limitaciones de nuestro estudio se encuentra el número de pacientes el cual se vio afectado por la pandemia; siendo una muestra pequeña, por lo que se necesitan más estudios prospectivos con un mayor número de casos. Esto también se evidenció en la asociación de la variable año de estudio con el rendimiento diagnóstico de la muestra, pues sí existió una diferencia significativa. Además, fue a partir de finales del 2021 que en el hospital se tuvo acceso a las agujas tipo FNB, lo cual incluyó en el rendimiento global de las biopsias. Otra limitación es que los resultados no pueden ser generalizados a todos los hospitales, pues la EUS se considera un procedimiento terapéutico avanzado que requiere cierto nivel de entrenamiento, y debido a que este estudio se realizó en un centro de referencia y por endoscopistas expertos, los resultados no pueden ser aplicados totalmente a centros con menor experiencia en biopsias hepáticas guiadas por EUS.
El rendimiento diagnóstico de las biopsias hepáticas guiadas por ecoendoscopia en este estudio llegó a ser de 77,08%; mientras que un 2,08% presentó algún efecto adverso posterior al procedimiento. Por lo tanto, se concluye que las biopsias guiadas por EUS para el diagnóstico de enfermedad hepática parenquimal tienen una efectividad cercana al 80%, considerando que en nuestro estudio más del 65% de los casos se realizaron con la aguja tipo FNA. Además, existió un perfil bajo de eventos adversos en nuestro medio; sin embargo, se necesitan más estudios prospectivos con un mayor número de pacientes para confirmar los datos descritos.